新人教版高中化学选修4第1章第3节 化学反应热的计算(40张PPT)
文档属性
| 名称 | 新人教版高中化学选修4第1章第3节 化学反应热的计算(40张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-11 00:00:00 | ||
图片预览










文档简介
(共40张PPT)
导入新课
金属钠在氯气中燃烧
测定燃烧热实验装置
在化学科研中,经常要测量化学反应所放出或吸收的热量,但是某些物质的反应热,由于种种原因不能直接测得,那么如何获得它们的反应热数据呢?
例:C燃烧生成CO,但却很难控制C的氧化只生成CO而不继续生成CO2,那么其反应热该如何获得呢?
C(g)+
O2(g)=CO(g)
一、盖斯定律
二、反应热计算
内容解析
一、盖斯定律
盖斯
盖斯,瑞士化学家,早年从事分析化学的研究,发现蔗糖可氧化成糖二酸。1830年专门从事化学热效应测定方法的改进。
1840年盖斯在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
1.盖斯定律:
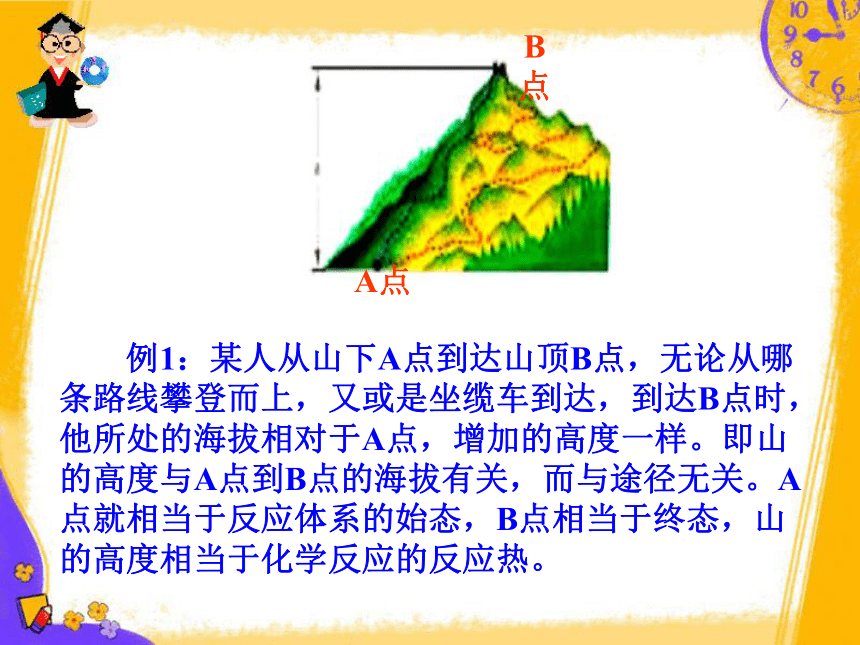
B点
A点
例1:某人从山下A点到达山顶B点,无论从哪条路线攀登而上,又或是坐缆车到达,到达B点时,他所处的海拔相对于A点,增加的高度一样。即山的高度与A点到B点的海拔有关,而与途径无关。A点就相当于反应体系的始态,B点相当于终态,山的高度相当于化学反应的反应热。
CO(g)+
O2(g)=CO2(g)
C(s)+
O2(g)=CO2(g)
例2:C(s)+
O2(g)=CO(g),因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得。
CO(g)+
O2(g)=CO2(g)
C(s)+
O2(g)=CO2(g)
ΔH=-393.5
kJ/mol
ΔH=-283.0
kJ/mol
我们可以测得C与O2反应生成CO2以及CO与O2反应生成CO2的反应热,根据盖斯定律。可以很容易求算出
C(s)+
1/2O2(g)=CO(g)的ΔH。
∵ΔH1=ΔH2+ΔH3
∴ΔH2=ΔH1-ΔH3
=-393.5kJ/mol
-(-283.0kJ/mol)
=-110.5
kJ/mol
即:C(s)+
O2(g)=CO(g)的
ΔH=-110.5
kJ/mol
反应物A变为生成物D,可以有两个途径:a.由A直接变成D,反应热为ΔH;b.由A经过B变成C,再由C变成D,每步的反应热分别是ΔH1、ΔH2、ΔH3。如下图所示:
总结:
2.盖斯定律在生产和科学研究中有很重要的意义。
有些反应的反应热虽然无法直接测得,但利用盖斯定律不难间接计算求得。通过计算,合理利用煤、石油、天然气等当今世界上最重要的化石燃料,唤起了人们对资源利用和环境保护的意识和责任感。
二、反应热的计算
例1.某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。假如都在相同状态下,请写出发射火箭反应的热化学方程式。已知:
①N2(g)+2O2(g)=2NO2(g)?
△H1=+67.2kJ/mol?
?
②
N2H4(g)+O2(g)=N2(g)+2H2O(l)?
△H2=-534kJ/mol
2
N2H4(g)+
2NO2(g)=3N2(g)+4H2O(l)?
???
解析:根据盖斯定律得
发射火箭反应的热化学方程式为:②×2-①
△H=-1135.2kJ/mol
例2.乙醇的燃烧热:
△H=-1366.8kJ/mol,在25℃、101kPa,1kg乙醇充分燃烧放出多少热量?
解析:C2H5OH的摩尔质量是46g/mol
1kgC2H5OH的物质的量为:
1kgC2H5OH充分燃烧后放出的热量为:
1366.8kJ/mol×21.74mol=2.971×104kJ
1000g÷46g/mol=21.74mol
例3.实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH,但可测出CH4燃烧反应的ΔH1,根据盖斯定律求ΔH4
。已知:
a.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
ΔH1=-890.3kJ/mol
b.C(石墨)+O2(g)=CO2(g)
ΔH2=-393.5kJ/mol
c.H2(g)+
1/2O2(g)=H2O(l)
ΔH3=-285.8kJ/mol
d.C(石墨)+2H2(g)=CH4(g);ΔH4=?
解析:根据盖斯定律得
∵反应式a、b、c、d之间有以下关系:
b+c×2-a=d
∴ΔH4=ΔH2+2×ΔH3-ΔH1
=
-74.8kJ/mol
=-393.5
kJ/mol+2×(-285.8)
kJ/mol
-(-890.3)
kJ/mol
知识拓展:反应热的本质就是物质通过化学反应向外界吸收或释放能量的过程,只与反应物、生成物的总能量有关,与反应条件、反应过程无关。当反应物的总能量高于生成物的总能量时则反应放出能量,当反应物的总能量低于生成物的总能量时则反应吸收能量。
课堂小结
1.盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
2.盖斯定律在生产和科学研究中有很重要的意义。
3.反应热的本质就是物质通过化学反应向外界吸收或释放能量的过程,只与反应物、生成物的总能量有关,与反应条件、反应过程无关。当反应物的总能量高于生成物的总能量时则反应放出能量,当反应物的总能量低于生成物的总能量时则反应吸收能量。
课堂练习
一、填空
1.已知CH4(g)+2O2(g)=CO2(g)+2H2O(l);
ΔH=-890
kJ/mol,现有CH4和CO的混合气体共0.75
mol,完全燃烧后,生成CO2气体和18
g液态H2O,并放出515
kJ热量,CO燃烧的热化学方程式为:
___________________________________________
2CO(g)+O2(g)=2CO2(g)ΔH=-560
kJ/mol
2.已知下列两个热化学方程式:
H2(g)+
1/2O2(g)=H2O(1)
△H=-285.kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(1)
△H=-2220.0kJ/mol
实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是__
1:1
二、选择题
1.已知25
℃、101
kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)=CO2(g)
C(金刚石)+O2(g)=CO2(g)
ΔH=-393.51
kJ/mol
ΔH=-395.41
kJ/mol
据此判断,下列说法中正确的是
_
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低。
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
A
2.某H2
和CO的混合气体完全燃烧时放出113.74
kJ热量,同时生成3.6
g液态水,则原混合气体中H2和CO的物质的量之比为_
2H2(g)+O2(g)=2H2O(l)ΔH=-571.6
kJ/mol
CO(g)+
O2(g)=CO2(g)ΔH=-283.0
kJ/mol
A.
2:1
B.
1:2
C.
1:1??
D.
2:3
C
教材习题答案
1.
2.5molC在O2中完全燃烧生成CO2,放出多少热量?
提示:C(s)+O2(g)=CO2(g)
ΔH=-393.51
kJ/mol
2.5molC完全燃烧:Q
=2.5mol
×
(-393.51
kJ/mol)
=-938.8kJ
2.完全燃烧多少摩H2是生成液态水,才能得到1000kJ热量?
提示:
H2(g)的燃烧热ΔH=-285.8
kJ/mol
欲使H2完全燃烧生成液态水,得到1000kJ热量,需要H2
:
1000kJ÷285.8
kJ/mol=3.5mol
3.
4.0g硫粉在O2中完全燃烧生成SO2,放出37kJ热量,计算S的燃烧热。
提示:设S的燃烧热为ΔH
S(s)+O2(g)=SO2(g)
32g/mol
4.0g
ΔH
-37kJ
ΔH=
32g/mol×
(-37kJ
)÷
4.0g
=-296
kJ/mol
4.
1.00gCH4完全燃烧生成液态水和CO2,放出55.6kJ热量,计算CH4的燃烧热。
提示:设CH4的燃烧热为ΔH
CH4(g)+2O2(g)=CO2(g)+2H2O
(g)
16g/mol
1g
ΔH
-55.6kJ
ΔH=
16g/mol×
(-55.6kJ
)÷
1g
=-889.6
kJ/mol
5.
2.00gC2H2完全燃烧生成液态水和CO2,放出99.6kJ热量,3.00molC2H2完全燃烧能放出多少热量?燃烧相同物质的量的CH4和C2H2,哪种气体燃烧放出的热量多?
26g/mol
2.00g
ΔH
-99.6kJ
提示:1)求3.00molC2H2完全燃烧能放出的热量Q
C2H2(g)+
O2(g)=2CO2(g)+H2O
(l)
ΔH=26g/mol×
(-99.6kJ
)÷
2.00g
=-1294.8
kJ/mol
Q=3.00mol×
1294.8
kJ/mol=3884.4kJ
2)从题4已知CH4的燃烧热-889.6
kJ/mol,相比之下,燃烧相同物质的量的C2H2放出的热量多。
6.
试计算25℃时CO与H2O作用转化为H2和CO2反应的反应热。
提示:根据题意可知由题中反应(3)减反应(1)和(2)可得CO与H2O作用转化为H2和CO2反应,因此有:
ΔH=ΔH3
-(ΔH
1+ΔH2)
=-394
kJ/mol
+
(111
kJ/mol
+242kJ/mol)
=-41
kJ/mol
即:CO与H2O作用转化为H2和CO2反应的反应热为=-41
kJ/mol
7.
1kg人体脂肪可储存约32200kJ能量。一般人每行走1km大约要消耗170kJ能量,如果某人每天步行5km,1年中因此消耗的脂肪大约是多少?
提示:已知1kg人体脂肪储存32200kJ能量,行走1km消耗170kJ,求每天行走5km,1年中因此消耗的脂肪量:
170kJ/km×
5km/d
×
365d÷
32200kJ/kg
=9.64kg
8.一个体重为70kg的人脂肪储存的能量约为4.2×105kJ,如果快速奔跑1km要消耗420kJ能量,此人的脂肪可以维持奔跑的距离是多少?
提示:此人脂肪储存的能量约为4.2×105kJ,快速奔跑1km要消耗420kJ能量,此人的脂肪可以维持奔跑的距离为:
4.2×105kJ
÷420kJ/km=1000km
9.某锅炉用1.0t煤可烧开水50t(进锅炉水温20℃),请计算该锅炉的热效率。(1t煤燃烧热2.9×107kJ)
提示:1t煤燃烧热2.9×107kJ
50t水由20℃升温至100
℃,温差100
℃-20
℃=80
℃此时需要吸热:
50×103kg×80
℃
×4.184kJ/(kg
.℃)=1.6736×107kJ
锅炉的热效率=
(
1.6736×107kJ÷
2.9×107kJ)×100%
=
57.7%
10.现废品收购站已收购如下数量的废塑料:耐纶5m3、聚氯乙烯50m3、丙烯酸类型塑料5m3、聚丙烯40m3,如将它们加工成燃料,可回收多少能量?
提示:各种塑料可回收的能量分别是:
耐纶:5m3×4.2×104kJ/m3=21×104kJ
聚氯乙烯:50m3×1.6×104kJ/m3=80×104kJ
丙烯酸类型塑料:5m3×1.8×104kJ/m3=9×104kJ
聚丙烯:40m3×1.5×104kJ/m3=60×104kJ
将它们加工成燃料,可回收能量为:
21×104kJ+80×104kJ+×104kJ+60×104kJ=1.7×106kJ
导入新课
金属钠在氯气中燃烧
测定燃烧热实验装置
在化学科研中,经常要测量化学反应所放出或吸收的热量,但是某些物质的反应热,由于种种原因不能直接测得,那么如何获得它们的反应热数据呢?
例:C燃烧生成CO,但却很难控制C的氧化只生成CO而不继续生成CO2,那么其反应热该如何获得呢?
C(g)+
O2(g)=CO(g)
一、盖斯定律
二、反应热计算
内容解析
一、盖斯定律
盖斯
盖斯,瑞士化学家,早年从事分析化学的研究,发现蔗糖可氧化成糖二酸。1830年专门从事化学热效应测定方法的改进。
1840年盖斯在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
1.盖斯定律:
B点
A点
例1:某人从山下A点到达山顶B点,无论从哪条路线攀登而上,又或是坐缆车到达,到达B点时,他所处的海拔相对于A点,增加的高度一样。即山的高度与A点到B点的海拔有关,而与途径无关。A点就相当于反应体系的始态,B点相当于终态,山的高度相当于化学反应的反应热。
CO(g)+
O2(g)=CO2(g)
C(s)+
O2(g)=CO2(g)
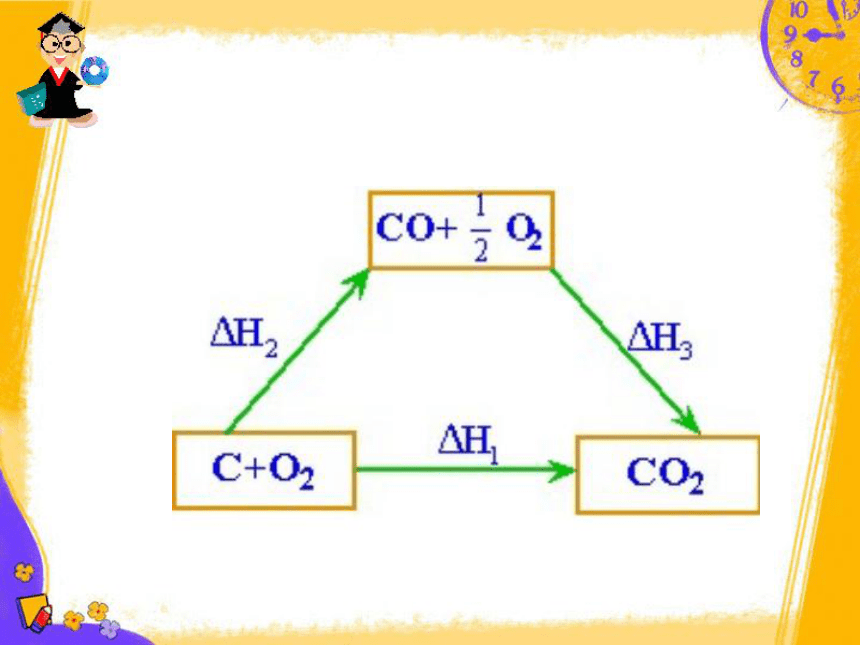
例2:C(s)+
O2(g)=CO(g),因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得。
CO(g)+
O2(g)=CO2(g)
C(s)+
O2(g)=CO2(g)
ΔH=-393.5
kJ/mol
ΔH=-283.0
kJ/mol
我们可以测得C与O2反应生成CO2以及CO与O2反应生成CO2的反应热,根据盖斯定律。可以很容易求算出
C(s)+
1/2O2(g)=CO(g)的ΔH。
∵ΔH1=ΔH2+ΔH3
∴ΔH2=ΔH1-ΔH3
=-393.5kJ/mol
-(-283.0kJ/mol)
=-110.5
kJ/mol
即:C(s)+
O2(g)=CO(g)的
ΔH=-110.5
kJ/mol
反应物A变为生成物D,可以有两个途径:a.由A直接变成D,反应热为ΔH;b.由A经过B变成C,再由C变成D,每步的反应热分别是ΔH1、ΔH2、ΔH3。如下图所示:
总结:
2.盖斯定律在生产和科学研究中有很重要的意义。
有些反应的反应热虽然无法直接测得,但利用盖斯定律不难间接计算求得。通过计算,合理利用煤、石油、天然气等当今世界上最重要的化石燃料,唤起了人们对资源利用和环境保护的意识和责任感。
二、反应热的计算
例1.某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。假如都在相同状态下,请写出发射火箭反应的热化学方程式。已知:
①N2(g)+2O2(g)=2NO2(g)?
△H1=+67.2kJ/mol?
?
②
N2H4(g)+O2(g)=N2(g)+2H2O(l)?
△H2=-534kJ/mol
2
N2H4(g)+
2NO2(g)=3N2(g)+4H2O(l)?
???
解析:根据盖斯定律得
发射火箭反应的热化学方程式为:②×2-①
△H=-1135.2kJ/mol
例2.乙醇的燃烧热:
△H=-1366.8kJ/mol,在25℃、101kPa,1kg乙醇充分燃烧放出多少热量?
解析:C2H5OH的摩尔质量是46g/mol
1kgC2H5OH的物质的量为:
1kgC2H5OH充分燃烧后放出的热量为:
1366.8kJ/mol×21.74mol=2.971×104kJ
1000g÷46g/mol=21.74mol
例3.实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH,但可测出CH4燃烧反应的ΔH1,根据盖斯定律求ΔH4
。已知:
a.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
ΔH1=-890.3kJ/mol
b.C(石墨)+O2(g)=CO2(g)
ΔH2=-393.5kJ/mol
c.H2(g)+
1/2O2(g)=H2O(l)
ΔH3=-285.8kJ/mol
d.C(石墨)+2H2(g)=CH4(g);ΔH4=?
解析:根据盖斯定律得
∵反应式a、b、c、d之间有以下关系:
b+c×2-a=d
∴ΔH4=ΔH2+2×ΔH3-ΔH1
=
-74.8kJ/mol
=-393.5
kJ/mol+2×(-285.8)
kJ/mol
-(-890.3)
kJ/mol
知识拓展:反应热的本质就是物质通过化学反应向外界吸收或释放能量的过程,只与反应物、生成物的总能量有关,与反应条件、反应过程无关。当反应物的总能量高于生成物的总能量时则反应放出能量,当反应物的总能量低于生成物的总能量时则反应吸收能量。
课堂小结
1.盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
2.盖斯定律在生产和科学研究中有很重要的意义。
3.反应热的本质就是物质通过化学反应向外界吸收或释放能量的过程,只与反应物、生成物的总能量有关,与反应条件、反应过程无关。当反应物的总能量高于生成物的总能量时则反应放出能量,当反应物的总能量低于生成物的总能量时则反应吸收能量。
课堂练习
一、填空
1.已知CH4(g)+2O2(g)=CO2(g)+2H2O(l);
ΔH=-890
kJ/mol,现有CH4和CO的混合气体共0.75
mol,完全燃烧后,生成CO2气体和18
g液态H2O,并放出515
kJ热量,CO燃烧的热化学方程式为:
___________________________________________
2CO(g)+O2(g)=2CO2(g)ΔH=-560
kJ/mol
2.已知下列两个热化学方程式:
H2(g)+
1/2O2(g)=H2O(1)
△H=-285.kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(1)
△H=-2220.0kJ/mol
实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是__
1:1
二、选择题
1.已知25
℃、101
kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)=CO2(g)
C(金刚石)+O2(g)=CO2(g)
ΔH=-393.51
kJ/mol
ΔH=-395.41
kJ/mol
据此判断,下列说法中正确的是
_
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低。
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
A
2.某H2
和CO的混合气体完全燃烧时放出113.74
kJ热量,同时生成3.6
g液态水,则原混合气体中H2和CO的物质的量之比为_
2H2(g)+O2(g)=2H2O(l)ΔH=-571.6
kJ/mol
CO(g)+
O2(g)=CO2(g)ΔH=-283.0
kJ/mol
A.
2:1
B.
1:2
C.
1:1??
D.
2:3
C
教材习题答案
1.
2.5molC在O2中完全燃烧生成CO2,放出多少热量?
提示:C(s)+O2(g)=CO2(g)
ΔH=-393.51
kJ/mol
2.5molC完全燃烧:Q
=2.5mol
×
(-393.51
kJ/mol)
=-938.8kJ
2.完全燃烧多少摩H2是生成液态水,才能得到1000kJ热量?
提示:
H2(g)的燃烧热ΔH=-285.8
kJ/mol
欲使H2完全燃烧生成液态水,得到1000kJ热量,需要H2
:
1000kJ÷285.8
kJ/mol=3.5mol
3.
4.0g硫粉在O2中完全燃烧生成SO2,放出37kJ热量,计算S的燃烧热。
提示:设S的燃烧热为ΔH
S(s)+O2(g)=SO2(g)
32g/mol
4.0g
ΔH
-37kJ
ΔH=
32g/mol×
(-37kJ
)÷
4.0g
=-296
kJ/mol
4.
1.00gCH4完全燃烧生成液态水和CO2,放出55.6kJ热量,计算CH4的燃烧热。
提示:设CH4的燃烧热为ΔH
CH4(g)+2O2(g)=CO2(g)+2H2O
(g)
16g/mol
1g
ΔH
-55.6kJ
ΔH=
16g/mol×
(-55.6kJ
)÷
1g
=-889.6
kJ/mol
5.
2.00gC2H2完全燃烧生成液态水和CO2,放出99.6kJ热量,3.00molC2H2完全燃烧能放出多少热量?燃烧相同物质的量的CH4和C2H2,哪种气体燃烧放出的热量多?
26g/mol
2.00g
ΔH
-99.6kJ
提示:1)求3.00molC2H2完全燃烧能放出的热量Q
C2H2(g)+
O2(g)=2CO2(g)+H2O
(l)
ΔH=26g/mol×
(-99.6kJ
)÷
2.00g
=-1294.8
kJ/mol
Q=3.00mol×
1294.8
kJ/mol=3884.4kJ
2)从题4已知CH4的燃烧热-889.6
kJ/mol,相比之下,燃烧相同物质的量的C2H2放出的热量多。
6.
试计算25℃时CO与H2O作用转化为H2和CO2反应的反应热。
提示:根据题意可知由题中反应(3)减反应(1)和(2)可得CO与H2O作用转化为H2和CO2反应,因此有:
ΔH=ΔH3
-(ΔH
1+ΔH2)
=-394
kJ/mol
+
(111
kJ/mol
+242kJ/mol)
=-41
kJ/mol
即:CO与H2O作用转化为H2和CO2反应的反应热为=-41
kJ/mol
7.
1kg人体脂肪可储存约32200kJ能量。一般人每行走1km大约要消耗170kJ能量,如果某人每天步行5km,1年中因此消耗的脂肪大约是多少?
提示:已知1kg人体脂肪储存32200kJ能量,行走1km消耗170kJ,求每天行走5km,1年中因此消耗的脂肪量:
170kJ/km×
5km/d
×
365d÷
32200kJ/kg
=9.64kg
8.一个体重为70kg的人脂肪储存的能量约为4.2×105kJ,如果快速奔跑1km要消耗420kJ能量,此人的脂肪可以维持奔跑的距离是多少?
提示:此人脂肪储存的能量约为4.2×105kJ,快速奔跑1km要消耗420kJ能量,此人的脂肪可以维持奔跑的距离为:
4.2×105kJ
÷420kJ/km=1000km
9.某锅炉用1.0t煤可烧开水50t(进锅炉水温20℃),请计算该锅炉的热效率。(1t煤燃烧热2.9×107kJ)
提示:1t煤燃烧热2.9×107kJ
50t水由20℃升温至100
℃,温差100
℃-20
℃=80
℃此时需要吸热:
50×103kg×80
℃
×4.184kJ/(kg
.℃)=1.6736×107kJ
锅炉的热效率=
(
1.6736×107kJ÷
2.9×107kJ)×100%
=
57.7%
10.现废品收购站已收购如下数量的废塑料:耐纶5m3、聚氯乙烯50m3、丙烯酸类型塑料5m3、聚丙烯40m3,如将它们加工成燃料,可回收多少能量?
提示:各种塑料可回收的能量分别是:
耐纶:5m3×4.2×104kJ/m3=21×104kJ
聚氯乙烯:50m3×1.6×104kJ/m3=80×104kJ
丙烯酸类型塑料:5m3×1.8×104kJ/m3=9×104kJ
聚丙烯:40m3×1.5×104kJ/m3=60×104kJ
将它们加工成燃料,可回收能量为:
21×104kJ+80×104kJ+×104kJ+60×104kJ=1.7×106kJ
