人教版高中化学必修一 2.3氧化还原反应(共45张ppt)
文档属性
| 名称 | 人教版高中化学必修一 2.3氧化还原反应(共45张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 606.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-11 21:12:21 | ||
图片预览









文档简介
第三节
氧化还原反应
依据反应物和生成物的类别以及反应前后物质种类的多少
化合反应
分解反应
置换反应
复分解反应
初中学过的化学反应四种基本类型:
知识回顾:
请看以下几个反应属于哪种基本反应类型。
举例
表示式
C+O2 === CO2
A+B = AB
CaCO3 === CaO+CO2↑
AB = A+B
C+2CuO === 2Cu+CO2↑
A+BC = AC+B
AgNO3+NaCl = AgCl↓+NaNO3
AB+CD = AD+CB
点燃
高温
高温
反应类型
化合反应
分解反应
置换反应
复分解反应
那么,下面这个反应属于什么反应类型呢?
Fe2O3+3CO ==== 2Fe+3CO2
高温
如果从得失氧的角度分析?
CO 得到氧被氧化,发生氧化反应
Fe2O3 失去氧被还原,发生还原反应
}同时发生
在同一个化学反应中,有一种物质被还原,另一种物质被氧化的反应叫氧化还原反应
那么下面这个反应还是氧化还原反应吗?
点燃
2Na+Cl2 ==2 NaCl
你能一眼看出它的反应类型吗?
如果从化合价的角度分析上述俩个例子?
Fe2O3+3CO ==== 2Fe+3CO2
高温
+3
+2
0
+4
-2
-2
-2
化合价升高
化合价降低
笔记:
化合价升高的物质被氧化,发生氧化反应
化合价降低的物质被还原,发生还原反应
氧化还原反应中元素化合价升降变化共存,即“有升必有降”
化合价升高
0 0 +1 -1
化合价降低
2Na + Cl2 = 2NaCl
点燃
并非只有得氧、失氧的反应才是氧化还原反应,凡是有元素化合价变化的反应都是氧化还原反应,这是它的特征现象,也是化学反应是否为氧化还原反应的判断新标准。
总结:
思考:氧化还原反应中为什么会有化合价的变化?
氧化还原反应的本质是什么?
活动探究: 1、金属钠在氯气中燃烧的实质
2、氢气在氯气中燃烧的实质
化合物NaCl 的形成过程
化合价升降的原因: (1)电子的得失
Na
Cl
失去e-
失去
e-后
得到
e-后
Na+
[ Cl ]-
Cl -
Na+
失去2e-,化合价升高
2Na + Cl2 = 2NaCl
点燃
0 0 +1 -1
钠在氯气中燃烧
得到2e- ,化合价降低
失电子
Na元素化合价升高
被氧化
得电子
Cl元素化合价降低
被还原
氧化反应
还原反应
化合物HCl的形成过程
化合价升降的原因: (2)电子的偏移
Cl
H
H
Cl
氯化氢的形成(HCl)
电子对偏向 Cl
H元素化合价升高
被氧化
电子对偏向 Cl
Cl元素化合价降低
被还原
氧化反应
还原反应
H2 +Cl2====2HCl
0
0
+1
-1
点燃
化合价升高
化合价降低
总结:氧化还原反应的实质是---电子发生了转移(电子的得失或偏移)。
也就是说:有电子转移的化学反应都是氧化还原反应。
化合价升高
失电子
被氧化
化合价降低
得电子
被还原
氧化反应
还原反应
(升、失、氧)
(降、得、还)
化合价升高
失电子
被氧化
氧化反应
1.化合反应:有单质参加的是氧化还原反应。
2.分解反应:有单质生成的是氧化还原反应。
3.置换反应:全部是氧化还原反应。
4.复分解反应:都是非氧化还原反应。
那我们的四大基本反应类型与我们今天学习的氧化还原反应有什么联系呢?
(1)CaO+H2O = Ca(OH)2
(2)2Na+Cl2 =2 NaCl
(6)CuO+H2 ==Cu+H2O
(7)CaCO3== CaO+CO2
(5)CaCl2+Na2CO3 = CaCO3↓+2NaCl
(4)Fe+CuSO4 = FeSO4+Cu
(3)NaOH+HCl = NaCl+H2O
(8)H2O2==H2O+O2
Ⅰ无化合价变化的反应
Ⅱ有化合价变化的反应
(化合反应)
(置换反应)
(复分解反应)
(分解反应)
(化合反应)
(复分解反应)
(分解反应)
(置换反应)
MnO2
△
高温
点燃
置换反应
复分解反应
化合反应
分解反应
化学反应
氧化还原反应
非氧化还原反应
第三节 氧化还原反应
(第二课时)
二、氧化剂和还原剂
在反应中,得到电子(或电子对偏向)的物质是氧化剂,在反应时所含元素的化合价降低,发生还原反应。(降 得 还 氧)
在反应中,失去电子(或电子对偏离)的物质是还原剂,在反应时所含元素的化合价升高,发生氧化反应。(升 失 氧 还)
氧化剂:
还原剂:
氧化剂——化合价降低的反应物
还原产物—化台价降低的产物
还原剂——化合价升高的反应物
氧化产物——化合价升高的产物
氧化还原反应两对概念
氧化剂 + 还原剂 = 氧化产物 + 还原产物
失e-,化合价升高,被氧化
得e-,化合价降低,被还原
CuO + H2 == H2O + Cu
+2
0
0
+1
化合价升高,被氧化(氧化反应)
化合价降低,被还原(还原反应)
氧化剂
还原剂
氧化产物
还原产物
常见氧化剂:O2、Cl2、浓H2SO4、HNO3、KMnO4、FeCl3 等
常见还原剂:Al、Na、Cu、Zn、Fe、C、H2 、CO等
你还能补充一些吗?
练习:1. 指出下列氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物。
① Fe2O3 + 3CO 2Fe + 3CO2
② SO2 + 2H2S == 2H2O + 3S
③ Zn + 2HCl == ZnCl2 + H2↑
④ 2KClO3 2KCl + 3O2↑
氧化剂 还原剂 还原产物 氧化产物
氧化剂 还原剂 还原产物 ,氧化产物
还原剂 氧化剂 氧化产物 还原产物
还原剂与氧化剂 还原产物 氧化产物
(1)双线桥法
+2
0
0
+1
失2×e-,
被氧化
化合价升高,
得2e-,
被还原
化合价降低,
CuO + H2 == H2O + Cu
高温
步骤:①标价态②连双线③注得失
三、氧化还原反应电子转移的表示方法
用双线桥应注意的事项:
1、双线桥:同一元素从反应物指向生成物。
2、得失电子总数表示:变价的原子个数 × (化合价的变化值)e-。
3、反应中还原剂失去电子的总数等于氧化剂得到电子的总数。
3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O
0 +5 -1
失5e-,化合价升高,被氧化
得5×e-,化合价降低,被还原
用双线桥分析氧化还原反应
氧化剂___________ 还原剂___________
氧化产物__________ 还原产物_________
转移的电子数____________
Cl2
Cl2
KClO3
KCl
5e-
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
0 +5 +2 +2
失3×2e-,化合价升高,被氧化
得2×3e-,化合价降低,被还原
氧化剂___________ 还原剂___________
氧化产物__________ 还原产物_________
转移的电子数____________
HNO3
Cu
Cu(NO3)2
NO
6e-
单线相连失与得,方向电子要明确。
2e-
(2)单线桥表示法
单线桥注意事项:
2.不标得失,只标电子转移数目
1.箭头从失电子元素指向得电子元素
CuO + H2 === Cu + H2O
高温
练习: 用单线桥表示下列氧化还原反应。
2KClO3 == 2KCl +3O2
小结:
氧化剂(降 得 还 氧)对应还原产物。
还原剂(升 失 氧 还)对应氧化产物。
表示方法:双线桥法
单线桥法
第三节 氧 化 还 原 反 应
(第 三 课 时)
理清氧化还原反应三对概念的逻辑关系
氧化剂 + 还原剂 还原产物 + 氧化产物
失e-,化合价升高,被氧化
得e-,化合价降低,被还原
e-
氧化剂:具有氧化性,即物质得电子(电子偏向)、化合价降低的性质。
还原剂:具有还原性,即物质失电子(电子偏离)、化合价升高的性质。
结论:
最高价态……只具氧化性
最低价态……只具还原性
中间价态……兼有氧化性和还原性
练习:从化合价角度分析下列微粒的性质
在Fe3+、Fe2+、Al3+、H+、S、Zn、Cl-等粒子中只有氧化性的是 ,只有还原性的是 ,兼有氧化性和还原性的是 。
Fe3+、Al3+、H+
Zn、Cl-
Fe2+、S
高价氧化低价还,中间价态两性全。
元素常见化合价:
Fe:0, +2, +3 S:-2, 0 ,+4, +6 H:0 ,+1
Al:0 ,+3 Cl:-1 ,0, +1, +5, +7
氧化性和还原性相对强弱的比较
CuSO4 + Fe = Cu + FeSO4
还原性:Fe﹥ Cu
氧化性:CuSO4﹥ FeSO4 (Cu2+﹥ Fe2+)
方法一:(1)金属活动顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Ag
金属单质失电子能力增强,还原性逐渐增强
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ H+ Cu2+ Fe3+ Ag+
金属阳离子得电子能力增强,氧化性逐渐增强
(2)非金属活动顺序
非金属单质得电子能力增强,氧化性逐渐增强
F2 CI2 Br2 I2 S
F CI Br I S
-
-
-
2-
-
非金属阴离子失电子能力减弱还原性逐渐减弱
还原性:还原剂﹥ 还原产物
氧化性:氧化剂﹥ 氧化产物
方法二:依据反应方向判断
氧化剂 + 还原剂 = 氧化产物 + 还原产物
失e-,化合价升高,被氧化
得e-,化合价降低,被还原
方法三:根据反应结果(产物的价态)判断
同一物质在相同条件下,被不同氧化剂氧化的程度越大,氧化剂的氧化性越强。
如:
2Fe+3Cl2==2FeCl3
Fe+S=FeS
则氧化性:Cl2>S。
点燃
方法四:从反应所需条件和反应的剧烈程度判断
一组反应中,反应条件要求越低,反应越剧烈,对应反应物的氧化性或还原性越强。
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓)==2KCl+2MnCl2+ 5Cl2↑+8H2O
从反应条件可以看出氧化剂的氧化能力:KMnO4>MnO2。
△
例:己知反应:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
2FeCl2 + Cl2 = 2FeCl3
SO2 + I2 + 2H2O = H2SO4 + 2HI
判断下列物质的还原能力由强到弱的顺序是( )
A. I- > Fe2+> Cl- >SO2 B. Cl-> Fe2+> SO2 > I-
C. Fe2+>I- > Cl- > SO2 D. SO2>I- > Fe2+> Cl-
试判断下列物质Cl2、 Fe3+ 、I2 、SO2的氧化能力由强到弱的顺序是( )
D
Cl2 > Fe3+ > I2 > SO2
练习1:
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是( )
B
(A)无水硫酸铜、蔗糖 (B)硅胶、硫酸亚铁
(C)食盐、硫酸亚铁 (D)生石灰、食盐
练习2:
苹果汁是人们喜欢的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生,说明维生素C具有( )
B
(A)氧化性 (B)还原性
(C)碱性 (D)酸性
为什么加入维生素C就能防止Fe2+被氧化?
维生素C比Fe2+的还原性强
步骤:三标一查
①标电子得失及其得失总数
②标化合价变化
③标反应类型
④查转移电子是否相等
氧化还原反应
依据反应物和生成物的类别以及反应前后物质种类的多少
化合反应
分解反应
置换反应
复分解反应
初中学过的化学反应四种基本类型:
知识回顾:
请看以下几个反应属于哪种基本反应类型。
举例
表示式
C+O2 === CO2
A+B = AB
CaCO3 === CaO+CO2↑
AB = A+B
C+2CuO === 2Cu+CO2↑
A+BC = AC+B
AgNO3+NaCl = AgCl↓+NaNO3
AB+CD = AD+CB
点燃
高温
高温
反应类型
化合反应
分解反应
置换反应
复分解反应
那么,下面这个反应属于什么反应类型呢?
Fe2O3+3CO ==== 2Fe+3CO2
高温
如果从得失氧的角度分析?
CO 得到氧被氧化,发生氧化反应
Fe2O3 失去氧被还原,发生还原反应
}同时发生
在同一个化学反应中,有一种物质被还原,另一种物质被氧化的反应叫氧化还原反应
那么下面这个反应还是氧化还原反应吗?
点燃
2Na+Cl2 ==2 NaCl
你能一眼看出它的反应类型吗?
如果从化合价的角度分析上述俩个例子?
Fe2O3+3CO ==== 2Fe+3CO2
高温
+3
+2
0
+4
-2
-2
-2
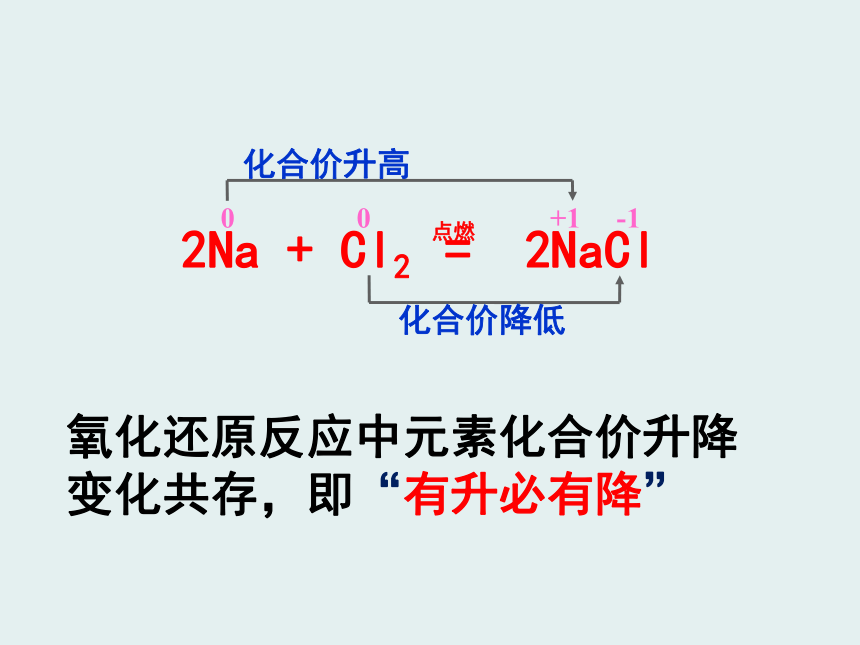
化合价升高
化合价降低
笔记:
化合价升高的物质被氧化,发生氧化反应
化合价降低的物质被还原,发生还原反应
氧化还原反应中元素化合价升降变化共存,即“有升必有降”
化合价升高
0 0 +1 -1
化合价降低
2Na + Cl2 = 2NaCl
点燃
并非只有得氧、失氧的反应才是氧化还原反应,凡是有元素化合价变化的反应都是氧化还原反应,这是它的特征现象,也是化学反应是否为氧化还原反应的判断新标准。
总结:
思考:氧化还原反应中为什么会有化合价的变化?
氧化还原反应的本质是什么?
活动探究: 1、金属钠在氯气中燃烧的实质
2、氢气在氯气中燃烧的实质
化合物NaCl 的形成过程
化合价升降的原因: (1)电子的得失
Na
Cl
失去e-
失去
e-后
得到
e-后
Na+
[ Cl ]-
Cl -
Na+
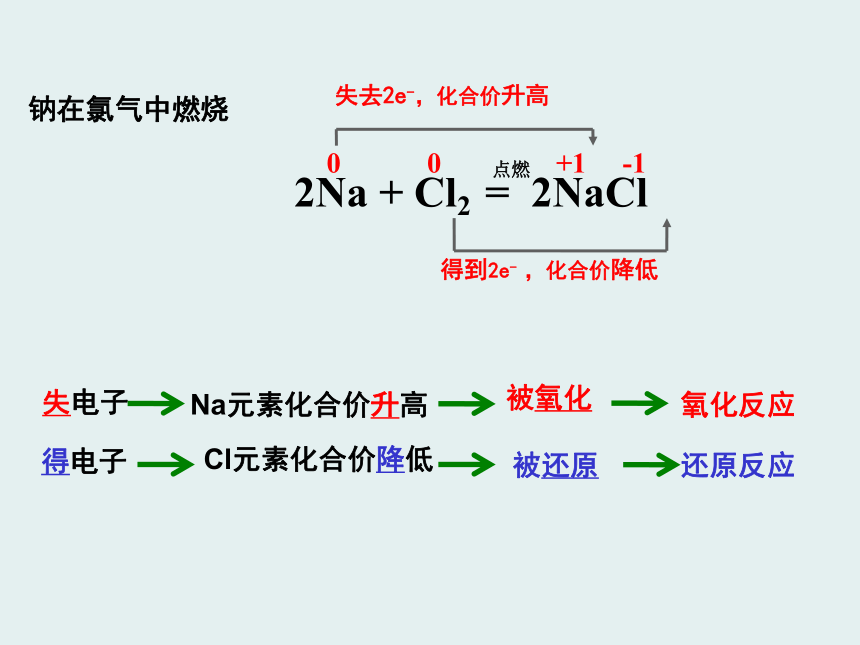
失去2e-,化合价升高
2Na + Cl2 = 2NaCl
点燃
0 0 +1 -1
钠在氯气中燃烧
得到2e- ,化合价降低
失电子
Na元素化合价升高
被氧化
得电子
Cl元素化合价降低
被还原
氧化反应
还原反应
化合物HCl的形成过程
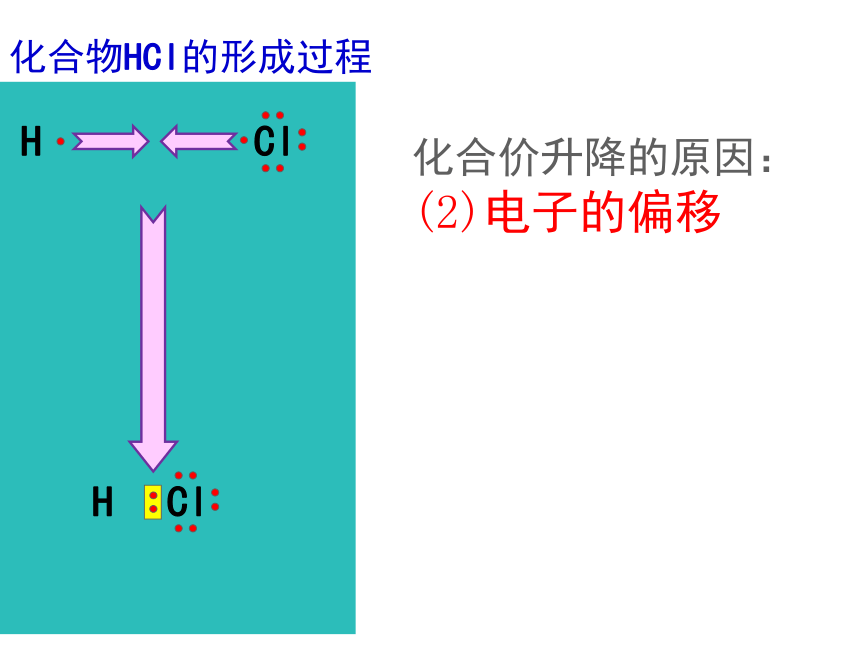
化合价升降的原因: (2)电子的偏移
Cl
H
H
Cl
氯化氢的形成(HCl)
电子对偏向 Cl
H元素化合价升高
被氧化
电子对偏向 Cl
Cl元素化合价降低
被还原
氧化反应
还原反应
H2 +Cl2====2HCl
0
0
+1
-1
点燃
化合价升高
化合价降低
总结:氧化还原反应的实质是---电子发生了转移(电子的得失或偏移)。
也就是说:有电子转移的化学反应都是氧化还原反应。
化合价升高
失电子
被氧化
化合价降低
得电子
被还原
氧化反应
还原反应
(升、失、氧)
(降、得、还)
化合价升高
失电子
被氧化
氧化反应
1.化合反应:有单质参加的是氧化还原反应。
2.分解反应:有单质生成的是氧化还原反应。
3.置换反应:全部是氧化还原反应。
4.复分解反应:都是非氧化还原反应。
那我们的四大基本反应类型与我们今天学习的氧化还原反应有什么联系呢?
(1)CaO+H2O = Ca(OH)2
(2)2Na+Cl2 =2 NaCl
(6)CuO+H2 ==Cu+H2O
(7)CaCO3== CaO+CO2
(5)CaCl2+Na2CO3 = CaCO3↓+2NaCl
(4)Fe+CuSO4 = FeSO4+Cu
(3)NaOH+HCl = NaCl+H2O
(8)H2O2==H2O+O2
Ⅰ无化合价变化的反应
Ⅱ有化合价变化的反应
(化合反应)
(置换反应)
(复分解反应)
(分解反应)
(化合反应)
(复分解反应)
(分解反应)
(置换反应)
MnO2
△
高温
点燃
置换反应
复分解反应
化合反应
分解反应
化学反应
氧化还原反应
非氧化还原反应
第三节 氧化还原反应
(第二课时)
二、氧化剂和还原剂
在反应中,得到电子(或电子对偏向)的物质是氧化剂,在反应时所含元素的化合价降低,发生还原反应。(降 得 还 氧)
在反应中,失去电子(或电子对偏离)的物质是还原剂,在反应时所含元素的化合价升高,发生氧化反应。(升 失 氧 还)
氧化剂:
还原剂:
氧化剂——化合价降低的反应物
还原产物—化台价降低的产物
还原剂——化合价升高的反应物
氧化产物——化合价升高的产物
氧化还原反应两对概念
氧化剂 + 还原剂 = 氧化产物 + 还原产物
失e-,化合价升高,被氧化
得e-,化合价降低,被还原
CuO + H2 == H2O + Cu
+2
0
0
+1
化合价升高,被氧化(氧化反应)
化合价降低,被还原(还原反应)
氧化剂
还原剂
氧化产物
还原产物
常见氧化剂:O2、Cl2、浓H2SO4、HNO3、KMnO4、FeCl3 等
常见还原剂:Al、Na、Cu、Zn、Fe、C、H2 、CO等
你还能补充一些吗?
练习:1. 指出下列氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物。
① Fe2O3 + 3CO 2Fe + 3CO2
② SO2 + 2H2S == 2H2O + 3S
③ Zn + 2HCl == ZnCl2 + H2↑
④ 2KClO3 2KCl + 3O2↑
氧化剂 还原剂 还原产物 氧化产物
氧化剂 还原剂 还原产物 ,氧化产物
还原剂 氧化剂 氧化产物 还原产物
还原剂与氧化剂 还原产物 氧化产物
(1)双线桥法
+2
0
0
+1
失2×e-,
被氧化
化合价升高,
得2e-,
被还原
化合价降低,
CuO + H2 == H2O + Cu
高温
步骤:①标价态②连双线③注得失
三、氧化还原反应电子转移的表示方法
用双线桥应注意的事项:
1、双线桥:同一元素从反应物指向生成物。
2、得失电子总数表示:变价的原子个数 × (化合价的变化值)e-。
3、反应中还原剂失去电子的总数等于氧化剂得到电子的总数。
3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O
0 +5 -1
失5e-,化合价升高,被氧化
得5×e-,化合价降低,被还原
用双线桥分析氧化还原反应
氧化剂___________ 还原剂___________
氧化产物__________ 还原产物_________
转移的电子数____________
Cl2
Cl2
KClO3
KCl
5e-
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
0 +5 +2 +2
失3×2e-,化合价升高,被氧化
得2×3e-,化合价降低,被还原
氧化剂___________ 还原剂___________
氧化产物__________ 还原产物_________
转移的电子数____________
HNO3
Cu
Cu(NO3)2
NO
6e-
单线相连失与得,方向电子要明确。
2e-
(2)单线桥表示法
单线桥注意事项:
2.不标得失,只标电子转移数目
1.箭头从失电子元素指向得电子元素
CuO + H2 === Cu + H2O
高温
练习: 用单线桥表示下列氧化还原反应。
2KClO3 == 2KCl +3O2
小结:
氧化剂(降 得 还 氧)对应还原产物。
还原剂(升 失 氧 还)对应氧化产物。
表示方法:双线桥法
单线桥法
第三节 氧 化 还 原 反 应
(第 三 课 时)
理清氧化还原反应三对概念的逻辑关系
氧化剂 + 还原剂 还原产物 + 氧化产物
失e-,化合价升高,被氧化
得e-,化合价降低,被还原
e-
氧化剂:具有氧化性,即物质得电子(电子偏向)、化合价降低的性质。
还原剂:具有还原性,即物质失电子(电子偏离)、化合价升高的性质。
结论:
最高价态……只具氧化性
最低价态……只具还原性
中间价态……兼有氧化性和还原性
练习:从化合价角度分析下列微粒的性质
在Fe3+、Fe2+、Al3+、H+、S、Zn、Cl-等粒子中只有氧化性的是 ,只有还原性的是 ,兼有氧化性和还原性的是 。
Fe3+、Al3+、H+
Zn、Cl-
Fe2+、S
高价氧化低价还,中间价态两性全。
元素常见化合价:
Fe:0, +2, +3 S:-2, 0 ,+4, +6 H:0 ,+1
Al:0 ,+3 Cl:-1 ,0, +1, +5, +7
氧化性和还原性相对强弱的比较
CuSO4 + Fe = Cu + FeSO4
还原性:Fe﹥ Cu
氧化性:CuSO4﹥ FeSO4 (Cu2+﹥ Fe2+)
方法一:(1)金属活动顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Ag
金属单质失电子能力增强,还原性逐渐增强
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ H+ Cu2+ Fe3+ Ag+
金属阳离子得电子能力增强,氧化性逐渐增强
(2)非金属活动顺序
非金属单质得电子能力增强,氧化性逐渐增强
F2 CI2 Br2 I2 S
F CI Br I S
-
-
-
2-
-
非金属阴离子失电子能力减弱还原性逐渐减弱
还原性:还原剂﹥ 还原产物
氧化性:氧化剂﹥ 氧化产物
方法二:依据反应方向判断
氧化剂 + 还原剂 = 氧化产物 + 还原产物
失e-,化合价升高,被氧化
得e-,化合价降低,被还原
方法三:根据反应结果(产物的价态)判断
同一物质在相同条件下,被不同氧化剂氧化的程度越大,氧化剂的氧化性越强。
如:
2Fe+3Cl2==2FeCl3
Fe+S=FeS
则氧化性:Cl2>S。
点燃
方法四:从反应所需条件和反应的剧烈程度判断
一组反应中,反应条件要求越低,反应越剧烈,对应反应物的氧化性或还原性越强。
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓)==2KCl+2MnCl2+ 5Cl2↑+8H2O
从反应条件可以看出氧化剂的氧化能力:KMnO4>MnO2。
△
例:己知反应:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
2FeCl2 + Cl2 = 2FeCl3
SO2 + I2 + 2H2O = H2SO4 + 2HI
判断下列物质的还原能力由强到弱的顺序是( )
A. I- > Fe2+> Cl- >SO2 B. Cl-> Fe2+> SO2 > I-
C. Fe2+>I- > Cl- > SO2 D. SO2>I- > Fe2+> Cl-
试判断下列物质Cl2、 Fe3+ 、I2 、SO2的氧化能力由强到弱的顺序是( )
D
Cl2 > Fe3+ > I2 > SO2
练习1:
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是( )
B
(A)无水硫酸铜、蔗糖 (B)硅胶、硫酸亚铁
(C)食盐、硫酸亚铁 (D)生石灰、食盐
练习2:
苹果汁是人们喜欢的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生,说明维生素C具有( )
B
(A)氧化性 (B)还原性
(C)碱性 (D)酸性
为什么加入维生素C就能防止Fe2+被氧化?
维生素C比Fe2+的还原性强
步骤:三标一查
①标电子得失及其得失总数
②标化合价变化
③标反应类型
④查转移电子是否相等
