气体摩尔体积
图片预览






文档简介
(共25张PPT)
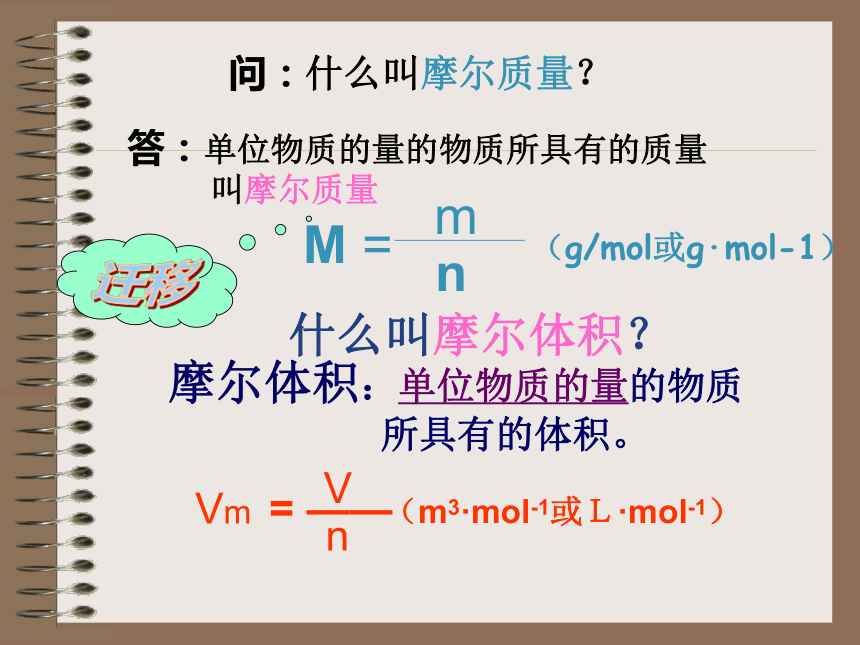
问:什么叫摩尔质量?
答:单位物质的量的物质所具有的质量
叫摩尔质量
什么叫摩尔体积?
摩尔体积:单位物质的量的物质
所具有的体积。
Vm
(m3·mol-1或L·mol-1)
V
n
= ——
M =
m
n
(g/mol或g·mol-1)
物质摩尔体积 相同吗???
固体物质
1mol铁
1mol铝
1mol铅
6.02×1023
个原子
55.8克
6.02×1023
个原子
26.98克
7.1cm
3
10cm
3
18.3cm
3
个原子
207.2克
6.02×1023
1mol水
1mol硫酸
6.02×1023
个分子
98克
6.02×1023
个分子
18克
18.0cm
3
54.1cm
3
液体物质
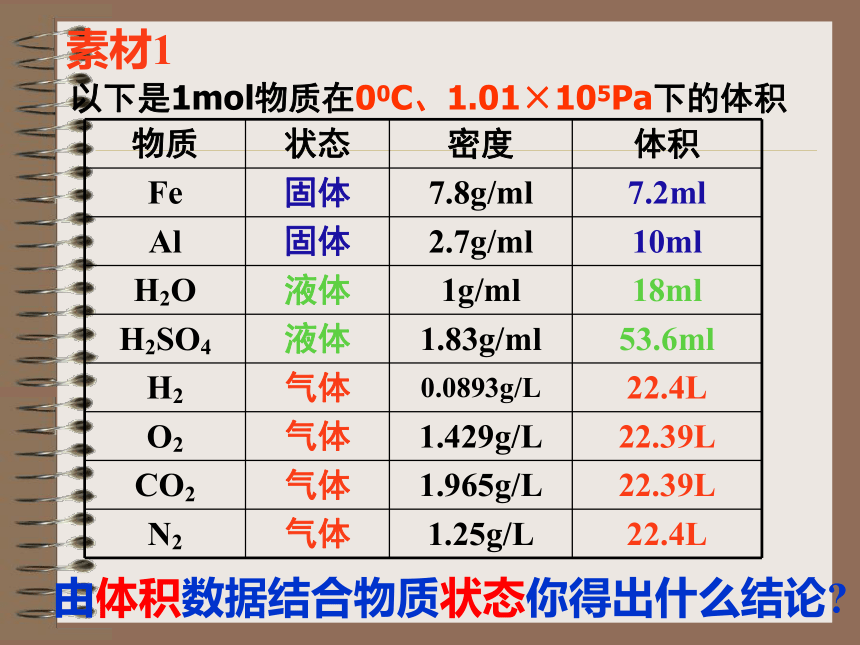
素材1
以下是1mol物质在00C、1.01×105Pa下的体积
物质 状态 密度 体积
Fe 固体 7.8g/ml 7.2ml
Al 固体 2.7g/ml 10ml
H2O 液体 1g/ml 18ml
H2SO4 液体 1.83g/ml 53.6ml
H2 气体 0.0893g/L 22.4L
O2 气体 1.429g/L 22.39L
CO2 气体 1.965g/L 22.39L
N2 气体 1.25g/L 22.4L
由体积数据结合物质状态你得出什么结论
结论:
1. 1摩尔不同的固态或液态物质,体积不同。
2. 在相同状况下, 1摩尔任何气体的体积基本相同。
思考:在相同状况下,为什么1mol不同的固态和液态物质的体积不同,而气态物质的体积却几乎相同呢?
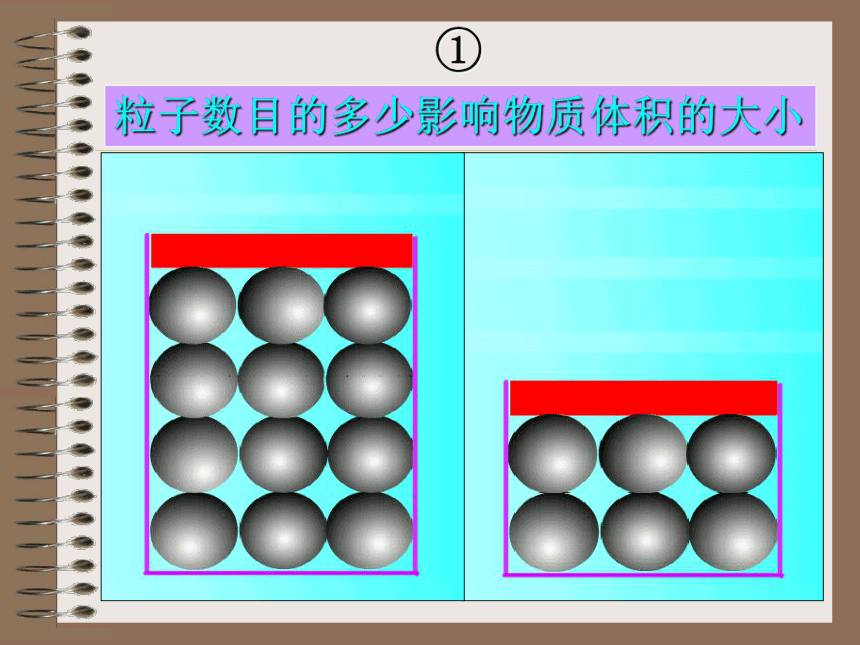
①
粒子数目的多少影响物质体积的大小
②
粒子本身的大小影响物质体积的大小
③
粒子之间的距离影响物质体积的大小
一、影响物质体积大小 的因素
外因:
内因:
(1) 温度
(2) 压强
(1)粒子数目多少
(2)粒子本身大小
(3)粒子间的平均距离
1.固体液体物质中,粒子紧密排列,粒子的距离近似为零。所以固体液体的体积主要决定于粒子的数目和粒子的大小。
粒子之间距离很大时(比如气体),粒子本身的大小对物质的体积影响很小,几乎可以忽略。
2.粒子间的距离
2、决定气体物质体积大小的因素
思考:气体分子间的距离和什么有关?
1.粒子的数目
①温度升高,气体分子间的平均距离增大,体积增大
②压强增大,气体分子间的平均距离减小。体积减小。
二、气体摩尔体积
定义:单位物质的量(1mol)的气体所 占体积。
符号: Vm
公式:
Vm=
V
n
常用单位有L/mol(L·mol-1)和m3/mol。
1.适用范围:任何气体
2.状况:一定温度和压强下,通常用标准状况
3.定量:1mol
4.Vm=22.4L/mol 的成立条件:
标准状况下
5. 22.4L/mol为近似值
6. 比较气体体积必须指明温度和压强
7.并不是只有标准状况下,Vm=22.4L/mol
混合气体或者纯净气体
0℃、一个大气压
几点注意:
练习
1、判断下列说法是否正确?为什么?
(2)标准状况下任何气体的体积都约是22.4L
(4)1摩尔H2O在标准状况下的体积约为22.4L
(5)1摩尔SO2在20 ℃时的体积比22.4L大
错
错
对
错
错
错
2、填写下列空白:
(1)标况下,0.5molH2占有的体积是 L
(2)标况下, 2molO2占有的体积是 L
(3)标况下,4.48LCO2的物质的量是 mol
(4)标况下,33.6LH2 的物质的量是 mol
(1) 在标准状况下,1mol任何物质体积为22.4L
(3)标准状况下,1molO2和N2混合气体的体积约为22.4L。
(6)只有在标准状况下,气体的摩尔体积才约为
22.4L/mol
3、在标准状况下, 2 . 2 g CO2 的体积是多少?
n(CO2) =
m [CO2]
M[CO2]
=
2 . 2 g
44 g ·mol -1
=
0 . 05mol
V(CO2) =
n(CO2) · Vm(CO2)
= 0 . 05 mol × 22 . 4 L / mol
= 1 . 1 2L
解:
在相同的温度和压强下,相同体积的任何气体都含相同数目的分子吗?为什么?
思考:
三、阿伏加德罗定律
内容:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
即: V1/V2 = N1/N2 = n1/n2
注意:
(1)理解:“同温、同压、同体积、同分子数”
只要有任何的“三同”,必有“四同”。
(2)适用于气态物质。既适用于单一气体,又适用于混合气体。
课堂小结
一、决定物质体积大小的因素 决定气体物质体积大小的因素
二、气体摩尔体积:定义、符号、公式、常用
单位、标准状况
三、阿伏加德罗定律:内容、适用对象、应用
条件
你们掌握了吗?
课堂练习
1.判断下列说法是否正确?为什么?
(1)1LN2和1LO2在同温同压下所含分子数相同;
(2)1molN2和1molO2所占体积相同;
(3)1molN2和1molO2所含分子数相同;
2.3molO2和2molO3分子数之比为————;
在相同条件下气体的体积比为————。
问:什么叫摩尔质量?
答:单位物质的量的物质所具有的质量
叫摩尔质量
什么叫摩尔体积?
摩尔体积:单位物质的量的物质
所具有的体积。
Vm
(m3·mol-1或L·mol-1)
V
n
= ——
M =
m
n
(g/mol或g·mol-1)
物质摩尔体积 相同吗???
固体物质
1mol铁
1mol铝
1mol铅
6.02×1023
个原子
55.8克
6.02×1023
个原子
26.98克
7.1cm
3
10cm
3
18.3cm
3
个原子
207.2克
6.02×1023
1mol水
1mol硫酸
6.02×1023
个分子
98克
6.02×1023
个分子
18克
18.0cm
3
54.1cm
3
液体物质
素材1
以下是1mol物质在00C、1.01×105Pa下的体积
物质 状态 密度 体积
Fe 固体 7.8g/ml 7.2ml
Al 固体 2.7g/ml 10ml
H2O 液体 1g/ml 18ml
H2SO4 液体 1.83g/ml 53.6ml
H2 气体 0.0893g/L 22.4L
O2 气体 1.429g/L 22.39L
CO2 气体 1.965g/L 22.39L
N2 气体 1.25g/L 22.4L
由体积数据结合物质状态你得出什么结论
结论:
1. 1摩尔不同的固态或液态物质,体积不同。
2. 在相同状况下, 1摩尔任何气体的体积基本相同。
思考:在相同状况下,为什么1mol不同的固态和液态物质的体积不同,而气态物质的体积却几乎相同呢?
①
粒子数目的多少影响物质体积的大小
②
粒子本身的大小影响物质体积的大小
③
粒子之间的距离影响物质体积的大小
一、影响物质体积大小 的因素
外因:
内因:
(1) 温度
(2) 压强
(1)粒子数目多少
(2)粒子本身大小
(3)粒子间的平均距离
1.固体液体物质中,粒子紧密排列,粒子的距离近似为零。所以固体液体的体积主要决定于粒子的数目和粒子的大小。
粒子之间距离很大时(比如气体),粒子本身的大小对物质的体积影响很小,几乎可以忽略。
2.粒子间的距离
2、决定气体物质体积大小的因素
思考:气体分子间的距离和什么有关?
1.粒子的数目
①温度升高,气体分子间的平均距离增大,体积增大
②压强增大,气体分子间的平均距离减小。体积减小。
二、气体摩尔体积
定义:单位物质的量(1mol)的气体所 占体积。
符号: Vm
公式:
Vm=
V
n
常用单位有L/mol(L·mol-1)和m3/mol。
1.适用范围:任何气体
2.状况:一定温度和压强下,通常用标准状况
3.定量:1mol
4.Vm=22.4L/mol 的成立条件:
标准状况下
5. 22.4L/mol为近似值
6. 比较气体体积必须指明温度和压强
7.并不是只有标准状况下,Vm=22.4L/mol
混合气体或者纯净气体
0℃、一个大气压
几点注意:
练习
1、判断下列说法是否正确?为什么?
(2)标准状况下任何气体的体积都约是22.4L
(4)1摩尔H2O在标准状况下的体积约为22.4L
(5)1摩尔SO2在20 ℃时的体积比22.4L大
错
错
对
错
错
错
2、填写下列空白:
(1)标况下,0.5molH2占有的体积是 L
(2)标况下, 2molO2占有的体积是 L
(3)标况下,4.48LCO2的物质的量是 mol
(4)标况下,33.6LH2 的物质的量是 mol
(1) 在标准状况下,1mol任何物质体积为22.4L
(3)标准状况下,1molO2和N2混合气体的体积约为22.4L。
(6)只有在标准状况下,气体的摩尔体积才约为
22.4L/mol
3、在标准状况下, 2 . 2 g CO2 的体积是多少?
n(CO2) =
m [CO2]
M[CO2]
=
2 . 2 g
44 g ·mol -1
=
0 . 05mol
V(CO2) =
n(CO2) · Vm(CO2)
= 0 . 05 mol × 22 . 4 L / mol
= 1 . 1 2L
解:
在相同的温度和压强下,相同体积的任何气体都含相同数目的分子吗?为什么?
思考:
三、阿伏加德罗定律
内容:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
即: V1/V2 = N1/N2 = n1/n2
注意:
(1)理解:“同温、同压、同体积、同分子数”
只要有任何的“三同”,必有“四同”。
(2)适用于气态物质。既适用于单一气体,又适用于混合气体。
课堂小结
一、决定物质体积大小的因素 决定气体物质体积大小的因素
二、气体摩尔体积:定义、符号、公式、常用
单位、标准状况
三、阿伏加德罗定律:内容、适用对象、应用
条件
你们掌握了吗?
课堂练习
1.判断下列说法是否正确?为什么?
(1)1LN2和1LO2在同温同压下所含分子数相同;
(2)1molN2和1molO2所占体积相同;
(3)1molN2和1molO2所含分子数相同;
2.3molO2和2molO3分子数之比为————;
在相同条件下气体的体积比为————。
