华东师大版八年级科学上册第六章第四节《化学式》第三课时(课件 共25张ppt)
文档属性
| 名称 | 华东师大版八年级科学上册第六章第四节《化学式》第三课时(课件 共25张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-10-12 00:00:00 | ||
图片预览







文档简介
(共27张PPT)
第六章
物质的构成
第4节
化学式(3)
如果用“
”
表示氢原子,请你用示意图来表示2H、
H2、
2H2
,并叙述其中
的“2”各代表什么意义?
2H
,表示
;
H2
,表示
;
2H2
,
。
2个氢原子
一个氢分子由2个氢原子构成
前面的“2”表示2个氢分子;
后面的“2”表示1个氢分子由2个氢原子构成
1、请你写出元素符号周围数字的含义:
2、下列化学式的书写中不正确的是(
)
A.CaCl2
B.AlCl2
C.H2SO4
D.H2O
3、在下列物质中,氮的化合价最低的是(
)
A.N2
B.NO2
C.HNO3
D.NH3
B
D
1、掌握单质、化合物的化学式的书写方法;
2、能根据物质的名称写出相应的化学式;
3、知道化学式的式量(相对分子质量)的含义
和计算方法。
金属单质:铁
铝
固态非金属单质:硫
磷
稀有气体:氖气
氦气
Fe
Al
S
P
He
Ne
氧气
氢气
氮气
氯气
气体非金属单质:
O2
H2
用元素符号直接
表示化学式
在元素符号
右下角加上数字表示化学式
N2
Cl2
化学式的书写方法
1、单质:
练习单质的书写
请写出下列物质的化学式:
(1)氧气
;
(2)氩气
;
(3)氯气
;
(4)木炭
;
(5)固态碘
。
O2
He
Cl2
C
I2
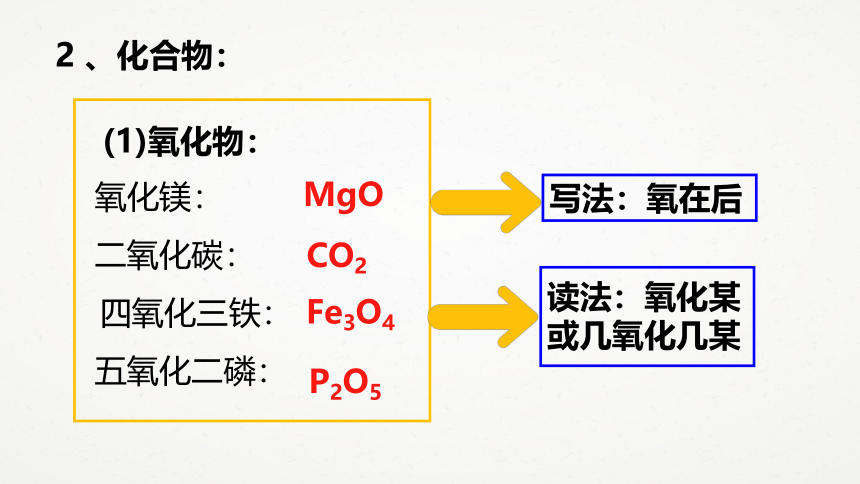
MgO
Fe3O4
CO2
P2O5
写法:氧在后
读法:氧化某
或几氧化几某
2
、化合物:
氧化镁:
二氧化碳:
四氧化三铁:
五氧化二磷:
(1)氧化物:
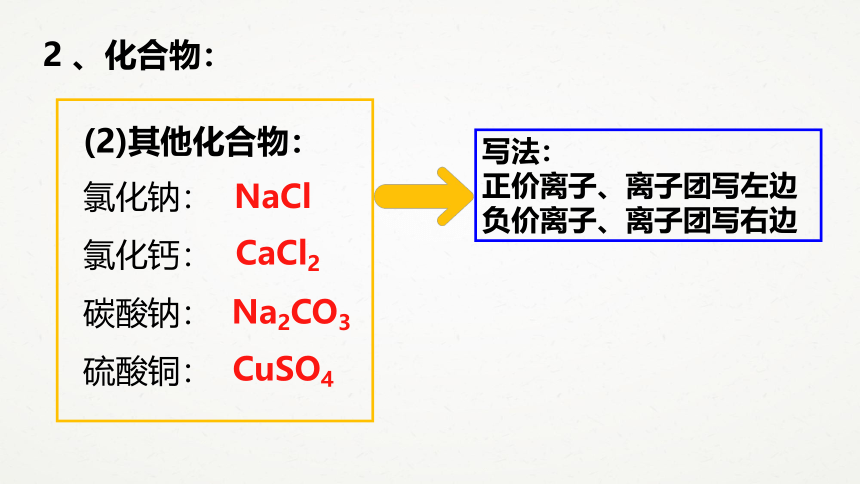
NaCl
CaCl2
Na2CO3
CuSO4
写法:
正价离子、离子团写左边
负价离子、离子团写右边
2
、化合物:
氯化钠:
氯化钙:
碳酸钠:
硫酸铜:
(2)其他化合物:
①
写出元素符号,正价在左边,负价在右边,化合价标在元素的正上方。
例:氧化铝的化学式的书写
Al
O
+3
-2
化学式书写的一般步骤
②
交叉法,把原子数写在各元素的符号的下方。
Al
O
+3
-2
3
2
例:氧化铝的化学式的书写
化学式书写的一般步骤
③
按正价与负价的代数和为0的原则检查化学式
书写是否正确。
Al2O3
(+3)×2+(-3)×3=0
例:氧化铝的化学式的书写
化学式书写的一般步骤
①
写出元素符号和原子团,正价在左边,负价在右边,化合价标在它们的正上方。
例:硫酸铝的化学式的书写
Al
SO4
+3
-2
化学式书写的一般步骤
例:硫酸铝的化学式的书写
Al
SO4
+3
-2
化学式书写的一般步骤
②
交叉法,确定铝离子个数为2,硫酸根离子个数为3。
例:硫酸铝的化学式的书写
Al
SO4
+3
-2
化学式书写的一般步骤
③
要表示2个或2个以上的原子团,必须给原子团加上括号,再在右下角标上阿拉伯数字。最后检查。
2
(
)
3
练习氧化物的书写
请写出下列物质的化学式:
(1)二氧化碳
;
(2)三氧化硫
;
(3)氧化亚铁
;
(4)氧化铁
;
(5)四氧化三铁
。
CO2
SO3
FeO
Fe2O3
Fe3O4
练习有原子团(根)的化学式的书写
请写出下列物质的化学式:
(1)氢氧化钠
;
(2)氢氧化铝
;
(3)硫酸铁
;
(4)氯化铵
;
(5)碳酸钙
。
NaOH
Al(OH)3
Fe2(SO)3
(NH4)Cl
CaCO3
分子的质量就是化学式中各原子的质量的总和。
故各原子的相对原子质量的总和即为化学式的式量(相对分子质量)。
式量(相对分子质量)
如:CaO
的式量=40+16=56
O2的式量=16
×2=32
H2SO4的式量=1
×2+32+16
×4=98
练习相对分子质量的计算
请写出下列物质的相对分子质量:
(1)二氧化碳
;
(2)氢氧化钠
;
(3)氧化亚铁
;
(4)硫酸
;
(5)氯化氢
。
44
40
72
98
36.5
根据化学式的计算
1、计算物质的相对分子质量
练习1:计算
KMnO4
的相对分子质量。
练习2:计算
(NH4)2CO3
的相对分子质量。
例1:
计算二氧化碳(CO2)的相对分子质量。
二氧化碳(CO2)的相对分子质量=12+16×
2=44
例2:
计算Cu2(OH)2CO3的相对分子质量。
Cu2(OH)2CO3的相对分子质量=64×2+(16+1)
×2+12+16×3=222
2、计算组成物质的各元素的质量比
练习1:计算水中氢元素和氧元素的质量比。
练习2:求硫酸(H2SO4)中各元素的质量比。
例题:二氧化碳中碳元素和氧元素的质量比
C:O=12:16×2=3:8
H2O中氢元素和氧元素的质量比
H:O=1×2:16=1:16
H2SO4中氢、硫、氧三种元素的质量比
H:S:O=1×2:32:16×4=1:16:32
例题:
求出水中氢元素的质量分数
练习:
求出二氧化硫中硫元素的质量分数。
解:
H%=
=
=
=
11.1%
解:S%=
=
=50%
2H
H2O
2
18
S
SO2
32
64
3、计算物质中某一元素的质量分数
1×2
1×2+16
练习:求出22克二氧化碳中氧元素的质量。
mN=mCO2
×二氧化碳中氧的质量分数
=22克×
——
=16克
2O
CO2
4、计算纯净物中某一元素的质量
例题:
求出18克水中氧元素的质量分数。
mO=mH2O
×水分子中氧的质量分数
=18克×
——
=16克
2H
H2O
1、金属单质:
用元素符号表示它们的化学式。
2、稀有气体:
用元素符号表示它们的化学式。
3、一般固态非金属单质:
用元素符号表示它们的化学式。
4、某些气体:
用元素符号右下角加小数字表示。
一、化学式的书写
(一)单质:
1、(1)氧化物:写出组成氧化物的元素符号。氧元素符号写在右边,
其他元素符号写在左边。
(2)其他化合物:写出元素或原子团符号,一般后读(正价)元素(原子团)写在左边,先读(负价)元素(或原子团)写在右边。
2、根据化合物的正负化合价的代数和为零的原则,确定各元素的原子个数(或原子个数比)。
3、把原子数写在各元素符号的右下角,即得到化学式(原子数为1时省略)。
4、检查化学式,正价总数与负价总数的代数和为零。
(二)化合物:
二、相对分子质量(式量)
分子的质量就是化学式中各原子的质量的总和。
各原子的相对原子质量的总和即为化学式的式量(相对分子质量)。
第六章
物质的构成
第4节
化学式(3)
如果用“
”
表示氢原子,请你用示意图来表示2H、
H2、
2H2
,并叙述其中
的“2”各代表什么意义?
2H
,表示
;
H2
,表示
;
2H2
,
。
2个氢原子
一个氢分子由2个氢原子构成
前面的“2”表示2个氢分子;
后面的“2”表示1个氢分子由2个氢原子构成
1、请你写出元素符号周围数字的含义:
2、下列化学式的书写中不正确的是(
)
A.CaCl2
B.AlCl2
C.H2SO4
D.H2O
3、在下列物质中,氮的化合价最低的是(
)
A.N2
B.NO2
C.HNO3
D.NH3
B
D
1、掌握单质、化合物的化学式的书写方法;
2、能根据物质的名称写出相应的化学式;
3、知道化学式的式量(相对分子质量)的含义
和计算方法。
金属单质:铁
铝
固态非金属单质:硫
磷
稀有气体:氖气
氦气
Fe
Al
S
P
He
Ne
氧气
氢气
氮气
氯气
气体非金属单质:
O2
H2
用元素符号直接
表示化学式
在元素符号
右下角加上数字表示化学式
N2
Cl2
化学式的书写方法
1、单质:
练习单质的书写
请写出下列物质的化学式:
(1)氧气
;
(2)氩气
;
(3)氯气
;
(4)木炭
;
(5)固态碘
。
O2
He
Cl2
C
I2
MgO
Fe3O4
CO2
P2O5
写法:氧在后
读法:氧化某
或几氧化几某
2
、化合物:
氧化镁:
二氧化碳:
四氧化三铁:
五氧化二磷:
(1)氧化物:
NaCl
CaCl2
Na2CO3
CuSO4
写法:
正价离子、离子团写左边
负价离子、离子团写右边
2
、化合物:
氯化钠:
氯化钙:
碳酸钠:
硫酸铜:
(2)其他化合物:
①
写出元素符号,正价在左边,负价在右边,化合价标在元素的正上方。
例:氧化铝的化学式的书写
Al
O
+3
-2
化学式书写的一般步骤
②
交叉法,把原子数写在各元素的符号的下方。
Al
O
+3
-2
3
2
例:氧化铝的化学式的书写
化学式书写的一般步骤
③
按正价与负价的代数和为0的原则检查化学式
书写是否正确。
Al2O3
(+3)×2+(-3)×3=0
例:氧化铝的化学式的书写
化学式书写的一般步骤
①
写出元素符号和原子团,正价在左边,负价在右边,化合价标在它们的正上方。
例:硫酸铝的化学式的书写
Al
SO4
+3
-2
化学式书写的一般步骤
例:硫酸铝的化学式的书写
Al
SO4
+3
-2
化学式书写的一般步骤
②
交叉法,确定铝离子个数为2,硫酸根离子个数为3。
例:硫酸铝的化学式的书写
Al
SO4
+3
-2
化学式书写的一般步骤
③
要表示2个或2个以上的原子团,必须给原子团加上括号,再在右下角标上阿拉伯数字。最后检查。
2
(
)
3
练习氧化物的书写
请写出下列物质的化学式:
(1)二氧化碳
;
(2)三氧化硫
;
(3)氧化亚铁
;
(4)氧化铁
;
(5)四氧化三铁
。
CO2
SO3
FeO
Fe2O3
Fe3O4
练习有原子团(根)的化学式的书写
请写出下列物质的化学式:
(1)氢氧化钠
;
(2)氢氧化铝
;
(3)硫酸铁
;
(4)氯化铵
;
(5)碳酸钙
。
NaOH
Al(OH)3
Fe2(SO)3
(NH4)Cl
CaCO3
分子的质量就是化学式中各原子的质量的总和。
故各原子的相对原子质量的总和即为化学式的式量(相对分子质量)。
式量(相对分子质量)
如:CaO
的式量=40+16=56
O2的式量=16
×2=32
H2SO4的式量=1
×2+32+16
×4=98
练习相对分子质量的计算
请写出下列物质的相对分子质量:
(1)二氧化碳
;
(2)氢氧化钠
;
(3)氧化亚铁
;
(4)硫酸
;
(5)氯化氢
。
44
40
72
98
36.5
根据化学式的计算
1、计算物质的相对分子质量
练习1:计算
KMnO4
的相对分子质量。
练习2:计算
(NH4)2CO3
的相对分子质量。
例1:
计算二氧化碳(CO2)的相对分子质量。
二氧化碳(CO2)的相对分子质量=12+16×
2=44
例2:
计算Cu2(OH)2CO3的相对分子质量。
Cu2(OH)2CO3的相对分子质量=64×2+(16+1)
×2+12+16×3=222
2、计算组成物质的各元素的质量比
练习1:计算水中氢元素和氧元素的质量比。
练习2:求硫酸(H2SO4)中各元素的质量比。
例题:二氧化碳中碳元素和氧元素的质量比
C:O=12:16×2=3:8
H2O中氢元素和氧元素的质量比
H:O=1×2:16=1:16
H2SO4中氢、硫、氧三种元素的质量比
H:S:O=1×2:32:16×4=1:16:32
例题:
求出水中氢元素的质量分数
练习:
求出二氧化硫中硫元素的质量分数。
解:
H%=
=
=
=
11.1%
解:S%=
=
=50%
2H
H2O
2
18
S
SO2
32
64
3、计算物质中某一元素的质量分数
1×2
1×2+16
练习:求出22克二氧化碳中氧元素的质量。
mN=mCO2
×二氧化碳中氧的质量分数
=22克×
——
=16克
2O
CO2
4、计算纯净物中某一元素的质量
例题:
求出18克水中氧元素的质量分数。
mO=mH2O
×水分子中氧的质量分数
=18克×
——
=16克
2H
H2O
1、金属单质:
用元素符号表示它们的化学式。
2、稀有气体:
用元素符号表示它们的化学式。
3、一般固态非金属单质:
用元素符号表示它们的化学式。
4、某些气体:
用元素符号右下角加小数字表示。
一、化学式的书写
(一)单质:
1、(1)氧化物:写出组成氧化物的元素符号。氧元素符号写在右边,
其他元素符号写在左边。
(2)其他化合物:写出元素或原子团符号,一般后读(正价)元素(原子团)写在左边,先读(负价)元素(或原子团)写在右边。
2、根据化合物的正负化合价的代数和为零的原则,确定各元素的原子个数(或原子个数比)。
3、把原子数写在各元素符号的右下角,即得到化学式(原子数为1时省略)。
4、检查化学式,正价总数与负价总数的代数和为零。
(二)化合物:
二、相对分子质量(式量)
分子的质量就是化学式中各原子的质量的总和。
各原子的相对原子质量的总和即为化学式的式量(相对分子质量)。
同课章节目录
- 第1章 运动和力
- 1 机械运动
- 2 力
- 3 几种常见的力
- 4 运动和力
- 5 二力平衡的条件
- 第2章 压力 压强
- 1 压强
- 2 液体内部的压强
- 3 大气压强
- 4 流体的压强与流速的关系
- 第3章 浮力
- 1 密度
- 2 浮力
- 3 阿基米德原理
- 4 物体浮沉条件及其应用
- 第4章 植物的物质和能量的转化
- 1 绿色开花植物的营养器官
- 2 水在植物体中的代谢
- 3 无机盐在植物体内的代谢
- 4 植物的光合作用和呼吸作用
- 第5章 人体的物质和能量的转化
- 1 食物的消化和吸收
- 2 人体的呼吸
- 3 人体内的物质运输
- 4 人体的排泄
- 5 人体生命活动过程中物质和能量的转化
- 第6章 物质的构成
- 1 构成物质的微粒
- 2 元素
- 3 物质的分类
- 4 化学式
- 5 固态物质
