人教版高二化学选修3 第一章 原子结构与性质 章末测试题
文档属性
| 名称 | 人教版高二化学选修3 第一章 原子结构与性质 章末测试题 |

|
|
| 格式 | docx | ||
| 文件大小 | 120.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-13 16:19:14 | ||
图片预览



文档简介
人教版第一章原子结构与性质章末测试题
一、单选题
具有下列电子层结构的原子,其第一电离能由大到小排列正确的是
能级上只有一对成对电子的原子外围电子构型为的原子其3p能级为半满的原子正三价的阳离子结构与氖相同的原子
A.
B.
C.
D.
X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍.下列有关叙述正确的是
A.
Y的价层电子排布式为
B.
稳定性:Y的氢化物的氢化物
C.
第一电离能:
D.
X、Y两元素形成的化合物为离子化合物
如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是
A.
电负性:
B.
离子半径:
C.
分子中各原子的最外层均满足8电子稳定结构
D.
Z元素基态原子最外层电子排布图为?
下列有关微粒性质的排列顺序中,错误的是
A.
元素的电负性:
B.
元素的第一电离能:
C.
离子半径:
D.
原子的未成对电子数:
原子核外P能层和p能级可容纳的最多电子数分别为
A.
32和2
B.
50和6
C.
72和6
D.
86和10
构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以表示某能级的能量,以下各式中正确的是
A.
B.
C.
D.
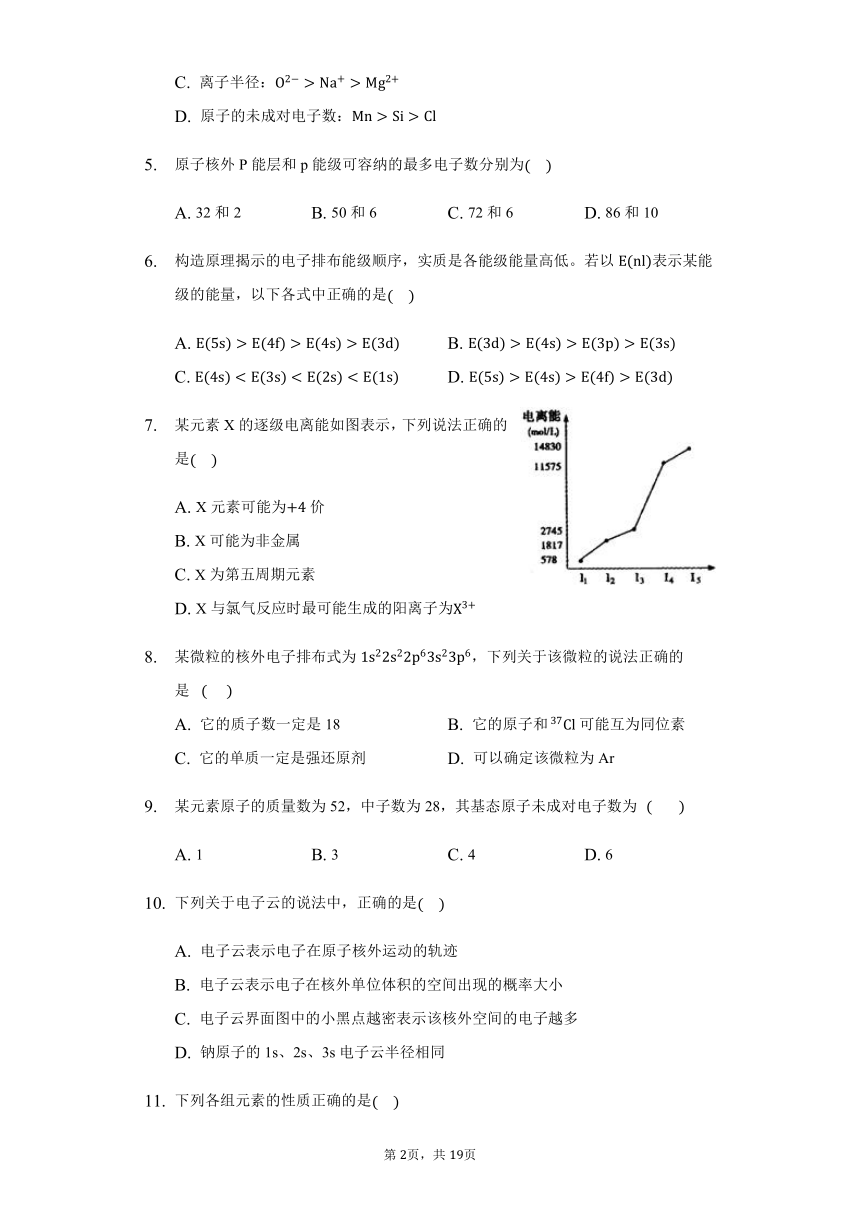
某元素X的逐级电离能如图表示,下列说法正确的是
A.
X元素可能为价
B.
X可能为非金属
C.
X为第五周期元素
D.
X与氯气反应时最可能生成的阳离子为
某微粒的核外电子排布式为,下列关于该微粒的说法正确的是?
???
A.
它的质子数一定是18
B.
它的原子和可能互为同位素
C.
它的单质一定是强还原剂
D.
可以确定该微粒为Ar
某元素原子的质量数为52,中子数为28,其基态原子未成对电子数为
?
?
?
A.
1
B.
3
C.
4
D.
6
下列关于电子云的说法中,正确的是
A.
电子云表示电子在原子核外运动的轨迹
B.
电子云表示电子在核外单位体积的空间出现的概率大小
C.
电子云界面图中的小黑点越密表示该核外空间的电子越多
D.
钠原子的1s、2s、3s电子云半径相同
下列各组元素的性质正确的是
A.
第一电离能:
B.
电负性:
C.
最高正价:
D.
原子半径:
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为,b与c形成的化合物的电子式为下列说法中正确的是
A.
原子半径:
B.
电负性:
C.
原子序数:
D.
最高价含氧酸的酸性:
如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是
A.
离子半径:
B.
氢化物的稳定性:
C.
失去电子能力:
D.
单质的氧化性:
已知号元素的离子、、、都具有相同的电子层结构,下列关系正确的是
A.
质子数,离子的还原性
B.
氢化物的稳定性
C.
原子半径,第一电离能
D.
电负性
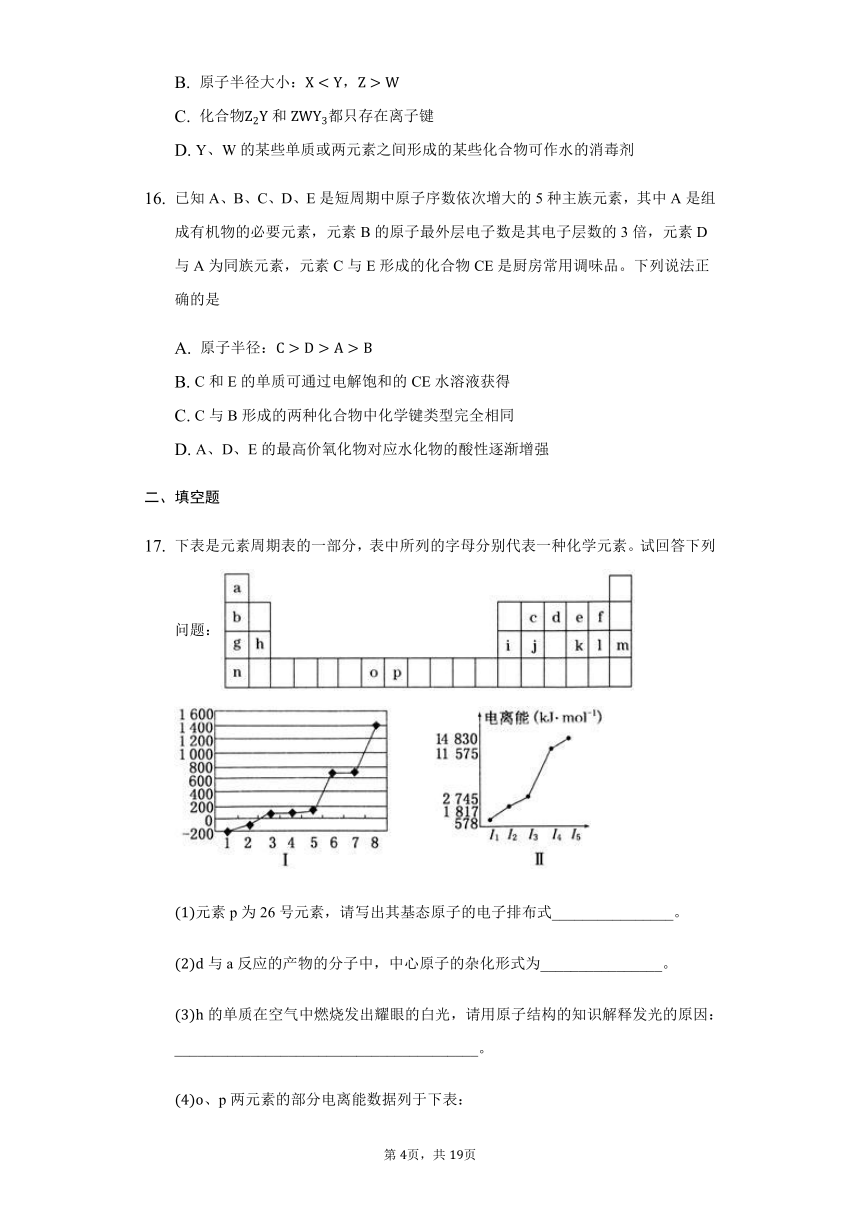
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3:4,的最外层为8电子结构,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,下列说法正确的是
A.
X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B.
原子半径大小:,
C.
化合物和都只存在离子键
D.
Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,元素B的原子最外层电子数是其电子层数的3倍,元素D与A为同族元素,元素C与E形成的化合物CE是厨房常用调味品。下列说法正确的是
A.
原子半径:
B.
C和E的单质可通过电解饱和的CE水溶液获得
C.
C与B形成的两种化合物中化学键类型完全相同
D.
A、D、E的最高价氧化物对应水化物的酸性逐渐增强
二、填空题
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
元素p为26号元素,请写出其基态原子的电子排布式________________。
与a反应的产物的分子中,中心原子的杂化形式为________________。
的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:________________________________________。
、p两元素的部分电离能数据列于下表:
元素
o
p
电离能
717
759
1509
1561
3248
2957
比较两元素的、可知,气态再失去一个电子比气态再失去一个电子难。对此,你的解释是______________________________________________。
第三周期8种元素按单质熔点高低的顺序如图Ⅰ所示,其中电负性最大的是_______________填图中的序号。
表中所列的某主族元素的电离能情况如图Ⅱ所示,则该元素是____________填元素符号。
请回答:
Ⅰ:C、N、O、Al、Si、Cu是常见的六种元素.
位于元素周期表第
______
周期第
______
族.
的基态原子核外电子排布式为
______
;Cu的基态原子最外层有
______
个电子.
用“”或“”填空:
原子半径
电负性
熔点
沸点
Al
______
Si
N
______
O
金刚石
______
晶体硅
______
Ⅱ:
的电子式
______
.
镁燃烧不能用灭火,用化学方程式表示其理由
______
.
在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式
______
.
完成以下氧化还原反应的离子方程式:
______
______
______
______
______
______
.
已知5种元素的原子序数的大小顺序为、C同周期,B、C同主族与B形成的离子化合物中所有离子的电子数相同,其电子总数为和E可形成4核10电子分子,完成下列问题:
写出5种元素的名称:A_______B______C______D______E______
用电子式表示离子化合物的形成过程__________________________________________
写出D元素形成的单质的结构式:_________________
写出下列物质的电子式:
E与B形成的化合物_____________
A、B、E形成的化合物________________
D、E形成的化合物_________________
三、实验题
X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如表所示:
X
Y
Z
W
R
P
Q
原子半径
主要化合价
,
,
,
其他
阳离子核外无电子
无机非金属材料的主角
焰色反应呈黄色
在自然界中有质量数为35和37的两种核素,它们之间的关系是互为______.
的单质与水反应的化学方程式是______;R与Q两元素最高价氧化物水化物反应的离子方程式______.
与R相比,非金属性较强的是______用元素符号表示,下列事实能证明这一结论的是______填字母序号.
常温下Y的单质呈固态,R的单质呈气态
稳定性
与R形成的化合物中Y呈正价
写出工业制取Y的单质的化学方程式______.
反应?过程中的能量变化如图所示,回答下列问题.
该反应是______反应填“吸热”“放热”;
反应体系中加入催化剂对反应热是否有影响?______,原因是______从能量说明
氨气是共价型氢化物.工业常用氨气和醋酸二氨合铜的混合液来吸收一氧化碳醋酸根简写为反应方程式为:?
请写出基态Cu原子的电子排布式?______??
氨水溶液中各元素原子的电负性从大到小排列顺序为?______??
醋酸分子中的两个碳原子,甲基碳和羧基碳的杂化方式分别是?______??
生成物中所含化学键类型有?______??
离子键????????配位键??????????键??????????
A、B、C、D、E为同周期原子序数依次增大的短周期元素,已知A、B、种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
写出下列元素符号:
____________?,B____________,C___________,D__________,E____________
与E两元素可形成化合物,用电子式表示其化合物的形成过程:____________________________________________________________?。
写出A、B两元素的最高价氧化物的水化物相互反应的化学方程式:__________________________________________________________?。
、D、E的氢化物稳定性由强到弱依次为:用化学式表示________________________________?。
答案和解析
1.【答案】C
【解答】
轨道上只有一对成对电子的原子,则该元素为S;
外围电子构型为的原子,则该元素为Ar;
其3p轨道为半充满的原子,则该元素为P;
正三价的阳离子结构与氖相同的原子,则该元素为Al.
已知同周期从左到右,第一电离能逐渐增大,第VA族和第VIA族反常,同周期稀有气体的第一电离能最大;
所以第一电离能由大到小排列为,即第一电离能由大到小排列为:,故C正确。
故选C。
2.【答案】C
【解析】解:X、Y、Z为短周期元素,X原子最外层只有一个电子,则X为H、Li或Na;Y原子的最外层电子数比内层电子总数少4,则Y有3个电子层,最外层有6个电子,则Y为硫元素;Z的最外层电子数是内层电子总数的三倍,则Z有2个电子层,最外层电子数为6,则Z为氧元素,
A.Y为硫元素,Y的价层电子排布式为,故A错误;
B.Y为硫元素,Z为氧元素,非金属性,非金属性越强,氢化物越稳定,氢化物稳定性,故B错误;
C.Y为硫元素,Z为氧元素,第一电离能:,故C正确;
D.X为H、Li或Na,Y为硫元素,H、Li或Na与硫元素可以形成硫化氢属于共价化合物,硫化钠和硫化锂属于离子化合物,故D错误;
3.【答案】C
【解析】解:图为元素周期表中短周期的一部分,由Y、Z、M在周期表中的位置关系可知,Y为F元素,M为Cl元素,Z为S元素。
A、同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性:,故电负性,故A错误;
B、电子层排布相同,核电荷数越大离子半径越小,最外层电子数相同,电子层越多离子半径越大,离子半径:,故B错误;
C、为,分子中S元素化合价为价,,S原子满足8电子稳定结构,Cl元素化合价为价,,Cl原子满足8电子稳定结构,故C正确;
D、不同轨道的单电子自旋方向不同,违反了洪特规则,故D错误。
4.【答案】B
【解答】
A、得电子能力,所以元素的电负性,故A正确;
B、C的电子排布式:,N的电子排布式:,p轨道处于半充满状态,O的电子排布式:,第一电离能应该是N的最大,故B错误;
C、这些离子是电子层一样多的微粒,根据核电荷数越多半径越小,则离子半径:,故C正确;
D、Mn、Si、Cl原子的未成对电子数分别为5、2、1,即原子的未成对电子数:,故D正确。
故选B。
5.【答案】C
【解答】
P能层为原子核外第6能层,可容纳的最多电子数为,p能级有3个轨道,最多可容纳6个电子,
故选C。
6.【答案】B
【解答】
A.应为,故A错误;
B.符合构造原理,故B正确;
C.应为,故C错误;
D.应为,故D错误。
故选:B。
7.【答案】D
【解答】
A.X元素最外层有3个电子,所以在化合物中通常显价,故A错误;
B.第ⅢA族元素有金属也有非金属,第一电离能为578kJ且属于第IIIA族的元素是Al元素,属于金属元素,故B错误;
C.从B的分析可知,该元素是Al元素,位于第三周期,故C错误;
D.该主族元素最外层有3个电子,在反应中容易失去电子,所以与氯气反应时最可能生成的阳离子为,故D正确。
故选:D。
8.【答案】B
【解答】
A.若为Ar原子,质子数为18,若为离子,可能为阳离子、或阴离子、,则它的质子数不一定是18,故A错误;
B.若为离子,可能为,则可能为,它的原子和可能互为同位素,故B正确;
C.可能为的电子排布,具有强氧化性,故C错误;
D.微粒不一定为原子,则不一定为Ar,故D错误。
9.【答案】D
【解答】
质量数52,中子数28,则该元素原子的质子数为,该元素为Cr元素,基态原子的电子排布式为:,
3d能级具有5个轨道,5个电子优先分别占据1个轨道,且自旋方法相同,故有6个未成对电子,
故选D。
10.【答案】B
【解答】
A、电子云表示电子在原子核外出现机率的大小,而不能表示运动的轨迹,故A错误;
B、电子云表示电子在核外单位体积的空间出现的概率大小,故B正确;
C、电子云界面图中的小黑点越密表示电子在该核外空间出现的机会越多,故C错误;
D、钠原子的1s、2s、3s电子云半径依次增大,故D错误;
故选B.
11.【答案】A
【解答】
A.同一主族,从上到下,元素的第一电离能逐渐减小,所以第一电离能:,故A正确;
B.同周期,从左到右,元素的电负性逐渐增大,所以电负性:,故B错误;
C.主族元素最外层电子数最高正价,氧、氟无正价,所以最高正价:,故C错误;
D.同一周期元素从左到右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,下一周期元素的原子半径一般比相邻上一周期元素的原子半径大;所以原子半径:,故D错误。
故选A。
12.【答案】D
【解析】解:由A的原子结构示意图可知,,A的原子序数为14,故A为Si元素;
由b与c形成的化合物的电子式可知c原子核外应有5个电子,为第ⅤA族元素,应为N元素,
b最外层应有1个电子,与a同周期,应为Na元素,
c、d同主族,则d为P元素,
A.原子半径应为,即,故A错误;
B.同周期元素从左到右元素的电负性逐渐增强,同主族元素从上到下电负性逐渐减弱,则应为,故B错误;
C.原子序数的大小顺序为,即,故C错误;
D.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,为,即,故D正确.
故选:D.
由a的原子结构示意图可知,,a的原子序数为14,故a为Si元素;
由b与c形成的化合物的电子式可知c原子核外应有5个电子,为第ⅤA族元素,应为N元素,
b最外层应有1个电子,与a同周期,应为Na元素,
c、d同主族,则d为P元素,
结合对应单质、化合物的性质以及元素周期律知识解答该题.
13.【答案】C
【解析】解:
同周期主族元素自左而右原子半径减小,同主族自上而下原子半径增大,前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为F元素,Y为Li元素,Z为Na元素,M为Si元素,N为Cl元素,
A.N、Z两种元素的离子分别为、,电子层越多离子半径越大,故离子半径,故A正确;
B.同周期自左而右非金属性增强,故非金属性,非金属性越强氢化物越稳定,故氢化物稳定性,故B正确;
C.同主族自上而下金属性增强,失去电子能力增强,故失去电子能力:,故C错误;
D.同主族自上而下非金属性减弱,单质氧化性减弱,故氧化性:,故D正确;
14.【答案】D
【解析】解:元素周期表前三周期元素的离子、、、具有相同电子层结构,核外电子数相等,所以,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,
A.由以上分析可知,,则质子数,非金属性,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,则离子还原性,故A错误;
B.非金属性,非金属性越强氢化物越稳定性,氢化物稳定性为,故B错误;
C.W为Al元素,X为Na元素,同周期随原子序数增大原子半径减小、第一电离能呈增大趋势,故原子半径,第一电离能,故C错误;
D.同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性:,故D正确。
15.【答案】D
【解答】
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,则X为C元素,X、Y的核电荷数之比为3:4,则Y为O元素,的最外层为8电子结构,W为F或Cl元素,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,则Z为Na元素,W只能为Cl元素,
A.X与Y形成的化合物有CO、等,Z的最高价氧化物的水化物为NaOH,CO和NaOH不反应,故A错误;
B.一般说来,电子层数越多,原子半径越大,电子层数相同,质子数越多,半径越小,则原子半径大小,,故B错误;
C.化合物和分别为、,存在离子键和共价键,故C错误;
D.Y的单质臭氧,W的单质氯气,对应的化合物,可作为水的消毒剂,故D正确。
故选D。
16.【答案】A
【解析】解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,则A为C;元素D与A为同族元素,则D为Si;元素B的原子最外层电子数是其电子层数的3倍,则电子层数为2,最外层电子数为6,所以B为O;元素C与E形成的化合物CE是厨房常用调味品,CE为NaCl,结合原子序数可知C为Na,E为Cl,
A.同周期从左向右原子半径在减小,电子层越多半径越大,所以原子半径为,即,故A正确;
B.电解NaCl溶液得到NaOH、氢气、氯气,则电解熔融的NaCl可得到Na和氯气,故B错误;
C.C与B形成的两种化合物为、,中只有离子键,而中有离子键和非极性共价键,故C错误;
D.A、D、E的最高价氧化物对应水化物分别为、、,非金属性,故酸性,故D错误;
17.【答案】?
电子从能量较高的轨道跃迁到能量较低的轨道时,以光子的形式释放能量
的3d轨道电子排布为半满状态,比较稳定
?
【解答】
号为铁元素,其基态原子的电子排布式为。
为N元素,a为H元素,二者形成的中N原子的杂化形式为。
为Mg元素,Mg单质在空气中燃烧发出耀眼的白光,原因是电子从能量较高的轨道跃迁到能量较低的轨道时,以光子的形式释放能量。
元素为Mn,其基态原子电子排布式为,的基态离子的电子排布式为,其3d轨道为半充满结构,相对比较稳定,当其失去第三个电子时比较困难,而的基态离子的电子排布式为,其3d能级再失去一个电子即为半充满结构,形成相对比较稳定的结构,故其失去第三个电子比较容易。
第三周期8种元素分别为钠、镁、铝、硅、磷、硫、氯、氩,其单质中钠、镁、铝形成金属晶体,熔点依次升高;硅形成原子晶体;磷、硫、氯、氩形成分子晶体,且常温下磷、硫为固体,氧气、氩为气体,故8种元素按单质熔点由高到低的顺序为硅、铝、镁、硫、磷、钠、氯、氩,其中电负性最大的为氯。
由图可知,该元素的电离能远大于,故为第ⅢA族元素,周期表中所列的第ⅢA族元素i属于第三周期,应为Al。
18.【答案】三;IVA;
;1;
;;;;
;
;
;
;5;;2;10;
【解答】
I.原子序数为14,有3个电子层,最外层电子数为4,故Si处于第三周期第IVA族,故答案为:三;IVA;
原子核外电子数为7,其核外电子排布式为:,Cu元素为29号元素,处于第四周期IB族,原子外围电子排布为,故其最外层电子数为1,
故答案为:;1;
同周期自左而右原子半径减小、电负性增大,故原子半径,电负性:,
金刚石与晶体硅均为原子晶体,由于原子半径,故C键长键长,故C键更稳定,故熔点:金刚石晶体硅;
、均为分子晶体,相对分子质量越大,沸点越高,由于相对分子质量大于,故沸点,
故答案为:;;;
Ⅱ中氧原子之间形成1对共用电子对,氧原子与氢原子之间形成1对共用电子对,电子式为,故答案为:;
在二氧化碳中燃烧生成MgO与碳,反应方程式为:,故答案为:;
在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,说明生成AgBr,反应离子方程式为:,
故答案为:;
反应中Mn元素化合价由价降低为价,共降低5价,C元素化合价由价升高为价,共升高2价,化合价升降最小公倍数为10,可以确定的系数为2、的系数为5,由原子守恒可知的系数为2、的系数为10,由电荷守恒可知,反应物中缺项为,由元素守恒可知生成物中缺项为,配平后离子方程式为:
故答案为:2;5;;2;10;。
19.【答案】钠???
氧???
硫???
氮???
氢
或
【解答】
A与B形成离子化合物,中所有离子的电子数相同,且电子总数为30,所以每个离子都有10个电子,由化学式的结构可知,B带2个单位负电荷,A带1个单位正电荷,所以A是Na元素,B是O元素,因为A、C同周期,B与C同主族,所以C为S元素;D和E可形成4核10电子的分子,每个原子平均不到3个电子,可知其中一定含有氢原子,分子中有4个原子核共10个电子,一定是,结合原子序数,可知D是N元素,E是H元素,据此可得下列结论:
由上述分析可知,A为Na,B为O,C为S,D为N,E为H,故答案为:钠;氧;硫;氮;氢;
是,由钠离子与氧离子形成的离子化合物,的形成过程为:,故答案为:;
元素形成的单质为,其结构式为:,故答案为:;
与B形成的化合物为或,电子式为:或,故答案为:或;
A、B、E形成的化合物为NaOH,其电子式为:,故答案为:;
D与E形成的化合物为等,电子式为:,故答案为:。
20.【答案】同位素
?
?
?
Cl
?
bc
?
?
放热
?
不影响
?
催化剂不改变平衡的移动
【解析】解:X、Y、Z、W、R、P、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y的化合价主要为,,是无机非金属材料的主角,则Y为Si元素;Z焰色反应呈黄色,则Z为Na元素;R的主要化合价为,,则R为Cl元素;W有价,处于VIA族,原子半径小于Cl,故W为O元素;Q主要化合价为价,原子半径,则Q为Al元素;P有、价,处于VA族,原子半径小于Cl,故P为N元素.
在自然界中有质量数为35和37的两种核素,中子数不同,二者互为同位素,
故答案为:同位素;
为Na元素,钠与水反应生成氢氧化钠和氢气,反应方程式为:,R与Q两元素最高价氧化物水化物分别为、,二者反应离子方程式为:,
故答案为:;;
为Si元素,R为Cl元素,同周期自左而右,非金属性增强,所以非金属性;
状态属于物理性质,不能说明元素的非金属性强弱,故a错误;
非金属越强,氢化物越稳定,稳定性,说明X的非金属性强,故b正确;
与R形成的化合物中Y呈正价,说明X吸引电子能力强,X的非金属性强,故c正确;
故答案为:Cl;bc;
工业制取的单质的化学方程式:,
故答案为:;
由图可知,反应物总能量高于生成物总能量,则该反应是放热反应,故答案为:放热;
催化剂不改变平衡的移动,不影响反应热,故答案为:不影响;催化剂不改变平衡的移动.
X、Y、Z、W、R、P、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y的化合价主要为,,是无机非金属材料的主角,则Y为Si元素;Z焰色反应呈黄色,则Z为Na元素;R的主要化合价为,,则R为Cl元素;W有价,处于VIA族,原子半径小于Cl,故W为O元素;Q主要化合价为价,原子半径,则Q为Al元素;P有、价,处于VA族,原子半径小于Cl,故P为N元素.
本题考查结构性质位置关系应用、化学反应中能量变化,关键是根据原子半径、化合价推断元素,理解掌握元素周期律,注意金属性、非金属性强弱比较实验事实.
21.【答案】
、
【解答】
元素为29号元素,原子核外有29个电子,所以核外电子排布式为:,故答案为:;?
氨水溶液中含N、O、H三种元素,氢的电负性最小,又同周期自左而右电负性增大,故电负性从大到小的排列顺序为,故答案为:;?
醋酸分子中的两个碳原子,甲基碳采用杂化,羧基碳采用杂化,故答案为:、;?
与存在配位键,中N与H形成键,??与Ac?之间是离子键,Ac?内有碳氧双键,所以还有键,即存在的化学键类型为:配位键、键、键和离子键,故D正确。
故答案为:abcd。?
22.【答案】
?Al
?Si
?P
?Cl
【解答】
由“这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水”可知,在A、B、E中必定有Al,由“A、B、C、D、E为原子序数依次增大的短周期元素”和“C元素的最外层电子数比次外层电子数少
4”可知,C为Si,又由“D元素原子次外层电子数比最外层电子数多
3”,所以D为P,所以只能B为Al,A为可能为Cl或S,当E为S时,不满足“A、B、种原子最外层共有11个电子”,所以E只能为Cl;
由以上分析可知A为Na,B为Al,C为Si,D为P,E为Cl,故答案为:Na;Al;Si;P;Cl。
?用电子式表示氯化钠的形成过程为:;
故答案为:。
、B两元素最高价氧化物的水化物分别为NaOH和,相互反应的化学方程式为,
故答案为:。
为Si,D为P,E为Cl,非金属性,元素的非金属性越强,对应的氢化物越稳定,所以C、D、E的氢化物稳定性由强到弱依次为
故答案为:。
第2页,共2页
第1页,共1页
一、单选题
具有下列电子层结构的原子,其第一电离能由大到小排列正确的是
能级上只有一对成对电子的原子外围电子构型为的原子其3p能级为半满的原子正三价的阳离子结构与氖相同的原子
A.
B.
C.
D.
X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍.下列有关叙述正确的是
A.
Y的价层电子排布式为
B.
稳定性:Y的氢化物的氢化物
C.
第一电离能:
D.
X、Y两元素形成的化合物为离子化合物
如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是
A.
电负性:
B.
离子半径:
C.
分子中各原子的最外层均满足8电子稳定结构
D.
Z元素基态原子最外层电子排布图为?
下列有关微粒性质的排列顺序中,错误的是
A.
元素的电负性:
B.
元素的第一电离能:
C.
离子半径:
D.
原子的未成对电子数:
原子核外P能层和p能级可容纳的最多电子数分别为
A.
32和2
B.
50和6
C.
72和6
D.
86和10
构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以表示某能级的能量,以下各式中正确的是
A.
B.
C.
D.
某元素X的逐级电离能如图表示,下列说法正确的是
A.
X元素可能为价
B.
X可能为非金属
C.
X为第五周期元素
D.
X与氯气反应时最可能生成的阳离子为
某微粒的核外电子排布式为,下列关于该微粒的说法正确的是?
???
A.
它的质子数一定是18
B.
它的原子和可能互为同位素
C.
它的单质一定是强还原剂
D.
可以确定该微粒为Ar
某元素原子的质量数为52,中子数为28,其基态原子未成对电子数为
?
?
?
A.
1
B.
3
C.
4
D.
6
下列关于电子云的说法中,正确的是
A.
电子云表示电子在原子核外运动的轨迹
B.
电子云表示电子在核外单位体积的空间出现的概率大小
C.
电子云界面图中的小黑点越密表示该核外空间的电子越多
D.
钠原子的1s、2s、3s电子云半径相同
下列各组元素的性质正确的是
A.
第一电离能:
B.
电负性:
C.
最高正价:
D.
原子半径:
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为,b与c形成的化合物的电子式为下列说法中正确的是
A.
原子半径:
B.
电负性:
C.
原子序数:
D.
最高价含氧酸的酸性:
如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是
A.
离子半径:
B.
氢化物的稳定性:
C.
失去电子能力:
D.
单质的氧化性:
已知号元素的离子、、、都具有相同的电子层结构,下列关系正确的是
A.
质子数,离子的还原性
B.
氢化物的稳定性
C.
原子半径,第一电离能
D.
电负性
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3:4,的最外层为8电子结构,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,下列说法正确的是
A.
X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B.
原子半径大小:,
C.
化合物和都只存在离子键
D.
Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,元素B的原子最外层电子数是其电子层数的3倍,元素D与A为同族元素,元素C与E形成的化合物CE是厨房常用调味品。下列说法正确的是
A.
原子半径:
B.
C和E的单质可通过电解饱和的CE水溶液获得
C.
C与B形成的两种化合物中化学键类型完全相同
D.
A、D、E的最高价氧化物对应水化物的酸性逐渐增强
二、填空题
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
元素p为26号元素,请写出其基态原子的电子排布式________________。
与a反应的产物的分子中,中心原子的杂化形式为________________。
的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:________________________________________。
、p两元素的部分电离能数据列于下表:
元素
o
p
电离能
717
759
1509
1561
3248
2957
比较两元素的、可知,气态再失去一个电子比气态再失去一个电子难。对此,你的解释是______________________________________________。
第三周期8种元素按单质熔点高低的顺序如图Ⅰ所示,其中电负性最大的是_______________填图中的序号。
表中所列的某主族元素的电离能情况如图Ⅱ所示,则该元素是____________填元素符号。
请回答:
Ⅰ:C、N、O、Al、Si、Cu是常见的六种元素.
位于元素周期表第
______
周期第
______
族.
的基态原子核外电子排布式为
______
;Cu的基态原子最外层有
______
个电子.
用“”或“”填空:
原子半径
电负性
熔点
沸点
Al
______
Si
N
______
O
金刚石
______
晶体硅
______
Ⅱ:
的电子式
______
.
镁燃烧不能用灭火,用化学方程式表示其理由
______
.
在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式
______
.
完成以下氧化还原反应的离子方程式:
______
______
______
______
______
______
.
已知5种元素的原子序数的大小顺序为、C同周期,B、C同主族与B形成的离子化合物中所有离子的电子数相同,其电子总数为和E可形成4核10电子分子,完成下列问题:
写出5种元素的名称:A_______B______C______D______E______
用电子式表示离子化合物的形成过程__________________________________________
写出D元素形成的单质的结构式:_________________
写出下列物质的电子式:
E与B形成的化合物_____________
A、B、E形成的化合物________________
D、E形成的化合物_________________
三、实验题
X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如表所示:
X
Y
Z
W
R
P
Q
原子半径
主要化合价
,
,
,
其他
阳离子核外无电子
无机非金属材料的主角
焰色反应呈黄色
在自然界中有质量数为35和37的两种核素,它们之间的关系是互为______.
的单质与水反应的化学方程式是______;R与Q两元素最高价氧化物水化物反应的离子方程式______.
与R相比,非金属性较强的是______用元素符号表示,下列事实能证明这一结论的是______填字母序号.
常温下Y的单质呈固态,R的单质呈气态
稳定性
与R形成的化合物中Y呈正价
写出工业制取Y的单质的化学方程式______.
反应?过程中的能量变化如图所示,回答下列问题.
该反应是______反应填“吸热”“放热”;
反应体系中加入催化剂对反应热是否有影响?______,原因是______从能量说明
氨气是共价型氢化物.工业常用氨气和醋酸二氨合铜的混合液来吸收一氧化碳醋酸根简写为反应方程式为:?
请写出基态Cu原子的电子排布式?______??
氨水溶液中各元素原子的电负性从大到小排列顺序为?______??
醋酸分子中的两个碳原子,甲基碳和羧基碳的杂化方式分别是?______??
生成物中所含化学键类型有?______??
离子键????????配位键??????????键??????????
A、B、C、D、E为同周期原子序数依次增大的短周期元素,已知A、B、种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
写出下列元素符号:
____________?,B____________,C___________,D__________,E____________
与E两元素可形成化合物,用电子式表示其化合物的形成过程:____________________________________________________________?。
写出A、B两元素的最高价氧化物的水化物相互反应的化学方程式:__________________________________________________________?。
、D、E的氢化物稳定性由强到弱依次为:用化学式表示________________________________?。
答案和解析
1.【答案】C
【解答】
轨道上只有一对成对电子的原子,则该元素为S;
外围电子构型为的原子,则该元素为Ar;
其3p轨道为半充满的原子,则该元素为P;
正三价的阳离子结构与氖相同的原子,则该元素为Al.
已知同周期从左到右,第一电离能逐渐增大,第VA族和第VIA族反常,同周期稀有气体的第一电离能最大;
所以第一电离能由大到小排列为,即第一电离能由大到小排列为:,故C正确。
故选C。
2.【答案】C
【解析】解:X、Y、Z为短周期元素,X原子最外层只有一个电子,则X为H、Li或Na;Y原子的最外层电子数比内层电子总数少4,则Y有3个电子层,最外层有6个电子,则Y为硫元素;Z的最外层电子数是内层电子总数的三倍,则Z有2个电子层,最外层电子数为6,则Z为氧元素,
A.Y为硫元素,Y的价层电子排布式为,故A错误;
B.Y为硫元素,Z为氧元素,非金属性,非金属性越强,氢化物越稳定,氢化物稳定性,故B错误;
C.Y为硫元素,Z为氧元素,第一电离能:,故C正确;
D.X为H、Li或Na,Y为硫元素,H、Li或Na与硫元素可以形成硫化氢属于共价化合物,硫化钠和硫化锂属于离子化合物,故D错误;
3.【答案】C
【解析】解:图为元素周期表中短周期的一部分,由Y、Z、M在周期表中的位置关系可知,Y为F元素,M为Cl元素,Z为S元素。
A、同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性:,故电负性,故A错误;
B、电子层排布相同,核电荷数越大离子半径越小,最外层电子数相同,电子层越多离子半径越大,离子半径:,故B错误;
C、为,分子中S元素化合价为价,,S原子满足8电子稳定结构,Cl元素化合价为价,,Cl原子满足8电子稳定结构,故C正确;
D、不同轨道的单电子自旋方向不同,违反了洪特规则,故D错误。
4.【答案】B
【解答】
A、得电子能力,所以元素的电负性,故A正确;
B、C的电子排布式:,N的电子排布式:,p轨道处于半充满状态,O的电子排布式:,第一电离能应该是N的最大,故B错误;
C、这些离子是电子层一样多的微粒,根据核电荷数越多半径越小,则离子半径:,故C正确;
D、Mn、Si、Cl原子的未成对电子数分别为5、2、1,即原子的未成对电子数:,故D正确。
故选B。
5.【答案】C
【解答】
P能层为原子核外第6能层,可容纳的最多电子数为,p能级有3个轨道,最多可容纳6个电子,
故选C。
6.【答案】B
【解答】
A.应为,故A错误;
B.符合构造原理,故B正确;
C.应为,故C错误;
D.应为,故D错误。
故选:B。
7.【答案】D
【解答】
A.X元素最外层有3个电子,所以在化合物中通常显价,故A错误;
B.第ⅢA族元素有金属也有非金属,第一电离能为578kJ且属于第IIIA族的元素是Al元素,属于金属元素,故B错误;
C.从B的分析可知,该元素是Al元素,位于第三周期,故C错误;
D.该主族元素最外层有3个电子,在反应中容易失去电子,所以与氯气反应时最可能生成的阳离子为,故D正确。
故选:D。
8.【答案】B
【解答】
A.若为Ar原子,质子数为18,若为离子,可能为阳离子、或阴离子、,则它的质子数不一定是18,故A错误;
B.若为离子,可能为,则可能为,它的原子和可能互为同位素,故B正确;
C.可能为的电子排布,具有强氧化性,故C错误;
D.微粒不一定为原子,则不一定为Ar,故D错误。
9.【答案】D
【解答】
质量数52,中子数28,则该元素原子的质子数为,该元素为Cr元素,基态原子的电子排布式为:,
3d能级具有5个轨道,5个电子优先分别占据1个轨道,且自旋方法相同,故有6个未成对电子,
故选D。
10.【答案】B
【解答】
A、电子云表示电子在原子核外出现机率的大小,而不能表示运动的轨迹,故A错误;
B、电子云表示电子在核外单位体积的空间出现的概率大小,故B正确;
C、电子云界面图中的小黑点越密表示电子在该核外空间出现的机会越多,故C错误;
D、钠原子的1s、2s、3s电子云半径依次增大,故D错误;
故选B.
11.【答案】A
【解答】
A.同一主族,从上到下,元素的第一电离能逐渐减小,所以第一电离能:,故A正确;
B.同周期,从左到右,元素的电负性逐渐增大,所以电负性:,故B错误;
C.主族元素最外层电子数最高正价,氧、氟无正价,所以最高正价:,故C错误;
D.同一周期元素从左到右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,下一周期元素的原子半径一般比相邻上一周期元素的原子半径大;所以原子半径:,故D错误。
故选A。
12.【答案】D
【解析】解:由A的原子结构示意图可知,,A的原子序数为14,故A为Si元素;
由b与c形成的化合物的电子式可知c原子核外应有5个电子,为第ⅤA族元素,应为N元素,
b最外层应有1个电子,与a同周期,应为Na元素,
c、d同主族,则d为P元素,
A.原子半径应为,即,故A错误;
B.同周期元素从左到右元素的电负性逐渐增强,同主族元素从上到下电负性逐渐减弱,则应为,故B错误;
C.原子序数的大小顺序为,即,故C错误;
D.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,为,即,故D正确.
故选:D.
由a的原子结构示意图可知,,a的原子序数为14,故a为Si元素;
由b与c形成的化合物的电子式可知c原子核外应有5个电子,为第ⅤA族元素,应为N元素,
b最外层应有1个电子,与a同周期,应为Na元素,
c、d同主族,则d为P元素,
结合对应单质、化合物的性质以及元素周期律知识解答该题.
13.【答案】C
【解析】解:
同周期主族元素自左而右原子半径减小,同主族自上而下原子半径增大,前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为F元素,Y为Li元素,Z为Na元素,M为Si元素,N为Cl元素,
A.N、Z两种元素的离子分别为、,电子层越多离子半径越大,故离子半径,故A正确;
B.同周期自左而右非金属性增强,故非金属性,非金属性越强氢化物越稳定,故氢化物稳定性,故B正确;
C.同主族自上而下金属性增强,失去电子能力增强,故失去电子能力:,故C错误;
D.同主族自上而下非金属性减弱,单质氧化性减弱,故氧化性:,故D正确;
14.【答案】D
【解析】解:元素周期表前三周期元素的离子、、、具有相同电子层结构,核外电子数相等,所以,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,
A.由以上分析可知,,则质子数,非金属性,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,则离子还原性,故A错误;
B.非金属性,非金属性越强氢化物越稳定性,氢化物稳定性为,故B错误;
C.W为Al元素,X为Na元素,同周期随原子序数增大原子半径减小、第一电离能呈增大趋势,故原子半径,第一电离能,故C错误;
D.同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性:,故D正确。
15.【答案】D
【解答】
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,则X为C元素,X、Y的核电荷数之比为3:4,则Y为O元素,的最外层为8电子结构,W为F或Cl元素,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,则Z为Na元素,W只能为Cl元素,
A.X与Y形成的化合物有CO、等,Z的最高价氧化物的水化物为NaOH,CO和NaOH不反应,故A错误;
B.一般说来,电子层数越多,原子半径越大,电子层数相同,质子数越多,半径越小,则原子半径大小,,故B错误;
C.化合物和分别为、,存在离子键和共价键,故C错误;
D.Y的单质臭氧,W的单质氯气,对应的化合物,可作为水的消毒剂,故D正确。
故选D。
16.【答案】A
【解析】解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,则A为C;元素D与A为同族元素,则D为Si;元素B的原子最外层电子数是其电子层数的3倍,则电子层数为2,最外层电子数为6,所以B为O;元素C与E形成的化合物CE是厨房常用调味品,CE为NaCl,结合原子序数可知C为Na,E为Cl,
A.同周期从左向右原子半径在减小,电子层越多半径越大,所以原子半径为,即,故A正确;
B.电解NaCl溶液得到NaOH、氢气、氯气,则电解熔融的NaCl可得到Na和氯气,故B错误;
C.C与B形成的两种化合物为、,中只有离子键,而中有离子键和非极性共价键,故C错误;
D.A、D、E的最高价氧化物对应水化物分别为、、,非金属性,故酸性,故D错误;
17.【答案】?
电子从能量较高的轨道跃迁到能量较低的轨道时,以光子的形式释放能量
的3d轨道电子排布为半满状态,比较稳定
?
【解答】
号为铁元素,其基态原子的电子排布式为。
为N元素,a为H元素,二者形成的中N原子的杂化形式为。
为Mg元素,Mg单质在空气中燃烧发出耀眼的白光,原因是电子从能量较高的轨道跃迁到能量较低的轨道时,以光子的形式释放能量。
元素为Mn,其基态原子电子排布式为,的基态离子的电子排布式为,其3d轨道为半充满结构,相对比较稳定,当其失去第三个电子时比较困难,而的基态离子的电子排布式为,其3d能级再失去一个电子即为半充满结构,形成相对比较稳定的结构,故其失去第三个电子比较容易。
第三周期8种元素分别为钠、镁、铝、硅、磷、硫、氯、氩,其单质中钠、镁、铝形成金属晶体,熔点依次升高;硅形成原子晶体;磷、硫、氯、氩形成分子晶体,且常温下磷、硫为固体,氧气、氩为气体,故8种元素按单质熔点由高到低的顺序为硅、铝、镁、硫、磷、钠、氯、氩,其中电负性最大的为氯。
由图可知,该元素的电离能远大于,故为第ⅢA族元素,周期表中所列的第ⅢA族元素i属于第三周期,应为Al。
18.【答案】三;IVA;
;1;
;;;;
;
;
;
;5;;2;10;
【解答】
I.原子序数为14,有3个电子层,最外层电子数为4,故Si处于第三周期第IVA族,故答案为:三;IVA;
原子核外电子数为7,其核外电子排布式为:,Cu元素为29号元素,处于第四周期IB族,原子外围电子排布为,故其最外层电子数为1,
故答案为:;1;
同周期自左而右原子半径减小、电负性增大,故原子半径,电负性:,
金刚石与晶体硅均为原子晶体,由于原子半径,故C键长键长,故C键更稳定,故熔点:金刚石晶体硅;
、均为分子晶体,相对分子质量越大,沸点越高,由于相对分子质量大于,故沸点,
故答案为:;;;
Ⅱ中氧原子之间形成1对共用电子对,氧原子与氢原子之间形成1对共用电子对,电子式为,故答案为:;
在二氧化碳中燃烧生成MgO与碳,反应方程式为:,故答案为:;
在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,说明生成AgBr,反应离子方程式为:,
故答案为:;
反应中Mn元素化合价由价降低为价,共降低5价,C元素化合价由价升高为价,共升高2价,化合价升降最小公倍数为10,可以确定的系数为2、的系数为5,由原子守恒可知的系数为2、的系数为10,由电荷守恒可知,反应物中缺项为,由元素守恒可知生成物中缺项为,配平后离子方程式为:
故答案为:2;5;;2;10;。
19.【答案】钠???
氧???
硫???
氮???
氢
或
【解答】
A与B形成离子化合物,中所有离子的电子数相同,且电子总数为30,所以每个离子都有10个电子,由化学式的结构可知,B带2个单位负电荷,A带1个单位正电荷,所以A是Na元素,B是O元素,因为A、C同周期,B与C同主族,所以C为S元素;D和E可形成4核10电子的分子,每个原子平均不到3个电子,可知其中一定含有氢原子,分子中有4个原子核共10个电子,一定是,结合原子序数,可知D是N元素,E是H元素,据此可得下列结论:
由上述分析可知,A为Na,B为O,C为S,D为N,E为H,故答案为:钠;氧;硫;氮;氢;
是,由钠离子与氧离子形成的离子化合物,的形成过程为:,故答案为:;
元素形成的单质为,其结构式为:,故答案为:;
与B形成的化合物为或,电子式为:或,故答案为:或;
A、B、E形成的化合物为NaOH,其电子式为:,故答案为:;
D与E形成的化合物为等,电子式为:,故答案为:。
20.【答案】同位素
?
?
?
Cl
?
bc
?
?
放热
?
不影响
?
催化剂不改变平衡的移动
【解析】解:X、Y、Z、W、R、P、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y的化合价主要为,,是无机非金属材料的主角,则Y为Si元素;Z焰色反应呈黄色,则Z为Na元素;R的主要化合价为,,则R为Cl元素;W有价,处于VIA族,原子半径小于Cl,故W为O元素;Q主要化合价为价,原子半径,则Q为Al元素;P有、价,处于VA族,原子半径小于Cl,故P为N元素.
在自然界中有质量数为35和37的两种核素,中子数不同,二者互为同位素,
故答案为:同位素;
为Na元素,钠与水反应生成氢氧化钠和氢气,反应方程式为:,R与Q两元素最高价氧化物水化物分别为、,二者反应离子方程式为:,
故答案为:;;
为Si元素,R为Cl元素,同周期自左而右,非金属性增强,所以非金属性;
状态属于物理性质,不能说明元素的非金属性强弱,故a错误;
非金属越强,氢化物越稳定,稳定性,说明X的非金属性强,故b正确;
与R形成的化合物中Y呈正价,说明X吸引电子能力强,X的非金属性强,故c正确;
故答案为:Cl;bc;
工业制取的单质的化学方程式:,
故答案为:;
由图可知,反应物总能量高于生成物总能量,则该反应是放热反应,故答案为:放热;
催化剂不改变平衡的移动,不影响反应热,故答案为:不影响;催化剂不改变平衡的移动.
X、Y、Z、W、R、P、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y的化合价主要为,,是无机非金属材料的主角,则Y为Si元素;Z焰色反应呈黄色,则Z为Na元素;R的主要化合价为,,则R为Cl元素;W有价,处于VIA族,原子半径小于Cl,故W为O元素;Q主要化合价为价,原子半径,则Q为Al元素;P有、价,处于VA族,原子半径小于Cl,故P为N元素.
本题考查结构性质位置关系应用、化学反应中能量变化,关键是根据原子半径、化合价推断元素,理解掌握元素周期律,注意金属性、非金属性强弱比较实验事实.
21.【答案】
、
【解答】
元素为29号元素,原子核外有29个电子,所以核外电子排布式为:,故答案为:;?
氨水溶液中含N、O、H三种元素,氢的电负性最小,又同周期自左而右电负性增大,故电负性从大到小的排列顺序为,故答案为:;?
醋酸分子中的两个碳原子,甲基碳采用杂化,羧基碳采用杂化,故答案为:、;?
与存在配位键,中N与H形成键,??与Ac?之间是离子键,Ac?内有碳氧双键,所以还有键,即存在的化学键类型为:配位键、键、键和离子键,故D正确。
故答案为:abcd。?
22.【答案】
?Al
?Si
?P
?Cl
【解答】
由“这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水”可知,在A、B、E中必定有Al,由“A、B、C、D、E为原子序数依次增大的短周期元素”和“C元素的最外层电子数比次外层电子数少
4”可知,C为Si,又由“D元素原子次外层电子数比最外层电子数多
3”,所以D为P,所以只能B为Al,A为可能为Cl或S,当E为S时,不满足“A、B、种原子最外层共有11个电子”,所以E只能为Cl;
由以上分析可知A为Na,B为Al,C为Si,D为P,E为Cl,故答案为:Na;Al;Si;P;Cl。
?用电子式表示氯化钠的形成过程为:;
故答案为:。
、B两元素最高价氧化物的水化物分别为NaOH和,相互反应的化学方程式为,
故答案为:。
为Si,D为P,E为Cl,非金属性,元素的非金属性越强,对应的氢化物越稳定,所以C、D、E的氢化物稳定性由强到弱依次为
故答案为:。
第2页,共2页
第1页,共1页
