2020年新高考全国卷Ⅱ化学高考试题(海南卷)(无答案)
文档属性
| 名称 | 2020年新高考全国卷Ⅱ化学高考试题(海南卷)(无答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 294.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-13 00:00:00 | ||
图片预览


文档简介
2020海南化学高考真题
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1.化学科学与社会活动密切相关。下述措施应积极推广的是
A.在抗击新冠肺炎疫情斗争中,提高环境友好无残留消毒剂的使用比例
B.原料药生产厂通过蒸发与焚烧过程,处理其生产废液
C.海边建筑工程施工,就近取海水海沙生产混凝土
D.为保证食物的口感与风味,增加食品添加剂使用品种与数量
2.古籍《天工开物》收录了井盐的生产过程。其中“汲水而上,入于釜中煎炼,顷刻结盐,色成至白”的描述,涉及的物质分离操作为
A.趁热过滤 B.萃取分液 C.常压蒸馏 D.浓缩结晶
3.下列叙述正确的是
A. HClO 的结构式为H-Cl-O B.核内有33个中子的Fe表示为Fe
C. NH2OH的电子式为 D. CH3CHO 的球棍模型为
4.实验室制备下列气体,能实现的是
A. Cl2: MnO2与稀HCl溶液混合 B. C2H4: CaC2 与H2O混合
C. CO2: 加热饱和NaHCO3溶液 D. SO2: Cu 丝与稀H2SO4混合
5.下列说法错误的是
A.新榨油脂不及时干燥脱水易变质 B.聚氯乙烯可制作食品内包装材料
C.维生素C可作预包装食品抗氧剂 D.卤水点豆腐本质属于蛋白质聚沉
6. NO与CO是燃油汽车尾气中的两种有害气体,常温常压下它们之间的反应:
CO(g)+ NO(g)=CO2(g)+N2(g) ΔH= -374.3 kJ·mol-1 K=2.5×1060, 反应速率较小。
有关该反应的说法正确的是
A. K很大,NO与CO在排入大气之前就已反应完全
B.增大压强,平衡将向右移动,K> 2.5×1060
C.升高温度,既增大反应速率又增大K
D.选用适宜催化剂可达到尾气排放标准
7.向CuSO4溶液中滴加氨水至过量,下列叙述正确的是
A.先出现沉淀,后沉淀溶解变为无色溶液
B.离子方程式为Cu2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 4H2O
C. Cu2+与 NH3中的氮原子以π键结合
D. NH3分子中∠HNH为109?28ˊ
8. NA代表阿伏加德罗常数的值。下列说法正确的是
A.1molHC≡CH分子中所含σ键数为5 NA
B.1L0.1 mol·L-1的Na2CO3溶液含CO32-的数目为0.1 NA
C.78 g Na2O2与足量水完全反应,电子转移数为NA
D.标准状况下,2.24 L C2H5OH所含氢原子数为0.6 NA
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。
若正确答案只包括一个选项, 多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9.含有下列有害组分的尾气,常用NaOH溶液吸收以保护环境。吸收过程中发生歧化反应
的是
A.SO3 B. Cl2 C. NO2 D. HBr
10. 姜黄素是我国古代劳动人民从姜黄根茎中提取得到的一种黄色食用色素。下列关于姜黄素说法正确的是
A.分子式为C21H22O6
B.分子中存在手性碳原子
C.分子中存在3种含氧官能团
D.既能发生取代反应,又能发生加成反应
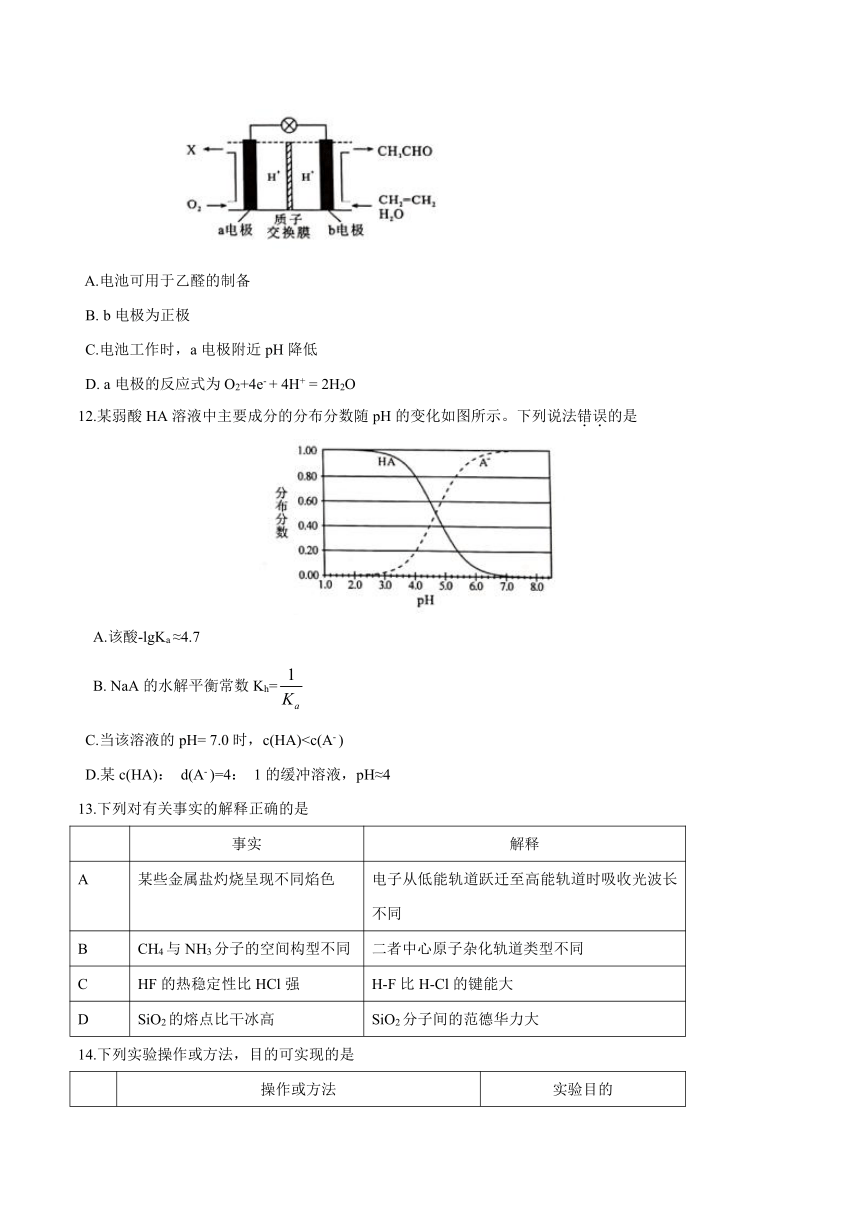
11.某燃料电池主要构成要素如图所示,下列说法正确的是
A.电池可用于乙醛的制备
B. b电极为正极
C.电池工作时,a电极附近pH降低
D. a电极的反应式为O2+4e- + 4H+ = 2H2O
12.某弱酸HA溶液中主要成分的分布分数随pH的变化如图所示。下列说法错误的是
A.该酸-lgKa ≈4.7
B. NaA的水解平衡常数Kh=
C.当该溶液的pH= 7.0时,c(HA) D.某c(HA): d(A- )=4: 1的缓冲溶液,pH≈4
13.下列对有关事实的解释正确的是
事实 解释
A 某些金属盐灼烧呈现不同焰色
电子从低能轨道跃迁至高能轨道时吸收光波长不同
B CH4与NH3分子的空间构型不同 二者中心原子杂化轨道类型不同
C HF的热稳定性比HCl强 H-F比H-Cl的键能大
D SiO2的熔点比干冰高 SiO2分子间的范德华力大
14.下列实验操作或方法,目的可实现的是
操作或方法 实验目的
A 向未知弱酸性试液中滴加含有SCN 的溶液 确证试液中Fe2+存在
B
等体积0.1 mol·L-1Ag+和[Ag(NH3)2]+溶液分别与大量1 mol·L-1葡萄糖碱性溶液形成银镜 判断多步过程中, 分步反应
速率与浓度的关系
C
稀H2SO4酸化n(KBrO3): n(KBr)= 1 :5的混合液替代溴水 降低液溴的贮存与使用风险
D
向0.1 mol·L-1 Na2S2O3溶液中缓慢滴加0.2 mol·L-1盐酸 由浑浊情况测定单质硫的
溶解度
三、非选择题:共5题,60分。
15. (10分)
以黄铁矿(主要成分FeS2)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
回答问题:
(1)黄铁矿中硫元素的化合价为 。
(2)由炉渣制备还原铁粉的化学方程式为_ 。
(3)欲得到更纯的NaHSO3,反应①应通入____ _ (填 “过量”或“不足量”)的SO2气体。
(4)因为Na2S2O5具有_ 性, 导致商品Na2S2O5 中不可避免地存在Na2SO4。
检验其中含有SO42-的方法是_ 。
(5)一般用 K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。
反应式: Cr2O72- +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ +7H2O
某次实验称取0.2800 g样品,滴定时消耗浓度为0.03000 mol·L-1的K2Cr2O7 溶液25.10 mL,
则样品中铁含量为 %。
16. (10分)
作为一种绿色消毒剂,H2O2 在公共卫生事业中发挥了重要的作用。已知反应:
H2O2(l)= H2O(1)+ O2(g) △H= -98 kJ·mol-1 K= 2.88×1020
回答问题:
(1) H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是_ 。
(2)纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:
H2O2(l) = H2O(g)+ O2(g),放出大量气体,驱动火箭升空。每消耗34g H2O2,理论上
(填“放出”或“吸收”)热量_____ 98kJ (填“大于”、“小于”或“等于”)。
(3)纯H2O2相对稳定,实验表明在54℃下恒温贮存2周,浓度仍能保持99%,原因是H2O2分解反应的 (填编号)。
a. ΔH比较小 b. K不够大 c.速率比较小 d.活化能比较大
(4)向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起
作用。某组实验数据如下:
t/min 0 10 20 30 40 50
c(H2O2)/mol ·L-1 0.70 0.49 0.35 0.25 0.17 0.12
0-30 min H2O2反应的平均速率v=_____ mol ·L·min-1
(5) H2O2 的一种衍生物K2S2O8,阴离子结构式为( )。其中性溶液加热至沸后,溶液pH降低,用离子方程式表明原因: 。
17. (12分)
聚异丁烯是一种性能优异的功能高分子材料。某科研小组研究了使用特定引发剂、正己烷为溶剂、无水条件下异丁烯的聚合工艺。已知:异丁烯沸点266K。
反应方程式及主要装置示意图如下:
回答问题:
(1)仪器A的名称是_____, P4O10 作用是_ 。
(2)将钠块加入正己烷中,除去微量的水,反应方程式为_ _.。
(3)浴槽中可选用的适宜冷却剂是_ (填序号)。
序号 冷却剂 最低温度/℃
甲 NaC1-冰(质量比1 :3) -21
乙 CaCl2·6H2O-冰(质量比1.43: 1) -55
丙 液氨 -33
(4)补齐操作步骤
选项为: a.向三口瓶中通入一定量异丁烯
b.向三口瓶中加入一定量 正己烷
①____ _ (填编号);
②待反应体系温度下降至既定温度:
③____ (填编号);
④搅拌下滴加引发剂,一定时间后加入反应终止剂停止反应。经后续处理得成品。
(5)测得成品平均相对分子质量为2.8×106,平均聚合度为 。
18. (14 分)
苯佐卡因是临床常用的一种手术用药。以甲苯为起始原料的合成路线如下:
回答问题:
(1)甲笨分子内共面的H原子数最多为______ 个。
(2) A的名称是_ 。
(3)在A的同分异构体中,符合下列条件的是_____ _ ( 写出一种结构简式)。
①与A具有相同官能团 ②属于芳香化合物 ③核磁共振氢谱有 5组峰
(4) B中官能团名称为_ 。
(5) B→C的反应方程式为___ 。
(6)反应过程中产出的铁泥属于危化品,处理方式为______ ( 填编号).
a.高温炉焚烧 b.填埋 c.交有资质单位处理
(7)设计以甲苯和丙三醇为原料合成3—苄氧基—1,2—丙二醇()的路线
_ (其他试剂任选)。
已知:在于HCl催化下丙酮与醇ROH反应生成缩酮。缩酮在碱性条件下稳定。在酸中水解为丙酮和醇ROH。
19. (14 分)
氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH3OH
和H2O在某Cu/Zn-Al催化剂存在下生产H2, H2 与Mg在一定条件下制得储氢物质X。
回答问题: .
(1) Al在周期表中的位置_ 。基态Zn的价层电子排布式____ 。
(2)水分了中氧原子的杂化轨道类型 。
(3)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有___ _种键能数据。
CH3OH可以与水以任意比例互溶的原因是_ 。
(4) X的晶胞结构如图所示(晶胞参数:α =β =γ=90?,a=b=450.25 pm),密度为1.4g cm-3, H-的配位数为__ _, X的储氢质量分数是_ ___ ,c= pm (列出计算式即可)。
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1.化学科学与社会活动密切相关。下述措施应积极推广的是
A.在抗击新冠肺炎疫情斗争中,提高环境友好无残留消毒剂的使用比例
B.原料药生产厂通过蒸发与焚烧过程,处理其生产废液
C.海边建筑工程施工,就近取海水海沙生产混凝土
D.为保证食物的口感与风味,增加食品添加剂使用品种与数量
2.古籍《天工开物》收录了井盐的生产过程。其中“汲水而上,入于釜中煎炼,顷刻结盐,色成至白”的描述,涉及的物质分离操作为
A.趁热过滤 B.萃取分液 C.常压蒸馏 D.浓缩结晶
3.下列叙述正确的是
A. HClO 的结构式为H-Cl-O B.核内有33个中子的Fe表示为Fe
C. NH2OH的电子式为 D. CH3CHO 的球棍模型为
4.实验室制备下列气体,能实现的是
A. Cl2: MnO2与稀HCl溶液混合 B. C2H4: CaC2 与H2O混合
C. CO2: 加热饱和NaHCO3溶液 D. SO2: Cu 丝与稀H2SO4混合
5.下列说法错误的是
A.新榨油脂不及时干燥脱水易变质 B.聚氯乙烯可制作食品内包装材料
C.维生素C可作预包装食品抗氧剂 D.卤水点豆腐本质属于蛋白质聚沉
6. NO与CO是燃油汽车尾气中的两种有害气体,常温常压下它们之间的反应:
CO(g)+ NO(g)=CO2(g)+N2(g) ΔH= -374.3 kJ·mol-1 K=2.5×1060, 反应速率较小。
有关该反应的说法正确的是
A. K很大,NO与CO在排入大气之前就已反应完全
B.增大压强,平衡将向右移动,K> 2.5×1060
C.升高温度,既增大反应速率又增大K
D.选用适宜催化剂可达到尾气排放标准
7.向CuSO4溶液中滴加氨水至过量,下列叙述正确的是
A.先出现沉淀,后沉淀溶解变为无色溶液
B.离子方程式为Cu2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 4H2O
C. Cu2+与 NH3中的氮原子以π键结合
D. NH3分子中∠HNH为109?28ˊ
8. NA代表阿伏加德罗常数的值。下列说法正确的是
A.1molHC≡CH分子中所含σ键数为5 NA
B.1L0.1 mol·L-1的Na2CO3溶液含CO32-的数目为0.1 NA
C.78 g Na2O2与足量水完全反应,电子转移数为NA
D.标准状况下,2.24 L C2H5OH所含氢原子数为0.6 NA
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。
若正确答案只包括一个选项, 多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9.含有下列有害组分的尾气,常用NaOH溶液吸收以保护环境。吸收过程中发生歧化反应
的是
A.SO3 B. Cl2 C. NO2 D. HBr
10. 姜黄素是我国古代劳动人民从姜黄根茎中提取得到的一种黄色食用色素。下列关于姜黄素说法正确的是
A.分子式为C21H22O6
B.分子中存在手性碳原子
C.分子中存在3种含氧官能团
D.既能发生取代反应,又能发生加成反应
11.某燃料电池主要构成要素如图所示,下列说法正确的是
A.电池可用于乙醛的制备
B. b电极为正极
C.电池工作时,a电极附近pH降低
D. a电极的反应式为O2+4e- + 4H+ = 2H2O
12.某弱酸HA溶液中主要成分的分布分数随pH的变化如图所示。下列说法错误的是
A.该酸-lgKa ≈4.7
B. NaA的水解平衡常数Kh=
C.当该溶液的pH= 7.0时,c(HA)
13.下列对有关事实的解释正确的是
事实 解释
A 某些金属盐灼烧呈现不同焰色
电子从低能轨道跃迁至高能轨道时吸收光波长不同
B CH4与NH3分子的空间构型不同 二者中心原子杂化轨道类型不同
C HF的热稳定性比HCl强 H-F比H-Cl的键能大
D SiO2的熔点比干冰高 SiO2分子间的范德华力大
14.下列实验操作或方法,目的可实现的是
操作或方法 实验目的
A 向未知弱酸性试液中滴加含有SCN 的溶液 确证试液中Fe2+存在
B
等体积0.1 mol·L-1Ag+和[Ag(NH3)2]+溶液分别与大量1 mol·L-1葡萄糖碱性溶液形成银镜 判断多步过程中, 分步反应
速率与浓度的关系
C
稀H2SO4酸化n(KBrO3): n(KBr)= 1 :5的混合液替代溴水 降低液溴的贮存与使用风险
D
向0.1 mol·L-1 Na2S2O3溶液中缓慢滴加0.2 mol·L-1盐酸 由浑浊情况测定单质硫的
溶解度
三、非选择题:共5题,60分。
15. (10分)
以黄铁矿(主要成分FeS2)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
回答问题:
(1)黄铁矿中硫元素的化合价为 。
(2)由炉渣制备还原铁粉的化学方程式为_ 。
(3)欲得到更纯的NaHSO3,反应①应通入____ _ (填 “过量”或“不足量”)的SO2气体。
(4)因为Na2S2O5具有_ 性, 导致商品Na2S2O5 中不可避免地存在Na2SO4。
检验其中含有SO42-的方法是_ 。
(5)一般用 K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。
反应式: Cr2O72- +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ +7H2O
某次实验称取0.2800 g样品,滴定时消耗浓度为0.03000 mol·L-1的K2Cr2O7 溶液25.10 mL,
则样品中铁含量为 %。
16. (10分)
作为一种绿色消毒剂,H2O2 在公共卫生事业中发挥了重要的作用。已知反应:
H2O2(l)= H2O(1)+ O2(g) △H= -98 kJ·mol-1 K= 2.88×1020
回答问题:
(1) H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是_ 。
(2)纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:
H2O2(l) = H2O(g)+ O2(g),放出大量气体,驱动火箭升空。每消耗34g H2O2,理论上
(填“放出”或“吸收”)热量_____ 98kJ (填“大于”、“小于”或“等于”)。
(3)纯H2O2相对稳定,实验表明在54℃下恒温贮存2周,浓度仍能保持99%,原因是H2O2分解反应的 (填编号)。
a. ΔH比较小 b. K不够大 c.速率比较小 d.活化能比较大
(4)向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起
作用。某组实验数据如下:
t/min 0 10 20 30 40 50
c(H2O2)/mol ·L-1 0.70 0.49 0.35 0.25 0.17 0.12
0-30 min H2O2反应的平均速率v=_____ mol ·L·min-1
(5) H2O2 的一种衍生物K2S2O8,阴离子结构式为( )。其中性溶液加热至沸后,溶液pH降低,用离子方程式表明原因: 。
17. (12分)
聚异丁烯是一种性能优异的功能高分子材料。某科研小组研究了使用特定引发剂、正己烷为溶剂、无水条件下异丁烯的聚合工艺。已知:异丁烯沸点266K。
反应方程式及主要装置示意图如下:
回答问题:
(1)仪器A的名称是_____, P4O10 作用是_ 。
(2)将钠块加入正己烷中,除去微量的水,反应方程式为_ _.。
(3)浴槽中可选用的适宜冷却剂是_ (填序号)。
序号 冷却剂 最低温度/℃
甲 NaC1-冰(质量比1 :3) -21
乙 CaCl2·6H2O-冰(质量比1.43: 1) -55
丙 液氨 -33
(4)补齐操作步骤
选项为: a.向三口瓶中通入一定量异丁烯
b.向三口瓶中加入一定量 正己烷
①____ _ (填编号);
②待反应体系温度下降至既定温度:
③____ (填编号);
④搅拌下滴加引发剂,一定时间后加入反应终止剂停止反应。经后续处理得成品。
(5)测得成品平均相对分子质量为2.8×106,平均聚合度为 。
18. (14 分)
苯佐卡因是临床常用的一种手术用药。以甲苯为起始原料的合成路线如下:
回答问题:
(1)甲笨分子内共面的H原子数最多为______ 个。
(2) A的名称是_ 。
(3)在A的同分异构体中,符合下列条件的是_____ _ ( 写出一种结构简式)。
①与A具有相同官能团 ②属于芳香化合物 ③核磁共振氢谱有 5组峰
(4) B中官能团名称为_ 。
(5) B→C的反应方程式为___ 。
(6)反应过程中产出的铁泥属于危化品,处理方式为______ ( 填编号).
a.高温炉焚烧 b.填埋 c.交有资质单位处理
(7)设计以甲苯和丙三醇为原料合成3—苄氧基—1,2—丙二醇()的路线
_ (其他试剂任选)。
已知:在于HCl催化下丙酮与醇ROH反应生成缩酮。缩酮在碱性条件下稳定。在酸中水解为丙酮和醇ROH。
19. (14 分)
氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH3OH
和H2O在某Cu/Zn-Al催化剂存在下生产H2, H2 与Mg在一定条件下制得储氢物质X。
回答问题: .
(1) Al在周期表中的位置_ 。基态Zn的价层电子排布式____ 。
(2)水分了中氧原子的杂化轨道类型 。
(3)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有___ _种键能数据。
CH3OH可以与水以任意比例互溶的原因是_ 。
(4) X的晶胞结构如图所示(晶胞参数:α =β =γ=90?,a=b=450.25 pm),密度为1.4g cm-3, H-的配位数为__ _, X的储氢质量分数是_ ___ ,c= pm (列出计算式即可)。
同课章节目录
