人教版化学高中必修1第三节:硫和氮的氧化物(54张PPT)
文档属性
| 名称 | 人教版化学高中必修1第三节:硫和氮的氧化物(54张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-15 07:29:44 | ||
图片预览









文档简介
(共54张PPT)
第三节
硫和氮的氧化物
硫在自然界的存在(化合态)
石膏
黄铜矿
黄铁矿
皓矾:??ZnSO4.7H2O
钡餐,重晶石:?BaSO4
绿矾:??FeSO4.7H2O?
芒硝:??Na2SO4.10H2O?
明矾:?KAl(SO4)2.12H2O?
生石膏:CaSO4.2H2O?
熟石膏:2CaSO4.H2O
莫尔盐:(NH4)2SO4.FeSO4.6H2O
胆矾、蓝矾:CuSO4.5H2O?
黄铁矿(愚人金):FeS2
大苏打(海波):Na2S2O3
泻盐:MgSO4.7H2O
波尔多液:CuSO4+Ca(OH)2
锌钡白:ZnS+BaSO4
硫的各种单质
二氧化硫和三氧化硫
一、主要来源:
点燃
S+O2===SO2
现象:
空气中:
微弱的淡蓝色火焰;
纯氧中:
明亮的蓝紫色火焰。
二、物理性质
1、无色、有刺激性气味、气体
2、易液化(-10℃)
3、密度大于空气
4、易溶于水(1:40)
P90实验4-7。
5、有毒
SO2是污染大气的主要有害物质之一。
三、化学性质
1、具有酸性氧化物的性质
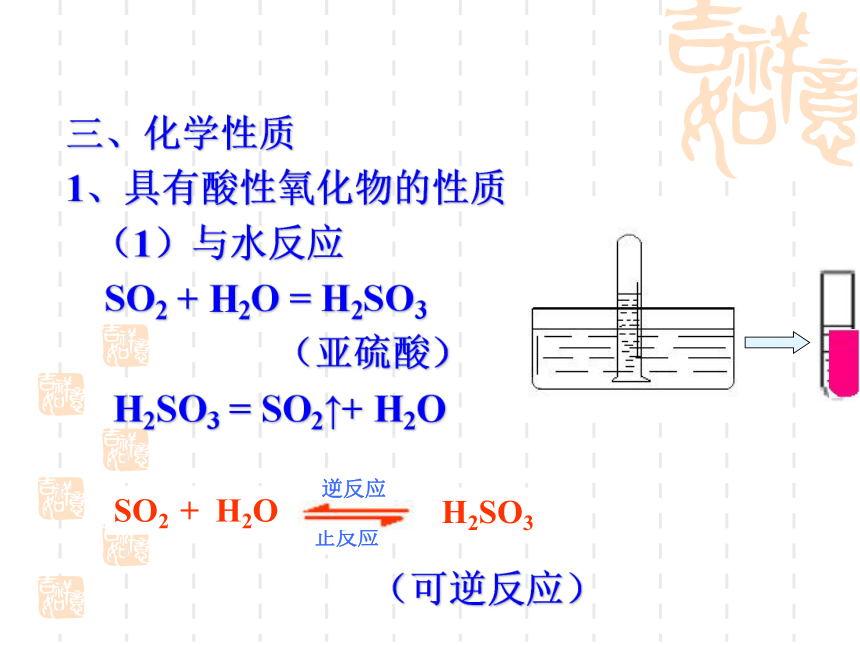
(1)与水反应
SO2
+
H2O
=
H2SO3
(亚硫酸)
H2SO3
=
SO2↑+
H2O
(可逆反应)
SO2
+
H2O
正反应
逆反应
H2SO3
可逆反应
定义:
在相同条件下,既能向正反应方向进行,同时又能向逆反应方向进行的化学反应。
特点:
a.
同一条件、同时进行;
b.
用可逆号
连接;
c.
反应体系中,与化学反应有关的各种物质共存。
(2)与碱反应:
SO2+2NaOH=Na2SO3+H2O
SO2+Ca(OH)2=CaSO3↓+H2O
CaSO3+SO2+H2O=Ca(HSO3)2
使澄清石灰水先变浑浊后变澄清的气体除二氧化碳外,还可能是二氧化硫。
2SO2
+
Ca(OH)2
=
Ca(HSO3)2
S
0
S
-2
S
+4
S
+6
思考:根据SO2中S的化合价,推断它具有怎样的性质?
SO2既有氧化性,又有还原性。
2、氧化性
(弱氧化性)
SO2
+
2H2S
=
3S↓+
2H2O
3、还原性
SO2+Cl2+2H2O=H2SO4+2HCl
SO2+Br2+2H2O=H2SO4+2HBr
SO2+I2+2H2O=H2SO4+2HI
5SO2+2KMnO4+2H2O
=K2SO4
+
2MnSO4+2H2SO4
(SO2可使紫红色KMnO4溶液褪色。)
(此反应可用来吸收SO2。)
2
SO2
+
O2
2
SO3
催化剂
△
品红溶液滴入亚硫酸溶液后,为什么会褪色?
加热时又显红色说明了什么?
氯气与二氧化硫比较
4.漂白性:
某些有机色素+SO2
△
无色的物质
经SO2漂白的物质长时间光照或受热后,会恢复原来的颜色,因此,其漂白作用不持久。
SO2与某些有色物质生成不稳定的无色物质。
SO2与有色物质生成不稳定的无色物质
HClO将有色物质氧化成无色物质
非氧化还原反应
氧化还原反应
不可逆
漂白某些有色物质,不能使紫色石蕊试液褪色
漂白大多数有色物质,能使紫色石蕊试液褪色
比较SO2与HClO的漂白性
物质
SO2
HClO
原理
实质
程度
范围
漂白原理
氧化
化合
吸附
漂白剂
漂白效果
氯水(HClO)
漂粉精、O3
H2O2、Na2O2
等
SO2
H2SO3
活性炭
持久
加热后
不恢复
暂时
加热后
恢复
暂时
加热后
恢复
SO2能使品红溶液褪色,加热后恢复。
——
利用此反应可用来检验SO2
北方市场上,经常见有外面非常白而里面却是黄的馒头和粉丝,里外不一样,它的做法是在一个封闭的容器中先放入馒头或粉丝,再放入燃烧着的硫后熏一下而得到的,您能否马上就食用或用来做菜?
为什么长时间放置的报纸和草帽会变黄?
四、SO2的用途
1、制硫酸
2、漂白
3、杀菌消毒
总结
SO2
与H2O反应
与碱反应
氧化性
还原性
酸酐
+4价
漂白性
特
性
与某些碱性氧化物反应
练习
1、下列可用来鉴别SO2和CO2的方法是
(
)
A、通入紫色石蕊试液
B、闻气味
C、通入澄清石灰水
D、通入品红溶液中
BD
2、二氧化硫和氯气都有漂白性,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将
(
)
A
、和氯气单独通过时相同
B、和二氧化硫单独通过时相同
C、是二者作用效果之和
D、失去漂白性
D
SO2
+
Cl2
+
2H2O
=
2HCl
+
H2
SO4
3、如何除去CO2中含有的SO2?
A、气体通过NaOH溶液
B、气体通过品红溶液
品红溶液用来检验,不用来吸收SO2。
C、气体通过Na2CO3溶液
D、气体通过酸性KMnO4溶液
E、气体通过饱和NaHCO3溶液
√
√
4、如何设计实验证明某混合气体中既有二氧化碳又有二氧化硫?
①处品红溶液褪色,说明有SO2;③处品红溶液不褪色,说明SO2已经完全除去;④处澄清石灰水变浑浊,说明有CO2。
足量的KMnO4溶液的颜色不褪尽或不褪色(或不褪成无色)。
5、为了减少矿物燃料燃烧时产生的硫的氧化物对空气的污染,科学工作者研究出了多种脱硫技术:
(1)在含硫的矿物燃料中加生石灰,及时吸收燃烧过程中产生的SO2,这种方法称为“钙基固硫”另外也可以采用烟气脱硫技术,用石灰浆液或石灰石在烟气吸收塔内循环,吸收烟气中的SO2。
(2)在冶金工业的烟道废气中,常混有大量的SO2和CO,它们都是大气的污染物,在773K和催化剂(铝矾土)的作用下,使二者反应可收回大量的硫黄。
请写出以上在脱硫技术中涉及的化学反应的方程式。
食物的化妆品——二氧化硫
二氧化硫在食品业中的应用,可使一些食品如银耳、果干、果脯等具有美好的外观,所以有人称它为化妆品性的添加剂。一些不法生产者,为了得到更白的银耳,在大棚内放置了硫黄,采用这种传统的“硫黄熏蒸”工艺生产出来的银耳往往会残留一定量的二氧化硫。日前,上海质监部门对银耳产品进行了一次专项抽查,结果发现被抽检的21种银耳产品居然全部存在二氧化硫残留量超标的现象。部分银耳产品的二氧化硫残留连量居然高达2.83g/kg,最低的二氧化硫残留量也有0.125g/kg。我国《食品添加剂使用卫生标准》(GB2760-1996)对食品中二氧化硫的允许残留量做了强制性的规定,根据这一标准,银耳产品中不得含有二氧化硫残留。因此银耳并非越白越好。
问:
(1)二氧化硫可使一些食品具有美好的外观,这是利用了二氧化硫的
性。
(2)国家为什么要严格控制食品中二氧化硫的含量?
(1)漂白性。
(2)二氧化硫有毒,二氧化硫进水则形成亚硫酸,亚硫酸及其对应的盐不仅会引发支气管痉挛,还会在人体内转化成一种致癌物质——亚硝铵。
在新疆与青海交界处有一山谷,人称魔鬼谷。经常电闪雷鸣,狂风暴雨,把人畜击毙。然而谷内却是牧草茂盛,四季常青。请解释原因。
N2
+
O2
====
2NO
放电或高温
2NO
+
O2
=
2NO2
3NO2
+
H2O
=
2HNO3
+
NO
雷雨发庄稼
信使分子——NO
1.一氧化氮在神经系统中的作用?
???
一氧化氮是一种神经信使分子,参与包括学习、记忆在内的多种生理过程,并且具有调节脑血流的作用。
???
在神经系统中,二氧化氮除了具有重要的生理功能外,还具有神经毒性。脑缺血诱导表达i
N0S,生成大量一氧化氮,对神经系统造成损伤。此外,一些神经退行性疾病的发生发展也有一氧化氮参与。
2.一氧化氮在免疫中的作用?
???
一氧化氮是免疫系统对付细菌、病毒、肿瘤细胞等病原体的有效武器。
???
除了以上生理功能外,一氧化氮还在呼吸系统、内分泌系统中起重要作用。
Prize
citation:
"for
their
discoveries
concerning
nitric
oxide
as
a
signalling
molecule
in
the
cardiovascular
system"
授奖致辞:
“(表彰他们)关于一氧化氮在心血管组织中作为信号分子的发现"
2N2
+
O2
=
2NO
2NO
+
O2
=
2
NO2
放电或高温
NO:无色、不溶于水的有毒气体。
NO2:红棕色,有刺激性气味的有毒气体。密度比空气大,易溶于水,易液化。
二氧化氮和一氧化氮
科学探究:
现给你一试管二氧化氮,其他药品和仪器自选。请设计实验,要求尽可能多地使二氧化氮被水吸收。
1.请设计实验,要求尽可能多地使二氧化氮被水吸收。
2.
你的设计对工业上生产硝酸有什么启示?(从原料的充分利用、减少污染物的排放等方面考虑。)
实验步骤
现象
解释
1
将一支充满NO2的试管倒放在盛有水的水槽中
红棕色气体逐渐消失,水位上升,最后水充满整个试管的2/3,无色气体充满试管的1/3
3NO2
+
H2O
=2HNO3
+
NO
NO2红棕色气体,易溶于水,NO无色、不溶于水
2
制取少量氧气
2KClO3
=
2KCl
+
3O2
3
将氧气慢慢地通入(1)试管中
无色气体变为红棕色气体又变为无色气体,但气体体积逐渐缩小,液面不断上升
2NO+
O2
=
2NO2
3NO2
+
H2O
=2HNO3
+
NO
二氧化氮与水的反应:(工业上制取硝酸的原理)
3NO2
+
H2O
==
2HNO3
+
NO
(1)NO2、NO混合气体溶于水
3NO2
+
H2O
=
2HNO3
+
NO
例1:10mLNO2和NO的混合气体通入水中,
充分反应后,剩余6mL气体。
问:剩余气体是什么?
原混合气体中NO2有多少?
有关NO、NO2、O2混合气体
通入水中的计算
(2)
NO、O2混合气体溶于水
2NO
+
O2
===
2NO2
①
3NO2
+
H2O
===
2HNO3
+
NO
②
①×3+
②×2得:
4NO
+
3O2
+2H2O
===
4HNO3
例2:将1LNO和1LO2的混合气体通入水中,
充分反应后。
问:剩余的气体是什么?是多少?
(3)
NO2、O2混合气体溶于水
3NO2
+
H2O
=
2HNO3
+
NO
①
2NO
+
O2
=
2NO2
②
①×2+
②×1得:
4NO2
+
O2
+2H2O
===
4HNO3
例3:常温下,将3LNO2和1LO2混合后充于试管中,并将试管倒立在水槽中,充分反应后,剩余气体是什么?其体积约占试管体积的几分之几?
若是5LNO2和1LO2呢?
室温时,将盛有20mLNO2和O2的混合气体的量筒倒立在盛有水的水槽中,充分反应后,量筒内残留气体3mL,则原混合气体中NO2的体积是多少?
酸雨的形成
化石燃料的燃烧等原因
硫和氮的氧化物
硫酸和硝酸酸雾
1.什么是酸雨?
2.正常雨水pH应在什么范围?
3.酸雨是怎样形成的?
4.酸雨有什么危害?
亚硫酸等
解决方法
SO2的污染
“空中死神”
——
酸雨
酸雨是英国化学家R·A·Smith
1872年最先提出的,一般是指pH<5.6的雨、雪、雾等大气降水。(由于大气中CO2的存在,正常的雨pH≤5.6。)
酸雨被人们美称为“空中死神”,是因为它对生物、土壤、建筑材料等危害很大。在广东、广西、四川盆地及贵州大部分地区形成了我国西南、华南酸雨区,已与欧洲、北美并列成为全球三大酸雨区。
NOx的污染
来源:
(1)汽车等排放的尾气
(2)煤、石油等化石燃料的燃烧
(3)硝酸工厂的废气
危害:
引起光化学烟雾、臭氧层空洞、酸雨
光化学烟雾
光化学烟雾简介
氮氧化物(NOx)和碳氢化合物(HC)在大气环境中受到强烈的太阳紫外线照射后,发生复杂的光化学反应,主要生成光化学氧化剂(主要是O3)及其它多种复杂的化合物,这是一种新的二次污染物,统成为光化学烟雾。
对人类最大的危害是刺激眼睛和上呼吸道粘膜,引起眼睛红肿和喉炎,使机体缺氧,出现头痛,引起肺气肿等。
1943年美国洛杉矶——最早的光化学烟雾事件
1970年美国加利福尼亚州
1971年日本东京
……
第三节
硫和氮的氧化物
硫在自然界的存在(化合态)
石膏
黄铜矿
黄铁矿
皓矾:??ZnSO4.7H2O
钡餐,重晶石:?BaSO4
绿矾:??FeSO4.7H2O?
芒硝:??Na2SO4.10H2O?
明矾:?KAl(SO4)2.12H2O?
生石膏:CaSO4.2H2O?
熟石膏:2CaSO4.H2O
莫尔盐:(NH4)2SO4.FeSO4.6H2O
胆矾、蓝矾:CuSO4.5H2O?
黄铁矿(愚人金):FeS2
大苏打(海波):Na2S2O3
泻盐:MgSO4.7H2O
波尔多液:CuSO4+Ca(OH)2
锌钡白:ZnS+BaSO4
硫的各种单质
二氧化硫和三氧化硫
一、主要来源:
点燃
S+O2===SO2
现象:
空气中:
微弱的淡蓝色火焰;
纯氧中:
明亮的蓝紫色火焰。
二、物理性质
1、无色、有刺激性气味、气体
2、易液化(-10℃)
3、密度大于空气
4、易溶于水(1:40)
P90实验4-7。
5、有毒
SO2是污染大气的主要有害物质之一。
三、化学性质
1、具有酸性氧化物的性质
(1)与水反应
SO2
+
H2O
=
H2SO3
(亚硫酸)
H2SO3
=
SO2↑+
H2O
(可逆反应)
SO2
+
H2O
正反应
逆反应
H2SO3
可逆反应
定义:
在相同条件下,既能向正反应方向进行,同时又能向逆反应方向进行的化学反应。
特点:
a.
同一条件、同时进行;
b.
用可逆号
连接;
c.
反应体系中,与化学反应有关的各种物质共存。
(2)与碱反应:
SO2+2NaOH=Na2SO3+H2O
SO2+Ca(OH)2=CaSO3↓+H2O
CaSO3+SO2+H2O=Ca(HSO3)2
使澄清石灰水先变浑浊后变澄清的气体除二氧化碳外,还可能是二氧化硫。
2SO2
+
Ca(OH)2
=
Ca(HSO3)2
S
0
S
-2
S
+4
S
+6
思考:根据SO2中S的化合价,推断它具有怎样的性质?
SO2既有氧化性,又有还原性。
2、氧化性
(弱氧化性)
SO2
+
2H2S
=
3S↓+
2H2O
3、还原性
SO2+Cl2+2H2O=H2SO4+2HCl
SO2+Br2+2H2O=H2SO4+2HBr
SO2+I2+2H2O=H2SO4+2HI
5SO2+2KMnO4+2H2O
=K2SO4
+
2MnSO4+2H2SO4
(SO2可使紫红色KMnO4溶液褪色。)
(此反应可用来吸收SO2。)
2
SO2
+
O2
2
SO3
催化剂
△
品红溶液滴入亚硫酸溶液后,为什么会褪色?
加热时又显红色说明了什么?
氯气与二氧化硫比较
4.漂白性:
某些有机色素+SO2
△
无色的物质
经SO2漂白的物质长时间光照或受热后,会恢复原来的颜色,因此,其漂白作用不持久。
SO2与某些有色物质生成不稳定的无色物质。
SO2与有色物质生成不稳定的无色物质
HClO将有色物质氧化成无色物质
非氧化还原反应
氧化还原反应
不可逆
漂白某些有色物质,不能使紫色石蕊试液褪色
漂白大多数有色物质,能使紫色石蕊试液褪色
比较SO2与HClO的漂白性
物质
SO2
HClO
原理
实质
程度
范围
漂白原理
氧化
化合
吸附
漂白剂
漂白效果
氯水(HClO)
漂粉精、O3
H2O2、Na2O2
等
SO2
H2SO3
活性炭
持久
加热后
不恢复
暂时
加热后
恢复
暂时
加热后
恢复
SO2能使品红溶液褪色,加热后恢复。
——
利用此反应可用来检验SO2
北方市场上,经常见有外面非常白而里面却是黄的馒头和粉丝,里外不一样,它的做法是在一个封闭的容器中先放入馒头或粉丝,再放入燃烧着的硫后熏一下而得到的,您能否马上就食用或用来做菜?
为什么长时间放置的报纸和草帽会变黄?
四、SO2的用途
1、制硫酸
2、漂白
3、杀菌消毒
总结
SO2
与H2O反应
与碱反应
氧化性
还原性
酸酐
+4价
漂白性
特
性
与某些碱性氧化物反应
练习
1、下列可用来鉴别SO2和CO2的方法是
(
)
A、通入紫色石蕊试液
B、闻气味
C、通入澄清石灰水
D、通入品红溶液中
BD
2、二氧化硫和氯气都有漂白性,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将
(
)
A
、和氯气单独通过时相同
B、和二氧化硫单独通过时相同
C、是二者作用效果之和
D、失去漂白性
D
SO2
+
Cl2
+
2H2O
=
2HCl
+
H2
SO4
3、如何除去CO2中含有的SO2?
A、气体通过NaOH溶液
B、气体通过品红溶液
品红溶液用来检验,不用来吸收SO2。
C、气体通过Na2CO3溶液
D、气体通过酸性KMnO4溶液
E、气体通过饱和NaHCO3溶液
√
√
4、如何设计实验证明某混合气体中既有二氧化碳又有二氧化硫?
①处品红溶液褪色,说明有SO2;③处品红溶液不褪色,说明SO2已经完全除去;④处澄清石灰水变浑浊,说明有CO2。
足量的KMnO4溶液的颜色不褪尽或不褪色(或不褪成无色)。
5、为了减少矿物燃料燃烧时产生的硫的氧化物对空气的污染,科学工作者研究出了多种脱硫技术:
(1)在含硫的矿物燃料中加生石灰,及时吸收燃烧过程中产生的SO2,这种方法称为“钙基固硫”另外也可以采用烟气脱硫技术,用石灰浆液或石灰石在烟气吸收塔内循环,吸收烟气中的SO2。
(2)在冶金工业的烟道废气中,常混有大量的SO2和CO,它们都是大气的污染物,在773K和催化剂(铝矾土)的作用下,使二者反应可收回大量的硫黄。
请写出以上在脱硫技术中涉及的化学反应的方程式。
食物的化妆品——二氧化硫
二氧化硫在食品业中的应用,可使一些食品如银耳、果干、果脯等具有美好的外观,所以有人称它为化妆品性的添加剂。一些不法生产者,为了得到更白的银耳,在大棚内放置了硫黄,采用这种传统的“硫黄熏蒸”工艺生产出来的银耳往往会残留一定量的二氧化硫。日前,上海质监部门对银耳产品进行了一次专项抽查,结果发现被抽检的21种银耳产品居然全部存在二氧化硫残留量超标的现象。部分银耳产品的二氧化硫残留连量居然高达2.83g/kg,最低的二氧化硫残留量也有0.125g/kg。我国《食品添加剂使用卫生标准》(GB2760-1996)对食品中二氧化硫的允许残留量做了强制性的规定,根据这一标准,银耳产品中不得含有二氧化硫残留。因此银耳并非越白越好。
问:
(1)二氧化硫可使一些食品具有美好的外观,这是利用了二氧化硫的
性。
(2)国家为什么要严格控制食品中二氧化硫的含量?
(1)漂白性。
(2)二氧化硫有毒,二氧化硫进水则形成亚硫酸,亚硫酸及其对应的盐不仅会引发支气管痉挛,还会在人体内转化成一种致癌物质——亚硝铵。
在新疆与青海交界处有一山谷,人称魔鬼谷。经常电闪雷鸣,狂风暴雨,把人畜击毙。然而谷内却是牧草茂盛,四季常青。请解释原因。
N2
+
O2
====
2NO
放电或高温
2NO
+
O2
=
2NO2
3NO2
+
H2O
=
2HNO3
+
NO
雷雨发庄稼
信使分子——NO
1.一氧化氮在神经系统中的作用?
???
一氧化氮是一种神经信使分子,参与包括学习、记忆在内的多种生理过程,并且具有调节脑血流的作用。
???
在神经系统中,二氧化氮除了具有重要的生理功能外,还具有神经毒性。脑缺血诱导表达i
N0S,生成大量一氧化氮,对神经系统造成损伤。此外,一些神经退行性疾病的发生发展也有一氧化氮参与。
2.一氧化氮在免疫中的作用?
???
一氧化氮是免疫系统对付细菌、病毒、肿瘤细胞等病原体的有效武器。
???
除了以上生理功能外,一氧化氮还在呼吸系统、内分泌系统中起重要作用。
Prize
citation:
"for
their
discoveries
concerning
nitric
oxide
as
a
signalling
molecule
in
the
cardiovascular
system"
授奖致辞:
“(表彰他们)关于一氧化氮在心血管组织中作为信号分子的发现"
2N2
+
O2
=
2NO
2NO
+
O2
=
2
NO2
放电或高温
NO:无色、不溶于水的有毒气体。
NO2:红棕色,有刺激性气味的有毒气体。密度比空气大,易溶于水,易液化。
二氧化氮和一氧化氮
科学探究:
现给你一试管二氧化氮,其他药品和仪器自选。请设计实验,要求尽可能多地使二氧化氮被水吸收。
1.请设计实验,要求尽可能多地使二氧化氮被水吸收。
2.
你的设计对工业上生产硝酸有什么启示?(从原料的充分利用、减少污染物的排放等方面考虑。)
实验步骤
现象
解释
1
将一支充满NO2的试管倒放在盛有水的水槽中
红棕色气体逐渐消失,水位上升,最后水充满整个试管的2/3,无色气体充满试管的1/3
3NO2
+
H2O
=2HNO3
+
NO
NO2红棕色气体,易溶于水,NO无色、不溶于水
2
制取少量氧气
2KClO3
=
2KCl
+
3O2
3
将氧气慢慢地通入(1)试管中
无色气体变为红棕色气体又变为无色气体,但气体体积逐渐缩小,液面不断上升
2NO+
O2
=
2NO2
3NO2
+
H2O
=2HNO3
+
NO
二氧化氮与水的反应:(工业上制取硝酸的原理)
3NO2
+
H2O
==
2HNO3
+
NO
(1)NO2、NO混合气体溶于水
3NO2
+
H2O
=
2HNO3
+
NO
例1:10mLNO2和NO的混合气体通入水中,
充分反应后,剩余6mL气体。
问:剩余气体是什么?
原混合气体中NO2有多少?
有关NO、NO2、O2混合气体
通入水中的计算
(2)
NO、O2混合气体溶于水
2NO
+
O2
===
2NO2
①
3NO2
+
H2O
===
2HNO3
+
NO
②
①×3+
②×2得:
4NO
+
3O2
+2H2O
===
4HNO3
例2:将1LNO和1LO2的混合气体通入水中,
充分反应后。
问:剩余的气体是什么?是多少?
(3)
NO2、O2混合气体溶于水
3NO2
+
H2O
=
2HNO3
+
NO
①
2NO
+
O2
=
2NO2
②
①×2+
②×1得:
4NO2
+
O2
+2H2O
===
4HNO3
例3:常温下,将3LNO2和1LO2混合后充于试管中,并将试管倒立在水槽中,充分反应后,剩余气体是什么?其体积约占试管体积的几分之几?
若是5LNO2和1LO2呢?
室温时,将盛有20mLNO2和O2的混合气体的量筒倒立在盛有水的水槽中,充分反应后,量筒内残留气体3mL,则原混合气体中NO2的体积是多少?
酸雨的形成
化石燃料的燃烧等原因
硫和氮的氧化物
硫酸和硝酸酸雾
1.什么是酸雨?
2.正常雨水pH应在什么范围?
3.酸雨是怎样形成的?
4.酸雨有什么危害?
亚硫酸等
解决方法
SO2的污染
“空中死神”
——
酸雨
酸雨是英国化学家R·A·Smith
1872年最先提出的,一般是指pH<5.6的雨、雪、雾等大气降水。(由于大气中CO2的存在,正常的雨pH≤5.6。)
酸雨被人们美称为“空中死神”,是因为它对生物、土壤、建筑材料等危害很大。在广东、广西、四川盆地及贵州大部分地区形成了我国西南、华南酸雨区,已与欧洲、北美并列成为全球三大酸雨区。
NOx的污染
来源:
(1)汽车等排放的尾气
(2)煤、石油等化石燃料的燃烧
(3)硝酸工厂的废气
危害:
引起光化学烟雾、臭氧层空洞、酸雨
光化学烟雾
光化学烟雾简介
氮氧化物(NOx)和碳氢化合物(HC)在大气环境中受到强烈的太阳紫外线照射后,发生复杂的光化学反应,主要生成光化学氧化剂(主要是O3)及其它多种复杂的化合物,这是一种新的二次污染物,统成为光化学烟雾。
对人类最大的危害是刺激眼睛和上呼吸道粘膜,引起眼睛红肿和喉炎,使机体缺氧,出现头痛,引起肺气肿等。
1943年美国洛杉矶——最早的光化学烟雾事件
1970年美国加利福尼亚州
1971年日本东京
……
