第2章物质转化与材料利用复习
图片预览



文档简介
(共34张PPT)
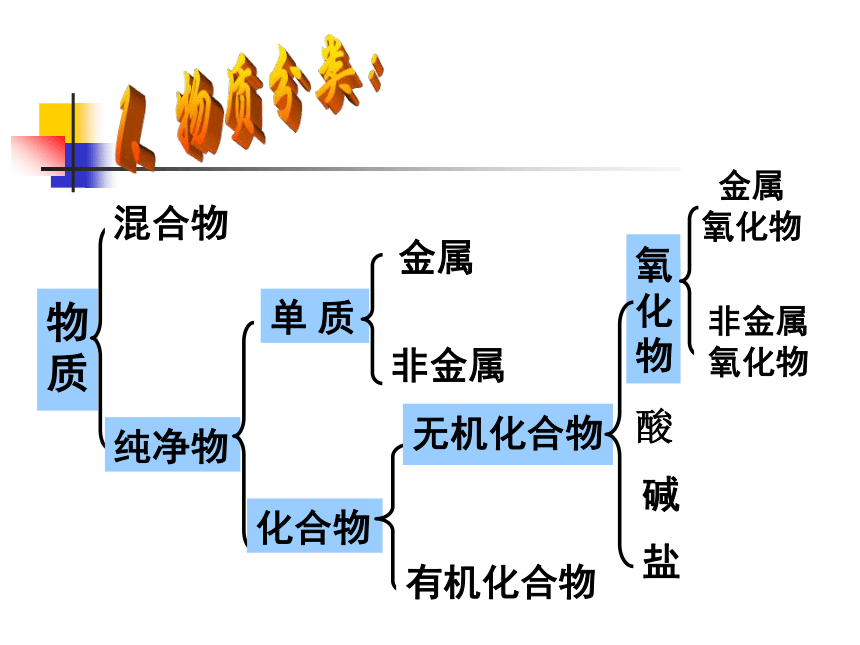
物质
混合物
纯净物
单 质
化合物
金属
非金属
有机化合物
氧化物
酸
碱
盐
金属 氧化物
非金属 氧化物
无机化合物
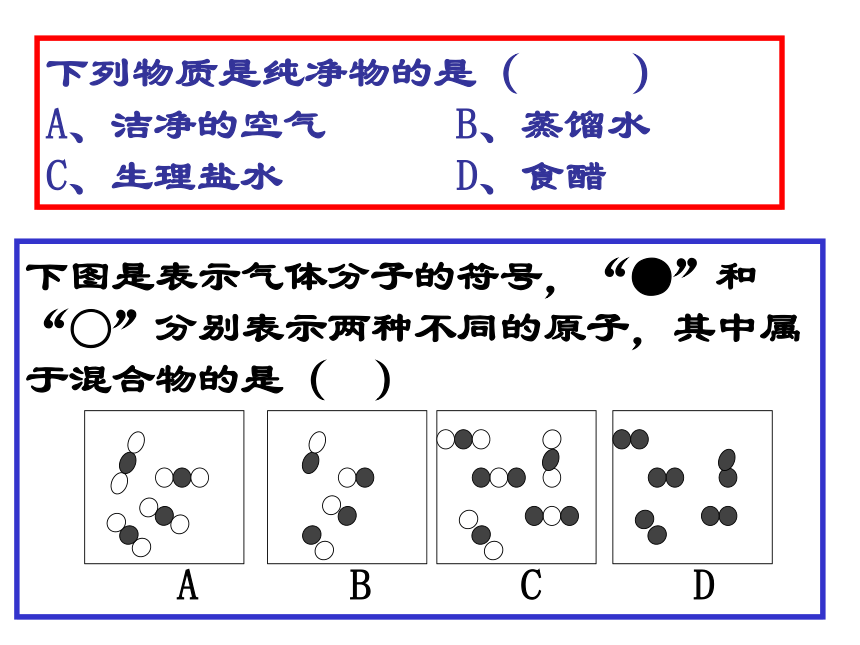
下列物质是纯净物的是( )
A、洁净的空气 B、蒸馏水 C、生理盐水 D、食醋
下图是表示气体分子的符号,“●”和“○”分别表示两种不同的原子,其中属于混合物的是( )
A B C D
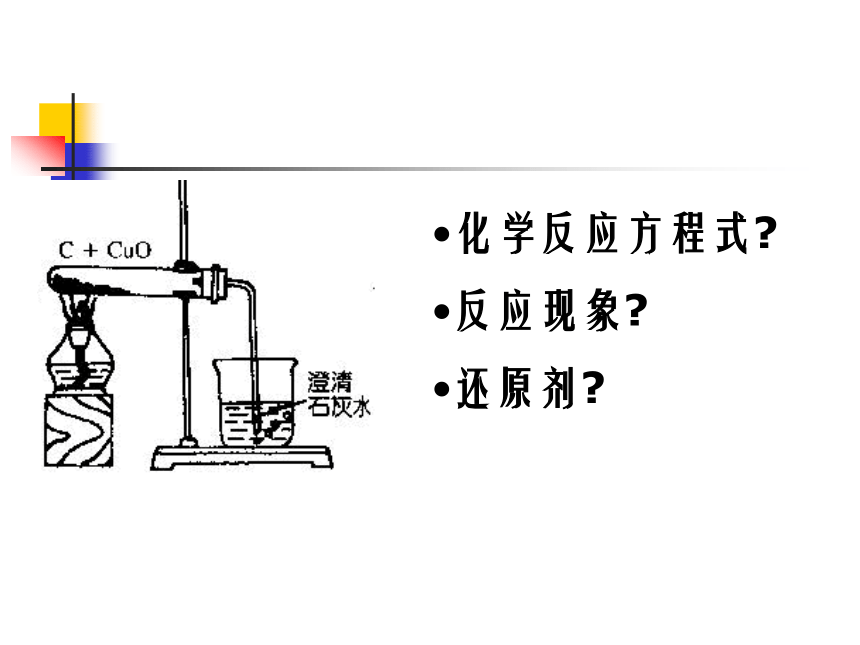
化学反应方程式
反应现象
还原剂
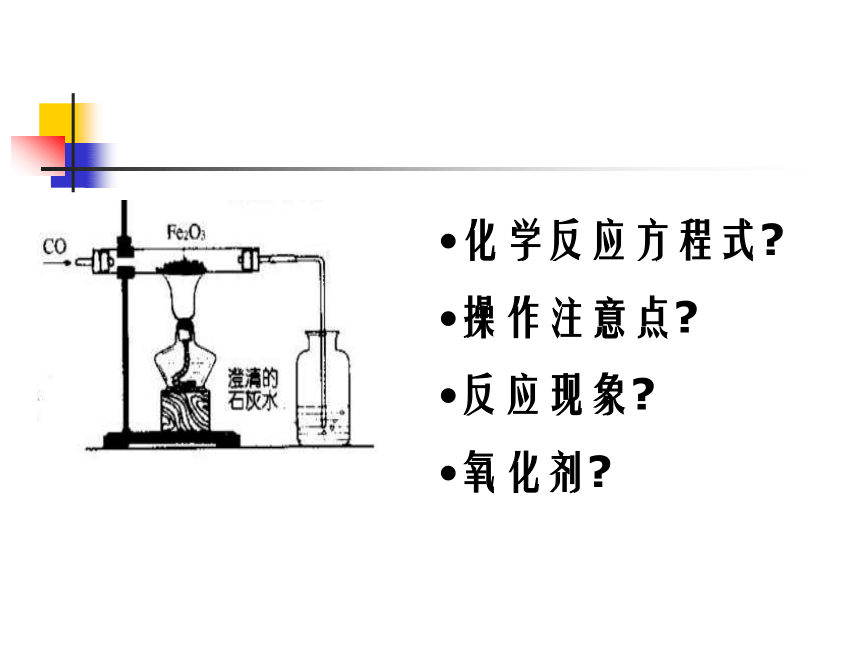
化学反应方程式
操作注意点
反应现象
氧化剂
化学反应方程式
操作注意点
反应现象
氧化剂
3CO + Fe2O3 === 3CO2 + 2Fe
高温
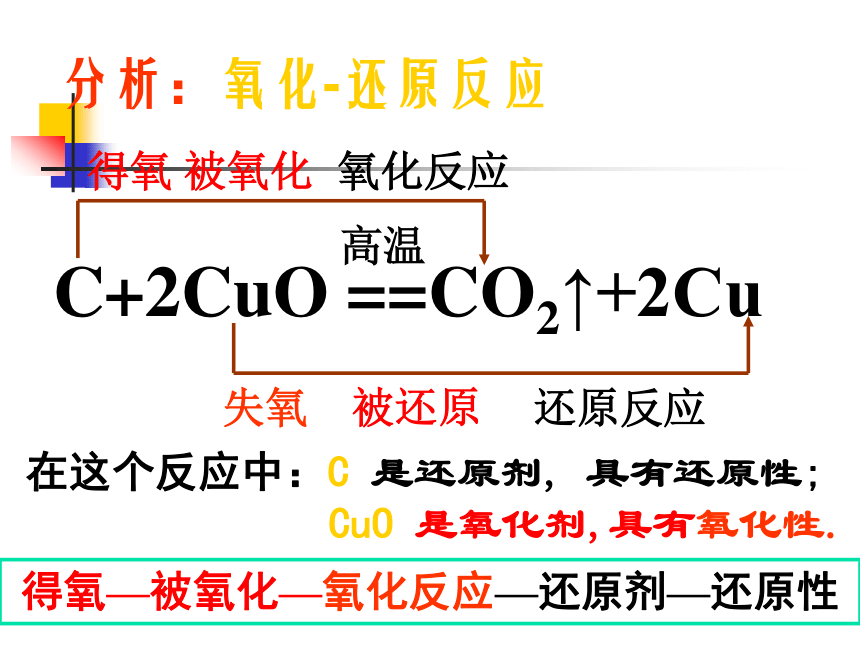
C+2CuO ==CO2↑+2Cu
高温
分析:氧化-还原反应
氧化反应
得氧 被氧化
失氧 被还原
还原反应
得氧—被氧化—氧化反应—还原剂—还原性
在这个反应中:C 是还原剂, 具有还原性;
CuO 是氧化剂,具有氧化性.
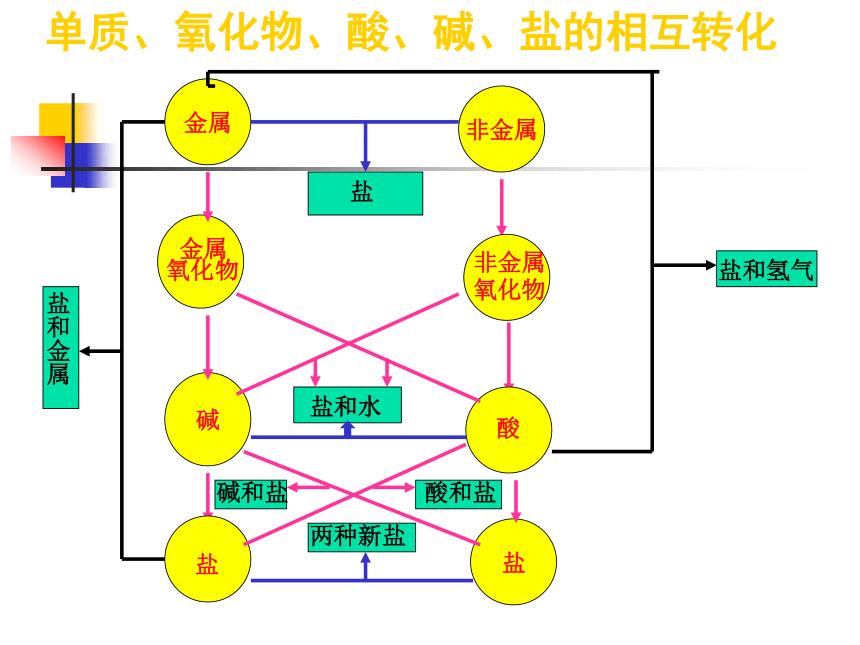
单质、氧化物、酸、碱、盐的相互转化
金属
碱
非金属
盐
盐
盐和水
两种新盐
碱和盐
酸和盐
盐和金属
盐和氢气
盐
酸
金属
氧化
物
非金属氧化物
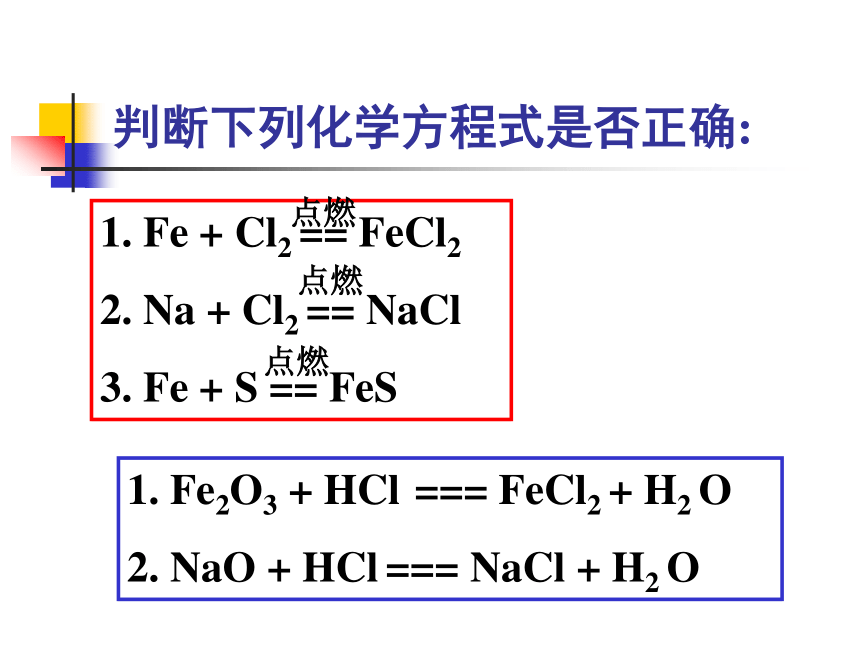
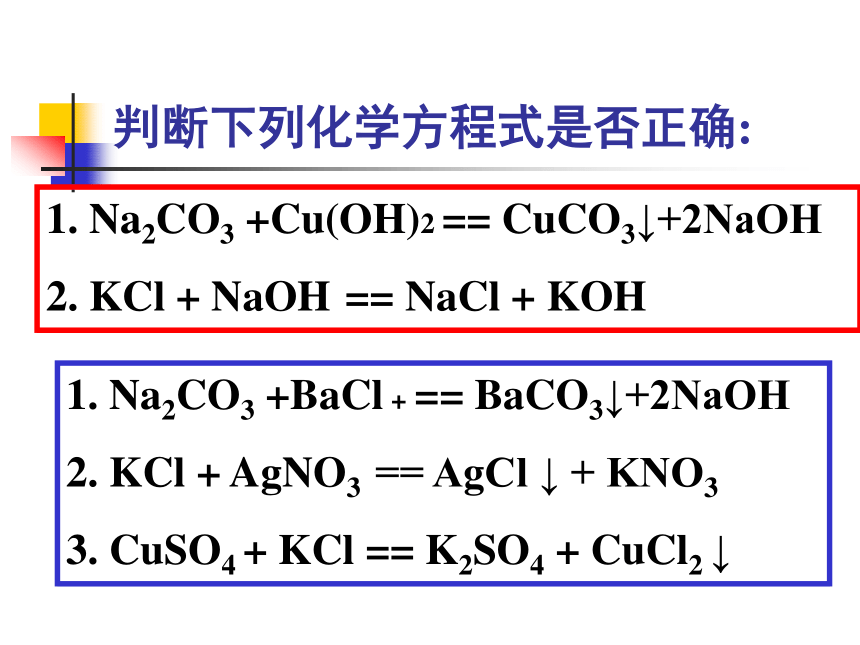
判断下列化学方程式是否正确:
Fe + Cl2 == FeCl2
Na + Cl2 == NaCl
Fe + S == FeS
点燃
点燃
点燃
Fe2O3 + HCl === FeCl2 + H2 O
NaO + HCl === NaCl + H2 O
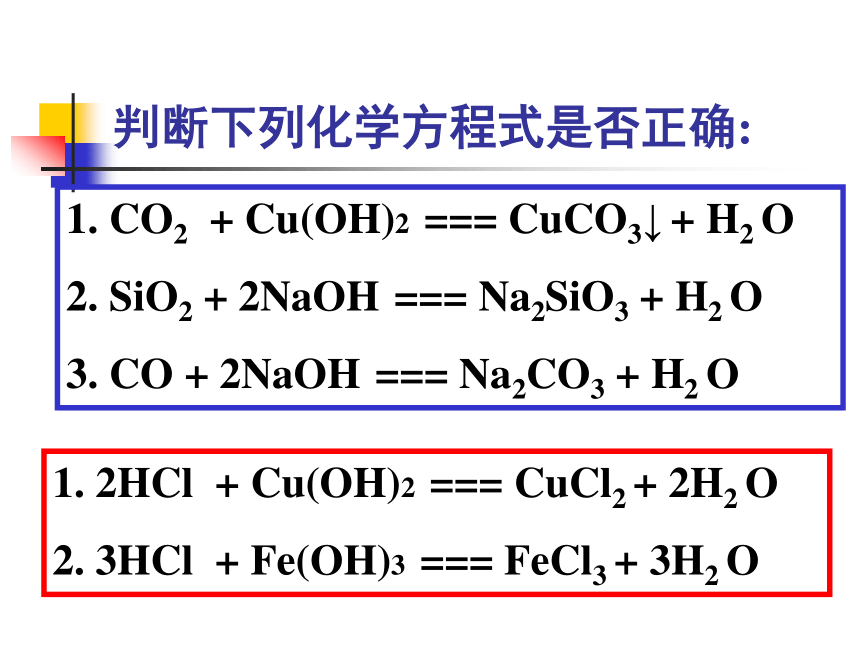
CO2 + Cu(OH)2 === CuCO3↓ + H2 O
SiO2 + 2NaOH === Na2SiO3 + H2 O
3. CO + 2NaOH === Na2CO3 + H2 O
2HCl + Cu(OH)2 === CuCl2 + 2H2 O
3HCl + Fe(OH)3 === FeCl3 + 3H2 O
判断下列化学方程式是否正确:
判断下列化学方程式是否正确:
Na2CO3 +Cu(OH)2 == CuCO3↓+2NaOH
KCl + NaOH == NaCl + KOH
Na2CO3 +BaCl + == BaCO3↓+2NaOH
KCl + AgNO3 == AgCl ↓ + KNO3
CuSO4 + KCl == K2SO4 + CuCl2 ↓
判断下列化学方程式是否正确:
H2CO3 + CaCl2 == 2HCl+ CaCO3 ↓
6HCl + Fe2(SO4)3 ===2FeCl3 + 3H2 SO4
CuO +H2O== Cu(OH)2
K2O +H2O== 2KOH
SO2 + H2O == H2SO4
1. 金属+酸—
2. 金属氧化物+酸—
3. 碱+酸—
4. 碳酸盐+酸—
1. 金属氧化物+水 —可溶性碱
2. 可溶性碱+可溶性盐—不溶性碱
SO42-的鉴定:
Cl-的鉴定:
CO32-的鉴定:
NH4+的鉴定:
氯化钡溶液和稀硝酸
硝酸银溶液和稀硝酸
稀盐酸和澄清石灰水
氢氧化钠和湿润的红色石蕊试纸
⑴金刚石、石墨:C
⑵水银、汞:Hg
(3)生石灰、氧化钙:CaO
(4)干冰:CO2
(5)盐酸、氢氯酸:HCl
(6)亚硫酸:H2SO3
(7)氢硫酸:H2S
(8)熟石灰、消石灰:Ca(OH)2
(9)苛性钠、火碱、烧碱:NaOH
(10)纯碱:Na2CO3
碳酸钠晶体、纯碱晶体:Na2CO3.10H2O
(11)碳酸氢钠:NaHCO3 (也叫小苏打)
(12)胆矾、蓝矾、硫酸铜晶体:CuSO4.5H2O
(13)铜绿、孔雀石:Cu2(OH)2CO3
(14)甲醇:CH3OH 有毒、失明、死亡
(15)酒精、乙醇:C2H5OH
(16)醋酸、乙酸CH3COOH
(17)氨气:NH3 (碱性气体)
(18)氨水:NH3.H2O
(19)亚硝酸钠:NaNO2 (工业用盐、有毒)
(21)波尔多液 :CuSO4 Ca(OH)2
碳铵 硫铵
尿素 草木灰
明矾
一.有关物质颜色的记忆
黑色固体:石墨、炭粉、铁粉、CuO、
MnO2、Fe3O4
红色固体:Cu、Fe2O3 、红磷
▲硫:淡黄色 ▲KMnO4为紫黑色
▲ Cu2(OH)2CO3为绿色
2、溶液颜色
Cu2+溶液蓝色:CuSO4溶液、CuCI2溶液;
Fe3+溶液黄色:FeCI3溶液为黄色;
Fe2+溶液为浅绿色:FeCI2溶液、FeSO4溶液;
高锰酸钾溶液
二.有关沉淀的记忆
“六白”“一蓝”“一红褐”
“六白” CaCO3 Ag2 CO3 BaCO3
BaSO4 AgCl Mg(OH)2
“一蓝” Cu(OH)2
“一红褐” Fe(OH)3
2.复分解反应
条件:生成物中必须有沉淀、气体、水三者之一生成。
碱+盐——新碱+新盐
盐+盐——新盐+新盐
条件:1.反应物都溶于水
2.生成物中有沉淀、气体、水三者之一生成
1、相互间能发生反应产生沉淀、气体或水的,不能共存。
2、离子间能结合成沉淀、气体或水的,不能共存。例如:H+和OH-,Ag+和CI-,Ba2+和SO42-,H+和CO32-等离子不能在同一溶液中共存。
3、背景:酸性溶液中有大量的H+,碱性溶液中有大量的OH- 。
所以,在这里,把用到最多的特征离子总结如下:
CO32- H+ Ag+ Cl- Ag+
Ba2+ 、Ca2+ SO42- Ba2+ OH- Mg2+
Fe3+ Cu2+
NH4
这些离子之间的互相应用,可以使很多题都得到简化。
应用提高
(1)常温下,下列物质可以通过金属与酸 反应直接制取的是( ) A.AgCl B.MgCl2 C.CuCl2 D.FeCl3
(2)制作松花蛋所用的配料主要有纯碱、食盐、生石灰、草木灰(主要成分K2CO3).水等物质,制作时需将它们混合并充分搅拌,写出有关的方程式。
(3)只用一种试剂鉴别NaOH、Ca(OH)2、H2SO4三种无色溶液,这种试剂是 .
(4)在不用指示剂的条件下,欲将含有盐酸的氯化钙溶液变为中性,应选用的试剂是( ) A.澄清石灰水 B.硝酸银溶液 C.石灰石粉末 D.生石灰粉末
应用提高
现有木炭、空气、水和生石灰,如何制取纯净的碳酸钙?
现有钠、铁、空气、水和稀盐酸,如何制取氢氧化钠和氢氧化铁?
现有氧化铜、石灰石、水和稀盐酸,如何制取氢氧化铜?
物质
混合物
纯净物
单 质
化合物
金属
非金属
有机化合物
氧化物
酸
碱
盐
金属 氧化物
非金属 氧化物
无机化合物
下列物质是纯净物的是( )
A、洁净的空气 B、蒸馏水 C、生理盐水 D、食醋
下图是表示气体分子的符号,“●”和“○”分别表示两种不同的原子,其中属于混合物的是( )
A B C D
化学反应方程式
反应现象
还原剂
化学反应方程式
操作注意点
反应现象
氧化剂
化学反应方程式
操作注意点
反应现象
氧化剂
3CO + Fe2O3 === 3CO2 + 2Fe
高温
C+2CuO ==CO2↑+2Cu
高温
分析:氧化-还原反应
氧化反应
得氧 被氧化
失氧 被还原
还原反应
得氧—被氧化—氧化反应—还原剂—还原性
在这个反应中:C 是还原剂, 具有还原性;
CuO 是氧化剂,具有氧化性.
单质、氧化物、酸、碱、盐的相互转化
金属
碱
非金属
盐
盐
盐和水
两种新盐
碱和盐
酸和盐
盐和金属
盐和氢气
盐
酸
金属
氧化
物
非金属氧化物
判断下列化学方程式是否正确:
Fe + Cl2 == FeCl2
Na + Cl2 == NaCl
Fe + S == FeS
点燃
点燃
点燃
Fe2O3 + HCl === FeCl2 + H2 O
NaO + HCl === NaCl + H2 O
CO2 + Cu(OH)2 === CuCO3↓ + H2 O
SiO2 + 2NaOH === Na2SiO3 + H2 O
3. CO + 2NaOH === Na2CO3 + H2 O
2HCl + Cu(OH)2 === CuCl2 + 2H2 O
3HCl + Fe(OH)3 === FeCl3 + 3H2 O
判断下列化学方程式是否正确:
判断下列化学方程式是否正确:
Na2CO3 +Cu(OH)2 == CuCO3↓+2NaOH
KCl + NaOH == NaCl + KOH
Na2CO3 +BaCl + == BaCO3↓+2NaOH
KCl + AgNO3 == AgCl ↓ + KNO3
CuSO4 + KCl == K2SO4 + CuCl2 ↓
判断下列化学方程式是否正确:
H2CO3 + CaCl2 == 2HCl+ CaCO3 ↓
6HCl + Fe2(SO4)3 ===2FeCl3 + 3H2 SO4
CuO +H2O== Cu(OH)2
K2O +H2O== 2KOH
SO2 + H2O == H2SO4
1. 金属+酸—
2. 金属氧化物+酸—
3. 碱+酸—
4. 碳酸盐+酸—
1. 金属氧化物+水 —可溶性碱
2. 可溶性碱+可溶性盐—不溶性碱
SO42-的鉴定:
Cl-的鉴定:
CO32-的鉴定:
NH4+的鉴定:
氯化钡溶液和稀硝酸
硝酸银溶液和稀硝酸
稀盐酸和澄清石灰水
氢氧化钠和湿润的红色石蕊试纸
⑴金刚石、石墨:C
⑵水银、汞:Hg
(3)生石灰、氧化钙:CaO
(4)干冰:CO2
(5)盐酸、氢氯酸:HCl
(6)亚硫酸:H2SO3
(7)氢硫酸:H2S
(8)熟石灰、消石灰:Ca(OH)2
(9)苛性钠、火碱、烧碱:NaOH
(10)纯碱:Na2CO3
碳酸钠晶体、纯碱晶体:Na2CO3.10H2O
(11)碳酸氢钠:NaHCO3 (也叫小苏打)
(12)胆矾、蓝矾、硫酸铜晶体:CuSO4.5H2O
(13)铜绿、孔雀石:Cu2(OH)2CO3
(14)甲醇:CH3OH 有毒、失明、死亡
(15)酒精、乙醇:C2H5OH
(16)醋酸、乙酸CH3COOH
(17)氨气:NH3 (碱性气体)
(18)氨水:NH3.H2O
(19)亚硝酸钠:NaNO2 (工业用盐、有毒)
(21)波尔多液 :CuSO4 Ca(OH)2
碳铵 硫铵
尿素 草木灰
明矾
一.有关物质颜色的记忆
黑色固体:石墨、炭粉、铁粉、CuO、
MnO2、Fe3O4
红色固体:Cu、Fe2O3 、红磷
▲硫:淡黄色 ▲KMnO4为紫黑色
▲ Cu2(OH)2CO3为绿色
2、溶液颜色
Cu2+溶液蓝色:CuSO4溶液、CuCI2溶液;
Fe3+溶液黄色:FeCI3溶液为黄色;
Fe2+溶液为浅绿色:FeCI2溶液、FeSO4溶液;
高锰酸钾溶液
二.有关沉淀的记忆
“六白”“一蓝”“一红褐”
“六白” CaCO3 Ag2 CO3 BaCO3
BaSO4 AgCl Mg(OH)2
“一蓝” Cu(OH)2
“一红褐” Fe(OH)3
2.复分解反应
条件:生成物中必须有沉淀、气体、水三者之一生成。
碱+盐——新碱+新盐
盐+盐——新盐+新盐
条件:1.反应物都溶于水
2.生成物中有沉淀、气体、水三者之一生成
1、相互间能发生反应产生沉淀、气体或水的,不能共存。
2、离子间能结合成沉淀、气体或水的,不能共存。例如:H+和OH-,Ag+和CI-,Ba2+和SO42-,H+和CO32-等离子不能在同一溶液中共存。
3、背景:酸性溶液中有大量的H+,碱性溶液中有大量的OH- 。
所以,在这里,把用到最多的特征离子总结如下:
CO32- H+ Ag+ Cl- Ag+
Ba2+ 、Ca2+ SO42- Ba2+ OH- Mg2+
Fe3+ Cu2+
NH4
这些离子之间的互相应用,可以使很多题都得到简化。
应用提高
(1)常温下,下列物质可以通过金属与酸 反应直接制取的是( ) A.AgCl B.MgCl2 C.CuCl2 D.FeCl3
(2)制作松花蛋所用的配料主要有纯碱、食盐、生石灰、草木灰(主要成分K2CO3).水等物质,制作时需将它们混合并充分搅拌,写出有关的方程式。
(3)只用一种试剂鉴别NaOH、Ca(OH)2、H2SO4三种无色溶液,这种试剂是 .
(4)在不用指示剂的条件下,欲将含有盐酸的氯化钙溶液变为中性,应选用的试剂是( ) A.澄清石灰水 B.硝酸银溶液 C.石灰石粉末 D.生石灰粉末
应用提高
现有木炭、空气、水和生石灰,如何制取纯净的碳酸钙?
现有钠、铁、空气、水和稀盐酸,如何制取氢氧化钠和氢氧化铁?
现有氧化铜、石灰石、水和稀盐酸,如何制取氢氧化铜?
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
