山东省德州市夏津第一中学2020-2021学年高二上学期九月月考化学试卷
文档属性
| 名称 | 山东省德州市夏津第一中学2020-2021学年高二上学期九月月考化学试卷 |

|
|
| 格式 | doc | ||
| 文件大小 | 775.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-15 00:00:00 | ||
图片预览


文档简介
夏津第一中学2020-2021学年高二上学期九月月考
化学试题
考试时间:90分钟;
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
可能用到的原子量:H:1 C:12 O:16 Na:23 Fe:56 Cu:64 Zn:65 Ag:108
一、单选题(本题共10小题,每小题只有一个选项符合题意,选对得2分,选错得0分,共20分)
1.已知反应A+B=C+D的能量变化如图所示(E1、E2均为正值),下列说法正确的是( )
A.该反应吸收的能量为(E1-E2)
B.该反应只有在加热条件下才能进行
C.A和B的总能量一定高于C和D的总能量
D.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
2.下列有关说法正确的是( )
A.已知HI(g) 1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
B.已知2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1,则氢气的摩尔燃烧焓为ΔH=-285.8 kJ·mol-1
C.已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
3.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(盛有KNO3琼脂的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
① 在外电路上,电流由铜电极流向银电极
② 正极反应为:Ag++e―=Ag
③ 盐桥中的NO3-移向AgNO3溶液,K+移向Cu(NO3)2溶液
④ 将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②④ C.②③ D.③④
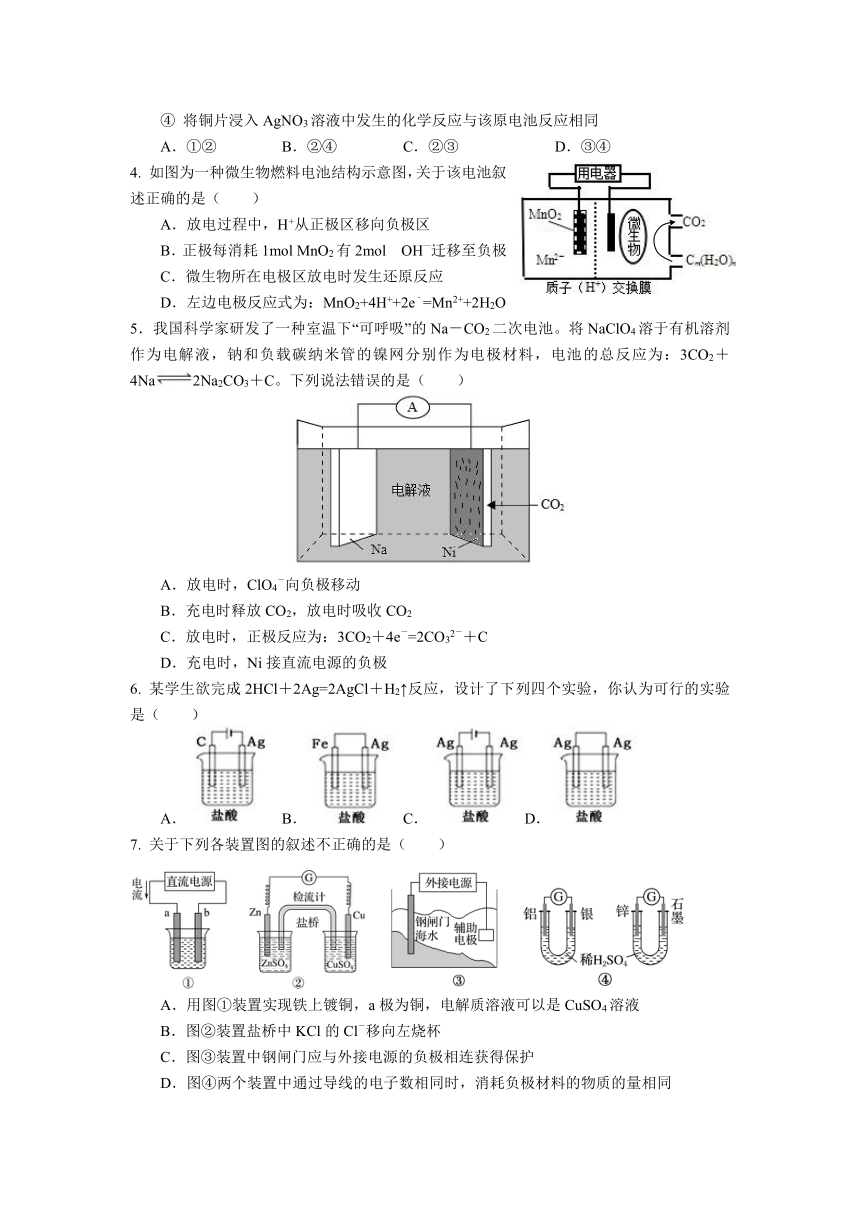
4. 如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
A.放电过程中,H+从正极区移向负极区
B.正极每消耗1mol MnO2有2mol OH—迁移至负极
C.微生物所在电极区放电时发生还原反应
D.左边电极反应式为:MnO2+4H++2e﹣=Mn2++2H2O
5.我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na2Na2CO3+C。下列说法错误的是( )
A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-=2CO32-+C
D.充电时,Ni接直流电源的负极
6. 某学生欲完成2HCl+2Ag=2AgCl+H2↑反应,设计了下列四个实验,你认为可行的实验是( )
A. B. C. D.
7. 关于下列各装置图的叙述不正确的是( )
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向左烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量相同
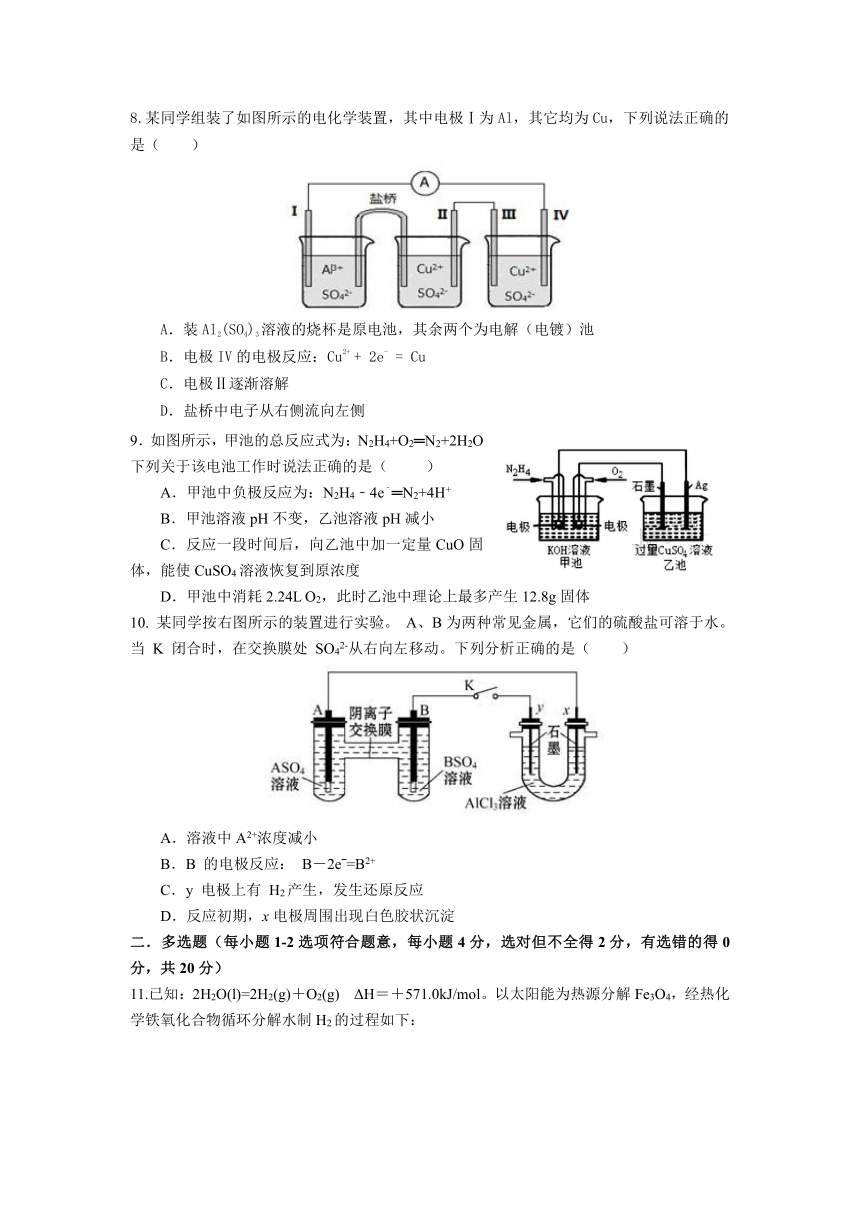
8.某同学组装了如图所示的电化学装置,其中电极Ⅰ为Al,其它均为Cu,下列说法正确的是( )
A.装Al2(SO4)3溶液的烧杯是原电池,其余两个为电解(电镀)池
B.电极IV的电极反应:Cu2+ + 2e- = Cu
C.电极Ⅱ逐渐溶解
D.盐桥中电子从右侧流向左侧
9.如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是( )
A.甲池中负极反应为:N2H4﹣4e﹣═N2+4H+
B.甲池溶液pH不变,乙池溶液pH减小
C.反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗2.24L O2,此时乙池中理论上最多产生12.8g固体
10. 某同学按右图所示的装置进行实验。 A、B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42-从右向左移动。下列分析正确的是( )
A.溶液中A2+浓度减小
B.B 的电极反应: B-2eˉ=B2+
C.y 电极上有 H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀
二.多选题(每小题1-2选项符合题意,每小题4分,选对但不全得2分,有选错的得0分,共20分)
11.已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是( )
A.过程Ⅱ热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=-128.9kJ/mol
B.过程Ⅰ中每消耗232gFe3O4转移2mol电子
C.过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
12.在一密闭容器中进行如下反应:2SO2(气)+O2(气)2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
A.SO2为0.4mol/L、O2为0.2mol/L B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L D.SO3为0.25mol/L
13.下列有关说法正确的是( )
A.若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化
B.工业上用石墨电极电解熔融 Al2O3冶炼金属铝时,阳极因被氧气氧化须定期更换
C.铅蓄电池放电时,负极质量减小
D.加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用
14 .重铬酸钾是工业合成的常用氧化剂和催化剂,如图所示的微生物电池,能利用K2Cr2O7实现对含苯酚(或醛类)废水的有效处理,该电池工作一段时间后,中间室内的NaC1溶液浓度减小,则下列叙述正确的是( )
A.a电极为负极,电子从a电极经过中间室到达b电极
B.M为阳离子交换膜,电解过程中中间室内的n(NaC1)减小
C.处理含苯甲醛废水时a电极反应式为:C6H5CHO-32e-+13H2O=7CO2+32H+
D.当b电极消耗等物质的量的K2Cr2O7时,a电极消耗的C6H5OH或C6H5CHO的物质的量之比为8:7
15. 某温度下,在2L的恒容密闭容器中充入气体A和气体B发生反应生成气体C,反应过程中各组分的物质的量随反应时间的变化如图所示。下列说法正确的是( )
A.t1时刻反应达到平衡状态
B.B的平衡转化率为10%
C.该反应的化学方程式可表示为:A+3B2C
D.该温度下,反应的平衡常数为300
三.综合题(共60分)
16.(12分)I.氢气在工业合成中应用广泛。
(1)通过下列反应可以制备甲醇
①CO(g)+2H2(g)=CH3OH(g) △H=-90.8kJ·mol-1
②CO2(g)+H2(g)CO(g)+H2O(g) △H=+41.3kJ·mol-1
①请写出由CO2和H2制取甲醇的热化学方程式:______________________。
②根据以上信息判断CO2与H2制取甲醇的反应在 (填高温或低温)条件下可自发进行。
③当温度为850℃,反应②的化学平衡常数,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO H2O CO2 H2
0.5 mol 8.5 mol 2.0 mol 2.0 mol
此时上述的反应②中正、逆反应速率的关系式是___________(填代号),请结合必要的计算,说明理由 。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
Ⅱ.CH4可以消除氮氧化物的污染,主要反应原理为
CH4(g)+2NO2(g)CO2(g)+2H2O(g)+N2(g) △H=-868.7kJ·mol-1
(2)在3.00L密闭容器中通入1 mol CH4和2 mol NO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(p)的数据见下表(提示:恒温恒容条件下压强与气体的物质的量成正比):
反应时间t/min 0 2 4 6 8 10
总压强P/×100kPa 4.80 5.44 5.76 5.92 6.00 6.00
由表中数据计算,达到平衡时NO2的转化率为___________,该温度下的平衡常数K=___________。
17.(12分)2018年6月27日,国务院发布《打赢蓝天保卫战三年行动计划》,该计划是中国政府部署的一项污染防治行动计划,旨在持续改善空气质量,为群众留住更多蓝天。对废气的进行必要的处理,让空气更加清洁是环境科学的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
C (s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
2C (s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
若某反应的平衡常数表达式为,请写出此反应的热化学方程式 。
(2)用如图所示的电解装置可将雾霾中的NO、SO2分别转化为NH和SO
① NO在电极上发生的反应为 _________________。
②SO2在电极上发生的反应为 __________________。
③写出物质A的化学式____________。
(3)利用氨气可以设计高能环保燃料电池(反应原理:4NH3+3O2=2N2+6H2O),用该电池电解含有NO3-的碱性工业废水,在阴极产生N2。阴极的电极反应式为 ;在标准状况下,当阴极收集到13.44LN2时,理论上消耗NH3的体积为________L。
18.(10分)用如图所示的装置进行电解。通电一段时间后,发现湿润的淀粉-KI试纸的C端变为蓝色。
①E为电源的_________极,Fe为A池的_________极。
②A装置中发生反应的化学方程式为____________________________________。
③在B装置中观察到的现象是_____________________________________________。
④D端的电极反应式为_____________________________________________。
19.(12分)按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向___________极移动(填“正”或“负”)。
②若有1mole- 流过导线,则理论上负极质量减少____________g。
③若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________(填“锌极”或“铜极”),原因是 (用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g)bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
①反应化学方程式中各物质的系数比为a∶b∶c=_________。
②下列叙述中能说明上述反应达到平衡状态的是____________________________。
A.反应中当M与N的物质的量相等时
B.混合气体的总物质的量不随时间变化而变化
C.单位时间内每消耗amolN,同时消耗bmolM
D.混合气体的压强不随时间的变化而变化
E.M的物质的量浓度保持不变
20.(14分)(1)如图为氯碱工业电解饱和氯化钠溶液的装置示意图。
①电解时,阳极的电极反应式为_____________________________________。
②逸出的气体E是_____________;流出物质G的溶质是_____________(写出化学式)。
(2)可利用太阳能光伏电池电解水制高纯氢,工作示意图如图所示。通过控制开关连接或,可交替得到H2和O2。
①制H2时,连接 。产生H2的的电极反应式是 。
②改变开关连接方式,可得O2,写出此时电极3的电极反应式: 。
(3)酒驾的检验:目前最常用的是燃料电池型呼气酒精检测仪,其原理是乙醇被氧化为乙酸的过程中化学能转化为电能,用电压表测其电压示数越高,乙醇浓度越高。反应原理如图所示,写出测定酒驾时负极的电极反应式:_______________________________。
答案
一、选择题(1-10题每题2分,11-15题每题4分,共40分)
1—5 ACBDD 6—10 CDBCD
11.AC 12.BD 13.B 14.CD 15.C
二、非选择题(每空2分,共60分)
16.(12分)(1)①
②低温
③B ,∴平衡逆向移动,
(2)75%
17.(12分),
(2)①
②
③
(3)
18.(10分)①负 阴
②
③石墨电极有气体产生,电极溶解,溶液中有蓝色沉淀生成。
④
19.(12分)(1)①正 ②32.5 ③ 铜极
(2)①2:1:1 ②CE
20.(14分)(1)①
②
(2)①
②
(3)
化学试题
考试时间:90分钟;
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
可能用到的原子量:H:1 C:12 O:16 Na:23 Fe:56 Cu:64 Zn:65 Ag:108
一、单选题(本题共10小题,每小题只有一个选项符合题意,选对得2分,选错得0分,共20分)
1.已知反应A+B=C+D的能量变化如图所示(E1、E2均为正值),下列说法正确的是( )
A.该反应吸收的能量为(E1-E2)
B.该反应只有在加热条件下才能进行
C.A和B的总能量一定高于C和D的总能量
D.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
2.下列有关说法正确的是( )
A.已知HI(g) 1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
B.已知2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1,则氢气的摩尔燃烧焓为ΔH=-285.8 kJ·mol-1
C.已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
3.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(盛有KNO3琼脂的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
① 在外电路上,电流由铜电极流向银电极
② 正极反应为:Ag++e―=Ag
③ 盐桥中的NO3-移向AgNO3溶液,K+移向Cu(NO3)2溶液
④ 将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②④ C.②③ D.③④
4. 如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
A.放电过程中,H+从正极区移向负极区
B.正极每消耗1mol MnO2有2mol OH—迁移至负极
C.微生物所在电极区放电时发生还原反应
D.左边电极反应式为:MnO2+4H++2e﹣=Mn2++2H2O
5.我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na2Na2CO3+C。下列说法错误的是( )
A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-=2CO32-+C
D.充电时,Ni接直流电源的负极
6. 某学生欲完成2HCl+2Ag=2AgCl+H2↑反应,设计了下列四个实验,你认为可行的实验是( )
A. B. C. D.
7. 关于下列各装置图的叙述不正确的是( )
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向左烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量相同
8.某同学组装了如图所示的电化学装置,其中电极Ⅰ为Al,其它均为Cu,下列说法正确的是( )
A.装Al2(SO4)3溶液的烧杯是原电池,其余两个为电解(电镀)池
B.电极IV的电极反应:Cu2+ + 2e- = Cu
C.电极Ⅱ逐渐溶解
D.盐桥中电子从右侧流向左侧
9.如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是( )
A.甲池中负极反应为:N2H4﹣4e﹣═N2+4H+
B.甲池溶液pH不变,乙池溶液pH减小
C.反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗2.24L O2,此时乙池中理论上最多产生12.8g固体
10. 某同学按右图所示的装置进行实验。 A、B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42-从右向左移动。下列分析正确的是( )
A.溶液中A2+浓度减小
B.B 的电极反应: B-2eˉ=B2+
C.y 电极上有 H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀
二.多选题(每小题1-2选项符合题意,每小题4分,选对但不全得2分,有选错的得0分,共20分)
11.已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是( )
A.过程Ⅱ热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=-128.9kJ/mol
B.过程Ⅰ中每消耗232gFe3O4转移2mol电子
C.过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
12.在一密闭容器中进行如下反应:2SO2(气)+O2(气)2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
A.SO2为0.4mol/L、O2为0.2mol/L B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L D.SO3为0.25mol/L
13.下列有关说法正确的是( )
A.若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化
B.工业上用石墨电极电解熔融 Al2O3冶炼金属铝时,阳极因被氧气氧化须定期更换
C.铅蓄电池放电时,负极质量减小
D.加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用
14 .重铬酸钾是工业合成的常用氧化剂和催化剂,如图所示的微生物电池,能利用K2Cr2O7实现对含苯酚(或醛类)废水的有效处理,该电池工作一段时间后,中间室内的NaC1溶液浓度减小,则下列叙述正确的是( )
A.a电极为负极,电子从a电极经过中间室到达b电极
B.M为阳离子交换膜,电解过程中中间室内的n(NaC1)减小
C.处理含苯甲醛废水时a电极反应式为:C6H5CHO-32e-+13H2O=7CO2+32H+
D.当b电极消耗等物质的量的K2Cr2O7时,a电极消耗的C6H5OH或C6H5CHO的物质的量之比为8:7
15. 某温度下,在2L的恒容密闭容器中充入气体A和气体B发生反应生成气体C,反应过程中各组分的物质的量随反应时间的变化如图所示。下列说法正确的是( )
A.t1时刻反应达到平衡状态
B.B的平衡转化率为10%
C.该反应的化学方程式可表示为:A+3B2C
D.该温度下,反应的平衡常数为300
三.综合题(共60分)
16.(12分)I.氢气在工业合成中应用广泛。
(1)通过下列反应可以制备甲醇
①CO(g)+2H2(g)=CH3OH(g) △H=-90.8kJ·mol-1
②CO2(g)+H2(g)CO(g)+H2O(g) △H=+41.3kJ·mol-1
①请写出由CO2和H2制取甲醇的热化学方程式:______________________。
②根据以上信息判断CO2与H2制取甲醇的反应在 (填高温或低温)条件下可自发进行。
③当温度为850℃,反应②的化学平衡常数,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO H2O CO2 H2
0.5 mol 8.5 mol 2.0 mol 2.0 mol
此时上述的反应②中正、逆反应速率的关系式是___________(填代号),请结合必要的计算,说明理由 。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
Ⅱ.CH4可以消除氮氧化物的污染,主要反应原理为
CH4(g)+2NO2(g)CO2(g)+2H2O(g)+N2(g) △H=-868.7kJ·mol-1
(2)在3.00L密闭容器中通入1 mol CH4和2 mol NO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(p)的数据见下表(提示:恒温恒容条件下压强与气体的物质的量成正比):
反应时间t/min 0 2 4 6 8 10
总压强P/×100kPa 4.80 5.44 5.76 5.92 6.00 6.00
由表中数据计算,达到平衡时NO2的转化率为___________,该温度下的平衡常数K=___________。
17.(12分)2018年6月27日,国务院发布《打赢蓝天保卫战三年行动计划》,该计划是中国政府部署的一项污染防治行动计划,旨在持续改善空气质量,为群众留住更多蓝天。对废气的进行必要的处理,让空气更加清洁是环境科学的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
C (s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
2C (s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
若某反应的平衡常数表达式为,请写出此反应的热化学方程式 。
(2)用如图所示的电解装置可将雾霾中的NO、SO2分别转化为NH和SO
① NO在电极上发生的反应为 _________________。
②SO2在电极上发生的反应为 __________________。
③写出物质A的化学式____________。
(3)利用氨气可以设计高能环保燃料电池(反应原理:4NH3+3O2=2N2+6H2O),用该电池电解含有NO3-的碱性工业废水,在阴极产生N2。阴极的电极反应式为 ;在标准状况下,当阴极收集到13.44LN2时,理论上消耗NH3的体积为________L。
18.(10分)用如图所示的装置进行电解。通电一段时间后,发现湿润的淀粉-KI试纸的C端变为蓝色。
①E为电源的_________极,Fe为A池的_________极。
②A装置中发生反应的化学方程式为____________________________________。
③在B装置中观察到的现象是_____________________________________________。
④D端的电极反应式为_____________________________________________。
19.(12分)按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向___________极移动(填“正”或“负”)。
②若有1mole- 流过导线,则理论上负极质量减少____________g。
③若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________(填“锌极”或“铜极”),原因是 (用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g)bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
①反应化学方程式中各物质的系数比为a∶b∶c=_________。
②下列叙述中能说明上述反应达到平衡状态的是____________________________。
A.反应中当M与N的物质的量相等时
B.混合气体的总物质的量不随时间变化而变化
C.单位时间内每消耗amolN,同时消耗bmolM
D.混合气体的压强不随时间的变化而变化
E.M的物质的量浓度保持不变
20.(14分)(1)如图为氯碱工业电解饱和氯化钠溶液的装置示意图。
①电解时,阳极的电极反应式为_____________________________________。
②逸出的气体E是_____________;流出物质G的溶质是_____________(写出化学式)。
(2)可利用太阳能光伏电池电解水制高纯氢,工作示意图如图所示。通过控制开关连接或,可交替得到H2和O2。
①制H2时,连接 。产生H2的的电极反应式是 。
②改变开关连接方式,可得O2,写出此时电极3的电极反应式: 。
(3)酒驾的检验:目前最常用的是燃料电池型呼气酒精检测仪,其原理是乙醇被氧化为乙酸的过程中化学能转化为电能,用电压表测其电压示数越高,乙醇浓度越高。反应原理如图所示,写出测定酒驾时负极的电极反应式:_______________________________。
答案
一、选择题(1-10题每题2分,11-15题每题4分,共40分)
1—5 ACBDD 6—10 CDBCD
11.AC 12.BD 13.B 14.CD 15.C
二、非选择题(每空2分,共60分)
16.(12分)(1)①
②低温
③B ,∴平衡逆向移动,
(2)75%
17.(12分),
(2)①
②
③
(3)
18.(10分)①负 阴
②
③石墨电极有气体产生,电极溶解,溶液中有蓝色沉淀生成。
④
19.(12分)(1)①正 ②32.5 ③ 铜极
(2)①2:1:1 ②CE
20.(14分)(1)①
②
(2)①
②
(3)
同课章节目录
