江苏省如皋市2020-2021学年高二上学期教学质量调研(一)化学试题(必修) Word版含答案
文档属性
| 名称 | 江苏省如皋市2020-2021学年高二上学期教学质量调研(一)化学试题(必修) Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 733.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-15 20:41:30 | ||
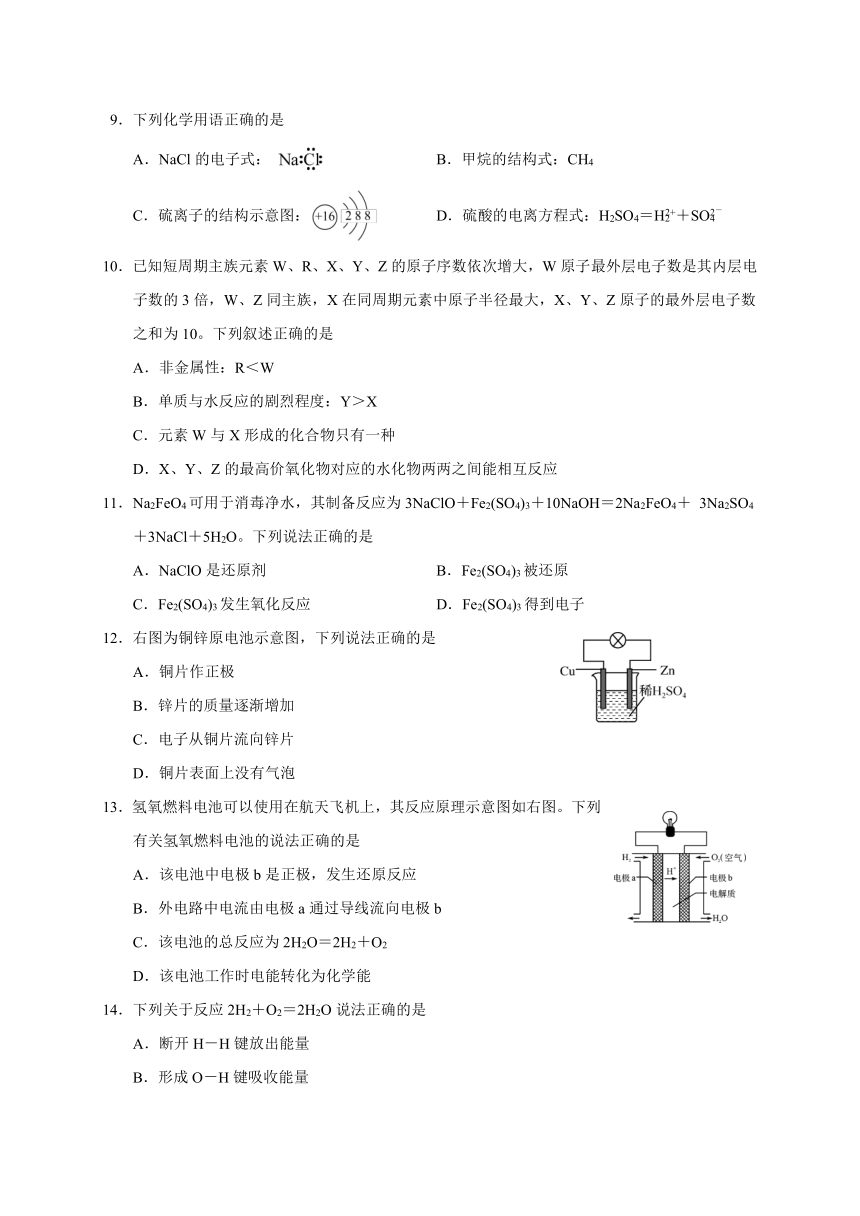
图片预览


文档简介
如皋市2020~2021学年度高二年级第一学期教学质量调研(一)
化学试题(必修)
注意事项:
1.本试卷分为选择题和非选择题两部分,总分:100分。考试时间:60分钟。
2.请把答案写在答题卡的指定栏目内。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5
选择题(共78分)
单项选择题:本题包括26 小题,每小题3分,共计78分。每小题只有一个选项符合题意。
1.科学史上每一次重大发现都极大地推动了科学的发展。1774年,拉瓦锡用精确的定量实验研究了氧化汞的分解和合成反应中各物质质量之间的变化关系。拉瓦锡由此实验研究并得出了
A.元素周期律 B.质量守恒定律
C.原子的构成规律 D.燃烧的本质规律
2.NaClO是抗击新冠肺炎期间一种常用消毒剂的有效成分。NaClO属于下列物质中的
A.酸 B.碱 C.盐 D.氧化物
3.下列物质的俗名与化学式对应正确的是
A.小苏打——Na2CO3 B.铁黑——Fe2O3
C.明矾——Al2(SO4)3 D.烧碱——NaOH
4.下列过程属于物理变化的是
A.高炉炼铁 B.海水晒盐 C.铝热焊接 D.高粱酿酒
5.反应2Mg+CO22MgO+C属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
6.下列物质中所含HCl的物质的量最多的是
A.6.02×1022个 HCl分子 B.36.5 g HCl
C.标准状况下11.2 L HCl D.20 mL 1 mol·L-1 HCl溶液
7.Sr常用于放射性同位素电池。下列关于Sr的说法正确的是
A.电子数为52 B.质子数为52
C.中子数为38 D.质量数为90
8.下列物质中,含有离子键的是
A.NH3 B.CO2 C.N2 D.MgCl2
9.下列化学用语正确的是
A.NaCl的电子式: B.甲烷的结构式:CH4
C.硫离子的结构示意图: D.硫酸的电离方程式:H2SO4=H+SO
10.已知短周期主族元素W、R、X、Y、Z的原子序数依次增大,W原子最外层电子数是其内层电子数的3倍,W、Z同主族,X在同周期元素中原子半径最大,X、Y、Z原子的最外层电子数之和为10。下列叙述正确的是
A.非金属性:R<W
B.单质与水反应的剧烈程度:Y>X
C.元素W与X形成的化合物只有一种
D.X、Y、Z的最高价氧化物对应的水化物两两之间能相互反应
11.Na2FeO4可用于消毒净水,其制备反应为3NaClO+Fe2(SO4)3+10NaOH=2Na2FeO4+ 3Na2SO4+3NaCl+5H2O。下列说法正确的是
A.NaClO是还原剂 B.Fe2(SO4)3被还原
C.Fe2(SO4)3发生氧化反应 D.Fe2(SO4)3得到电子
12.右图为铜锌原电池示意图,下列说法正确的是
A.铜片作正极
B.锌片的质量逐渐增加
C.电子从铜片流向锌片
D.铜片表面上没有气泡
13.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。下列有关氢氧燃料电池的说法正确的是
A.该电池中电极b是正极,发生还原反应
B.外电路中电流由电极a通过导线流向电极b
C.该电池的总反应为2H2O=2H2+O2
D.该电池工作时电能转化为化学能
14.下列关于反应2H2+O2=2H2O说法正确的是
A.断开H-H键放出能量
B.形成O-H键吸收能量
C.反应物的总能量大于生成物的总能量
D.反应物的总能量小于生成物的总能量
15.某工厂的一种无害化处理反应为6NO+4NH35N2+6H2O。下列关于该反应的说法正确的是
A.增大反应物浓度能减慢反应速率
B.降低温度能加快反应速率
C.使用催化剂能加快反应速率
D. NO与NH3能100%转化为产物
16.下列关于几种常见有机物的叙述不正确的是
A.甲烷能与氯气在光照条件下发生取代反应
B.乙醇不能被酸性KMnO4溶液氧化
C.乙烯能使溴的四氯化碳溶液褪色
D.乙醇能与金属钠发生反应
17.下列关于淀粉的说法正确的是
A.化学式为C6H12O6 B.不属于糖类
C.不能发生水解反应 D.常温下其水溶液遇碘变蓝色
18.下列与乙烷(CH3-CH3)分子互为同系物的是
A.CH2=CH2 B.HC≡CH C. D.CH3-CH2-CH3
19.下列与CH2=CH-CH3互为同分异构体的是
A.CH2=CH2 B.CH3-CH2-CH3 C. D.CH3-CH=CH2
20.下列关于浓硝酸的说法正确的是
A.难挥发 B.常温下不能氧化铜
C.保存在无色细口瓶中 D.常温下能使铝片钝化
21.下列关于NaHCO3的说法正确的是
A.加热时性质稳定 B.能与盐酸反应生成CO2
C.与澄清石灰水混合无现象 D.难溶于水
22.某溶液中含有大量的Cl-、OH-、NO,还可能大量存在的离子是
A.Na+ B.HCO C.NH D.Ag+
23.下列反应的离子方程式书写正确的是
A.醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O
B.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C.氯化铝溶液与氨水反应:Al3++4OH-=AlO+2H2O
D.碳酸钠溶液与稀盐酸的反应:Na2CO3+2H+=CO2↑+H2O
24.下列实验装置或操作正确的是
A.转移溶液 B.稀释浓硫酸 C.蒸发NaCl溶液 D.分离乙醇和水
25.下列鉴别物质的方法能达到目的的是
A.用加热的方法鉴别NH4Cl固体和NaCl固体
B.用焰色反应鉴别KCl固体和KOH固体
C.用丁达尔效应鉴别盐酸和硫酸溶液
D.用澄清石灰水鉴别SO2和CO2
26.关于新制饱和氯水,下列说法正确是
A.新制饱和氯水呈浅黄绿色,说明氯气溶于水但不与水反应
B.可以用pH试纸测量新制氯水的pH
C.向新制饱和氯水中通入SO2,溶液变为无色,是因为SO2将氯水漂白
D.新制氯水在光照时,溶液中会释放出氧气,同时溶液酸性增强
非选择题(共22分)
27.(6分) 乙烯是有机化学工业中的重要原料,以乙烯为原料可制取下列物质:
⑴乙醇和乙酸所含官能团的名称分别为 ▲ 、 ▲ 。
⑵写出由乙烯制取乙醇的化学方程式: ▲ 。
⑶写出乙醇与乙酸反应制取乙酸乙酯的化学方程式: ▲ 。
28.(6分) FeCl3溶液可用于蚀刻电路板上的铜,为回收蚀刻废液中的Cu和再生FeCl3溶液,实验小组采用了如下图所示的流程:
已知FeCl3溶液蚀刻电路板上的铜时所发生的反应为2FeCl3+Cu=2FeCl2+CuCl2
⑴检验蚀刻废液中是否存在Fe3+的方法是 ▲ 。
⑵从滤渣中回收铜的方法是 ▲ 。
⑶反应2的目的是再生FeCl3溶液,该反应的化学方程式为 ▲ 。
29.(10分)铵盐可用作化肥,也可用于实验室制取氨气。
⑴实验室制取氨气的装置如下图所示(部分固定及夹持类仪器已略去):
①生成氨气的化学方程式为 ▲ 。
②干燥管中所装物质X为 ▲ 。
③检验试管中氨气已集满的方法是 ▲ 。
⑵碳铵(NH4HCO3)常用作化肥,为测定某碳铵样品中氮元素的质量分数,某实验小组采用如下实验方案:准确称量0.8000 g碳铵样品于锥形瓶中,向其中加入20.00 mL 0.4000 mol·L-1的硫酸,充分反应后除去溶液中溶解的CO2。向锥形瓶中加入指示剂,用0.3000 mol·L-1的NaOH溶液滴定瓶中剩余的硫酸,当NaOH与硫酸恰好完全反应时,消耗NaOH溶液的体积为20.00 mL。请计算碳铵样品中氮元素的质量分数,写出计算过程(已知杂质不参与反应)。
2020~2021学年度高二年级第一学期教学质量调研(一)
化学试题(必修)参考答案与评分标准
一、单项选择题:本题包括26 小题, 每小题3 分, 共计78 分。每小题只有一个选项符合题意。
1.B 2.C 3.D 4.B 5.C 6.B 7.D 8.D 9.C
10.D 11.C 12.A 13.A 14.C 15.C 16.B 17.D 18.D
19.C 20.D 21.B 22.A 23.A 24.C 25.A 26.D
二、非选择题:(本部分3题,共22分)
27.⑴羟基 (1分) 羧基 (1分)
⑵CH2=CH2+H2OCH3CH2OH (2分)
⑶CH3COOH+HOCH2CH3CH3COOCH2CH3+H2O (2分)
(共6分)
28.⑴取少量蚀刻废液,向其中滴加KSCN溶液,若溶液变红,则废液中存在Fe3+;若溶液不变红,则废液中不存在Fe3+。 (2分)
⑵向废渣中加入足量稀盐酸,充分反应后过滤,所得滤渣为铜 (2分)
⑶2FeCl2+Cl2=2FeCl3 (2分)
(共6分)
29.⑴①2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O (2分)
②碱石灰 (1分)
③将湿润的红色石蕊试纸置于塞有棉花的试管口,若试纸变蓝,则氨气已集满(2分)
⑵n(NaOH)=0.3000 mol·L-1×0.02 L=0.006 mol (1分)
总的硫酸的物质的量n(H2SO4)=0.4000 mol·L-1×0.02 L=0.008 mol (1分)
与NaOH反应的硫酸的物质的量=0.006 mol×=0.003 mol
与NH4HCO3反应的硫酸的物质的量=0.008 mol-0.003 mol=0.005 mol
根据方程式2NH4HCO3+H2SO4=(NH4)2SO4+2CO2↑+2H2O可知:
n(NH4HCO3)=2×0.005 mol=0.01 mol (1分)
则碳铵样品中氮元素的质量分数w(N)=×100%=17.5% (2分)
(共10分)
化学试题(必修)
注意事项:
1.本试卷分为选择题和非选择题两部分,总分:100分。考试时间:60分钟。
2.请把答案写在答题卡的指定栏目内。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5
选择题(共78分)
单项选择题:本题包括26 小题,每小题3分,共计78分。每小题只有一个选项符合题意。
1.科学史上每一次重大发现都极大地推动了科学的发展。1774年,拉瓦锡用精确的定量实验研究了氧化汞的分解和合成反应中各物质质量之间的变化关系。拉瓦锡由此实验研究并得出了
A.元素周期律 B.质量守恒定律
C.原子的构成规律 D.燃烧的本质规律
2.NaClO是抗击新冠肺炎期间一种常用消毒剂的有效成分。NaClO属于下列物质中的
A.酸 B.碱 C.盐 D.氧化物
3.下列物质的俗名与化学式对应正确的是
A.小苏打——Na2CO3 B.铁黑——Fe2O3
C.明矾——Al2(SO4)3 D.烧碱——NaOH
4.下列过程属于物理变化的是
A.高炉炼铁 B.海水晒盐 C.铝热焊接 D.高粱酿酒
5.反应2Mg+CO22MgO+C属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
6.下列物质中所含HCl的物质的量最多的是
A.6.02×1022个 HCl分子 B.36.5 g HCl
C.标准状况下11.2 L HCl D.20 mL 1 mol·L-1 HCl溶液
7.Sr常用于放射性同位素电池。下列关于Sr的说法正确的是
A.电子数为52 B.质子数为52
C.中子数为38 D.质量数为90
8.下列物质中,含有离子键的是
A.NH3 B.CO2 C.N2 D.MgCl2
9.下列化学用语正确的是
A.NaCl的电子式: B.甲烷的结构式:CH4
C.硫离子的结构示意图: D.硫酸的电离方程式:H2SO4=H+SO
10.已知短周期主族元素W、R、X、Y、Z的原子序数依次增大,W原子最外层电子数是其内层电子数的3倍,W、Z同主族,X在同周期元素中原子半径最大,X、Y、Z原子的最外层电子数之和为10。下列叙述正确的是
A.非金属性:R<W
B.单质与水反应的剧烈程度:Y>X
C.元素W与X形成的化合物只有一种
D.X、Y、Z的最高价氧化物对应的水化物两两之间能相互反应
11.Na2FeO4可用于消毒净水,其制备反应为3NaClO+Fe2(SO4)3+10NaOH=2Na2FeO4+ 3Na2SO4+3NaCl+5H2O。下列说法正确的是
A.NaClO是还原剂 B.Fe2(SO4)3被还原
C.Fe2(SO4)3发生氧化反应 D.Fe2(SO4)3得到电子
12.右图为铜锌原电池示意图,下列说法正确的是
A.铜片作正极
B.锌片的质量逐渐增加
C.电子从铜片流向锌片
D.铜片表面上没有气泡
13.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。下列有关氢氧燃料电池的说法正确的是
A.该电池中电极b是正极,发生还原反应
B.外电路中电流由电极a通过导线流向电极b
C.该电池的总反应为2H2O=2H2+O2
D.该电池工作时电能转化为化学能
14.下列关于反应2H2+O2=2H2O说法正确的是
A.断开H-H键放出能量
B.形成O-H键吸收能量
C.反应物的总能量大于生成物的总能量
D.反应物的总能量小于生成物的总能量
15.某工厂的一种无害化处理反应为6NO+4NH35N2+6H2O。下列关于该反应的说法正确的是
A.增大反应物浓度能减慢反应速率
B.降低温度能加快反应速率
C.使用催化剂能加快反应速率
D. NO与NH3能100%转化为产物
16.下列关于几种常见有机物的叙述不正确的是
A.甲烷能与氯气在光照条件下发生取代反应
B.乙醇不能被酸性KMnO4溶液氧化
C.乙烯能使溴的四氯化碳溶液褪色
D.乙醇能与金属钠发生反应
17.下列关于淀粉的说法正确的是
A.化学式为C6H12O6 B.不属于糖类
C.不能发生水解反应 D.常温下其水溶液遇碘变蓝色
18.下列与乙烷(CH3-CH3)分子互为同系物的是
A.CH2=CH2 B.HC≡CH C. D.CH3-CH2-CH3
19.下列与CH2=CH-CH3互为同分异构体的是
A.CH2=CH2 B.CH3-CH2-CH3 C. D.CH3-CH=CH2
20.下列关于浓硝酸的说法正确的是
A.难挥发 B.常温下不能氧化铜
C.保存在无色细口瓶中 D.常温下能使铝片钝化
21.下列关于NaHCO3的说法正确的是
A.加热时性质稳定 B.能与盐酸反应生成CO2
C.与澄清石灰水混合无现象 D.难溶于水
22.某溶液中含有大量的Cl-、OH-、NO,还可能大量存在的离子是
A.Na+ B.HCO C.NH D.Ag+
23.下列反应的离子方程式书写正确的是
A.醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O
B.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C.氯化铝溶液与氨水反应:Al3++4OH-=AlO+2H2O
D.碳酸钠溶液与稀盐酸的反应:Na2CO3+2H+=CO2↑+H2O
24.下列实验装置或操作正确的是
A.转移溶液 B.稀释浓硫酸 C.蒸发NaCl溶液 D.分离乙醇和水
25.下列鉴别物质的方法能达到目的的是
A.用加热的方法鉴别NH4Cl固体和NaCl固体
B.用焰色反应鉴别KCl固体和KOH固体
C.用丁达尔效应鉴别盐酸和硫酸溶液
D.用澄清石灰水鉴别SO2和CO2
26.关于新制饱和氯水,下列说法正确是
A.新制饱和氯水呈浅黄绿色,说明氯气溶于水但不与水反应
B.可以用pH试纸测量新制氯水的pH
C.向新制饱和氯水中通入SO2,溶液变为无色,是因为SO2将氯水漂白
D.新制氯水在光照时,溶液中会释放出氧气,同时溶液酸性增强
非选择题(共22分)
27.(6分) 乙烯是有机化学工业中的重要原料,以乙烯为原料可制取下列物质:
⑴乙醇和乙酸所含官能团的名称分别为 ▲ 、 ▲ 。
⑵写出由乙烯制取乙醇的化学方程式: ▲ 。
⑶写出乙醇与乙酸反应制取乙酸乙酯的化学方程式: ▲ 。
28.(6分) FeCl3溶液可用于蚀刻电路板上的铜,为回收蚀刻废液中的Cu和再生FeCl3溶液,实验小组采用了如下图所示的流程:
已知FeCl3溶液蚀刻电路板上的铜时所发生的反应为2FeCl3+Cu=2FeCl2+CuCl2
⑴检验蚀刻废液中是否存在Fe3+的方法是 ▲ 。
⑵从滤渣中回收铜的方法是 ▲ 。
⑶反应2的目的是再生FeCl3溶液,该反应的化学方程式为 ▲ 。
29.(10分)铵盐可用作化肥,也可用于实验室制取氨气。
⑴实验室制取氨气的装置如下图所示(部分固定及夹持类仪器已略去):
①生成氨气的化学方程式为 ▲ 。
②干燥管中所装物质X为 ▲ 。
③检验试管中氨气已集满的方法是 ▲ 。
⑵碳铵(NH4HCO3)常用作化肥,为测定某碳铵样品中氮元素的质量分数,某实验小组采用如下实验方案:准确称量0.8000 g碳铵样品于锥形瓶中,向其中加入20.00 mL 0.4000 mol·L-1的硫酸,充分反应后除去溶液中溶解的CO2。向锥形瓶中加入指示剂,用0.3000 mol·L-1的NaOH溶液滴定瓶中剩余的硫酸,当NaOH与硫酸恰好完全反应时,消耗NaOH溶液的体积为20.00 mL。请计算碳铵样品中氮元素的质量分数,写出计算过程(已知杂质不参与反应)。
2020~2021学年度高二年级第一学期教学质量调研(一)
化学试题(必修)参考答案与评分标准
一、单项选择题:本题包括26 小题, 每小题3 分, 共计78 分。每小题只有一个选项符合题意。
1.B 2.C 3.D 4.B 5.C 6.B 7.D 8.D 9.C
10.D 11.C 12.A 13.A 14.C 15.C 16.B 17.D 18.D
19.C 20.D 21.B 22.A 23.A 24.C 25.A 26.D
二、非选择题:(本部分3题,共22分)
27.⑴羟基 (1分) 羧基 (1分)
⑵CH2=CH2+H2OCH3CH2OH (2分)
⑶CH3COOH+HOCH2CH3CH3COOCH2CH3+H2O (2分)
(共6分)
28.⑴取少量蚀刻废液,向其中滴加KSCN溶液,若溶液变红,则废液中存在Fe3+;若溶液不变红,则废液中不存在Fe3+。 (2分)
⑵向废渣中加入足量稀盐酸,充分反应后过滤,所得滤渣为铜 (2分)
⑶2FeCl2+Cl2=2FeCl3 (2分)
(共6分)
29.⑴①2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O (2分)
②碱石灰 (1分)
③将湿润的红色石蕊试纸置于塞有棉花的试管口,若试纸变蓝,则氨气已集满(2分)
⑵n(NaOH)=0.3000 mol·L-1×0.02 L=0.006 mol (1分)
总的硫酸的物质的量n(H2SO4)=0.4000 mol·L-1×0.02 L=0.008 mol (1分)
与NaOH反应的硫酸的物质的量=0.006 mol×=0.003 mol
与NH4HCO3反应的硫酸的物质的量=0.008 mol-0.003 mol=0.005 mol
根据方程式2NH4HCO3+H2SO4=(NH4)2SO4+2CO2↑+2H2O可知:
n(NH4HCO3)=2×0.005 mol=0.01 mol (1分)
则碳铵样品中氮元素的质量分数w(N)=×100%=17.5% (2分)
(共10分)
同课章节目录
