质量守恒定律(公开课)
图片预览








文档简介
(共23张PPT)
质量守恒定律
4.5化学方程式(第一课时) 内容:P122---123
学习目标:
1.理解质量守恒定律的涵义及关键词语。
2.会用化学反应实质及原子、分子的知识解释质量守恒定律。
托盘天平使用要点
1.校准:游码归零,平衡时指针在分度盘中央。当指针偏右时,可以把右边的螺母向里移动(或把左边的螺母向外移动);当指针偏左时,可以把左边的螺母向里移动(或把右边的螺母向外移动)
2.称量:左物右码,天平平衡,指针停在分度盘的 中央。
3.称量完毕后,砝码放回盒中,游码移回零处。
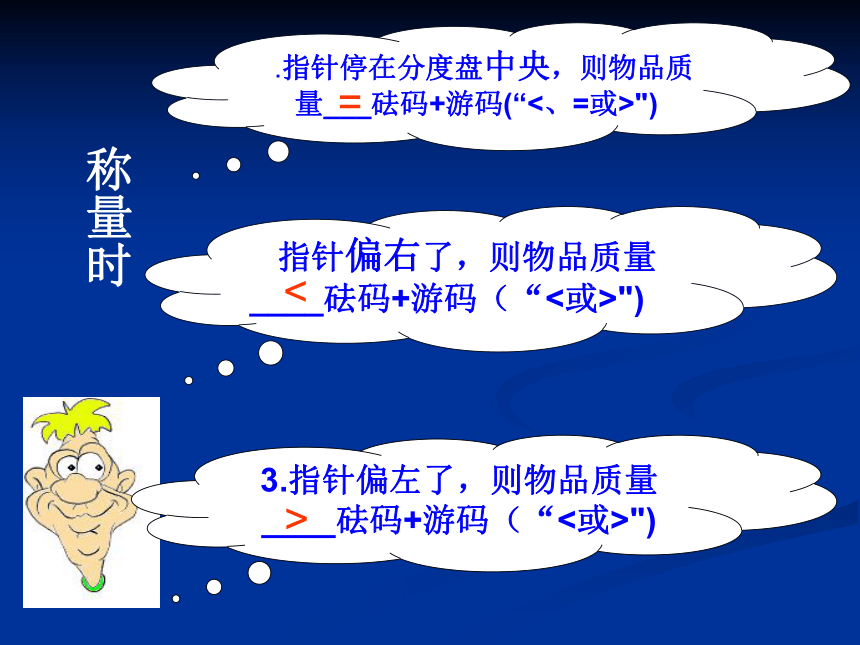
1.指针停在分度盘中央,则物品质量___砝码+游码(“<、=或>")
2.指针偏右了,则物品质量____砝码+游码(“<或>")
3.指针偏左了,则物品质量____砝码+游码(“<或>")
<
>
称量时
=
探究课题:
化学反应中,反应物和生成物的质量之间有什么变化?
探究实验1:硫酸铜溶液与氢氧化钠溶液反应 前后质量变化情况
目的:探究物质发生化学反应前后的质量关系
原理:硫酸铜+氢氧化钠=硫酸钠+氢氧化铜
CuSO4
NaOH
Na2SO4
Cu(OH)2
观察反应前两溶液的颜色:
硫酸铜溶液是______
氢氧化钠溶液是_______
蓝色
无色透明
操作步骤:请按照试卷上的操作流程图完成实验
实验注意安全
氢氧化钠溶液有腐蚀性
观察天平平衡时
指针位置
反应前
反应后
分度盘中央
分度盘中央
实验现象:两溶液混合时,有______________生成。
蓝色絮状物沉淀
4人/组
实验结论:
反应前物质的总质量等于反应后生成物的总质量。
有普遍意义吗
演示实验2:往过氧化氢溶液中加入二氧化锰前后质量变化情况
记录现象:
1.当二氧化锰加入时,可以看到____________
2.反应后再次称量时,指针_________(“偏左、偏右、不偏移”)
冒大量的气泡
偏右
说明反应后溶液的质量
催化剂的特点是:
反应前后质量和性质都不变
实验2的结果:
反应前溶液的质量=反应后溶液的质量
实验2中,反应后生成了氧气,“跑”掉了
所以反应后称量质量会减轻
大家说说看
我们如果将反应前后各物质都称量在内,应该在一个什么样的环境中进行反应实验呢?”
提出问题
密闭的环境中进行
解决办法
反应前物质的总质量 反应后物质的总质量
=
质量守恒定律
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
说明:1.必须是真正参加反应的物质
2.各物质的质量总和相等
随堂练习:
则生成氧化镁
的质量为____克
24克镁与16克氧气恰好完全反应,
40
质量守恒的原因分析:
2 反应前后原子的数目没有增减;
3 反应前后原子的质量没有改变。
1 反应前后原子的种类没有改变;
化分
重新组合
元素种类变了吗?
元素质量变了吗?
物质的总质量呢?
化学反应前后
物质种类呢?
分子种类呢?
不变
改变
质量守恒的原因(五不变):
一定发生改变的有:物质种类、分子种类。
可能发生改变的有:分子数目。
①反应前后原子的种类没变
②原子的数目没有增减
③原子的质量没有改变
④元素的种类没有改变
⑤反应前后总质量不变
}微观
宏观{
一、完成下列选择题
1.质量守恒定律适用于( )
A、物理变化 B、化学变化 C、化学变化和物理变化
2.质量守恒定律是_____的守恒
A 质量 B 体积 C 分子数 D 体积和分子数
B
A
二.质量守恒定律的简单应用.
1、将68克过氧化氢溶液加热至完全反应,得到水36克,则产生气体____克。
2、已知石蜡是蜡烛的主要成分,由蜡烛在空气中完全燃烧后的产物是CO2和H2O,判断石蜡中一定含有_______元素,可能含有___元素
C和H
O
3、实验表明,镁条在空气中燃烧后,生成物的质量比原来镁条的质量大.这一实验事实符合质量守恒定律吗 为什么
答:符合.因为有氧气参加了该反应
32
质量守恒定律的使用范围是什么?学了该定律,对我们有什么用?
质量守恒定律适用于一切化学反应
可运用定律 1. 进行有关的计算
2. 推测一些物质的组成
3. 解释一些实验事实
巩固练习
1、将24.5克氯酸钾加热至完全分解,得到固体质量14.9克,则产生气体__ __克。
2.蔗糖在隔绝空气加热时,生成碳和水,则可推断蔗糖的组成中一定含有( )元素。
A 碳、氧 B 氧 碳 氢 C 碳 氢
D氢 氧
3.已知1克氢气和8克氧气恰好完全反应生成9克水,现有2克氢气和足量的氧气参加反应,生成____水。
A、10克 B、18克 C、16克
9.6
B
B
作业:
1 复习教材;
下课后,请把烧杯内物质倒入指定容器,试管放在指定容器内。课后要洗手!!
质量守恒定律
4.5化学方程式(第一课时) 内容:P122---123
学习目标:
1.理解质量守恒定律的涵义及关键词语。
2.会用化学反应实质及原子、分子的知识解释质量守恒定律。
托盘天平使用要点
1.校准:游码归零,平衡时指针在分度盘中央。当指针偏右时,可以把右边的螺母向里移动(或把左边的螺母向外移动);当指针偏左时,可以把左边的螺母向里移动(或把右边的螺母向外移动)
2.称量:左物右码,天平平衡,指针停在分度盘的 中央。
3.称量完毕后,砝码放回盒中,游码移回零处。
1.指针停在分度盘中央,则物品质量___砝码+游码(“<、=或>")
2.指针偏右了,则物品质量____砝码+游码(“<或>")
3.指针偏左了,则物品质量____砝码+游码(“<或>")
<
>
称量时
=
探究课题:
化学反应中,反应物和生成物的质量之间有什么变化?
探究实验1:硫酸铜溶液与氢氧化钠溶液反应 前后质量变化情况
目的:探究物质发生化学反应前后的质量关系
原理:硫酸铜+氢氧化钠=硫酸钠+氢氧化铜
CuSO4
NaOH
Na2SO4
Cu(OH)2
观察反应前两溶液的颜色:
硫酸铜溶液是______
氢氧化钠溶液是_______
蓝色
无色透明
操作步骤:请按照试卷上的操作流程图完成实验
实验注意安全
氢氧化钠溶液有腐蚀性
观察天平平衡时
指针位置
反应前
反应后
分度盘中央
分度盘中央
实验现象:两溶液混合时,有______________生成。
蓝色絮状物沉淀
4人/组
实验结论:
反应前物质的总质量等于反应后生成物的总质量。
有普遍意义吗
演示实验2:往过氧化氢溶液中加入二氧化锰前后质量变化情况
记录现象:
1.当二氧化锰加入时,可以看到____________
2.反应后再次称量时,指针_________(“偏左、偏右、不偏移”)
冒大量的气泡
偏右
说明反应后溶液的质量
催化剂的特点是:
反应前后质量和性质都不变
实验2的结果:
反应前溶液的质量=反应后溶液的质量
实验2中,反应后生成了氧气,“跑”掉了
所以反应后称量质量会减轻
大家说说看
我们如果将反应前后各物质都称量在内,应该在一个什么样的环境中进行反应实验呢?”
提出问题
密闭的环境中进行
解决办法
反应前物质的总质量 反应后物质的总质量
=
质量守恒定律
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
说明:1.必须是真正参加反应的物质
2.各物质的质量总和相等
随堂练习:
则生成氧化镁
的质量为____克
24克镁与16克氧气恰好完全反应,
40
质量守恒的原因分析:
2 反应前后原子的数目没有增减;
3 反应前后原子的质量没有改变。
1 反应前后原子的种类没有改变;
化分
重新组合
元素种类变了吗?
元素质量变了吗?
物质的总质量呢?
化学反应前后
物质种类呢?
分子种类呢?
不变
改变
质量守恒的原因(五不变):
一定发生改变的有:物质种类、分子种类。
可能发生改变的有:分子数目。
①反应前后原子的种类没变
②原子的数目没有增减
③原子的质量没有改变
④元素的种类没有改变
⑤反应前后总质量不变
}微观
宏观{
一、完成下列选择题
1.质量守恒定律适用于( )
A、物理变化 B、化学变化 C、化学变化和物理变化
2.质量守恒定律是_____的守恒
A 质量 B 体积 C 分子数 D 体积和分子数
B
A
二.质量守恒定律的简单应用.
1、将68克过氧化氢溶液加热至完全反应,得到水36克,则产生气体____克。
2、已知石蜡是蜡烛的主要成分,由蜡烛在空气中完全燃烧后的产物是CO2和H2O,判断石蜡中一定含有_______元素,可能含有___元素
C和H
O
3、实验表明,镁条在空气中燃烧后,生成物的质量比原来镁条的质量大.这一实验事实符合质量守恒定律吗 为什么
答:符合.因为有氧气参加了该反应
32
质量守恒定律的使用范围是什么?学了该定律,对我们有什么用?
质量守恒定律适用于一切化学反应
可运用定律 1. 进行有关的计算
2. 推测一些物质的组成
3. 解释一些实验事实
巩固练习
1、将24.5克氯酸钾加热至完全分解,得到固体质量14.9克,则产生气体__ __克。
2.蔗糖在隔绝空气加热时,生成碳和水,则可推断蔗糖的组成中一定含有( )元素。
A 碳、氧 B 氧 碳 氢 C 碳 氢
D氢 氧
3.已知1克氢气和8克氧气恰好完全反应生成9克水,现有2克氢气和足量的氧气参加反应,生成____水。
A、10克 B、18克 C、16克
9.6
B
B
作业:
1 复习教材;
下课后,请把烧杯内物质倒入指定容器,试管放在指定容器内。课后要洗手!!
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
