鲁科版高中化学必修一第二章第一节2-1:元素与物质分类(31张PPT)
文档属性
| 名称 | 鲁科版高中化学必修一第二章第一节2-1:元素与物质分类(31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 841.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-15 20:46:58 | ||
图片预览











文档简介
(共31张PPT)
第
2
章
元素与物质世界
第
1
节
元素与物质的分类
粗心比无知更可怕!
习惯比聪明更重要!
元素与物质的关系
问题探究
一
化合物:
由两种或两种以上的元素组成的
纯净物。
化合态:元素以化合物的形式存在的状态。
单质:由同种元素组成的纯净物。
游离态:元素以单质的形式存在的状态。
交流·研讨
五
彩
缤
纷
的
铜
世
界
绿色
蓝色
紫红色
Cu
Cu(OH)2
Cu2(OH)2CO3
CuSO4
CuO
化
合
物
氧化物
盐
碱
单质
蓝色
白色
黑色
CuSO4·5H2O
Cu2O
红色
分析思考:
钠、氯化钠、氢气、水、
氧气、臭氧、一氧化碳、
二氧化碳
思考以下问题
【例1】只含有一种元素的物质是:(
)
A.可能是混合物
B.可能是单质也可能是化合物
C.一定是纯净物
D.一定是一种单质
【归纳】只含有一种元素的物质不一定是纯净物,例如O2和O3的混合气体。
A
小结
1、物质均由元素组成
,元素以游离态或化合态存在于物质之中。
2、
同一种元素组成的纯净物为单质;不同种元素组成的纯净物为化合物。
3、元素按照一定的规律以不同的种类和不同的方式组合成种类繁多的物质。
游离态:S
硫元素
SO2、SO3、
化合态:H2SO3
、
H2SO4、
H2S、
Na2S、
CuSO4
……
+4
+6
+4
-2
+6
-2
+6
0
硫元素常见的化合价为-2、0、+4、+6,你能说出分别对应这些价态硫元素的常见物质吗?这些物质分别属于那个类别?
硫
元
素
硫单质(游离态)
化合物
(化合态)
S2、S4、S6、S8
…
盐
氧化物
…
SO2、SO3
氧化物对应
的水化物
…
H2SO3、H2SO4
硫酸盐
…
Na2SO4
硫化物
…
Na2S
亚硫酸盐
…
Na2SO3
硫家族
氢化物
H2S
…
物质的分类
【交流·研讨二:】
尽可能多地列举你所知道的物质,然后从不同的角度对它们进行分类,说明分类依据并绘制简图表示分类结果
根据化合物的性质
在水溶液中或熔化状态下是否导电
〖问题1〗物质分类的依据
物质是否由同一种分子组成
物质
纯净物
混合物
单质
化合物
酸、碱、盐
氧化物
电解质
非电解质
溶液
浊液
胶体
元素
是否由同种元素组成
被分散物质颗粒的大小
?
?
?
?
?
氧
化
物
酸性氧化物
碱性氧化物
两性氧化物
CuO、Fe2O3、Na2O
CO、H2O
CO2、SO3
CaO、CuO、K2O
Al2O3、Zn2O
从组成元素分
非金属氧化物
金属氧化物
从性质分
物质的分类----氧化物的分类
过氧化物
不成盐氧化物
H2O2、Na2O2
CO、NO
酸性氧化物:能与碱反应生成盐和水的氧化物;
碱性氧化物:能与酸反应生成盐和水的氧化物。
(1)多数金属氧化物属于碱性氧化物;多数非金属氧化物属于酸性氧化物。
(2)碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物,例如:Mn2O7是酸性氧化物,Na2O2是过氧化物。非金属氧化物不一定是酸性氧化物,例如:CO和NO
(3)碱性氧化物不一定能与水反应生成相应的碱,例如:CuO不溶于水;酸性氧化物不一定能与水反应生成相应的酸,例如:SiO2不溶于水.
【归纳】
酸
从电离H+数分
一元酸:
二元酸:
三元酸:
从是否含氧分
含氧酸
高沸点酸:
从沸点高低分
无氧酸:
弱酸:
从电离程度分
强酸:
挥发性酸:
HCl
HNO3
HClO
H2SO4
H2CO3
H2S
H3PO4
H2SO4
HNO3
HClO
HCl
HF
H2S
HCl
HNO3
H2SO4
H2CO3
HF
H2S
CH3COOH
HClO
H3PO4
H2SO3
H2SO4
H3PO4
HCl
HNO3
碱
从电离OH-数分
一元碱:
二元碱:
从溶解性分
可溶性碱
不溶性碱:
弱碱:
从电离程度分
强碱:
KOH
NaOH
NH3.H2O
Ba(OH)2
Ca(OH)2
Mg(OH)2
KOH
NaOH
NH3﹒H2O
Ba(OH)2
Ca(OH)2
Mg(OH)2
Cu(OH)2
Fe(OH)3
KOH
NaOH
Ba(OH)2
Ca(OH)2
NH3﹒H2O
Mg(OH)2
Fe(OH)3
Cu(OH)2
盐
从中和程度分
正盐:
酸式盐:
碱式盐:
从酸根是否含氧分
含氧酸盐
硫酸盐:
从阴离子分
无氧酸盐:
钠盐
铵盐
从阳离子分
钾盐:
碳酸盐:
从溶解性分
可溶性盐
微溶性盐
难溶性盐
NaCl
K2SO4
(NH4)3PO4
NaHSO4
NH4HCO3
KH2PO4
Cu2(OH)2CO3
CuSO4
KNO3
NaClO
NH4Cl
CaF2
Na2S
KCl
KNO3
K2SO4
Na2CO3
NaF
Na2S
CH3COONa
(NH4)3PO4
(NH4)2SO4
NH4Cl
K2SO4
Na2SO4
CuSO4
K2CO3
Na2CO3
CaCO3
K2CO3
AgNO3
NaClO
NH4Cl
CaSO4
Ag2SO4
BaSO4
CaCO3
AgCl
2、根据物质类别研究物质性质
分6小组预测金属单质、酸性氧化物、碱性氧化物、酸、
碱、盐可能发生的反应?(写出可能的反应方程式)
盐
非金属单质
金属
Fe
O2
CuSO4溶液
酸
盐酸
反应关系
实验现象
结论
Fe+2HCl=FeCl2+H2↑
金属单质能跟酸反应
无色气体
类别:非金属单质
类别:酸
类别:盐
类别:金属
O2
稀HCl
CuSO4
金属铁
剧烈燃烧,生成黑色固体
3Fe+2O2=====Fe3O4
金属单质能跟非金属单质反应
点燃
铁表面有红色物质析出溶液由蓝色变为浅绿色
Fe+CuSO4=FeSO4+Cu
金属单质能跟盐反应
碱性
氧化物
酸
酸性
氧化物
水
酸性
氧化物
碱
碱性
氧化物
水
Ca(OH)2
CO2
CaO
盐酸
CaO
CO2
酸
盐
碱性
氧化物
指示剂
金属
碱
Ca(OH)2
AgNO3Na2CO3
盐酸
CaO
Fe
反应关系
实验现象
结论
酸能使石蕊试液变红色
Fe+2HCl=FeCl2+H2↑
酸能跟金属单质反应
CuO+2HCl=CuCl2+H2O
NaOH+HCl
=
NaCl
+
H2O
AgNO3+HCl=AgCl↓
+HNO3
酸能跟碱性氧化物反应
酸能跟碱发生反应
酸能跟某些盐发生反应
紫色石蕊
试液变红
无色气体
黑色氧化铜溶解溶液变蓝色
白色沉淀
试管发热
类别:指示剂
类别:金属单质
类别:氧化物
类别:碱
类别:盐
类别:酸
石蕊试液
金属铁
氧化铜
NaOH
AgNO3
稀盐酸
反应关系
实验现象
结论
碱能使酚酞试液变红色
Cl2+2NaOH=NaCl+NaClO+H2O
碱能跟某些金属单质反应
CO2+
2NaOH
=Na2CO3+H2O
2NaOH+H2SO4
=
Na2SO4
+
H2O
2NaOH
+
CuSO4
=Cu(OH)
2
↓
+Na2SO4
碱能跟酸性氧化物反应
碱能跟酸发生反应
碱能跟某些盐发生反应
无色酚酞
试液变红
黄绿色
消失
无明显现象
蓝色沉淀
试管发热
类别:指示剂
类别:非金属单质
类别:酸性氧化物
类别:酸
类别:盐
类别:碱
酚酞试液
Cl2
CO2
H2SO4
CuSO4
氢氧化钠
盐
盐
碱
金属
酸
Ca(OH)2
Fe
AgNO3
盐酸
NaCl
金属
碱性氧化物
碱
非金属
酸性氧化物
酸
用简图表示单质、氧化物、酸、碱、盐之间的转化关系
盐
盐
盐
盐+水
碱+盐
酸+盐
两种新盐
盐和金属
盐和氢气
1、每组物中都有一种物质与其他物质在分类上不同,试分析每组物质中的组成规律,将这种不同于其他物质的物质找出来。
A.NaCl
KCl
NaClO
MgCl2
B.HClO3
KClO3
Cl2
NaClO3
C.H3PO4
H4SiO4
HCl
H2SO4
D.铜
金
铂
钙
只有NaClO不是盐酸盐
只有Cl2中化合价为0价
其余为+5价
只有HCl不是含氧酸
只有Ca是活泼金属
5、判断下列反应能否发生
(1)Zn+HCl
(2)Ag+HCl
(3)Fe+H2SO4
(4)Zn+H2SO4
(5)Cu+ZnSO4
(6)Mg+H2SO4
(7)BaCl2+H2SO4
(8)Na2CO3+HCl
(9)FeCl3+NaOH
(10)NaCl+Cu(OH)2
(11)K2SO4+Ba(NO3)2
(12)CaCO3+NaCl
练一练
1.
下列物质中,碳元素全部以游离态存在的是(????
)
A.
碳酸钙、石墨、二氧化碳
B.
金刚石、石墨、C60
C.
一氧化碳、金刚石、碳黑
D.
碳酸氢钠、甲烷、金刚砂
2.
下列说法正确的是(???
)
A.
元素的存在形态只有两种:化合态和游离态
B.
同一元素,呈化合态时,其化合价一定比游离态时高
C.
有多少种元素,就有多少种物质
D.
同一元素在不同的物质中表现的存在形态一定不同
3
上海环保部门为了使城市生活垃圾得到合理利用,近年来逐步实施了生活垃圾分类投放的方法,其中塑料袋、废纸、旧橡胶制品等属于(???
)
A.
无机物?
B.
有机物
?C.
盐类?
D.
非金属单质
4.下列说法正确的是(
)
A.酸性氧化物都是非金属氧化物??????B.非金属氧化物都是酸性氧化物
C.金属氧化物都是碱性氧化物?????????
D.碱性氧化物都是金属氧化物
5.将下列各组物质按酸、碱、盐分类顺序排列,正确的是(
)
A.硫酸,纯碱,石灰石????????????????
B.醋酸,烧碱,硫酸铜
C.磷酸,熟石灰,苛性钾??????????????
D.醋酸,小苏打,熟石灰
细节决定成败,
规范造就高分!
第
2
章
元素与物质世界
第
1
节
元素与物质的分类
粗心比无知更可怕!
习惯比聪明更重要!
元素与物质的关系
问题探究
一
化合物:
由两种或两种以上的元素组成的
纯净物。
化合态:元素以化合物的形式存在的状态。
单质:由同种元素组成的纯净物。
游离态:元素以单质的形式存在的状态。
交流·研讨
五
彩
缤
纷
的
铜
世
界
绿色
蓝色
紫红色
Cu
Cu(OH)2
Cu2(OH)2CO3
CuSO4
CuO
化
合
物
氧化物
盐
碱
单质
蓝色
白色
黑色
CuSO4·5H2O
Cu2O
红色
分析思考:
钠、氯化钠、氢气、水、
氧气、臭氧、一氧化碳、
二氧化碳
思考以下问题
【例1】只含有一种元素的物质是:(
)
A.可能是混合物
B.可能是单质也可能是化合物
C.一定是纯净物
D.一定是一种单质
【归纳】只含有一种元素的物质不一定是纯净物,例如O2和O3的混合气体。
A
小结
1、物质均由元素组成
,元素以游离态或化合态存在于物质之中。
2、
同一种元素组成的纯净物为单质;不同种元素组成的纯净物为化合物。
3、元素按照一定的规律以不同的种类和不同的方式组合成种类繁多的物质。
游离态:S
硫元素
SO2、SO3、
化合态:H2SO3
、
H2SO4、
H2S、
Na2S、
CuSO4
……
+4
+6
+4
-2
+6
-2
+6
0
硫元素常见的化合价为-2、0、+4、+6,你能说出分别对应这些价态硫元素的常见物质吗?这些物质分别属于那个类别?
硫
元
素
硫单质(游离态)
化合物
(化合态)
S2、S4、S6、S8
…
盐
氧化物
…
SO2、SO3
氧化物对应
的水化物
…
H2SO3、H2SO4
硫酸盐
…
Na2SO4
硫化物
…
Na2S
亚硫酸盐
…
Na2SO3
硫家族
氢化物
H2S
…
物质的分类
【交流·研讨二:】
尽可能多地列举你所知道的物质,然后从不同的角度对它们进行分类,说明分类依据并绘制简图表示分类结果
根据化合物的性质
在水溶液中或熔化状态下是否导电
〖问题1〗物质分类的依据
物质是否由同一种分子组成
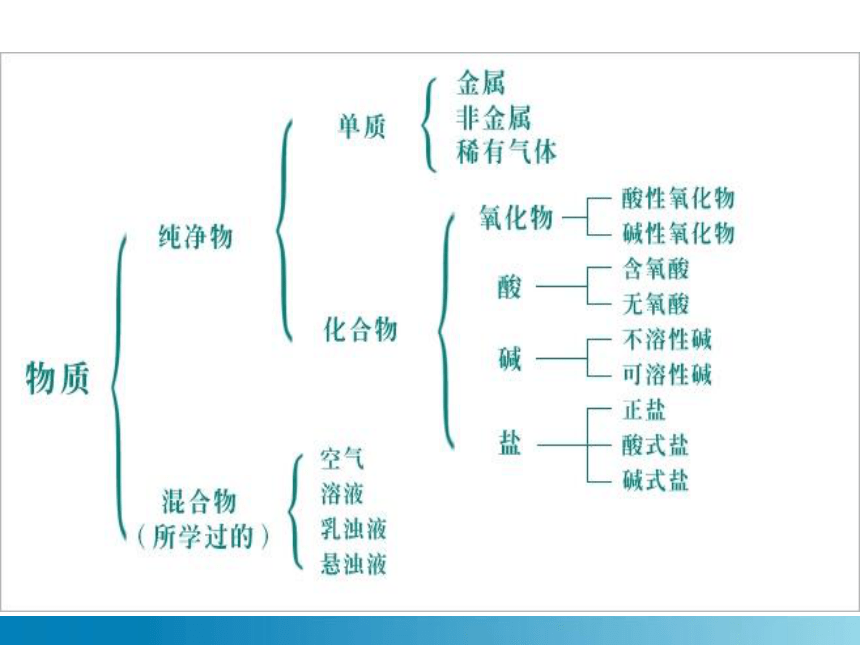
物质
纯净物
混合物
单质
化合物
酸、碱、盐
氧化物
电解质
非电解质
溶液
浊液
胶体
元素
是否由同种元素组成
被分散物质颗粒的大小
?
?
?
?
?
氧
化
物
酸性氧化物
碱性氧化物
两性氧化物
CuO、Fe2O3、Na2O
CO、H2O
CO2、SO3
CaO、CuO、K2O
Al2O3、Zn2O
从组成元素分
非金属氧化物
金属氧化物
从性质分
物质的分类----氧化物的分类
过氧化物
不成盐氧化物
H2O2、Na2O2
CO、NO
酸性氧化物:能与碱反应生成盐和水的氧化物;
碱性氧化物:能与酸反应生成盐和水的氧化物。
(1)多数金属氧化物属于碱性氧化物;多数非金属氧化物属于酸性氧化物。
(2)碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物,例如:Mn2O7是酸性氧化物,Na2O2是过氧化物。非金属氧化物不一定是酸性氧化物,例如:CO和NO
(3)碱性氧化物不一定能与水反应生成相应的碱,例如:CuO不溶于水;酸性氧化物不一定能与水反应生成相应的酸,例如:SiO2不溶于水.
【归纳】
酸
从电离H+数分
一元酸:
二元酸:
三元酸:
从是否含氧分
含氧酸
高沸点酸:
从沸点高低分
无氧酸:
弱酸:
从电离程度分
强酸:
挥发性酸:
HCl
HNO3
HClO
H2SO4
H2CO3
H2S
H3PO4
H2SO4
HNO3
HClO
HCl
HF
H2S
HCl
HNO3
H2SO4
H2CO3
HF
H2S
CH3COOH
HClO
H3PO4
H2SO3
H2SO4
H3PO4
HCl
HNO3
碱
从电离OH-数分
一元碱:
二元碱:
从溶解性分
可溶性碱
不溶性碱:
弱碱:
从电离程度分
强碱:
KOH
NaOH
NH3.H2O
Ba(OH)2
Ca(OH)2
Mg(OH)2
KOH
NaOH
NH3﹒H2O
Ba(OH)2
Ca(OH)2
Mg(OH)2
Cu(OH)2
Fe(OH)3
KOH
NaOH
Ba(OH)2
Ca(OH)2
NH3﹒H2O
Mg(OH)2
Fe(OH)3
Cu(OH)2
盐
从中和程度分
正盐:
酸式盐:
碱式盐:
从酸根是否含氧分
含氧酸盐
硫酸盐:
从阴离子分
无氧酸盐:
钠盐
铵盐
从阳离子分
钾盐:
碳酸盐:
从溶解性分
可溶性盐
微溶性盐
难溶性盐
NaCl
K2SO4
(NH4)3PO4
NaHSO4
NH4HCO3
KH2PO4
Cu2(OH)2CO3
CuSO4
KNO3
NaClO
NH4Cl
CaF2
Na2S
KCl
KNO3
K2SO4
Na2CO3
NaF
Na2S
CH3COONa
(NH4)3PO4
(NH4)2SO4
NH4Cl
K2SO4
Na2SO4
CuSO4
K2CO3
Na2CO3
CaCO3
K2CO3
AgNO3
NaClO
NH4Cl
CaSO4
Ag2SO4
BaSO4
CaCO3
AgCl
2、根据物质类别研究物质性质
分6小组预测金属单质、酸性氧化物、碱性氧化物、酸、
碱、盐可能发生的反应?(写出可能的反应方程式)
盐
非金属单质
金属
Fe
O2
CuSO4溶液
酸
盐酸
反应关系
实验现象
结论
Fe+2HCl=FeCl2+H2↑
金属单质能跟酸反应
无色气体
类别:非金属单质
类别:酸
类别:盐
类别:金属
O2
稀HCl
CuSO4
金属铁
剧烈燃烧,生成黑色固体
3Fe+2O2=====Fe3O4
金属单质能跟非金属单质反应
点燃
铁表面有红色物质析出溶液由蓝色变为浅绿色
Fe+CuSO4=FeSO4+Cu
金属单质能跟盐反应
碱性
氧化物
酸
酸性
氧化物
水
酸性
氧化物
碱
碱性
氧化物
水
Ca(OH)2
CO2
CaO
盐酸
CaO
CO2
酸
盐
碱性
氧化物
指示剂
金属
碱
Ca(OH)2
AgNO3Na2CO3
盐酸
CaO
Fe
反应关系
实验现象
结论
酸能使石蕊试液变红色
Fe+2HCl=FeCl2+H2↑
酸能跟金属单质反应
CuO+2HCl=CuCl2+H2O
NaOH+HCl
=
NaCl
+
H2O
AgNO3+HCl=AgCl↓
+HNO3
酸能跟碱性氧化物反应
酸能跟碱发生反应
酸能跟某些盐发生反应
紫色石蕊
试液变红
无色气体
黑色氧化铜溶解溶液变蓝色
白色沉淀
试管发热
类别:指示剂
类别:金属单质
类别:氧化物
类别:碱
类别:盐
类别:酸
石蕊试液
金属铁
氧化铜
NaOH
AgNO3
稀盐酸
反应关系
实验现象
结论
碱能使酚酞试液变红色
Cl2+2NaOH=NaCl+NaClO+H2O
碱能跟某些金属单质反应
CO2+
2NaOH
=Na2CO3+H2O
2NaOH+H2SO4
=
Na2SO4
+
H2O
2NaOH
+
CuSO4
=Cu(OH)
2
↓
+Na2SO4
碱能跟酸性氧化物反应
碱能跟酸发生反应
碱能跟某些盐发生反应
无色酚酞
试液变红
黄绿色
消失
无明显现象
蓝色沉淀
试管发热
类别:指示剂
类别:非金属单质
类别:酸性氧化物
类别:酸
类别:盐
类别:碱
酚酞试液
Cl2
CO2
H2SO4
CuSO4
氢氧化钠
盐
盐
碱
金属
酸
Ca(OH)2
Fe
AgNO3
盐酸
NaCl
金属
碱性氧化物
碱
非金属
酸性氧化物
酸
用简图表示单质、氧化物、酸、碱、盐之间的转化关系
盐
盐
盐
盐+水
碱+盐
酸+盐
两种新盐
盐和金属
盐和氢气
1、每组物中都有一种物质与其他物质在分类上不同,试分析每组物质中的组成规律,将这种不同于其他物质的物质找出来。
A.NaCl
KCl
NaClO
MgCl2
B.HClO3
KClO3
Cl2
NaClO3
C.H3PO4
H4SiO4
HCl
H2SO4
D.铜
金
铂
钙
只有NaClO不是盐酸盐
只有Cl2中化合价为0价
其余为+5价
只有HCl不是含氧酸
只有Ca是活泼金属
5、判断下列反应能否发生
(1)Zn+HCl
(2)Ag+HCl
(3)Fe+H2SO4
(4)Zn+H2SO4
(5)Cu+ZnSO4
(6)Mg+H2SO4
(7)BaCl2+H2SO4
(8)Na2CO3+HCl
(9)FeCl3+NaOH
(10)NaCl+Cu(OH)2
(11)K2SO4+Ba(NO3)2
(12)CaCO3+NaCl
练一练
1.
下列物质中,碳元素全部以游离态存在的是(????
)
A.
碳酸钙、石墨、二氧化碳
B.
金刚石、石墨、C60
C.
一氧化碳、金刚石、碳黑
D.
碳酸氢钠、甲烷、金刚砂
2.
下列说法正确的是(???
)
A.
元素的存在形态只有两种:化合态和游离态
B.
同一元素,呈化合态时,其化合价一定比游离态时高
C.
有多少种元素,就有多少种物质
D.
同一元素在不同的物质中表现的存在形态一定不同
3
上海环保部门为了使城市生活垃圾得到合理利用,近年来逐步实施了生活垃圾分类投放的方法,其中塑料袋、废纸、旧橡胶制品等属于(???
)
A.
无机物?
B.
有机物
?C.
盐类?
D.
非金属单质
4.下列说法正确的是(
)
A.酸性氧化物都是非金属氧化物??????B.非金属氧化物都是酸性氧化物
C.金属氧化物都是碱性氧化物?????????
D.碱性氧化物都是金属氧化物
5.将下列各组物质按酸、碱、盐分类顺序排列,正确的是(
)
A.硫酸,纯碱,石灰石????????????????
B.醋酸,烧碱,硫酸铜
C.磷酸,熟石灰,苛性钾??????????????
D.醋酸,小苏打,熟石灰
细节决定成败,
规范造就高分!
