新人教版高一必修2化学4.1《开发利用金属矿物和海水资源》(37张PPT)
文档属性
| 名称 | 新人教版高一必修2化学4.1《开发利用金属矿物和海水资源》(37张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-15 20:49:38 | ||
图片预览










文档简介
(共37张PPT)
第四章
化学与自然资源的开发利用
一、金属矿物的开发利用
黄铜矿
赤铁矿
铝矿
锰矿
钨矿
锌矿
1.金属矿物的冶炼步骤:
矿石富集---金属冶炼---精炼
人类最早发现和应用的金属分别是:
冶炼金属的实质是用还原的方法
使金属化合物中的金属离子得到
电子变成金属原子。
将金属从其化合物中还原出来用于生产和制造各种金属材料的过程在工业上称为金属的冶炼。
2.金属的冶炼原理:
Mn+
+
ne-
==
M
金属活动性顺序
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性逐渐减弱
金属离子的得电子能力逐渐增强
3.冶炼金属的方法
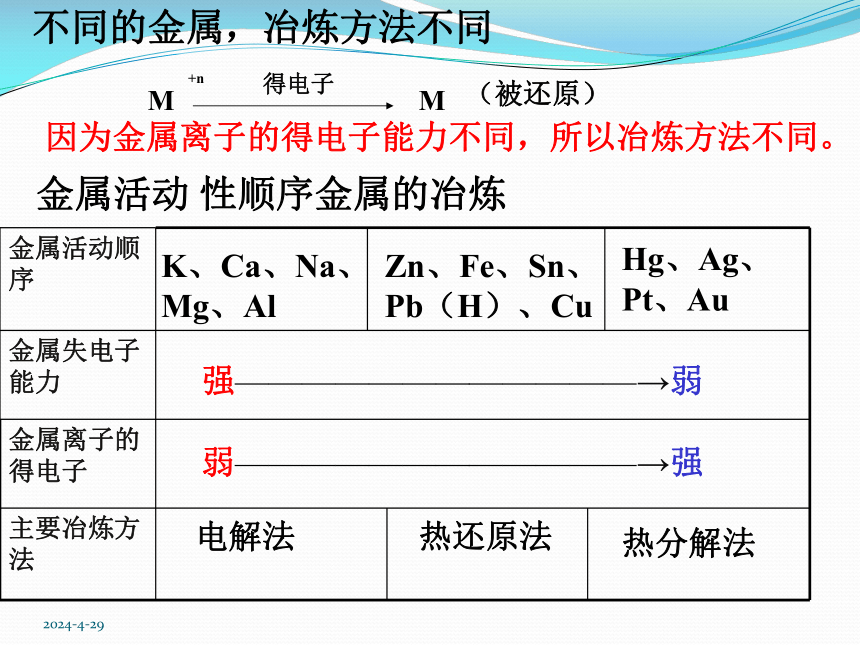
不同的金属,冶炼方法不同
+n
M
得电子
M
(被还原)
因为金属离子的得电子能力不同,所以冶炼方法不同。
金属活动
性顺序金属的冶炼
金属活动顺序
金属失电子能力
金属离子的得电子
主要冶炼方法
K、Ca、Na、Mg、Al
Zn、Fe、Sn、Pb(H)、Cu
Hg、Ag、Pt、Au
强————————————→弱
弱————————————→强
电解法
热还原法
热分解法
(1)、热分解法(适合一些不活泼金属)
2HgO
===
2Hg
+
O2
↑
加热
2Ag2O
===
4Ag
+
O2
↑
加热
(2)、物理提取法:适用于极不活泼的
金属——Pt、Au
(3)、热还原法(适用于大部分金属)
CuO+H2
===
Cu
+
H2O
高温
Fe2O3+3CO
===
2Fe
+
3CO2
↑
高温
铝热反应
实验4-1
注意观察现象
反应现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。
Fe2O3+2Al
===
2Fe
+
Al2O3
高温
铝热剂
铝是还原剂,在一定的条件下与某些金属氧化物反应,把其中的金属还原成单质。所以一些活泼的金属也可作还原剂。
3MnO2+4Al
===
3Mn+
2Al2O3
高温
Cr2O3+2Al
===
2Cr
+
Al2O3
高温
3Co3O4+8Al
===
9Co
+
4Al2O3
高温
其它铝热反应
铝热反应的应用
??????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????
???
铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等
由于早期炼铝十分困难,所以铝的价格十分昂贵,一度超越金银之上,直至19世纪上半叶,铝还是欧洲许多高级珠宝店的高档货。
然而自从美国青年化学家霍尔发明电解制铝法后,制铝工
艺不断改进,现在人们已经熟练掌握了从铝土矿(主要成
分是Al2O3,当然还是有很多其它杂质的)中冶炼铝的技术了,使得制铝成本大大下降,铝的价格也一降千丈,走入千家万户。
(4)、电解法(适合一些非常活泼金属)
MgCl2
(熔融)
===
Mg
+
Cl2
↑
电解
2Al2O3
(熔融)
===
4Al
+
3O2
↑
电解
冰晶石
2NaCl
(熔融)
===
2Na
+
Cl2
↑
电解
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
电解法
热还原法
热分解法
物理提取法
今天铝的产量已经仅次于钢铁了,铝及铝合金成为现代文明不可缺少的金属,铝在工业上被称为“钢精”,是因为它的合金不但轻,而且强度足以替代钢铁,铝除了用于建材之外,还被用于航天工业,如我国第一颗人造卫星东方红一号,外壳全部用铝合金制成,美国的阿波罗—11号,宇宙飞船所用的金属材料中,铝及合金75%左右,可以说人类送上太空的金属中,铝是最多的了。
注意:正常人的人体,每70公斤体重约含61毫克铝。
但铝摄入过多却是对人体有害的,经研究表明,铝元素能渗入人脑,与神经元细胞释放出来的具有传递信息功能的有机碱反应,导致神经系统传递信息受阻,引起老年痴呆。
镁在地壳中含量只有铝的四分之一,而且镁比铝更加活泼,所以要想矿物质中获取镁,代价比铝更高。
海洋中含有大量的氯化镁,海水又咸又苦。
咸是因为含有氯化钠,
苦是因为含有氯化镁,
同样道理,粗盐易潮解是因为其中含有较多的氯化镁,而氯化镁易吸水。
据估算,假如每年从海水中提取1亿吨镁再过一百万年,海水中镁的含量也只会从目前的0.13%降低到0.12%,即只减少了万分之一。可谓取之不尽,用之不竭。
4、合理开发和利用矿物资源,主要途径有:
(1)、提高金属矿物的利用率
(2)、减少金属的使用量
(3)、加强金属资源的回收和再利用
(4)、使用其他材料代替金属材料
…
…
1、下列各种冶炼方法中,可以制得
相应金属的是(
)
A、加热氧化铝
B、加热碳酸钙
C、电解熔融氯化钠
D、氯化钠与铝粉高温共热
2、根据金属在金属活动顺序表中的位置
及性质,推测制取下列金属最适宜的方法:
①Na
②Zn
③Hg
④Au
C
电解法
加热还原法
加热分解法
物理提取法
二、
海洋是
“历史留给人类的资源储备”
1.海水水资源的利用:海水的淡化
(1)使海水淡化的途径
通过海水中提取淡水或从海水中把盐分离
出去,都可以达到淡化海水的目的。
(2)海水淡化的方法及其特点
海水淡化的方法主要有蒸馏法、电渗析法、
离子交换法等。
其中蒸馏法的历史最久,
技术和工艺也比较完善,
但成本较高。
海水蒸馏原理示意图:
太阳能蒸发海水示意图:
含80多种元素,以氢、氧、
氯、钠、镁、硫、钙、钾等
较多。被称为“元素的故乡”。
海水中铀多达45亿吨
是已知陆地铀矿储量
的4500倍。氘有50亿
吨足够人类用上千万
年
海水中的化学资源
海水中含有的各种元素的特点:
种类多,总储量大,富集程度低。因此,从海水中
提取物质需要解决物质的富集的问题。
海洋中的矿产资源
海水中蕴藏的资源及其开发意义
海洋水资源:海水中水的储量约为1.3×109亿吨,约占全球总水量的97%。
化学资源:含元素80多种,海洋资源中,利用潜力最大的是海水中的化学资源。目前,在陆地上发现的100多种化学元素,在海水中已找到80多种,其中70多种可供提取。如,氯化钠(即食盐)有4亿亿吨,镁约有1800万亿吨,钾有500万亿吨,溴约有90万亿吨,核燃料约40亿吨-50亿吨。
矿产资源:海洋中所贮存的各种矿物约500亿吨。通常只要每平方米有5㎏的矿物。锰结核、可燃冰、砂和砾石,用于冶金、燃料、建筑、石英砂用制玻璃等。
空间资源:海洋可利用空间包括海上、海中、海底三个部分。海洋空间利用已从传统的交通运输扩大到生产、通信、电力输送、储藏、文化娱乐等诸多领域。我国拥有18000公里的大陆海岸线,管辖的海域面积近300万平方公里。
能源:海水运动中蕴藏着巨大的能量,包括潮汐能资源、波浪能资源、海流能资源、温差和盐差能资源、海上水能资源,它们都属于可再生能源,而且没有污染。
生物资源:由鱼、虾、贝、藻等组成的海洋生物资源,除了直接捕捞供食用和药用外,通过养殖、增殖等途径还可实现可持续利用。海洋生物品种繁多,我国就有20278种,其中入药的有700种。
2.海水化学资源的开发利用
海水综合利用的重要方向是:海水淡化同化工生产结合、同能源技术结合。如从海水中制得的氯化钠除食用外,还用作工业原料,如生产烧碱、纯碱、金属钠以及氯气、盐酸、漂白粉等含氯化工产品。从海水中制取镁、钾、溴及其化工产品,是在传统制盐工业上的发展。
从海水中获得其他物质和能量具有广阔的前景。
例如,铀和重水目前是核能开发中的重要原料,从海水中提取铀和重水对一个国家来说具有战略意义。化学在开发海洋药物方面也将发挥越来越大的作用。潮汐能、波浪能等也是越来越受到重视和开发的新型能源。
煮
海
为
盐
(1)从海水中提取NaCl
从海水中制取盐的方法主要有:盐田法、电渗析法和冷冻法。
盐田法
制得的粗盐中含较多的氯化镁和氯化钙及泥沙,请设计实验除去NaCl中混有的泥沙、Ca2+、Mg2+离子的方法(需要仪器及实验步骤)
先将样品溶解,加稍过量的氢氧化钙,再加入稍过量的碳酸钠溶液,过滤;在滤液中加入稍过量的盐酸,蒸发结晶即可。
思考:
(2)海水提溴:主要方法是空气吹出法
主要流程
海水
浓缩
酸化
浓缩海水Br-
通入
氯气
海水Cl-Br2
通入空气
水蒸气(吹入)
吸收塔SO2
反应后
富集溴
HBr、SO42-
通入Cl2
Cl-Br2
分离
溴单质
化学方程式:
2NaBr
+
Cl2
===
Br2
+2NaCl
Br2
+
SO2
+
2H2O
===
2HBr
+
H2SO4
2HBr
+
Cl2
===
Br2
+
2HCl
(2).从海水中提取溴的主要工艺流程
⑤用四氯化碳(或苯)萃取吸收塔内的溶液中的溴单质。
①用蒸馏法将海水浓缩,用硫酸将浓缩的海水酸化。
②向酸化的海水中通入适量的氯气,使溴离子转化为溴单质:2NaBr+Cl2=Br2+2NaCl
③向含溴单质的水溶液中通入空气和水蒸汽,将溴单质
吹入盛有二氧化硫溶液的吸收塔内以达到富集的目的:
Br2+SO2+2H2O=2HBr+H2SO4
④向吸收塔内的溶液中通入适量的氯气:
2HBr+Cl2=2HCl+Br2
(3)海带提碘:
海带
海带灰
溶解过滤
灼烧
残渣
含I-的溶液
稀H2SO4
H2O2
含I2的溶液
含I2的有机溶液
萃取
海带中的碘元素主要以I-的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。
用H2O2做氧化剂,反应的离子方程式是:2I-+H2O2+2H+=I2+2H2O
(3).从海带中提取碘的实验
②提取流程
①反应原理
含碘单质的有机溶液
含碘单质的溶液
试剂
残渣
含碘元素的溶液
海带
溶解
过滤
海
带
灰
灼烧
(1)称取3g干海带,用刷子把干海带表面的附着物刷净(不要用水洗,有I-)。
将海带剪碎,用酒精润湿(便于灼烧)后,放在坩埚中。
(2)用酒精灯灼烧盛有海带的坩埚,至海带完全成灰,停止加热,冷却。
(3)将海带灰转移到小烧杯中,再向烧杯中加入10ml蒸馏水,搅拌,煮沸2min-3min,使可溶物溶解,过滤。
(4)向滤液中滴入几滴稀硫酸,再加入约1ml
H2O2溶液,观察现象。
(5)取少量上述滤液,加几滴淀粉溶液,观察现象。
④实验注意事项
③实验方法
海带不要用水洗,以免洗去海带中的碘;用干
海带从而易于燃烧;灼烧海带的地方要注意通风。
3.海水综合利用联合工业体系一例(如下图)
第四章
化学与自然资源的开发利用
一、金属矿物的开发利用
黄铜矿
赤铁矿
铝矿
锰矿
钨矿
锌矿
1.金属矿物的冶炼步骤:
矿石富集---金属冶炼---精炼
人类最早发现和应用的金属分别是:
冶炼金属的实质是用还原的方法
使金属化合物中的金属离子得到
电子变成金属原子。
将金属从其化合物中还原出来用于生产和制造各种金属材料的过程在工业上称为金属的冶炼。
2.金属的冶炼原理:
Mn+
+
ne-
==
M
金属活动性顺序
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性逐渐减弱
金属离子的得电子能力逐渐增强
3.冶炼金属的方法
不同的金属,冶炼方法不同
+n
M
得电子
M
(被还原)
因为金属离子的得电子能力不同,所以冶炼方法不同。
金属活动
性顺序金属的冶炼
金属活动顺序
金属失电子能力
金属离子的得电子
主要冶炼方法
K、Ca、Na、Mg、Al
Zn、Fe、Sn、Pb(H)、Cu
Hg、Ag、Pt、Au
强————————————→弱
弱————————————→强
电解法
热还原法
热分解法
(1)、热分解法(适合一些不活泼金属)
2HgO
===
2Hg
+
O2
↑
加热
2Ag2O
===
4Ag
+
O2
↑
加热
(2)、物理提取法:适用于极不活泼的
金属——Pt、Au
(3)、热还原法(适用于大部分金属)
CuO+H2
===
Cu
+
H2O
高温
Fe2O3+3CO
===
2Fe
+
3CO2
↑
高温
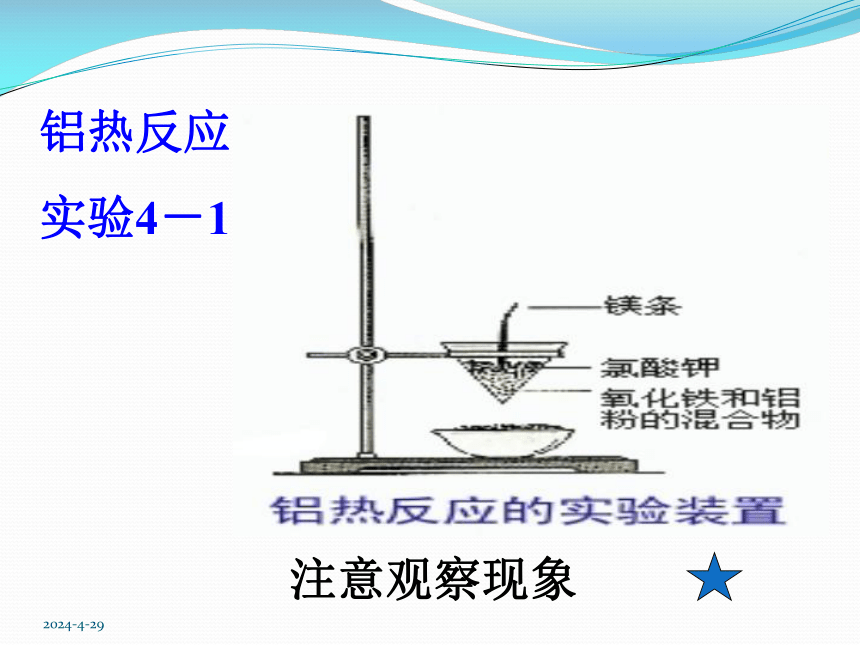
铝热反应
实验4-1
注意观察现象
反应现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。
Fe2O3+2Al
===
2Fe
+
Al2O3
高温
铝热剂
铝是还原剂,在一定的条件下与某些金属氧化物反应,把其中的金属还原成单质。所以一些活泼的金属也可作还原剂。
3MnO2+4Al
===
3Mn+
2Al2O3
高温
Cr2O3+2Al
===
2Cr
+
Al2O3
高温
3Co3O4+8Al
===
9Co
+
4Al2O3
高温
其它铝热反应
铝热反应的应用
??????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????
???
铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等
由于早期炼铝十分困难,所以铝的价格十分昂贵,一度超越金银之上,直至19世纪上半叶,铝还是欧洲许多高级珠宝店的高档货。
然而自从美国青年化学家霍尔发明电解制铝法后,制铝工
艺不断改进,现在人们已经熟练掌握了从铝土矿(主要成
分是Al2O3,当然还是有很多其它杂质的)中冶炼铝的技术了,使得制铝成本大大下降,铝的价格也一降千丈,走入千家万户。
(4)、电解法(适合一些非常活泼金属)
MgCl2
(熔融)
===
Mg
+
Cl2
↑
电解
2Al2O3
(熔融)
===
4Al
+
3O2
↑
电解
冰晶石
2NaCl
(熔融)
===
2Na
+
Cl2
↑
电解
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
电解法
热还原法
热分解法
物理提取法
今天铝的产量已经仅次于钢铁了,铝及铝合金成为现代文明不可缺少的金属,铝在工业上被称为“钢精”,是因为它的合金不但轻,而且强度足以替代钢铁,铝除了用于建材之外,还被用于航天工业,如我国第一颗人造卫星东方红一号,外壳全部用铝合金制成,美国的阿波罗—11号,宇宙飞船所用的金属材料中,铝及合金75%左右,可以说人类送上太空的金属中,铝是最多的了。
注意:正常人的人体,每70公斤体重约含61毫克铝。
但铝摄入过多却是对人体有害的,经研究表明,铝元素能渗入人脑,与神经元细胞释放出来的具有传递信息功能的有机碱反应,导致神经系统传递信息受阻,引起老年痴呆。
镁在地壳中含量只有铝的四分之一,而且镁比铝更加活泼,所以要想矿物质中获取镁,代价比铝更高。
海洋中含有大量的氯化镁,海水又咸又苦。
咸是因为含有氯化钠,
苦是因为含有氯化镁,
同样道理,粗盐易潮解是因为其中含有较多的氯化镁,而氯化镁易吸水。
据估算,假如每年从海水中提取1亿吨镁再过一百万年,海水中镁的含量也只会从目前的0.13%降低到0.12%,即只减少了万分之一。可谓取之不尽,用之不竭。
4、合理开发和利用矿物资源,主要途径有:
(1)、提高金属矿物的利用率
(2)、减少金属的使用量
(3)、加强金属资源的回收和再利用
(4)、使用其他材料代替金属材料
…
…
1、下列各种冶炼方法中,可以制得
相应金属的是(
)
A、加热氧化铝
B、加热碳酸钙
C、电解熔融氯化钠
D、氯化钠与铝粉高温共热
2、根据金属在金属活动顺序表中的位置
及性质,推测制取下列金属最适宜的方法:
①Na
②Zn
③Hg
④Au
C
电解法
加热还原法
加热分解法
物理提取法
二、
海洋是
“历史留给人类的资源储备”
1.海水水资源的利用:海水的淡化
(1)使海水淡化的途径
通过海水中提取淡水或从海水中把盐分离
出去,都可以达到淡化海水的目的。
(2)海水淡化的方法及其特点
海水淡化的方法主要有蒸馏法、电渗析法、
离子交换法等。
其中蒸馏法的历史最久,
技术和工艺也比较完善,
但成本较高。
海水蒸馏原理示意图:
太阳能蒸发海水示意图:
含80多种元素,以氢、氧、
氯、钠、镁、硫、钙、钾等
较多。被称为“元素的故乡”。
海水中铀多达45亿吨
是已知陆地铀矿储量
的4500倍。氘有50亿
吨足够人类用上千万
年
海水中的化学资源
海水中含有的各种元素的特点:
种类多,总储量大,富集程度低。因此,从海水中
提取物质需要解决物质的富集的问题。
海洋中的矿产资源
海水中蕴藏的资源及其开发意义
海洋水资源:海水中水的储量约为1.3×109亿吨,约占全球总水量的97%。
化学资源:含元素80多种,海洋资源中,利用潜力最大的是海水中的化学资源。目前,在陆地上发现的100多种化学元素,在海水中已找到80多种,其中70多种可供提取。如,氯化钠(即食盐)有4亿亿吨,镁约有1800万亿吨,钾有500万亿吨,溴约有90万亿吨,核燃料约40亿吨-50亿吨。
矿产资源:海洋中所贮存的各种矿物约500亿吨。通常只要每平方米有5㎏的矿物。锰结核、可燃冰、砂和砾石,用于冶金、燃料、建筑、石英砂用制玻璃等。
空间资源:海洋可利用空间包括海上、海中、海底三个部分。海洋空间利用已从传统的交通运输扩大到生产、通信、电力输送、储藏、文化娱乐等诸多领域。我国拥有18000公里的大陆海岸线,管辖的海域面积近300万平方公里。
能源:海水运动中蕴藏着巨大的能量,包括潮汐能资源、波浪能资源、海流能资源、温差和盐差能资源、海上水能资源,它们都属于可再生能源,而且没有污染。
生物资源:由鱼、虾、贝、藻等组成的海洋生物资源,除了直接捕捞供食用和药用外,通过养殖、增殖等途径还可实现可持续利用。海洋生物品种繁多,我国就有20278种,其中入药的有700种。
2.海水化学资源的开发利用
海水综合利用的重要方向是:海水淡化同化工生产结合、同能源技术结合。如从海水中制得的氯化钠除食用外,还用作工业原料,如生产烧碱、纯碱、金属钠以及氯气、盐酸、漂白粉等含氯化工产品。从海水中制取镁、钾、溴及其化工产品,是在传统制盐工业上的发展。
从海水中获得其他物质和能量具有广阔的前景。
例如,铀和重水目前是核能开发中的重要原料,从海水中提取铀和重水对一个国家来说具有战略意义。化学在开发海洋药物方面也将发挥越来越大的作用。潮汐能、波浪能等也是越来越受到重视和开发的新型能源。
煮
海
为
盐
(1)从海水中提取NaCl
从海水中制取盐的方法主要有:盐田法、电渗析法和冷冻法。
盐田法
制得的粗盐中含较多的氯化镁和氯化钙及泥沙,请设计实验除去NaCl中混有的泥沙、Ca2+、Mg2+离子的方法(需要仪器及实验步骤)
先将样品溶解,加稍过量的氢氧化钙,再加入稍过量的碳酸钠溶液,过滤;在滤液中加入稍过量的盐酸,蒸发结晶即可。
思考:
(2)海水提溴:主要方法是空气吹出法
主要流程
海水
浓缩
酸化
浓缩海水Br-
通入
氯气
海水Cl-Br2
通入空气
水蒸气(吹入)
吸收塔SO2
反应后
富集溴
HBr、SO42-
通入Cl2
Cl-Br2
分离
溴单质
化学方程式:
2NaBr
+
Cl2
===
Br2
+2NaCl
Br2
+
SO2
+
2H2O
===
2HBr
+
H2SO4
2HBr
+
Cl2
===
Br2
+
2HCl
(2).从海水中提取溴的主要工艺流程
⑤用四氯化碳(或苯)萃取吸收塔内的溶液中的溴单质。
①用蒸馏法将海水浓缩,用硫酸将浓缩的海水酸化。
②向酸化的海水中通入适量的氯气,使溴离子转化为溴单质:2NaBr+Cl2=Br2+2NaCl
③向含溴单质的水溶液中通入空气和水蒸汽,将溴单质
吹入盛有二氧化硫溶液的吸收塔内以达到富集的目的:
Br2+SO2+2H2O=2HBr+H2SO4
④向吸收塔内的溶液中通入适量的氯气:
2HBr+Cl2=2HCl+Br2
(3)海带提碘:
海带
海带灰
溶解过滤
灼烧
残渣
含I-的溶液
稀H2SO4
H2O2
含I2的溶液
含I2的有机溶液
萃取
海带中的碘元素主要以I-的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。
用H2O2做氧化剂,反应的离子方程式是:2I-+H2O2+2H+=I2+2H2O
(3).从海带中提取碘的实验
②提取流程
①反应原理
含碘单质的有机溶液
含碘单质的溶液
试剂
残渣
含碘元素的溶液
海带
溶解
过滤
海
带
灰
灼烧
(1)称取3g干海带,用刷子把干海带表面的附着物刷净(不要用水洗,有I-)。
将海带剪碎,用酒精润湿(便于灼烧)后,放在坩埚中。
(2)用酒精灯灼烧盛有海带的坩埚,至海带完全成灰,停止加热,冷却。
(3)将海带灰转移到小烧杯中,再向烧杯中加入10ml蒸馏水,搅拌,煮沸2min-3min,使可溶物溶解,过滤。
(4)向滤液中滴入几滴稀硫酸,再加入约1ml
H2O2溶液,观察现象。
(5)取少量上述滤液,加几滴淀粉溶液,观察现象。
④实验注意事项
③实验方法
海带不要用水洗,以免洗去海带中的碘;用干
海带从而易于燃烧;灼烧海带的地方要注意通风。
3.海水综合利用联合工业体系一例(如下图)
