粤教版九年级化学2.1空气的成分 (24张PPT)
文档属性
| 名称 | 粤教版九年级化学2.1空气的成分 (24张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-16 08:43:03 | ||
图片预览







文档简介
2.1 空气的成分
第二章 空气、物质的构成
思维风暴
1.说个宝,道个宝,
说它宝贵到处有,
看不见,摸不着,
不香不臭没味道,
万物生存离不了,
在你身边看不见,
越往高处它越少。
2.空气既看不见踪影,也闻不见问道,很不易察觉,你能根据生活中的经验来证明空气确实存在么?
3.你能设计一个实验去测定空气的成分吗?实验的根据是什么?
一、拉瓦锡的贡献
二、测量氧气的体积分数
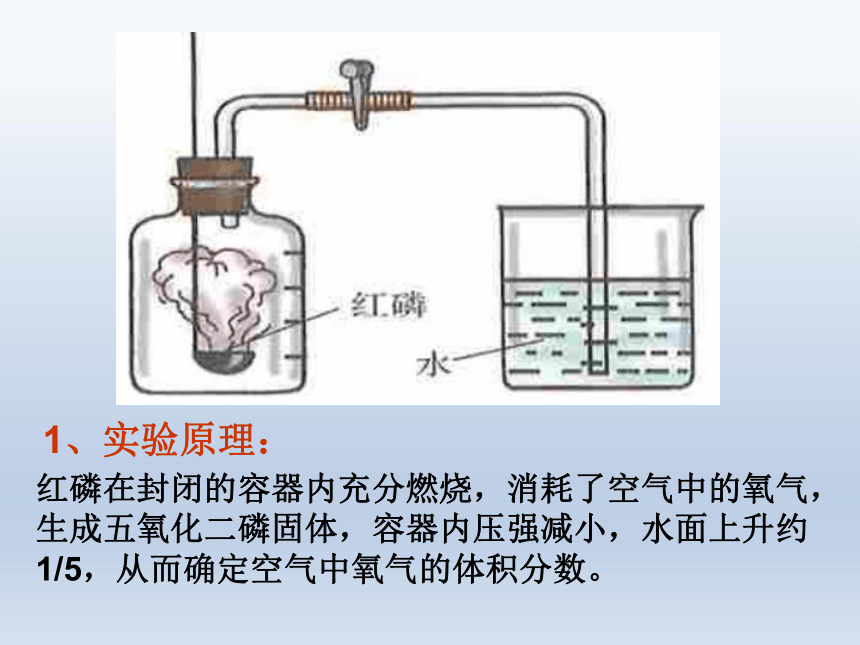
1、实验原理:
红磷在封闭的容器内充分燃烧,消耗了空气中的氧气,生成五氧化二磷固体,容器内压强减小,水面上升约1/5,从而确定空气中氧气的体积分数。
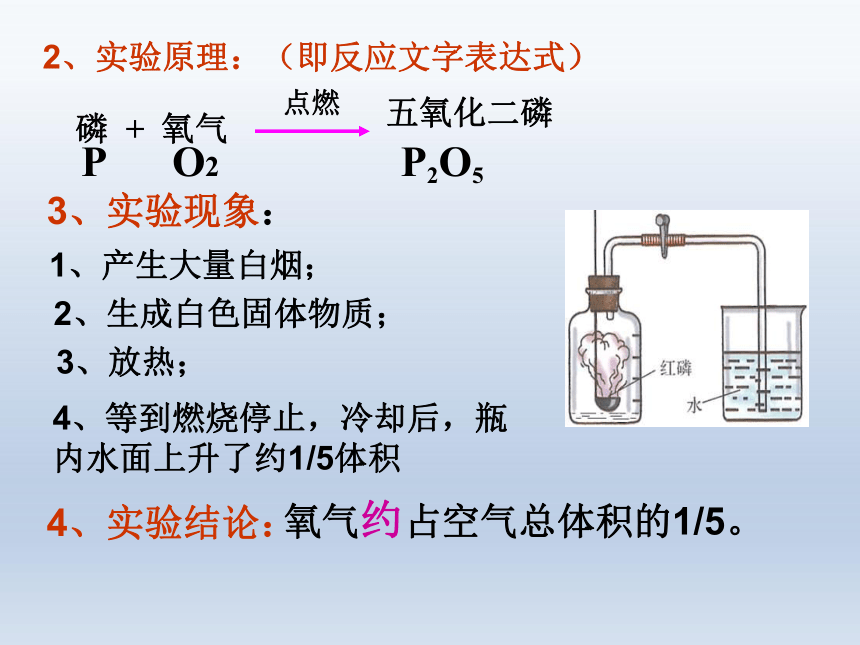
3、实验现象:
1、产生大量白烟;
4、等到燃烧停止,冷却后,瓶内水面上升了约1/5体积
4、实验结论:
氧气约占空气总体积的1/5。
2、实验原理:(即反应文字表达式)
P O2 P2O5
五氧化二磷
点燃
磷 + 氧气
2、生成白色固体物质;
3、放热;
想一想
1.根据实验现象,分析瓶内剩余气体具有怎样的性质?
答:不能燃烧,也不能支持燃烧;不能溶于水
2、红磷燃烧后生成的“大量白烟”可以说“大量白雾”吗?
答:不能,烟是固体微粒;雾是小液滴。
5.在实验中如果进入水的体积小于集气瓶总体积的1/5,会有什么原因呢?
答:(1)未冷却至室温便打开止水夹;
(2)装置漏气;
(3)红磷的量不足;
(4)有部分水留在导管中未进入集气瓶
(5)燃烧一定程度时,瓶内氧气含量小,
红磷不能继续燃烧。
(6)点燃红磷后燃烧匙未立即伸入集气瓶中
6、实验成功的关键:
(1)装置不能漏气;
(2)集气瓶中加少量水
(防止高温熔融物使瓶底炸裂)
(3)红磷应过量
(4)点燃红磷后要立即伸入集气瓶中,并塞紧塞子
(5)待红磷冷却后,打开弹簧夹
三、空气的组成
一百份体积的空气
氧气(O2)
21%
氮气(N2) 78%
稀有气体
0.94%
二氧化碳
0.03%
其他气体杂质
0.03%
四、氮气、稀有气体的用途
氮气通常有哪些性质?
氮气
化学性质稳定,常温下难跟其他物质发生反应,但在高温、高能量条件下可与某些物质发生反应。
氮气通常有哪些用途呢?
制硝酸、化肥的重要原料
用作保护气
液氮冷冻麻醉
合成染料、制造炸药
食品包装时充氮以防腐
稀有气体
氦(He)、氖(Ne)、氩 (Ar)、氪(Kr)、氙(Xe)
用途
制作霓虹灯等多种电光源
用作保护气
氦气用来充填升空气球
用于激光技术
性质:一般不跟其他物质反应
五、纯净物和混合物
只由一种物质组成
如:N2、O2、CO2、P、P2O5、H2O
混合物:
由两种或者两种以上物质组成
如:空气 海水 河水 矿泉水等
纯净物可以用专门的化学符号来表示如氮气、氧气、二氧化碳可分别表示为N2、 O2、CO2等。
纯净物:
温故知新
根据要求回答问题:
①在集气瓶中加少量水②检查装置的气密性③在燃烧匙中装足量红磷,夹紧止水夹④点燃红磷,伸入集气瓶中塞紧橡皮塞⑤待集气瓶冷却后打开止水夹
(1)步骤④中发生反应的文字表达式为 ;
(2)步骤⑤中打开止水夹后观察到的现象为 ;
(3)该实验得出空气组成的结论是 ;
(4)该实验剩余气体的性质有 ;
(5)实验后集气瓶中水少于1/5,,误差产生的原
因可能是 ;
实验药品探究:根据下列素材,请你谈谈为什么要选择红磷做此实验?
硫(固)+氧气(气) 二氧化硫(气)
木炭(固)+ 氧气(气) 二氧化碳(气)
磷(固)+氧气(气 ) 五氧化二磷(固)
铁(固)+氧气(气) 四氧化三铁(固)(纯氧中发生)
下列各物质,属于纯净物的是( )
A.纯净的空气 B.冰水混合物
C.冰冻矿泉水 D. “三鹿”牛奶
六、空气污染
2001-2006年间平均全球空气污染形势图
六、空气污染
第二章 空气、物质的构成
思维风暴
1.说个宝,道个宝,
说它宝贵到处有,
看不见,摸不着,
不香不臭没味道,
万物生存离不了,
在你身边看不见,
越往高处它越少。
2.空气既看不见踪影,也闻不见问道,很不易察觉,你能根据生活中的经验来证明空气确实存在么?
3.你能设计一个实验去测定空气的成分吗?实验的根据是什么?
一、拉瓦锡的贡献
二、测量氧气的体积分数
1、实验原理:
红磷在封闭的容器内充分燃烧,消耗了空气中的氧气,生成五氧化二磷固体,容器内压强减小,水面上升约1/5,从而确定空气中氧气的体积分数。
3、实验现象:
1、产生大量白烟;
4、等到燃烧停止,冷却后,瓶内水面上升了约1/5体积
4、实验结论:
氧气约占空气总体积的1/5。
2、实验原理:(即反应文字表达式)
P O2 P2O5
五氧化二磷
点燃
磷 + 氧气
2、生成白色固体物质;
3、放热;
想一想
1.根据实验现象,分析瓶内剩余气体具有怎样的性质?
答:不能燃烧,也不能支持燃烧;不能溶于水
2、红磷燃烧后生成的“大量白烟”可以说“大量白雾”吗?
答:不能,烟是固体微粒;雾是小液滴。
5.在实验中如果进入水的体积小于集气瓶总体积的1/5,会有什么原因呢?
答:(1)未冷却至室温便打开止水夹;
(2)装置漏气;
(3)红磷的量不足;
(4)有部分水留在导管中未进入集气瓶
(5)燃烧一定程度时,瓶内氧气含量小,
红磷不能继续燃烧。
(6)点燃红磷后燃烧匙未立即伸入集气瓶中
6、实验成功的关键:
(1)装置不能漏气;
(2)集气瓶中加少量水
(防止高温熔融物使瓶底炸裂)
(3)红磷应过量
(4)点燃红磷后要立即伸入集气瓶中,并塞紧塞子
(5)待红磷冷却后,打开弹簧夹
三、空气的组成
一百份体积的空气
氧气(O2)
21%
氮气(N2) 78%
稀有气体
0.94%
二氧化碳
0.03%
其他气体杂质
0.03%
四、氮气、稀有气体的用途
氮气通常有哪些性质?
氮气
化学性质稳定,常温下难跟其他物质发生反应,但在高温、高能量条件下可与某些物质发生反应。
氮气通常有哪些用途呢?
制硝酸、化肥的重要原料
用作保护气
液氮冷冻麻醉
合成染料、制造炸药
食品包装时充氮以防腐
稀有气体
氦(He)、氖(Ne)、氩 (Ar)、氪(Kr)、氙(Xe)
用途
制作霓虹灯等多种电光源
用作保护气
氦气用来充填升空气球
用于激光技术
性质:一般不跟其他物质反应
五、纯净物和混合物
只由一种物质组成
如:N2、O2、CO2、P、P2O5、H2O
混合物:
由两种或者两种以上物质组成
如:空气 海水 河水 矿泉水等
纯净物可以用专门的化学符号来表示如氮气、氧气、二氧化碳可分别表示为N2、 O2、CO2等。
纯净物:
温故知新
根据要求回答问题:
①在集气瓶中加少量水②检查装置的气密性③在燃烧匙中装足量红磷,夹紧止水夹④点燃红磷,伸入集气瓶中塞紧橡皮塞⑤待集气瓶冷却后打开止水夹
(1)步骤④中发生反应的文字表达式为 ;
(2)步骤⑤中打开止水夹后观察到的现象为 ;
(3)该实验得出空气组成的结论是 ;
(4)该实验剩余气体的性质有 ;
(5)实验后集气瓶中水少于1/5,,误差产生的原
因可能是 ;
实验药品探究:根据下列素材,请你谈谈为什么要选择红磷做此实验?
硫(固)+氧气(气) 二氧化硫(气)
木炭(固)+ 氧气(气) 二氧化碳(气)
磷(固)+氧气(气 ) 五氧化二磷(固)
铁(固)+氧气(气) 四氧化三铁(固)(纯氧中发生)
下列各物质,属于纯净物的是( )
A.纯净的空气 B.冰水混合物
C.冰冻矿泉水 D. “三鹿”牛奶
六、空气污染
2001-2006年间平均全球空气污染形势图
六、空气污染
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
