苏教版(2019)化学 必修第二册 专题7 第3单元 含氮化合物的合理使用 同步练习(含解析)
文档属性
| 名称 | 苏教版(2019)化学 必修第二册 专题7 第3单元 含氮化合物的合理使用 同步练习(含解析) |
|
|
| 格式 | doc | ||
| 文件大小 | 793.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-15 00:00:00 | ||
图片预览



文档简介
含氮化合物的合理使用
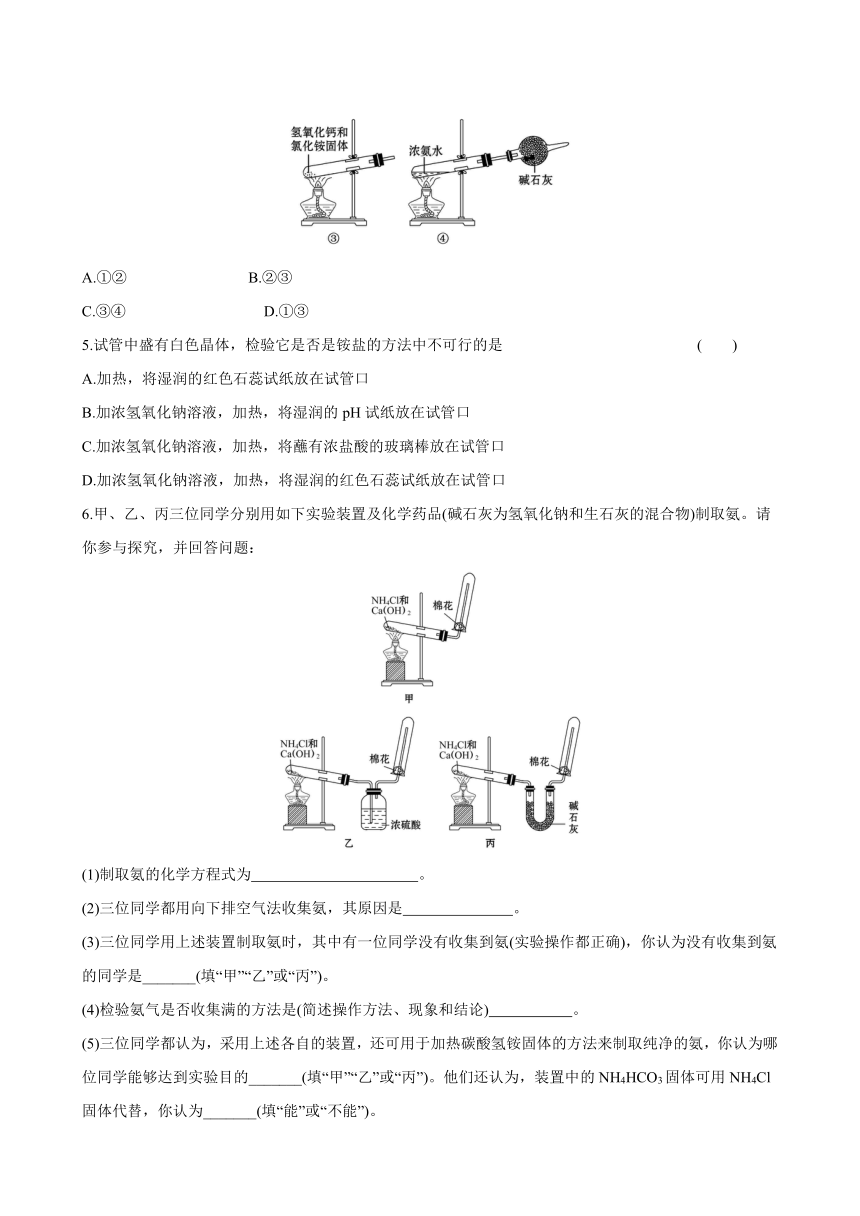
1.(双选)大型影剧院容纳的人数众多,防火安全非常重要,单就幕布而言防火等级分为4个等级。用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( )
A.幕布的着火点升高
B.幕布的质量增加
C.氯化铵分解吸收热量,降低了温度
D.氯化铵分解产生的气体隔绝了空气
2.(2020·枣庄高一检测)实验室可以按如图所示的装置干燥、收集气体M,多余的气体可用水吸收,则M是 ( )
A.NH3 B.NO C.Cl2 D.NO2
3.实验室制备干燥的氨气所需的药品是( )
A.NH4Cl稀溶液、NaOH稀溶液、碱石灰
B.饱和氨水、NaOH固体、五氧化二磷固体
C.NaOH溶液、NH4Cl晶体、浓硫酸
D.NH4Cl固体、消石灰、碱石灰
4.下面是实验室制取氨气的装置和选用的试剂,其中错误的是 ( )
A.①② B.②③
C.③④ D.①③
5.试管中盛有白色晶体,检验它是否是铵盐的方法中不可行的是 ( )
A.加热,将湿润的红色石蕊试纸放在试管口
B.加浓氢氧化钠溶液,加热,将湿润的pH试纸放在试管口
C.加浓氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在试管口
D.加浓氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
6.甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨。请你参与探究,并回答问题:
(1)制取氨的化学方程式为 。?
(2)三位同学都用向下排空气法收集氨,其原因是? 。?
(3)三位同学用上述装置制取氨时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨的同学是_______(填“甲”“乙”或“丙”)。?
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论) 。?
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨,你认为哪位同学能够达到实验目的_______(填“甲”“乙”或“丙”)。他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为_______(填“能”或“不能”)。?
7.为检验一种氮肥的成分,某学习小组的同学进行了以下实验:①加热氮肥样品生成气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊。②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化。由此可知该氮肥的主要成分是 ( )
A.NH4HCO3 B.NH4Cl
C.(NH4)2CO3 D.NH4NO3
8.(2020·临沂高一检测)把0.5 L含硫酸铵和硝酸铵的混合液分成两等份,一份用3 mol氢氧化钠刚好把氨全部赶出,另一份与1 mol氯化钡恰好完全反应,由此可知原溶液中N的物质的量浓度为 ( )
A.1 mol·L-1 B.2 mol·L-1
C.4 mol·L-1 D.0.5 mol·L-1
9.(2020·泰安高一检测)称取(NH4)2SO4和NH4HSO4混合物样品7.58 g,加入80.0 g质量分数为5.00%的NaOH溶液,充分反应后生成0.08 mol NH3。
(1)NaOH的物质的量为_______。?
(2)该混合样品中(NH4)2SO4和NH4HSO4的物质的量之比为_______。?
(3)下列物质既能够与强酸反应又能够与强碱反应,且反应后都能产生气体的是_______。?
A.硫化铵 B.亚硫酸氢钾
C.碳酸氢钠 D.硫酸氢铵
含氮化合物的合理使用
1.(双选)大型影剧院容纳的人数众多,防火安全非常重要,单就幕布而言防火等级分为4个等级。用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( )
A.幕布的着火点升高
B.幕布的质量增加
C.氯化铵分解吸收热量,降低了温度
D.氯化铵分解产生的气体隔绝了空气
【解析】选C、D。氯化铵受热分解,分解时吸收热量,同时产生的气体隔绝了空气。
2.(2020·枣庄高一检测)实验室可以按如图所示的装置干燥、收集气体M,多余的气体可用水吸收,则M是 ( )
A.NH3 B.NO C.Cl2 D.NO2
【解析】选A。NH3易溶于水,用防倒吸的装置吸收。
3.实验室制备干燥的氨气所需的药品是( )
A.NH4Cl稀溶液、NaOH稀溶液、碱石灰
B.饱和氨水、NaOH固体、五氧化二磷固体
C.NaOH溶液、NH4Cl晶体、浓硫酸
D.NH4Cl固体、消石灰、碱石灰
【解析】选D。实验室制取NH3是用NH4Cl固体与消石灰共热进行制取,不能在水溶液中反应制取氨气;由于NH3溶于水显碱性,故不能用P2O5固体和浓硫酸进行干燥,应用碱石灰进行干燥。
4.下面是实验室制取氨气的装置和选用的试剂,其中错误的是 ( )
A.①② B.②③
C.③④ D.①③
【解析】选D。NH4Cl受热可产生NH3和HCl,但两者遇冷会重新凝结产生NH4Cl,且可能出现堵塞导管的情况,③中试管口未向下倾斜会导致水倒流入试管底部而使试管破裂,①③符合题意。
5.试管中盛有白色晶体,检验它是否是铵盐的方法中不可行的是 ( )
A.加热,将湿润的红色石蕊试纸放在试管口
B.加浓氢氧化钠溶液,加热,将湿润的pH试纸放在试管口
C.加浓氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在试管口
D.加浓氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
【解析】选A。有的铵盐如NH4NO3受热分解不一定生成NH3,有的铵盐如氯化铵分解生成氨气和氯化氢,氯化氢溶于水显酸性,A错误;湿润的pH试纸测得NH325 ℃时pH大于7,NH3遇浓盐酸生成白烟,使湿润的红色石蕊试纸变蓝。B、C、D正确。
6.甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨。请你参与探究,并回答问题:
(1)制取氨的化学方程式为 。?
(2)三位同学都用向下排空气法收集氨,其原因是? 。?
(3)三位同学用上述装置制取氨时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨的同学是_______(填“甲”“乙”或“丙”)。?
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论) 。?
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨,你认为哪位同学能够达到实验目的_______(填“甲”“乙”或“丙”)。他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为_______(填“能”或“不能”)。?
【解析】(1)实验室用氢氧化钙和氯化铵在加热条件下制备氨的方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。
(2)氨极易溶于水,不能用排水法收集,氨的密度比空气的小,应用向下排空气法收集。
(3)氨为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收,答案为乙。
(4)检验氨气时可用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已收集满或用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已收集满。
(5)碳酸氢铵加热分解生成氨气、二氧化碳和水,其中可用碱石灰吸收二氧化碳和水,只有丙能做到,氯化铵加热分解生成氨气和氯化氢,在温度较低时又重新生成氯化铵,不能用氯化铵制备氨。
答案:(1)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(2)氨的密度比空气的小,氨极易溶于水
(3)乙
(4)用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已收集满)
(5)丙 不能
7.为检验一种氮肥的成分,某学习小组的同学进行了以下实验:①加热氮肥样品生成气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊。②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化。由此可知该氮肥的主要成分是 ( )
A.NH4HCO3 B.NH4Cl
C.(NH4)2CO3 D.NH4NO3
【解析】选A。因产生的两种气体一种为NH3,一种为CO2,故A、C符合,而加入BaCl2溶液后,无明显变化,(NH4)2CO3与BaCl2反应会产生白色沉淀,C错误。
8.(2020·临沂高一检测)把0.5 L含硫酸铵和硝酸铵的混合液分成两等份,一份用3 mol氢氧化钠刚好把氨全部赶出,另一份与1 mol氯化钡恰好完全反应,由此可知原溶液中N的物质的量浓度为 ( )
A.1 mol·L-1 B.2 mol·L-1
C.4 mol·L-1 D.0.5 mol·L-1
【解析】选C。一份中含的n[(NH4)2SO4]=n(S)=n(Ba2+)=1 mol,其中的n(N)=
2 mol,另一份含的n(N)=n(OH-)=3 mol,所以n(N)=3 mol-2 mol=1 mol,两份中含n(N)=2 mol,物质的量浓度为4 mol·L-1。
9.(2020·泰安高一检测)称取(NH4)2SO4和NH4HSO4混合物样品7.58 g,加入80.0 g质量分数为5.00%的NaOH溶液,充分反应后生成0.08 mol NH3。
(1)NaOH的物质的量为_______。?
(2)该混合样品中(NH4)2SO4和NH4HSO4的物质的量之比为_______。?
(3)下列物质既能够与强酸反应又能够与强碱反应,且反应后都能产生气体的是_______。?
A.硫化铵 B.亚硫酸氢钾
C.碳酸氢钠 D.硫酸氢铵
【解析】(1)NaOH的物质的量为(80g×5%)÷40 g·mol-1=0.1 mol。
(2)(NH4)2SO4和NH4HSO4混合物样品中加入NaOH溶液,NH4HSO4电离出的H+优先反应,根据N~OH-可知与H+反应消耗NaOH的物质的量为0.1 mol-0.08 mol=0.02 mol,则NH4HSO4的物质的量为0.02 mol,(NH4)2SO4的质量为7.58 g-115 g·mol-1×0.02 mol=5.28 g,其物质的量为5.28 g÷132 g·mol-1=0.04 mol,则(NH4)2SO4和NH4HSO4的物质的量比为0.04 mol∶0.02 mol=2∶1。
(3)硫化铵与盐酸反应生成氯化铵、硫化氢气体,与氢氧化钠加热反应生成硫化钠、水、氨气,A正确;亚硫酸氢钾与盐酸反应能够生成二氧化硫,而与氢氧化钠反应生成亚硫酸盐和水,不会产生气体,B错误;碳酸氢钠与盐酸反应能够生成二氧化碳,而与氢氧化钠反应生成碳酸酸钠和水,不会产生气体,C错误;硫酸氢铵与盐酸不反应,D错误。
答案:(1)0.1mol (2)2∶1 (3)A
1.(双选)大型影剧院容纳的人数众多,防火安全非常重要,单就幕布而言防火等级分为4个等级。用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( )
A.幕布的着火点升高
B.幕布的质量增加
C.氯化铵分解吸收热量,降低了温度
D.氯化铵分解产生的气体隔绝了空气
2.(2020·枣庄高一检测)实验室可以按如图所示的装置干燥、收集气体M,多余的气体可用水吸收,则M是 ( )
A.NH3 B.NO C.Cl2 D.NO2
3.实验室制备干燥的氨气所需的药品是( )
A.NH4Cl稀溶液、NaOH稀溶液、碱石灰
B.饱和氨水、NaOH固体、五氧化二磷固体
C.NaOH溶液、NH4Cl晶体、浓硫酸
D.NH4Cl固体、消石灰、碱石灰
4.下面是实验室制取氨气的装置和选用的试剂,其中错误的是 ( )
A.①② B.②③
C.③④ D.①③
5.试管中盛有白色晶体,检验它是否是铵盐的方法中不可行的是 ( )
A.加热,将湿润的红色石蕊试纸放在试管口
B.加浓氢氧化钠溶液,加热,将湿润的pH试纸放在试管口
C.加浓氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在试管口
D.加浓氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
6.甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨。请你参与探究,并回答问题:
(1)制取氨的化学方程式为 。?
(2)三位同学都用向下排空气法收集氨,其原因是? 。?
(3)三位同学用上述装置制取氨时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨的同学是_______(填“甲”“乙”或“丙”)。?
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论) 。?
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨,你认为哪位同学能够达到实验目的_______(填“甲”“乙”或“丙”)。他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为_______(填“能”或“不能”)。?
7.为检验一种氮肥的成分,某学习小组的同学进行了以下实验:①加热氮肥样品生成气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊。②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化。由此可知该氮肥的主要成分是 ( )
A.NH4HCO3 B.NH4Cl
C.(NH4)2CO3 D.NH4NO3
8.(2020·临沂高一检测)把0.5 L含硫酸铵和硝酸铵的混合液分成两等份,一份用3 mol氢氧化钠刚好把氨全部赶出,另一份与1 mol氯化钡恰好完全反应,由此可知原溶液中N的物质的量浓度为 ( )
A.1 mol·L-1 B.2 mol·L-1
C.4 mol·L-1 D.0.5 mol·L-1
9.(2020·泰安高一检测)称取(NH4)2SO4和NH4HSO4混合物样品7.58 g,加入80.0 g质量分数为5.00%的NaOH溶液,充分反应后生成0.08 mol NH3。
(1)NaOH的物质的量为_______。?
(2)该混合样品中(NH4)2SO4和NH4HSO4的物质的量之比为_______。?
(3)下列物质既能够与强酸反应又能够与强碱反应,且反应后都能产生气体的是_______。?
A.硫化铵 B.亚硫酸氢钾
C.碳酸氢钠 D.硫酸氢铵
含氮化合物的合理使用
1.(双选)大型影剧院容纳的人数众多,防火安全非常重要,单就幕布而言防火等级分为4个等级。用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( )
A.幕布的着火点升高
B.幕布的质量增加
C.氯化铵分解吸收热量,降低了温度
D.氯化铵分解产生的气体隔绝了空气
【解析】选C、D。氯化铵受热分解,分解时吸收热量,同时产生的气体隔绝了空气。
2.(2020·枣庄高一检测)实验室可以按如图所示的装置干燥、收集气体M,多余的气体可用水吸收,则M是 ( )
A.NH3 B.NO C.Cl2 D.NO2
【解析】选A。NH3易溶于水,用防倒吸的装置吸收。
3.实验室制备干燥的氨气所需的药品是( )
A.NH4Cl稀溶液、NaOH稀溶液、碱石灰
B.饱和氨水、NaOH固体、五氧化二磷固体
C.NaOH溶液、NH4Cl晶体、浓硫酸
D.NH4Cl固体、消石灰、碱石灰
【解析】选D。实验室制取NH3是用NH4Cl固体与消石灰共热进行制取,不能在水溶液中反应制取氨气;由于NH3溶于水显碱性,故不能用P2O5固体和浓硫酸进行干燥,应用碱石灰进行干燥。
4.下面是实验室制取氨气的装置和选用的试剂,其中错误的是 ( )
A.①② B.②③
C.③④ D.①③
【解析】选D。NH4Cl受热可产生NH3和HCl,但两者遇冷会重新凝结产生NH4Cl,且可能出现堵塞导管的情况,③中试管口未向下倾斜会导致水倒流入试管底部而使试管破裂,①③符合题意。
5.试管中盛有白色晶体,检验它是否是铵盐的方法中不可行的是 ( )
A.加热,将湿润的红色石蕊试纸放在试管口
B.加浓氢氧化钠溶液,加热,将湿润的pH试纸放在试管口
C.加浓氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在试管口
D.加浓氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
【解析】选A。有的铵盐如NH4NO3受热分解不一定生成NH3,有的铵盐如氯化铵分解生成氨气和氯化氢,氯化氢溶于水显酸性,A错误;湿润的pH试纸测得NH325 ℃时pH大于7,NH3遇浓盐酸生成白烟,使湿润的红色石蕊试纸变蓝。B、C、D正确。
6.甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨。请你参与探究,并回答问题:
(1)制取氨的化学方程式为 。?
(2)三位同学都用向下排空气法收集氨,其原因是? 。?
(3)三位同学用上述装置制取氨时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨的同学是_______(填“甲”“乙”或“丙”)。?
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论) 。?
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨,你认为哪位同学能够达到实验目的_______(填“甲”“乙”或“丙”)。他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为_______(填“能”或“不能”)。?
【解析】(1)实验室用氢氧化钙和氯化铵在加热条件下制备氨的方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。
(2)氨极易溶于水,不能用排水法收集,氨的密度比空气的小,应用向下排空气法收集。
(3)氨为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收,答案为乙。
(4)检验氨气时可用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已收集满或用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已收集满。
(5)碳酸氢铵加热分解生成氨气、二氧化碳和水,其中可用碱石灰吸收二氧化碳和水,只有丙能做到,氯化铵加热分解生成氨气和氯化氢,在温度较低时又重新生成氯化铵,不能用氯化铵制备氨。
答案:(1)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(2)氨的密度比空气的小,氨极易溶于水
(3)乙
(4)用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已收集满)
(5)丙 不能
7.为检验一种氮肥的成分,某学习小组的同学进行了以下实验:①加热氮肥样品生成气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊。②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化。由此可知该氮肥的主要成分是 ( )
A.NH4HCO3 B.NH4Cl
C.(NH4)2CO3 D.NH4NO3
【解析】选A。因产生的两种气体一种为NH3,一种为CO2,故A、C符合,而加入BaCl2溶液后,无明显变化,(NH4)2CO3与BaCl2反应会产生白色沉淀,C错误。
8.(2020·临沂高一检测)把0.5 L含硫酸铵和硝酸铵的混合液分成两等份,一份用3 mol氢氧化钠刚好把氨全部赶出,另一份与1 mol氯化钡恰好完全反应,由此可知原溶液中N的物质的量浓度为 ( )
A.1 mol·L-1 B.2 mol·L-1
C.4 mol·L-1 D.0.5 mol·L-1
【解析】选C。一份中含的n[(NH4)2SO4]=n(S)=n(Ba2+)=1 mol,其中的n(N)=
2 mol,另一份含的n(N)=n(OH-)=3 mol,所以n(N)=3 mol-2 mol=1 mol,两份中含n(N)=2 mol,物质的量浓度为4 mol·L-1。
9.(2020·泰安高一检测)称取(NH4)2SO4和NH4HSO4混合物样品7.58 g,加入80.0 g质量分数为5.00%的NaOH溶液,充分反应后生成0.08 mol NH3。
(1)NaOH的物质的量为_______。?
(2)该混合样品中(NH4)2SO4和NH4HSO4的物质的量之比为_______。?
(3)下列物质既能够与强酸反应又能够与强碱反应,且反应后都能产生气体的是_______。?
A.硫化铵 B.亚硫酸氢钾
C.碳酸氢钠 D.硫酸氢铵
【解析】(1)NaOH的物质的量为(80g×5%)÷40 g·mol-1=0.1 mol。
(2)(NH4)2SO4和NH4HSO4混合物样品中加入NaOH溶液,NH4HSO4电离出的H+优先反应,根据N~OH-可知与H+反应消耗NaOH的物质的量为0.1 mol-0.08 mol=0.02 mol,则NH4HSO4的物质的量为0.02 mol,(NH4)2SO4的质量为7.58 g-115 g·mol-1×0.02 mol=5.28 g,其物质的量为5.28 g÷132 g·mol-1=0.04 mol,则(NH4)2SO4和NH4HSO4的物质的量比为0.04 mol∶0.02 mol=2∶1。
(3)硫化铵与盐酸反应生成氯化铵、硫化氢气体,与氢氧化钠加热反应生成硫化钠、水、氨气,A正确;亚硫酸氢钾与盐酸反应能够生成二氧化硫,而与氢氧化钠反应生成亚硫酸盐和水,不会产生气体,B错误;碳酸氢钠与盐酸反应能够生成二氧化碳,而与氢氧化钠反应生成碳酸酸钠和水,不会产生气体,C错误;硫酸氢铵与盐酸不反应,D错误。
答案:(1)0.1mol (2)2∶1 (3)A
