仁爱版初中化学九上 5.2 质量守恒定律 教案
文档属性
| 名称 | 仁爱版初中化学九上 5.2 质量守恒定律 教案 |  | |
| 格式 | docx | ||
| 文件大小 | 322.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-17 09:31:38 | ||
图片预览




文档简介
《
质量守恒定律
第一课时》教学设计
【教材分析】
1.教学内容:
本节课内容是科普2011课标版九年级上册专题五化学变化及其表示单元2质量守恒定律
2.课程标准对本课题教学的要求
一级主题
二级主题
标准
活动探究建议
物质的
化学变
化
质量
守恒
定律
1.认识质量守恒定律,能说明化学反应中的质量关系。
2.认识定量研究对于化学科学发展的重大作用。
1.实验探究化学反应前后的质量关系。
2.用微粒的观点对质量守恒定律做出解释。
3.教材的地位和作用:质量守恒定律是初中化学的一个重要化学规律,是分析物质在化学反应中的质量关系的理论依据,它的应用贯穿于整个中学化学。本节教材在初中化学里有着承上启下的作用
【学情分析】
学生的知识现状:已了解元素符号、化学式、化学反应的实质,初步掌握了一些简单的化学反应。
学生的能力现状:初步掌握了简单的化学实验基板操作技能,而对化学探究学习方法的了解尚处于启蒙阶段。
学生的心理现状:学生刚开始学习化学,情绪和心理都处于比较兴奋、好奇状态,我会紧抓这一点。
【教学目标】
1、通过实验探究认识质量守恒定律,了解常见化学反应中的质量关系。
2、从微粒角度解释质量守恒的本质原因,并认识化学反应。
3、培养严谨求实的科学精神,认识定量研究对化学科学发展的作用。
教学重点:通过探究认识质量守恒定律
教学难点:1.引导学生通过实验探究得出结论
2.利用质量守恒定律解释某些化学现象。
教法学法:
??教法:演示实验、启发引导、归纳总结
学法:实验探究、合作学习
教
具:
多媒体、红磷、火柴、烧杯、试管、酒精灯、药匙、天平、镊子、硫酸铜溶液、铁钉、砂纸、碳酸钠粉末、稀盐酸等。
课时安排:1课时
【教学过程】
教学环节
教师活动
学生活动
设计意图
引入
吟诗“遥想公瑾当年当年,小乔出嫁了,雄姿英发,羽扇纶巾,谈笑间樯橹灰飞烟灭,故国神游,多情应笑我,早生华发。”
反应前的总质量有什么样的变化呢?
【两位同学自述】
波义尔和拉瓦锡的实验
认真听老师将这首诗念完,并思考思考学过化学的我们想到什么。
思考后回答发生了化学变化
两个学生分别以这两位科学家自述,简单讲解做实验的过程。
通过诗歌的展示,激发学生的学习兴趣。并且该诗为学生熟知的内容,理解相对简单。
通过录音的播放,不光可以激发学生的学习兴趣,还能够让他们简单了解两位科学家对实验探索的过程,并且感受到科学的严谨性。
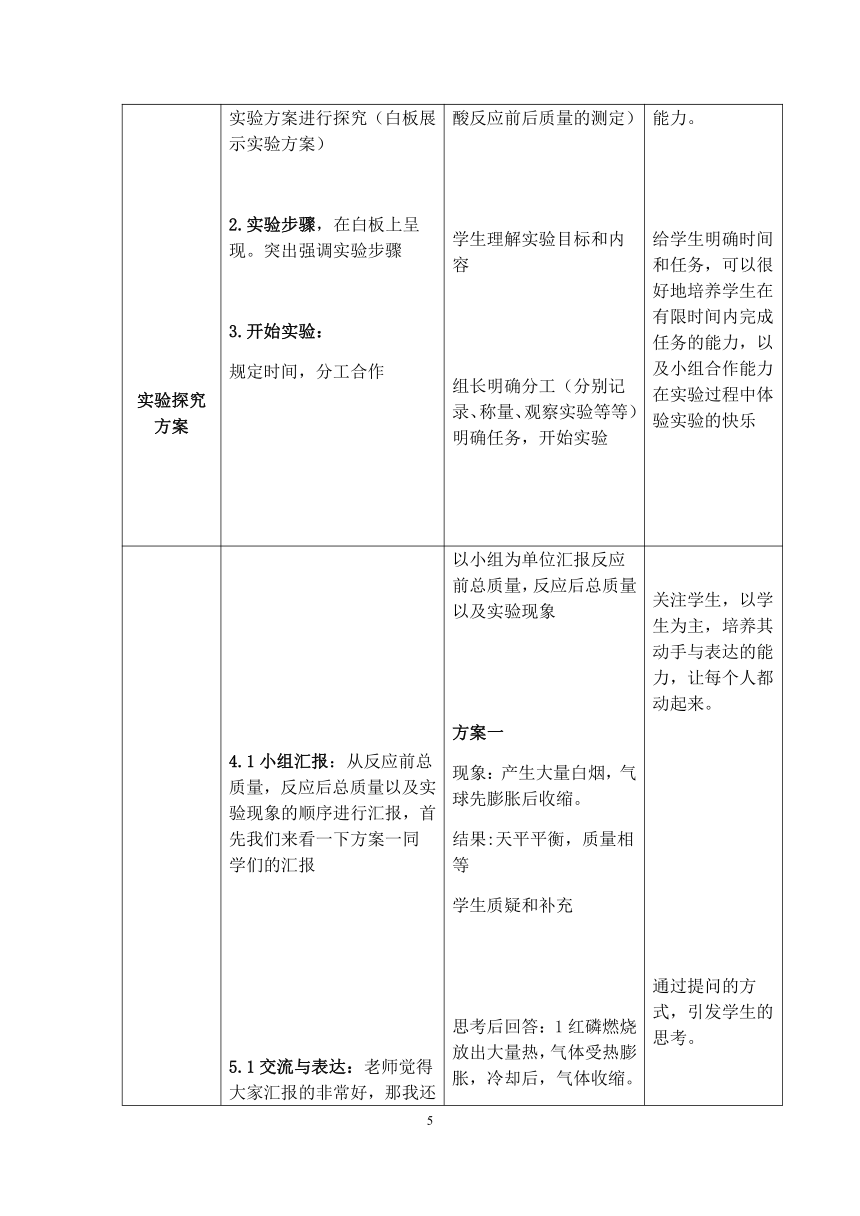
实验探究方案
实验探究:化学变化前后总质量的变化情况。
1.实验方案:我们通过三个实验方案进行探究(白板展示实验方案)
2.实验步骤,在白板上呈现。突出强调实验步骤
3.开始实验:
规定时间,分工合作
白板展示实验方案:红磷燃烧前后质量的测定、铁钉和硫酸铜反应前后质量的测定、碳酸钠和稀盐酸反应前后质量的测定)
学生理解实验目标和内容
组长明确分工(分别记录、称量、观察实验等等)明确任务,开始实验
通过实验探究,激发学生的积极性,调动学生的学习兴趣,培养学生的动手操作能力。
给学生明确时间和任务,可以很好地培养学生在有限时间内完成任务的能力,以及小组合作能力在实验过程中体验实验的快乐
小组汇报
得出结论
4.1小组汇报:从反应前总质量,反应后总质量以及实验现象的顺序进行汇报,首先我们来看一下方案一同学们的汇报
5.1交流与表达:老师觉得大家汇报的非常好,那我还有些疑惑,同学们能帮老师解答一下吗?(白板展示问题:1.气球为什么先收缩后膨胀?2.气球的作用)
分析:
我们通过几组实验都得到了反应前的总质量等于反应后的总质量,那么,造成这样结果的实质原因是什么呢?
4.2小组汇报:科学是严禁的,所以一次实验结果不能说明问题,我们来听第二组同学的汇报。
5.2交流与表达:简单展示铁钉和硫酸铜溶液反应的文字和符号表达式,了解出现这种现象的原因,并且告诉同学们,溶液颜色也会改变,从蓝色变为浅绿色。
5.3交流与表达:
方案三:天平不平衡的原因
(白板展示盐酸和稀盐酸反应的实质)
评价与反思:
改进实验的展示,
称量反应前的总质量,
将气球中的碳酸钠加入锥形瓶中,反应,称量反应后的总质量,
对比分析
(解释细小误差的原因:气球的浮力作用)
6.得出结论:质量守恒定律
(白板展示质量守恒定律的内容)
以小组为单位汇报反应前总质量,反应后总质量以及实验现象
方案一
现象:产生大量白烟,气球先膨胀后收缩。
结果:天平平衡,质量相等
学生质疑和补充
思考后回答:1红磷燃烧放出大量热,气体受热膨胀,冷却后,气体收缩。
起缓冲作用
分析反应前称量的装置:装置、空气、红磷、
反应后称量的装置
装置、其他气体、五氧化二磷,
得到反应前红磷和氧气的总质量等于反应后生成五氧化二磷的总质量
方案二
现象:铁钉表面有红色物质析出
结果:天平平衡,质量相等
方案三
现象:有大量气泡产生
结果:天平不平衡,质量不相等
二氧化碳逸出,没有计算其质量
学生观看教师改进实验
描述现象
得出结论
启示:
思考后得到有气体生成的实验要在密闭容器中进行
学生思考后试着总结
质量守恒定律的内容,
分析,找出重点词:化学变化、质量总和、参加、
适用于一切化学反应
学生边听讲,边做笔记
关注学生,以学生为主,培养其动手与表达的能力,让每个人都动起来。
通过提问的方式,引发学生的思考。
让学生自主分析,培养他们独立思考的能力和科学探究的精神
通过两个实验结果,鼓励学生自己总结质量守恒定律,培养学生归纳、概括能力
引导学生,提出质疑,并且解决形成质疑的原因
通过教师改进实验,再次验证质量守恒定律,并且还可以解释学生提出的质疑,通过两组实验的对比,学生可以发现不同,得到启示
微观解释
过渡:我们已经从实验结果上得到了质量守恒定律,那么出现守恒的微观实质是什么,我们一起来探讨一下
游戏:演示氢气和氯气点燃生成氯化氢微观原理
学生活动:每个学生桌面上都有氯原子和氢原子,根据教师提示,完成分子分解成原子,原子重新组合成新的分子的过程。
通过游戏的设置,让学生参与其中,将难懂的抽象概念转化为学生容易理解的具体实物,可以帮助学生掌握知识
活动与思考:在这个过程中什么没有发生变化(强调宏观和微观,帮助学生思考)
总结:
微观
原子的个数、原子的质量、原子的种类均没有发生变化
宏观
元素的种类、元素的质量不会发生变化
通过提问元素的概念将学生向宏观元素知识上牵引,分析出质量守恒定律成立的原因
总结
质量守恒定律成立的原因
总结出质量守恒的原因
及时反馈
详见附页
根据质量守恒定律思考回答
在新知识的运用中形成发展的知识结构。
课堂小结与
练习
课堂小结
课堂练习,详见附页
小结,并完成练习
巩固质量守恒定律的内容和守恒的原因。
【及时反馈】
早在17世纪,质量守恒定律发现之前,英国化学家波义耳曾经做过一个实验:在密闭的容器中燃烧金属时,得到了金属灰,然后打开容器盖,称量金属灰的质量,发现比原来金属质量增加了。
(1)试解释金属灰质量比原金属质量增加的原因。
(2)由于波义耳称量方法上的原因,他错过了发现质量守恒定律的机会。请你改进他的称量方法,以验证质量守恒定律。
【随堂练习】
1.在下列各项中,化学反应前后肯定没有发生改变的是( )
①原子的数目;②分子的数目;③元素的种类;④物质的总质量;⑤物质的种类;⑥原子的种类.
A.①③④⑤
B.①③④⑥
C.①④⑥⑤
D.①③⑤
2.某纯净物M微热就能分解生成NH3、H2O和CO2,由此还不能得出的结论是( )
M不稳定?
???
B.M是化合物??
C.M中含有水?
D.M由四种元素组成?
?
3如图是通过探究红磷燃烧前后质量的变化情况来验证质量守恒定律的实验装置图.试回答:
(1)试验中观察到的现象是
??????????????
(2)用玻璃管将左盘锥形瓶中的红磷引燃后要迅速塞紧瓶塞,原因是
(3)点燃红磷后,橡皮塞未塞紧,结果天平的指针
偏转?(填“向左”“向右”“不”)
(4)装置中气球的作用是
(5)此实验用烧红的玻璃管点燃红磷,还可以用
的方法点燃红磷;若换成白鳞,还可用用
的方法使他燃烧.
板书设计
质量守恒定律
4
质量守恒定律
第一课时》教学设计
【教材分析】
1.教学内容:
本节课内容是科普2011课标版九年级上册专题五化学变化及其表示单元2质量守恒定律
2.课程标准对本课题教学的要求
一级主题
二级主题
标准
活动探究建议
物质的
化学变
化
质量
守恒
定律
1.认识质量守恒定律,能说明化学反应中的质量关系。
2.认识定量研究对于化学科学发展的重大作用。
1.实验探究化学反应前后的质量关系。
2.用微粒的观点对质量守恒定律做出解释。
3.教材的地位和作用:质量守恒定律是初中化学的一个重要化学规律,是分析物质在化学反应中的质量关系的理论依据,它的应用贯穿于整个中学化学。本节教材在初中化学里有着承上启下的作用
【学情分析】
学生的知识现状:已了解元素符号、化学式、化学反应的实质,初步掌握了一些简单的化学反应。
学生的能力现状:初步掌握了简单的化学实验基板操作技能,而对化学探究学习方法的了解尚处于启蒙阶段。
学生的心理现状:学生刚开始学习化学,情绪和心理都处于比较兴奋、好奇状态,我会紧抓这一点。
【教学目标】
1、通过实验探究认识质量守恒定律,了解常见化学反应中的质量关系。
2、从微粒角度解释质量守恒的本质原因,并认识化学反应。
3、培养严谨求实的科学精神,认识定量研究对化学科学发展的作用。
教学重点:通过探究认识质量守恒定律
教学难点:1.引导学生通过实验探究得出结论
2.利用质量守恒定律解释某些化学现象。
教法学法:
??教法:演示实验、启发引导、归纳总结
学法:实验探究、合作学习
教
具:
多媒体、红磷、火柴、烧杯、试管、酒精灯、药匙、天平、镊子、硫酸铜溶液、铁钉、砂纸、碳酸钠粉末、稀盐酸等。
课时安排:1课时
【教学过程】
教学环节
教师活动
学生活动
设计意图
引入
吟诗“遥想公瑾当年当年,小乔出嫁了,雄姿英发,羽扇纶巾,谈笑间樯橹灰飞烟灭,故国神游,多情应笑我,早生华发。”
反应前的总质量有什么样的变化呢?
【两位同学自述】
波义尔和拉瓦锡的实验
认真听老师将这首诗念完,并思考思考学过化学的我们想到什么。
思考后回答发生了化学变化
两个学生分别以这两位科学家自述,简单讲解做实验的过程。
通过诗歌的展示,激发学生的学习兴趣。并且该诗为学生熟知的内容,理解相对简单。
通过录音的播放,不光可以激发学生的学习兴趣,还能够让他们简单了解两位科学家对实验探索的过程,并且感受到科学的严谨性。
实验探究方案
实验探究:化学变化前后总质量的变化情况。
1.实验方案:我们通过三个实验方案进行探究(白板展示实验方案)
2.实验步骤,在白板上呈现。突出强调实验步骤
3.开始实验:
规定时间,分工合作
白板展示实验方案:红磷燃烧前后质量的测定、铁钉和硫酸铜反应前后质量的测定、碳酸钠和稀盐酸反应前后质量的测定)
学生理解实验目标和内容
组长明确分工(分别记录、称量、观察实验等等)明确任务,开始实验
通过实验探究,激发学生的积极性,调动学生的学习兴趣,培养学生的动手操作能力。
给学生明确时间和任务,可以很好地培养学生在有限时间内完成任务的能力,以及小组合作能力在实验过程中体验实验的快乐
小组汇报
得出结论
4.1小组汇报:从反应前总质量,反应后总质量以及实验现象的顺序进行汇报,首先我们来看一下方案一同学们的汇报
5.1交流与表达:老师觉得大家汇报的非常好,那我还有些疑惑,同学们能帮老师解答一下吗?(白板展示问题:1.气球为什么先收缩后膨胀?2.气球的作用)
分析:
我们通过几组实验都得到了反应前的总质量等于反应后的总质量,那么,造成这样结果的实质原因是什么呢?
4.2小组汇报:科学是严禁的,所以一次实验结果不能说明问题,我们来听第二组同学的汇报。
5.2交流与表达:简单展示铁钉和硫酸铜溶液反应的文字和符号表达式,了解出现这种现象的原因,并且告诉同学们,溶液颜色也会改变,从蓝色变为浅绿色。
5.3交流与表达:
方案三:天平不平衡的原因
(白板展示盐酸和稀盐酸反应的实质)
评价与反思:
改进实验的展示,
称量反应前的总质量,
将气球中的碳酸钠加入锥形瓶中,反应,称量反应后的总质量,
对比分析
(解释细小误差的原因:气球的浮力作用)
6.得出结论:质量守恒定律
(白板展示质量守恒定律的内容)
以小组为单位汇报反应前总质量,反应后总质量以及实验现象
方案一
现象:产生大量白烟,气球先膨胀后收缩。
结果:天平平衡,质量相等
学生质疑和补充
思考后回答:1红磷燃烧放出大量热,气体受热膨胀,冷却后,气体收缩。
起缓冲作用
分析反应前称量的装置:装置、空气、红磷、
反应后称量的装置
装置、其他气体、五氧化二磷,
得到反应前红磷和氧气的总质量等于反应后生成五氧化二磷的总质量
方案二
现象:铁钉表面有红色物质析出
结果:天平平衡,质量相等
方案三
现象:有大量气泡产生
结果:天平不平衡,质量不相等
二氧化碳逸出,没有计算其质量
学生观看教师改进实验
描述现象
得出结论
启示:
思考后得到有气体生成的实验要在密闭容器中进行
学生思考后试着总结
质量守恒定律的内容,
分析,找出重点词:化学变化、质量总和、参加、
适用于一切化学反应
学生边听讲,边做笔记
关注学生,以学生为主,培养其动手与表达的能力,让每个人都动起来。
通过提问的方式,引发学生的思考。
让学生自主分析,培养他们独立思考的能力和科学探究的精神
通过两个实验结果,鼓励学生自己总结质量守恒定律,培养学生归纳、概括能力
引导学生,提出质疑,并且解决形成质疑的原因
通过教师改进实验,再次验证质量守恒定律,并且还可以解释学生提出的质疑,通过两组实验的对比,学生可以发现不同,得到启示
微观解释
过渡:我们已经从实验结果上得到了质量守恒定律,那么出现守恒的微观实质是什么,我们一起来探讨一下
游戏:演示氢气和氯气点燃生成氯化氢微观原理
学生活动:每个学生桌面上都有氯原子和氢原子,根据教师提示,完成分子分解成原子,原子重新组合成新的分子的过程。
通过游戏的设置,让学生参与其中,将难懂的抽象概念转化为学生容易理解的具体实物,可以帮助学生掌握知识
活动与思考:在这个过程中什么没有发生变化(强调宏观和微观,帮助学生思考)
总结:
微观
原子的个数、原子的质量、原子的种类均没有发生变化
宏观
元素的种类、元素的质量不会发生变化
通过提问元素的概念将学生向宏观元素知识上牵引,分析出质量守恒定律成立的原因
总结
质量守恒定律成立的原因
总结出质量守恒的原因
及时反馈
详见附页
根据质量守恒定律思考回答
在新知识的运用中形成发展的知识结构。
课堂小结与
练习
课堂小结
课堂练习,详见附页
小结,并完成练习
巩固质量守恒定律的内容和守恒的原因。
【及时反馈】
早在17世纪,质量守恒定律发现之前,英国化学家波义耳曾经做过一个实验:在密闭的容器中燃烧金属时,得到了金属灰,然后打开容器盖,称量金属灰的质量,发现比原来金属质量增加了。
(1)试解释金属灰质量比原金属质量增加的原因。
(2)由于波义耳称量方法上的原因,他错过了发现质量守恒定律的机会。请你改进他的称量方法,以验证质量守恒定律。
【随堂练习】
1.在下列各项中,化学反应前后肯定没有发生改变的是( )
①原子的数目;②分子的数目;③元素的种类;④物质的总质量;⑤物质的种类;⑥原子的种类.
A.①③④⑤
B.①③④⑥
C.①④⑥⑤
D.①③⑤
2.某纯净物M微热就能分解生成NH3、H2O和CO2,由此还不能得出的结论是( )
M不稳定?
???
B.M是化合物??
C.M中含有水?
D.M由四种元素组成?
?
3如图是通过探究红磷燃烧前后质量的变化情况来验证质量守恒定律的实验装置图.试回答:
(1)试验中观察到的现象是
??????????????
(2)用玻璃管将左盘锥形瓶中的红磷引燃后要迅速塞紧瓶塞,原因是
(3)点燃红磷后,橡皮塞未塞紧,结果天平的指针
偏转?(填“向左”“向右”“不”)
(4)装置中气球的作用是
(5)此实验用烧红的玻璃管点燃红磷,还可以用
的方法点燃红磷;若换成白鳞,还可用用
的方法使他燃烧.
板书设计
质量守恒定律
4
同课章节目录
- 专题一 走进化学殿堂
- 单元1 化学使生活更美好
- 单元2 如何学习化学
- 专题二 空气和水
- 单元1 多组分的空气
- 单元2 氧气
- 单元3 自然界的水
- 专题三 物质的构成
- 单元1 构成物质的微粒
- 单元2 组成物质的元素
- 单元3 纯净物组成的表示方法
- 专题四 燃料与燃烧
- 单元1 燃烧与灭火
- 单元2 碳及其化合物
- 单元3 化石燃料的利用
- 专题五 化学变化及其表示
- 单元1 化学变化是有条件的
- 单元2 质量守恒定律
- 单元3 化学方程式
- 专题六 物质的溶解
- 单元1 物质的溶解过程
- 单元2 物质的溶解性
- 单元3 物质的溶解性的改变
- 学生实验
- 实验1 实验基本操作
- 实验2 氧气的实验室制取与性质
- 实验3 燃烧的条件
- 实验4 二氧化碳的实验室制取与性质
- 实验5 一定浓度溶液的配置
