2012年高中化学学业水平测试课件:第11讲 物质结构
文档属性
| 名称 | 2012年高中化学学业水平测试课件:第11讲 物质结构 |  | |
| 格式 | rar | ||
| 文件大小 | 202.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | |||
| 科目 | 化学 | ||
| 更新时间 | 2011-10-03 13:00:15 | ||
图片预览








文档简介
(共29张PPT)
第十一讲 物质结构
1.了解元素、同位素的含义。
2.了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.了解原子核外电子排布。
4.了解化学键的定义。了解离子键、共价键的形成。
一、原子组成
1.元素、核素、同位素
(1)元素:是具有相同________的一类原子的总称。
(2)核素:是具有一定数目________和一定数目________的一种原子。一种元素有________核素。
如:氢元素的三种核素: (氕)、 (氘)、 (氚)的质子数相同,中子数不同,它们是三种不同原子,属于同一种元素,即氢元素。
1.(1)质子数 (2)质子 中子 多种
(3)同位素:同一元素的不同________(原子)间互称同位素。同位素的共同特征是:________相等,________不相等,在周期表中位置________。如:H 、H 、H互为同位素。
(4)核素、同位素、元素之间的关系如图所示:
(3)核素 质子数 中子数 相同
2.原子结构与原子内粒子相互关系
(1)关系图
(2)各个物理量之间的关系
①原子核电荷数(Z)=核内______(Z)= 核外________ = 原子序数
②质量数(A)= ________(Z)+ ________(N)
③阴离子( n-)核外电子数=______(Z)+______(n)
④阳离子( n+)核外电子数=______(Z)-正电荷数(n)
2.(1)A-Z (2)①质子数 电子数 ②质子数 中子数 ③质子数 负电荷数 ④质子数
特别提示:1.质子的数目决定元素的种类。
2.中子的数目决定元素的原子种类,影响原子质量。
3.核外电子分层排布,元素化学性质主要由最外层电子数决定。
4.质子和中子相对质量约为1,原子的相对质量整数值近似等于质量数A。
5.(1)同位素属于同一种元素,但不是同种原子。例如, 、 (D)、 (T)是三种不同的原子,但都是氢元素。
(2)同位素的质子数都相同,原子核外电子层结构相同,化学性质基本相同。
(3)大多数元素都有同位素,所以原子的种类数要比元素的种类数多得多。
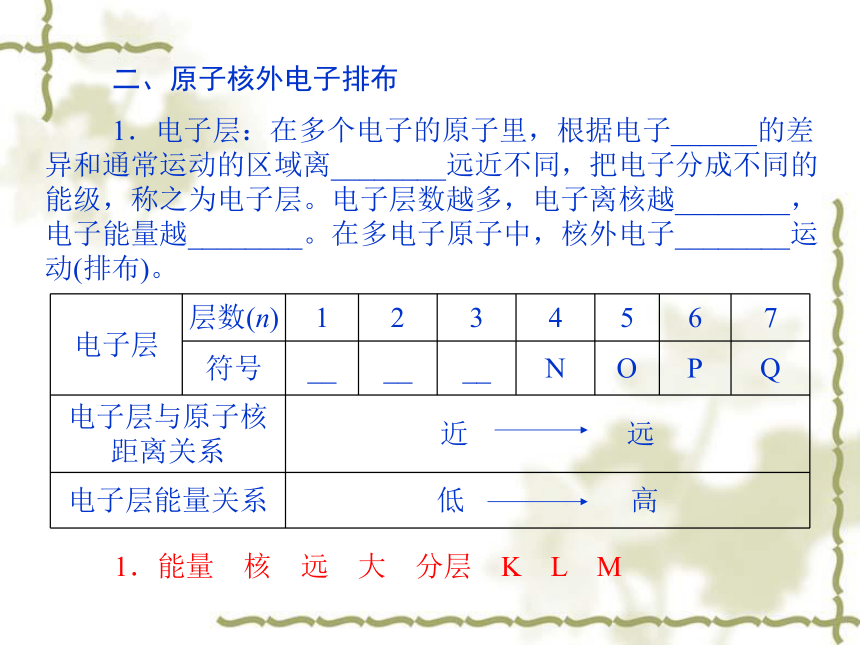
二、原子核外电子排布
1.电子层:在多个电子的原子里,根据电子______的差异和通常运动的区域离________远近不同,把电子分成不同的能级,称之为电子层。电子层数越多,电子离核越________,电子能量越________。在多电子原子中,核外电子________运动(排布)。
电子层 层数(n) 1 2 3 4 5 6 7
符号 __ __ __ N O P Q
电子层与原子核距离关系 近 远
电子层能量关系 低 高
1.能量 核 远 大 分层 K L M
2.原子核外电子排布规律
(1)能量最低原理。核外电子总是尽先排满能量________的电子层(离核越近,能量越低,电子运动状态越稳定)。
(2)每一层电子数最多不超过________。
(3)最外层电子数最多不超过________个,次外层电子数最多不超过________个,倒数第三层不超过________个(电子层K层为最外层时不超过2个电子)。
2.(1)最低 (2)2n2 (3)8 18 32
易错提示:1.核外电子的排布规律中的各项是相互联系的,不能孤立地理解,电子总是先排布在能量较低的电子层里,再逐渐排向能量较高的电子层。
2.最外电子层中排满8个电子(He除外),这种电子层结构为相对稳定结构,其他的电子层结构为相对不稳定结构。
3.金属阳离子一般比同种元素原子少一个电子层。
4.非金属阴离子与同种元素原子电子层相同,一般最外层为8个电子。
三、化学键
1.化学键
(1)定义:相邻________间的________相互作用称为化学键。
注意:①定义中的“原子”是广义上的原子,既包括中性原子,也包括带电原子或原子团(即离子)。
②相互作用,指电子与质子、电子与电子、质子与质子间电性相互吸引和相互排斥作用,处于相对平衡状态。
③强烈程度,相互作用力一般在200 kJ·mol-1以上。
④分子构成的物质中,在分子与分子之间的一定距离范围内存在一种弱相互作用,这种弱相互作用不是化学键,是分子间作用力(范德华力)一般在30 kJ·mol-1左右,主要影响物质的物理性质(如熔沸点)。
原子 强烈
2.化学键的类型
离子键、共价键比较
类型 离子键 共价键
定义 阴、阳离子之间通过
________作用形成的化学键 原子间通过____电子对形成的化学键。同种原子形成的共价键是____键,不同种原子形成的共价键是____键。
成键
粒子 ____、____离子 ________元素的原子
形成
条件 一般在金属元素原子和活泼非金属元素原子相互作用时产生 非金属元素的原子之间相互作用时产生
存在
实例 如:NaOH、NaHCO3、 NH4NO3、Na2O2、CaO等 如:H2、SO3、H2O2、NH3、H2SO4、 等
2.静电 共用 非极性 极性 阴 阳 非金属
特别提示:1.只含离子键的物质主要存在于非含氧酸盐、活泼金属氧化物中。如:NaCl、CaCl2、Na2O等中均只含离子键。
2.只含共价键的物质主要存在于由非金属元素形成的非金属单质、气态氢化物、非金属氧化物、酸、酸根、氢氧根、有机物分子等中。如:H2、C60、金刚石、晶体硅、HCl、SO2、HNO3、 、OH-、CH4等中均含有共价键。
3.既含有离子键又含有共价键的物质主要存在于含氧酸盐、铵盐、氢氧化物、金属过氧化物、有机酸盐等中。如:Na2SO4、KNO3、NH4Cl、NaOH、Ca(OH)2、Na2O2、CH3COONa等中既含有离子键又含有共价键。
4.稀有气体分子中不含化学键。如He、Ne、Ar等均不含化学键。
组成原子微粒关系
(2010年江苏省普通高中学业水平测试)下列ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是( )
A.20Ne和22Ne互为同位素
B.20Ne和22Ne互为同分异构体
C.20Ne和22Ne的质量数相同
D.20Ne和22Ne的中子数相同
解析:20Ne和22Ne元素符号相同,质子数相同,质量数不同,两者互为同位素。同位素原子的中子数不同,质量数不同。
答案:A
特别链接:同位素的性质:
1.天然存在的某种元素中,各种核素原子个数百分含量(丰度)一般是不变的。
2.同一元素的不同核素原子(或离子)化学性质几乎完全相同,物理性质有差异。如 、 、 的化学性质相同,但原子质量不同。
(2011年江苏省姜堰中学学业水平测试模拟)据报道,某些建筑材料会产生放射性同位素氡 ,从而对人体产生伤害。该同位素原子的中子数与质子数之差是( )
A.136 B.50 C.86 D.222
解析: 中子数=222-86=136,质子数=86;故
中子数与质子数之差=136-86=50;正确选项为B。
答案:B
原子核外电子排布
R元素的原子,其次外层的电子数为最外层电子数的2倍,则R是( )
A.Li B.Be C.Si D.S
解析:根据各原子核外电子排布情况分析,容易知答案为A、C。
答案:AC
某微粒的核外电子的数目分别为:K层2个,L层8个,M层8个,该微粒可能是( )
A.氢原子 B.钾离子
C.氯离子 D.无法确定
解析:具有18个电子电子的微粒可能是K+、Cl-等,故答案为B、C。
答案:BC
化学键
(2011年江苏省姜堰中学高二化学学业水平测试模拟)下列物质中,只含有共价键的化合物是( )
A.氢氧化钠 B.氯化钠
C.氢气 D.硫化氢
解析:氢氧化钠中含有共价键、离子键,故A错;氯化钠中只有离子键,故B错;氢气是只有共价键的单质,故C错;故本题正确选项为D。
答案:D
(2010年广东省惠州市学业水平模拟)下列物质既含有离子键又含有共价键的是( )
A.MgCl2 B.Ca(OH)2
C.CO2 D.CH2=CH2
解析:A是只有离子键;C、D中只有共价键;答案显然为B。
答案:B
一、单项选择
1.(2010年山东学业水平测试)19世纪中叶,门捷列夫的突出贡献是( )
A.提出原子学说 B.发现元素周期律
C.提出分子学说 D.发现氧气
解析:19世纪中叶,门捷列夫发现元素周期律,并绘制出第一张元素周期表。
答案:B
2.下列粒子的结构示意图中,表示硫原子的是( )
解析:根据核外电子排布规律判断。硫的原子序数是16,核内有16个质子,核外有16个电子。
答案:C
3.(2011年广东学业水平测试)碘-131是碘元素的一种放射性核素。下列关于I的说法正确的是( )
A.质量数为131 B.质子数为78
C.核外电子数为78 D.中子数为53
解析: 的质量数为131;质子数为53;核外电子数为53;中子数为78;故答案选A。
答案:A
4.(2011年江苏省新海高级中学业水平测试)Ce是地壳中含量最高的稀土金属铈元素,下列关于Ce的说法错误的是( )
A.质量数为198 B.中子数为82
C.质子数为58 D.核外电子数为58
解析: 的质量数为140,故A错;其它选项明显正确。
答案:A
5.(2011年汕头市学业水平测试模拟)下列具有相同电子层数的一组原子是( )
A.H、He、Li B.Li、Na、K
C.Na、Si、Ar D.O、S、Cl
解析:Na、Si、Ar都有三个电子层,其它选项明显不合题意,故答案为C。
答案:C
6.下列表示物质结构的化学用语或模型正确的是( )
A.8个中子的碳原子的核素符号:
B.HF的电子式:
C.Cl-离子的结构示意图:
D.CH4分子的比例模型:
解析:8个中子的碳原子的核素符号: ,HF是共
价化合物,其电子式为 ,Cl的原子序数为17,Cl-离
的结构示意图为: 。
答案:D
7.(2011年江苏省新海高级中学业水平测试)从某微粒的原子结构示意图反映出( )
A.质子数和中子数
B.中子数和电子数
C.核电荷数和核外电子层排布的电子数
D.质量数和核外电子层排布的电子数
解析:从某微粒的原子结构示意图反映出核电荷数和核外电子层排布的电子数,但没有办法知中子数、质量数,故只有C符合题意。
答案:C
8.(2010年广东省金山中学学业水平模拟)据报道我国最近合成新的同位素,其中一种是 (铪),它的质子数是( )
A.72 B.113 C.185 D.257·
解析:掌握元素符号各个方位数据表达的含义。
答案:A
二、多项选择(在每小题列出的四个选项中,至少有2个选项是正确的)
16.下列各组中不属于同位素关系的是( )
解析: 与 质量数相同; T2O是化合物超重水分子;金刚石与石墨互为同素异形体; 与 互为同位素。
答案:ABD
17.(2011广东罗定市学业水平测试模拟改编)Se是人体必需微量元素,下列关于 说法正确的是( )
解析:本题根据相关概念容易知答案为B、C。
答案:BC
第十一讲 物质结构
1.了解元素、同位素的含义。
2.了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.了解原子核外电子排布。
4.了解化学键的定义。了解离子键、共价键的形成。
一、原子组成
1.元素、核素、同位素
(1)元素:是具有相同________的一类原子的总称。
(2)核素:是具有一定数目________和一定数目________的一种原子。一种元素有________核素。
如:氢元素的三种核素: (氕)、 (氘)、 (氚)的质子数相同,中子数不同,它们是三种不同原子,属于同一种元素,即氢元素。
1.(1)质子数 (2)质子 中子 多种
(3)同位素:同一元素的不同________(原子)间互称同位素。同位素的共同特征是:________相等,________不相等,在周期表中位置________。如:H 、H 、H互为同位素。
(4)核素、同位素、元素之间的关系如图所示:
(3)核素 质子数 中子数 相同
2.原子结构与原子内粒子相互关系
(1)关系图
(2)各个物理量之间的关系
①原子核电荷数(Z)=核内______(Z)= 核外________ = 原子序数
②质量数(A)= ________(Z)+ ________(N)
③阴离子( n-)核外电子数=______(Z)+______(n)
④阳离子( n+)核外电子数=______(Z)-正电荷数(n)
2.(1)A-Z (2)①质子数 电子数 ②质子数 中子数 ③质子数 负电荷数 ④质子数
特别提示:1.质子的数目决定元素的种类。
2.中子的数目决定元素的原子种类,影响原子质量。
3.核外电子分层排布,元素化学性质主要由最外层电子数决定。
4.质子和中子相对质量约为1,原子的相对质量整数值近似等于质量数A。
5.(1)同位素属于同一种元素,但不是同种原子。例如, 、 (D)、 (T)是三种不同的原子,但都是氢元素。
(2)同位素的质子数都相同,原子核外电子层结构相同,化学性质基本相同。
(3)大多数元素都有同位素,所以原子的种类数要比元素的种类数多得多。
二、原子核外电子排布
1.电子层:在多个电子的原子里,根据电子______的差异和通常运动的区域离________远近不同,把电子分成不同的能级,称之为电子层。电子层数越多,电子离核越________,电子能量越________。在多电子原子中,核外电子________运动(排布)。
电子层 层数(n) 1 2 3 4 5 6 7
符号 __ __ __ N O P Q
电子层与原子核距离关系 近 远
电子层能量关系 低 高
1.能量 核 远 大 分层 K L M
2.原子核外电子排布规律
(1)能量最低原理。核外电子总是尽先排满能量________的电子层(离核越近,能量越低,电子运动状态越稳定)。
(2)每一层电子数最多不超过________。
(3)最外层电子数最多不超过________个,次外层电子数最多不超过________个,倒数第三层不超过________个(电子层K层为最外层时不超过2个电子)。
2.(1)最低 (2)2n2 (3)8 18 32
易错提示:1.核外电子的排布规律中的各项是相互联系的,不能孤立地理解,电子总是先排布在能量较低的电子层里,再逐渐排向能量较高的电子层。
2.最外电子层中排满8个电子(He除外),这种电子层结构为相对稳定结构,其他的电子层结构为相对不稳定结构。
3.金属阳离子一般比同种元素原子少一个电子层。
4.非金属阴离子与同种元素原子电子层相同,一般最外层为8个电子。
三、化学键
1.化学键
(1)定义:相邻________间的________相互作用称为化学键。
注意:①定义中的“原子”是广义上的原子,既包括中性原子,也包括带电原子或原子团(即离子)。
②相互作用,指电子与质子、电子与电子、质子与质子间电性相互吸引和相互排斥作用,处于相对平衡状态。
③强烈程度,相互作用力一般在200 kJ·mol-1以上。
④分子构成的物质中,在分子与分子之间的一定距离范围内存在一种弱相互作用,这种弱相互作用不是化学键,是分子间作用力(范德华力)一般在30 kJ·mol-1左右,主要影响物质的物理性质(如熔沸点)。
原子 强烈
2.化学键的类型
离子键、共价键比较
类型 离子键 共价键
定义 阴、阳离子之间通过
________作用形成的化学键 原子间通过____电子对形成的化学键。同种原子形成的共价键是____键,不同种原子形成的共价键是____键。
成键
粒子 ____、____离子 ________元素的原子
形成
条件 一般在金属元素原子和活泼非金属元素原子相互作用时产生 非金属元素的原子之间相互作用时产生
存在
实例 如:NaOH、NaHCO3、 NH4NO3、Na2O2、CaO等 如:H2、SO3、H2O2、NH3、H2SO4、 等
2.静电 共用 非极性 极性 阴 阳 非金属
特别提示:1.只含离子键的物质主要存在于非含氧酸盐、活泼金属氧化物中。如:NaCl、CaCl2、Na2O等中均只含离子键。
2.只含共价键的物质主要存在于由非金属元素形成的非金属单质、气态氢化物、非金属氧化物、酸、酸根、氢氧根、有机物分子等中。如:H2、C60、金刚石、晶体硅、HCl、SO2、HNO3、 、OH-、CH4等中均含有共价键。
3.既含有离子键又含有共价键的物质主要存在于含氧酸盐、铵盐、氢氧化物、金属过氧化物、有机酸盐等中。如:Na2SO4、KNO3、NH4Cl、NaOH、Ca(OH)2、Na2O2、CH3COONa等中既含有离子键又含有共价键。
4.稀有气体分子中不含化学键。如He、Ne、Ar等均不含化学键。
组成原子微粒关系
(2010年江苏省普通高中学业水平测试)下列ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是( )
A.20Ne和22Ne互为同位素
B.20Ne和22Ne互为同分异构体
C.20Ne和22Ne的质量数相同
D.20Ne和22Ne的中子数相同
解析:20Ne和22Ne元素符号相同,质子数相同,质量数不同,两者互为同位素。同位素原子的中子数不同,质量数不同。
答案:A
特别链接:同位素的性质:
1.天然存在的某种元素中,各种核素原子个数百分含量(丰度)一般是不变的。
2.同一元素的不同核素原子(或离子)化学性质几乎完全相同,物理性质有差异。如 、 、 的化学性质相同,但原子质量不同。
(2011年江苏省姜堰中学学业水平测试模拟)据报道,某些建筑材料会产生放射性同位素氡 ,从而对人体产生伤害。该同位素原子的中子数与质子数之差是( )
A.136 B.50 C.86 D.222
解析: 中子数=222-86=136,质子数=86;故
中子数与质子数之差=136-86=50;正确选项为B。
答案:B
原子核外电子排布
R元素的原子,其次外层的电子数为最外层电子数的2倍,则R是( )
A.Li B.Be C.Si D.S
解析:根据各原子核外电子排布情况分析,容易知答案为A、C。
答案:AC
某微粒的核外电子的数目分别为:K层2个,L层8个,M层8个,该微粒可能是( )
A.氢原子 B.钾离子
C.氯离子 D.无法确定
解析:具有18个电子电子的微粒可能是K+、Cl-等,故答案为B、C。
答案:BC
化学键
(2011年江苏省姜堰中学高二化学学业水平测试模拟)下列物质中,只含有共价键的化合物是( )
A.氢氧化钠 B.氯化钠
C.氢气 D.硫化氢
解析:氢氧化钠中含有共价键、离子键,故A错;氯化钠中只有离子键,故B错;氢气是只有共价键的单质,故C错;故本题正确选项为D。
答案:D
(2010年广东省惠州市学业水平模拟)下列物质既含有离子键又含有共价键的是( )
A.MgCl2 B.Ca(OH)2
C.CO2 D.CH2=CH2
解析:A是只有离子键;C、D中只有共价键;答案显然为B。
答案:B
一、单项选择
1.(2010年山东学业水平测试)19世纪中叶,门捷列夫的突出贡献是( )
A.提出原子学说 B.发现元素周期律
C.提出分子学说 D.发现氧气
解析:19世纪中叶,门捷列夫发现元素周期律,并绘制出第一张元素周期表。
答案:B
2.下列粒子的结构示意图中,表示硫原子的是( )
解析:根据核外电子排布规律判断。硫的原子序数是16,核内有16个质子,核外有16个电子。
答案:C
3.(2011年广东学业水平测试)碘-131是碘元素的一种放射性核素。下列关于I的说法正确的是( )
A.质量数为131 B.质子数为78
C.核外电子数为78 D.中子数为53
解析: 的质量数为131;质子数为53;核外电子数为53;中子数为78;故答案选A。
答案:A
4.(2011年江苏省新海高级中学业水平测试)Ce是地壳中含量最高的稀土金属铈元素,下列关于Ce的说法错误的是( )
A.质量数为198 B.中子数为82
C.质子数为58 D.核外电子数为58
解析: 的质量数为140,故A错;其它选项明显正确。
答案:A
5.(2011年汕头市学业水平测试模拟)下列具有相同电子层数的一组原子是( )
A.H、He、Li B.Li、Na、K
C.Na、Si、Ar D.O、S、Cl
解析:Na、Si、Ar都有三个电子层,其它选项明显不合题意,故答案为C。
答案:C
6.下列表示物质结构的化学用语或模型正确的是( )
A.8个中子的碳原子的核素符号:
B.HF的电子式:
C.Cl-离子的结构示意图:
D.CH4分子的比例模型:
解析:8个中子的碳原子的核素符号: ,HF是共
价化合物,其电子式为 ,Cl的原子序数为17,Cl-离
的结构示意图为: 。
答案:D
7.(2011年江苏省新海高级中学业水平测试)从某微粒的原子结构示意图反映出( )
A.质子数和中子数
B.中子数和电子数
C.核电荷数和核外电子层排布的电子数
D.质量数和核外电子层排布的电子数
解析:从某微粒的原子结构示意图反映出核电荷数和核外电子层排布的电子数,但没有办法知中子数、质量数,故只有C符合题意。
答案:C
8.(2010年广东省金山中学学业水平模拟)据报道我国最近合成新的同位素,其中一种是 (铪),它的质子数是( )
A.72 B.113 C.185 D.257·
解析:掌握元素符号各个方位数据表达的含义。
答案:A
二、多项选择(在每小题列出的四个选项中,至少有2个选项是正确的)
16.下列各组中不属于同位素关系的是( )
解析: 与 质量数相同; T2O是化合物超重水分子;金刚石与石墨互为同素异形体; 与 互为同位素。
答案:ABD
17.(2011广东罗定市学业水平测试模拟改编)Se是人体必需微量元素,下列关于 说法正确的是( )
解析:本题根据相关概念容易知答案为B、C。
答案:BC
同课章节目录
