2012年高中化学学业水平测试课件:第12讲 元素周期律和元素周期表
文档属性
| 名称 | 2012年高中化学学业水平测试课件:第12讲 元素周期律和元素周期表 |

|
|
| 格式 | rar | ||
| 文件大小 | 169.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | |||
| 科目 | 化学 | ||
| 更新时间 | 2011-10-03 00:00:00 | ||
图片预览








文档简介
(共22张PPT)
第十二讲 元素周期律和元素周期表
1.了解元素周期表(长式)的结构(周期、族)。
2.了解元素周期律的实质。以第3周期为例,了解同一周期内元素性质的递变规律与原子结构的关系。
3.以IA和ⅦA族为例,了解同一主族内元素性质递变规律与原子结构的关系。
4.了解金属、非金属在元素周期表中的位置及其性质递变的规律。
一、元素周期表
1.元素周期表的结构
元素周期表
2.原子结构与周期表关系
(1)电子层数=________数
(2)主族元素最外层电子数=________序数
特别提示:1.H核外电子数=最外层电子数=电子层数=周期数。
2.阳离子的电子层数比相应元素的周期数小1,阴离子的电子层数等于相应元素的周期数。
3.最外层电子数等于次外层电子数的微粒有Be、Ar、K+、Ca2+、P3-、S2-、Cl-、Si4-。
族
周期
二、元素周期律
1.含义:元素性质与结构随着元素的原子序数的递增而呈周期性变化,其实质是元素的原子核外________周期性变化。体现了元素性质与结构从________变到________变的规律。
2.主要体现形式
(1)核外电子排布:K层为最外层时电子数由1个递增至2个,其他电子层为最外层时电子数由1个递增至______个。
(2)主族原子半径(r)
①同周期从左至右原子的核电荷数越________,半径越________。如:rNa>rMg>rAl>rSi>rp>rs>rCl。
②同族:从上至下原子核电荷数越________,电子层数越多,原子半径越________。如:rLi<rNa<rK<rRb<rCs。
1.电子排布 量 质
2.(1)8 (2)①多 小 ②多 大
(3)主族元素化合价
①正价:同周期从左至右最高正价由________价递变到________价。一般是最高正价数=________电子数=族数。
②负价:从________价递变至________价(稀有气体元素化合价一般为零)。
(4)元素的性质
①同周期:从左至右金属性______,非金属性________。
②同主族:从上至下金属性______,非金属性________。
特别提示:1.F无正价;O最高正价只有+2价(OF2)。
2.金属元素只有零价和正价,无负价。
3.ⅠA、ⅡA、ⅢA族的金属元素无变价。
4.有金属元素组成的离子可能是阴离子,例如: 、
等。
(3)①+1 +7 最外层 ②-4 -1
(4)①减弱 增强 ②增强 减弱
元素周期表
(2011年广东省潮州市学业水平测试模拟) 在周期表中,第三、四、五、六周期元素的数目分别是( )
A.8、18、32、32 B.8、18、18、32
C.8、18、18、18 D.8、8、18、18
解析:此题考查了核外电子的排布规律和元素周期表的结构,容易得到答案为B。
答案:B
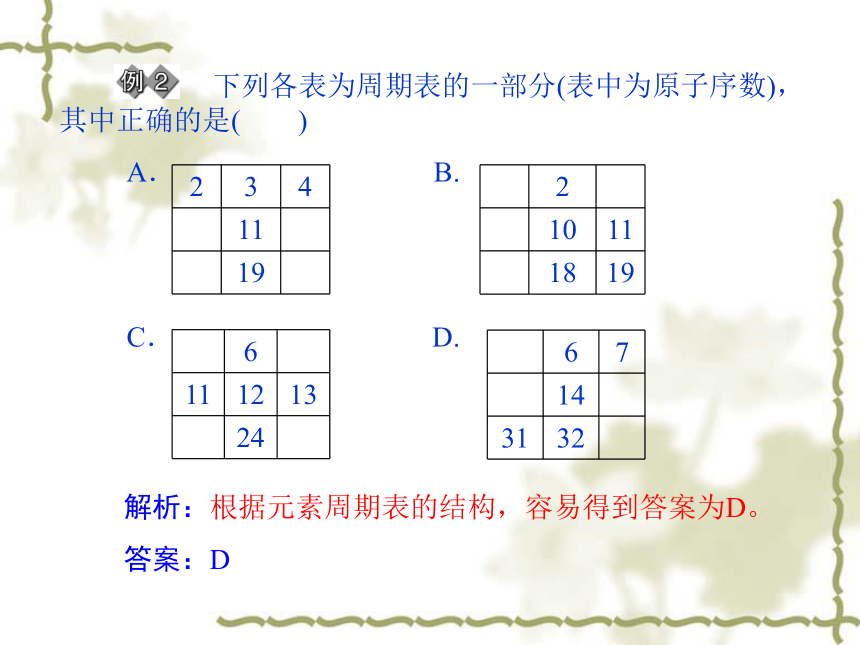
下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
A. B.
C. D.
2 3 4
11
19
2
10 11
18 19
6
11 12 13
24
6 7
14
31 32
解析:根据元素周期表的结构,容易得到答案为D。
答案:D
元素周期律
(2010年江苏省南京市学业水平模拟)同周期的X、Y、Z三种主族元素,其最高价氧化物对应的水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是( )
A.非金属性X>Y>Z
B.原子半径X>Y>Z
C.原子的最外层电子数按X、Y、Z的顺序由少到多
D.气态氢化物的稳定性按X、Y、Z的顺序由弱到强
解析:据三元素最高价氧化物对应水化物酸性强弱比较知,同周期Z、Y、X三种主族元素族序数递增,从左向右排列。据元素周期律知,非金属性X>Y>Z;原子半径Z>Y>X;原子的最外层电子数X>Y>Z;气态氢化物的稳定性X>Y>Z。
答案:A
元素周期表和元素周期律的应用
下列叙述正确的是( )
A.同周期元素的原子半径以ⅦA族的为最大
B.在周期表中零族元素的单质全部是气体
C.ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子
D.所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等
解析:同周期元素原子的半径从左到右依次减小,故A错;对于选项D,要审准题意,注意“原子形成单原子离子”,如氯原子形成的单原子离子只能是Cl-,故D错。
答案:BC
关于ⅠA族和ⅡA族元素的下列说法中正确的是( )
A.在同一周期中,ⅠA族单质的熔点比ⅡA族的高
B.浓度都是0.01 mol·L-1时,氢氧化钾溶液的pH比氢氧化钡的小
C.氧化钠的熔点比氧化镁的高
D.加热时,碳酸钠比碳酸镁易分解
解析:同周期的ⅠA族元素原子的原子半径比ⅡA族元素的大,价电子数少,故ⅠA族单质熔点应比ⅡA族单质低,A错。因Mg2+的半径小于Na+的半径,MgO中的离子键强于Na2O中的离子键,MgO的熔点高于Na2O,C错。难溶性的碳酸盐受热较易分解,D错;氢氧化钡为二元强碱,故B正确。
答案:B
一、单项选择
1.元素的性质随着原子序数的递增呈现周期性变化的根本原因是( )
A.元素相对原子质量的递增而引起的变化
B.元素的化合价呈周期性的变化
C.元素原子核外电子排布呈周期性的变化
D.元素的金属性和非金属性呈周期性变化
解析:元素的性质随着原子序数的递增呈现周期性变化的根本原因是元素原子核外电子排布呈周期性的变化,故选C。
答案:C
2.下列元素在周期表中是同一周期的是( )
A.C、O、Na、Al B.P、Cl、K、Ca
C.Ne、P、Cl、Ar D.Mg、S、P、Ar
解析:Mg、S、P、Ar都是第三周期元素。
答案:D
3.(2010广东省学业水平考试备考题)假设x是ⅡB族中元素的原子序数, 那么原子序数为x+1的元素是( )
A.ⅠB族 B.ⅢB族
C.ⅢA族 D.ⅡA族
解析:根据周期表的结构,可知ⅡB族的后一族是ⅢA族,故选C。
答案:C
4.下列数字表示元素的原子序数,其中包含金属、非金属、稀有气体元素各一种的是( )
A.3、16、20 B.2、4、18
C.11、15、18 D.9、10、17
解析:分别是11-Na;15-P;18-Ar。
答案:C
5.(2011年广东省深圳市学业水平测试模拟)下列原子中,核外电子层数与最外层电子数互不相等的是( )
A.H B.Be C.Mg D.Al
解析:Mg核外电子层数与最外层电子数分别为三、2,故答案为C。
答案:C
6.(2010年江西省学业水平模拟)短周期元素中,若两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子个数之比为1∶2,那么这些化合物共有( )
A.1种 B.2种 C.3种 D.4种
解析:符合题意的元素有H和Be、O和Na、F和Mg,它们形成化合物时原子个数之比为1∶2的有Na2O和MgF2。
答案:B
7.(2011年广东省汕头市金山中学学业水平测试)某元素原子的M层电子数是K层的2倍,该元素是( )
A.Mg B.C C.Si D.Ca
解析:Si原子的M层电子数是4,K层的电子数是2,故C符合题意。
答案:C
8.(2010年广东省惠州学业水平模拟)X元素的最高价氧化物的水化物的化学式为HXO4,则它对应的气态氢化物的化学式为( )
A.HX B.H2X C.XH3 D.XH4
解析:X元素的最高价氧化物的水化物的化学式为HXO4,知X元素的化合价为+7价,位于第ⅦA族,形成氢化物时化合价为-1价,即是HX。
答案:A
二、多项选择(在每小题列出的四个选项中,至少有2个选项是正确的)
16.(2010广东省学业水平考试备考题)下列元素中属于主族元素的是( )
A.铁 B.硫 C.氮 D.碘
解析:除了Fe为副族元素,其它均为主族元素,故B、C、D。
答案:BCD
17.以下元素之间结合可能形成共价化合物的是( )
A.原子序数是6和8的元素
B.原子序数是20和17
C.第ⅠA和ⅦA族的元素
D.第ⅢA和ⅦA族的元素
解析:C和O之间形成的化合物是共价化合物。第ⅠA族的H和ⅦA族元素形成共价化合物。第ⅢA的B是非金属元素和ⅦA族元素形成共价化合物。Ca和Cl结合只能生成CaCl2离子化合物。
答案:ACD
第十二讲 元素周期律和元素周期表
1.了解元素周期表(长式)的结构(周期、族)。
2.了解元素周期律的实质。以第3周期为例,了解同一周期内元素性质的递变规律与原子结构的关系。
3.以IA和ⅦA族为例,了解同一主族内元素性质递变规律与原子结构的关系。
4.了解金属、非金属在元素周期表中的位置及其性质递变的规律。
一、元素周期表
1.元素周期表的结构
元素周期表
2.原子结构与周期表关系
(1)电子层数=________数
(2)主族元素最外层电子数=________序数
特别提示:1.H核外电子数=最外层电子数=电子层数=周期数。
2.阳离子的电子层数比相应元素的周期数小1,阴离子的电子层数等于相应元素的周期数。
3.最外层电子数等于次外层电子数的微粒有Be、Ar、K+、Ca2+、P3-、S2-、Cl-、Si4-。
族
周期
二、元素周期律
1.含义:元素性质与结构随着元素的原子序数的递增而呈周期性变化,其实质是元素的原子核外________周期性变化。体现了元素性质与结构从________变到________变的规律。
2.主要体现形式
(1)核外电子排布:K层为最外层时电子数由1个递增至2个,其他电子层为最外层时电子数由1个递增至______个。
(2)主族原子半径(r)
①同周期从左至右原子的核电荷数越________,半径越________。如:rNa>rMg>rAl>rSi>rp>rs>rCl。
②同族:从上至下原子核电荷数越________,电子层数越多,原子半径越________。如:rLi<rNa<rK<rRb<rCs。
1.电子排布 量 质
2.(1)8 (2)①多 小 ②多 大
(3)主族元素化合价
①正价:同周期从左至右最高正价由________价递变到________价。一般是最高正价数=________电子数=族数。
②负价:从________价递变至________价(稀有气体元素化合价一般为零)。
(4)元素的性质
①同周期:从左至右金属性______,非金属性________。
②同主族:从上至下金属性______,非金属性________。
特别提示:1.F无正价;O最高正价只有+2价(OF2)。
2.金属元素只有零价和正价,无负价。
3.ⅠA、ⅡA、ⅢA族的金属元素无变价。
4.有金属元素组成的离子可能是阴离子,例如: 、
等。
(3)①+1 +7 最外层 ②-4 -1
(4)①减弱 增强 ②增强 减弱
元素周期表
(2011年广东省潮州市学业水平测试模拟) 在周期表中,第三、四、五、六周期元素的数目分别是( )
A.8、18、32、32 B.8、18、18、32
C.8、18、18、18 D.8、8、18、18
解析:此题考查了核外电子的排布规律和元素周期表的结构,容易得到答案为B。
答案:B
下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
A. B.
C. D.
2 3 4
11
19
2
10 11
18 19
6
11 12 13
24
6 7
14
31 32
解析:根据元素周期表的结构,容易得到答案为D。
答案:D
元素周期律
(2010年江苏省南京市学业水平模拟)同周期的X、Y、Z三种主族元素,其最高价氧化物对应的水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是( )
A.非金属性X>Y>Z
B.原子半径X>Y>Z
C.原子的最外层电子数按X、Y、Z的顺序由少到多
D.气态氢化物的稳定性按X、Y、Z的顺序由弱到强
解析:据三元素最高价氧化物对应水化物酸性强弱比较知,同周期Z、Y、X三种主族元素族序数递增,从左向右排列。据元素周期律知,非金属性X>Y>Z;原子半径Z>Y>X;原子的最外层电子数X>Y>Z;气态氢化物的稳定性X>Y>Z。
答案:A
元素周期表和元素周期律的应用
下列叙述正确的是( )
A.同周期元素的原子半径以ⅦA族的为最大
B.在周期表中零族元素的单质全部是气体
C.ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子
D.所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等
解析:同周期元素原子的半径从左到右依次减小,故A错;对于选项D,要审准题意,注意“原子形成单原子离子”,如氯原子形成的单原子离子只能是Cl-,故D错。
答案:BC
关于ⅠA族和ⅡA族元素的下列说法中正确的是( )
A.在同一周期中,ⅠA族单质的熔点比ⅡA族的高
B.浓度都是0.01 mol·L-1时,氢氧化钾溶液的pH比氢氧化钡的小
C.氧化钠的熔点比氧化镁的高
D.加热时,碳酸钠比碳酸镁易分解
解析:同周期的ⅠA族元素原子的原子半径比ⅡA族元素的大,价电子数少,故ⅠA族单质熔点应比ⅡA族单质低,A错。因Mg2+的半径小于Na+的半径,MgO中的离子键强于Na2O中的离子键,MgO的熔点高于Na2O,C错。难溶性的碳酸盐受热较易分解,D错;氢氧化钡为二元强碱,故B正确。
答案:B
一、单项选择
1.元素的性质随着原子序数的递增呈现周期性变化的根本原因是( )
A.元素相对原子质量的递增而引起的变化
B.元素的化合价呈周期性的变化
C.元素原子核外电子排布呈周期性的变化
D.元素的金属性和非金属性呈周期性变化
解析:元素的性质随着原子序数的递增呈现周期性变化的根本原因是元素原子核外电子排布呈周期性的变化,故选C。
答案:C
2.下列元素在周期表中是同一周期的是( )
A.C、O、Na、Al B.P、Cl、K、Ca
C.Ne、P、Cl、Ar D.Mg、S、P、Ar
解析:Mg、S、P、Ar都是第三周期元素。
答案:D
3.(2010广东省学业水平考试备考题)假设x是ⅡB族中元素的原子序数, 那么原子序数为x+1的元素是( )
A.ⅠB族 B.ⅢB族
C.ⅢA族 D.ⅡA族
解析:根据周期表的结构,可知ⅡB族的后一族是ⅢA族,故选C。
答案:C
4.下列数字表示元素的原子序数,其中包含金属、非金属、稀有气体元素各一种的是( )
A.3、16、20 B.2、4、18
C.11、15、18 D.9、10、17
解析:分别是11-Na;15-P;18-Ar。
答案:C
5.(2011年广东省深圳市学业水平测试模拟)下列原子中,核外电子层数与最外层电子数互不相等的是( )
A.H B.Be C.Mg D.Al
解析:Mg核外电子层数与最外层电子数分别为三、2,故答案为C。
答案:C
6.(2010年江西省学业水平模拟)短周期元素中,若两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子个数之比为1∶2,那么这些化合物共有( )
A.1种 B.2种 C.3种 D.4种
解析:符合题意的元素有H和Be、O和Na、F和Mg,它们形成化合物时原子个数之比为1∶2的有Na2O和MgF2。
答案:B
7.(2011年广东省汕头市金山中学学业水平测试)某元素原子的M层电子数是K层的2倍,该元素是( )
A.Mg B.C C.Si D.Ca
解析:Si原子的M层电子数是4,K层的电子数是2,故C符合题意。
答案:C
8.(2010年广东省惠州学业水平模拟)X元素的最高价氧化物的水化物的化学式为HXO4,则它对应的气态氢化物的化学式为( )
A.HX B.H2X C.XH3 D.XH4
解析:X元素的最高价氧化物的水化物的化学式为HXO4,知X元素的化合价为+7价,位于第ⅦA族,形成氢化物时化合价为-1价,即是HX。
答案:A
二、多项选择(在每小题列出的四个选项中,至少有2个选项是正确的)
16.(2010广东省学业水平考试备考题)下列元素中属于主族元素的是( )
A.铁 B.硫 C.氮 D.碘
解析:除了Fe为副族元素,其它均为主族元素,故B、C、D。
答案:BCD
17.以下元素之间结合可能形成共价化合物的是( )
A.原子序数是6和8的元素
B.原子序数是20和17
C.第ⅠA和ⅦA族的元素
D.第ⅢA和ⅦA族的元素
解析:C和O之间形成的化合物是共价化合物。第ⅠA族的H和ⅦA族元素形成共价化合物。第ⅢA的B是非金属元素和ⅦA族元素形成共价化合物。Ca和Cl结合只能生成CaCl2离子化合物。
答案:ACD
同课章节目录
