2012年高中化学学业水平测试课件:第九讲 非金属元素(一) 氢、氧、碳、硅
文档属性
| 名称 | 2012年高中化学学业水平测试课件:第九讲 非金属元素(一) 氢、氧、碳、硅 |

|
|
| 格式 | rar | ||
| 文件大小 | 131.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | |||
| 科目 | 化学 | ||
| 更新时间 | 2011-10-03 00:00:00 | ||
图片预览








文档简介
(共29张PPT)
第八讲 非金属元素(二)氢、氧、碳、硅
1.了解常见氢单质及其重要化合物的主要性质,了解其应用。
2.了解常见氧单质及其重要化合物的主要性质,了解其应用。
3.了解常见碳单质及其重要化合物的主要性质,了解其应用和对环境质量的影响。
4.了解常见硅单质及其重要化合物的主要性质,了解其应用和对环境质量的影响。
一、氢单质
1.氢的存在与性质
(1)存在:宇宙中,氢是最丰富的元素。地球上氢主要以________态存在于________和________中。氢主要有三种核素:H(氕)、H(D、氘)、H(T、氚)。
(2)物理性质:氢在通常条件下为无色无味、不溶于水,稍溶于有机溶剂的气体。
(3)化学通性:在常温下,氢比较不活泼,但在________下,氢是非常活泼的。除稀有气体元素外,几乎所有的元素都能与氢生成化合物。非金属元素的氢化物通常称为某化氢,如氯化氢、硫化氢等。
1.(1)化合 水 有机物 (3)高温
2.有H2参加或生成的主要反应
(1)氢气在加热或高温条件下 (点燃或使用催化剂) 参与反应,是很好的还原剂。如:
N2+3H2 ________________。
H2+S ________________。
(2)卤族单质(X2)在不同条件下与H2反应生成HX:
H2+X2=2HX(X:F、Cl、Br、I)
(3)氢化物受热分解如: 2HI ________________;
H2S ________________________。
高温、高压
催化剂
2.(1)2NH3 H2S (3)I2+H2 S+H2
(4)常见产生H2的主要反应
①铝、锌、镁、铁等金属与非氧化性酸反应。
②铝与氢氧化钠溶液反应。
③钠、镁、铝、铁等金属在一定的温度下与水反应 。
④电解水:2H2O ______________________。
注意:①②适用于实验室等少量氢气的制取;④是未来清洁能源来源。
2H2↑+O2↑
二、氧和水
1.有O2参加或生成的反应
(1)非金属与O2反应生成非金属氧化物, 卤族单质(X2) __________O2直接反应, 硫与氧气反应只生成________,氮与氧气放电条件下反应生成________。
(2)氧气的实验室制备反应:氯酸钾热分解(二氧化锰催化):2KClO3 ________;高锰酸钾加热分解:2KMnO4 ___________________。
(3)常见产生O2的分解反应
过氧化氢分解(二氧化锰催化):
2H2O2 ____________________________。
1.(1)不与 SO2 NO (2)2KCl+3O2↑ K2MnO4+MnO2+O2↑ (3)①2H2O+O2↑
2.有关水的反应
(1)水在氧化还原反应中的作用
①水作氧化剂,如:水与碳在高温下反应
C+H2O ________。
②水作还原剂,如:2F2+2H2O=_________________。
③水既作氧化剂又作还原剂:2H2O ___________。
④水既不作氧化剂也不作还原剂。如:
Cl2+H2O=_____________________________。
3NO2+H2O=_____________________________。
(2)水参与的非氧化还原反应:水与二氧化硫、三氧化硫、二氧化碳等酸性氧化物化合成酸,但不能与二氧化硅化合。
2.(1)①CO+H2 ②4HF+O2 ③2H2↑+O2↑
④HCl+HClO 2HNO3+NO
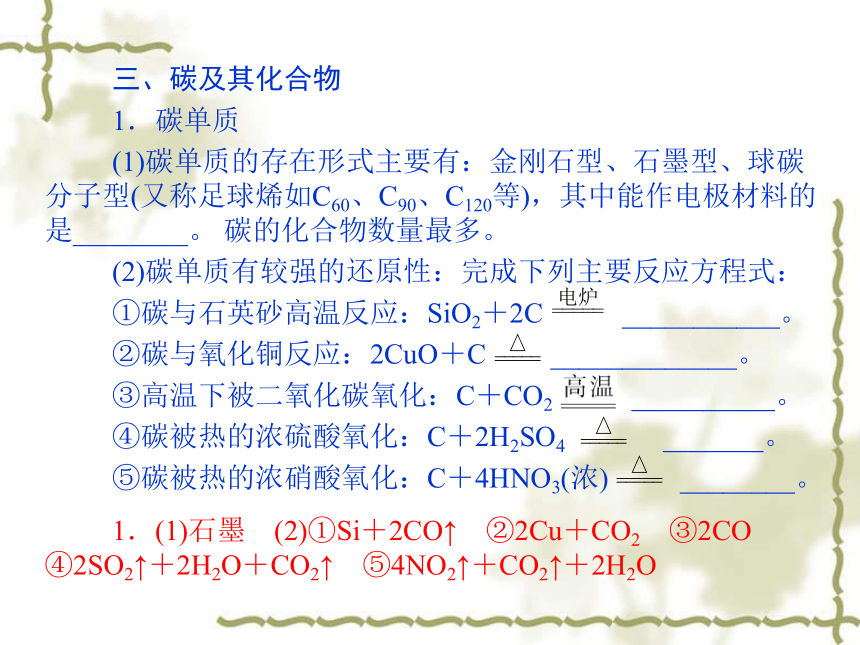
三、碳及其化合物
1.碳单质
(1)碳单质的存在形式主要有:金刚石型、石墨型、球碳分子型(又称足球烯如C60、C90、C120等),其中能作电极材料的是________。 碳的化合物数量最多。
(2)碳单质有较强的还原性:完成下列主要反应方程式:
①碳与石英砂高温反应:SiO2+2C ___________。
②碳与氧化铜反应:2CuO+C _____________。
③高温下被二氧化碳氧化:C+CO2 __________。
④碳被热的浓硫酸氧化:C+2H2SO4 _______。
⑤碳被热的浓硝酸氧化:C+4HNO3(浓) ________。
1.(1)石墨 (2)①Si+2CO↑ ②2Cu+CO2 ③2CO ④2SO2↑+2H2O+CO2↑ ⑤4NO2↑+CO2↑+2H2O
2.CO2、CO比较
CO CO2
物理
性质 1.无色无味有毒
2.不溶于水
3.比空气略轻 1.无色无味
2.溶于水(常温1∶1)
3.比空气重
化学
性质 1.强还原性
2.不与碱反应 1.弱氧化性
2.与碱反应
鉴别 燃烧产物使澄清石灰水变浑浊 使澄清________变浑浊
主要
用途 冶金工业作________剂、燃料 化工原料、灭火、饮料添加剂、人工降雨
2.石灰水 还原
3.碳酸盐
(1)常见碳酸盐俗称与主要化学成分:石灰石、蛋壳、贝壳、钟乳石—________;纯碱、苏打—________ ;小苏打—________;碳铵—________(氮肥);草木灰的主要成分—______;暂时硬水的主要成分—__________和__________ ;锅垢的主要成分—________和_________。
(2)碳酸氢钠与碳酸钠性质比较
①都能与盐酸等反应生成二氧化碳,在反应时耗酸量及生成气体反应速率________。
②两种盐均能与石灰水或氢氧化钡溶液生成______沉淀。
3.(1)CaCO3 Na2CO3 NaHCO3 NH4HCO3 K2CO3 Ca(HCO3)2 Mg(HCO3)2 CaCO3 Mg(OH)2
(2)①不同 ②白色
③碳酸氢钠能跟氢氧化钠等碱反应,碳酸钠________与NaOH反应。
④碳酸钠跟氯化钙或氯化钡溶液反应生成碳酸盐______沉淀,碳酸氢钠跟氯化钙或氯化钡溶液________反应。
(3)碳酸及其盐稳定性规律: 酸<酸式盐<正盐,如: H2CO3(4)碳酸盐溶解度规律:一般条件下:酸式盐>正盐,如:Ca(HCO3)2>CaCO3;特例:NaHCO3③不 ④白色 不
特别提示:1.自然现象中石灰岩洞和钟乳石形成、岩石的风化主要是碳酸钙转化为碳酸氢钙,石笋形成是碳酸氢钙转化为碳酸钙。
2.相同条件下酸与碳酸钠反应的反应速率比酸与碳酸氢钠的反应速率小。
3.除去碳酸氢钠溶液中的碳酸钠通CO2。
4.除去碳酸钠中碳酸氢钠杂质时,固体加热,溶液加NaOH。
5.除去二氧化碳中的氯化氢用饱和碳酸氢钠溶液,不用碳酸钠溶液。
四、硅及其化合物
1.硅单质
(1)晶体硅是有金属光泽的灰黑色固体,________材料。常温________酸碱反应(氢氟酸例外),加热时能被氧化剂氧化。
(2)硅单质的制备主要反应:SiO2+2C _______ (高温隔绝氧气)。
2.SiO2:是无色晶体,难溶于水,属于________氧化物,用于制光导纤维、玻璃仪器、玻璃原料、建筑材料等。
3.H2SiO3(硅酸)、H4SiO4(原硅酸):均难溶于水,H4SiO4易失水生成H2SiO3,它们受热脱水生成硅胶(SiO2)用作________剂和催化剂载体。
1.(1)半导体 不与 (2)Si+2CO↑ 2.酸性 3.干燥
4.Na2SiO3的水溶液是无色黏稠碱性液体,俗称“水玻璃”,主要用途可作肥皂填料、耐火材料和建筑材料的________剂等。
特别提示:1.电子元件、光电池、芯片等主要成分是Si。
2.水晶石、水晶玻璃、石英砂、石英玻璃、硅藻土、玛瑙与光导纤维等主要成分是SiO2 。
5.硅酸盐及其工业
①性质特征:性质__________,熔点__________,大都__________溶于水。
②主要原料:黏土(Al2O3·2SiO2·2H2O)、石英(SiO2)和长石(钾长石(KAlSi3O8)K2O·Al2O3·6SiO2或钠长石Na2O·Al2O3·6SiO2、高岭土[Al2Si2O5(OH)4] Al2O3·2SiO2·2H2O)。
③主要制品:玻璃、水泥、陶瓷、砖瓦、水玻璃(Na2SiO3的水溶液)等。
4.防腐 5.①稳定 较高 难
④水泥和玻璃的生产:
水泥 玻璃(普通)
原料 __________ __________
设备 水泥回转窑 玻璃熔炉
反应 复杂的物理化学变化 Na2CO3+SiO2Na2SiO3+CO2↑
CaCO3+SiO2CaSiO3+CO2↑
主要
成分 __________ __________
特性 水硬性
(加石膏调节硬化速度) 玻璃态物质(在一定温度范围内软化)非晶体
注意:硅在地壳中的含量排第二位,仅次于氧元素。
④石灰石、粘土 纯碱、石灰石、石英 3CaO·SiO2、2CaO· SiO2、3CaO·Al2O3 Na2O·CaO· 6SiO2
氢能源
H2将是21世纪最理想的能源,其根据不正确的是( )
A.水将成为生产H2的主要原料
B.在等质量的可燃气体中,H2燃烧时放出的热量最多
C.H2易液化,方便储存和携带
D.使用H2作燃料时有助于环境保护
解析: 选项A、B、D表述正确。选项C错误。因为H2沸点极低、难液化、分子体积小、易泄漏、常温呈气态,不方便携带。
答案:C
碳及其化合物
金刚石、石墨和碳60的性质有所不同,原因是( )
A.构成原子不同
B.各自的原子排列方式不同
C.具有不同的几何外形
D.硬度不同
解析:金刚石、石墨和碳60都是由C原子构成,A错;性质不同应该是结构不同,故B正确;C、D明显错。
答案:B
在大气层中,因CO2量不断增加,引起“温室效应”。造成CO2量增加的主要原因是( )
A.动、植物的呼吸作用造成的
B.实验室排出的CO2多了
C.森林等缘化地带被破坏,自然界吸收CO2的能力下降。
D.大量燃烧含碳的矿物燃料
解析:空气组成中,CO2占有0.03%体积,人吸入O2,呼出CO2;绿色植物在光照条件下,吸收CO2进行光合作用,故A明显不合题意;B显然也不对;石油、煤等自然资源的开发利用产生了大量CO2,所以造成温室效应是CD。
答案:CD
硅及其化合物
(2011年汕头市学业水平测试模拟)关于硅及其化合物的叙述中,不正确的是( )
A.水玻璃可作粘合剂及耐火材料
B.硅可做半导体材料
C.二氧化硅是光导纤维的原料
D.氮化硅陶瓷是做电子元件的材料
解析:氮化硅(Si3N4)陶瓷因其熔点高,对于金属及氧化物熔体具有相当的高温稳定性,越来越多被应用于热工各个领域,如陶瓷烧成、以及高温轴承等,故D错;A、B、C明显正确。
答案:D
一、单项选择
1.氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用。下列关于能源的说法错误的是( )
A.科学家研制出一种可将水分解成氢气和氧气的催化剂,这将使大量获得氢能源成为可能
B.利用氢能等清洁能源代替化石燃料,有利于节约资源、保护环境
C.为了有效发展民用氢能源,首先必须制得廉价的氢气
D.石油作为重要的可再生能源应该被尽量地利用
解析:石油是不可再生能源,D明显错。
答案:D
2.下列物质不能用来制备O2的是( )
A.KClO3 B.H2O
C.H2O2 D.稀HNO3
解析:KClO3可以在MnO2作催化剂时加热分解;H2O可以电解得到O2;H2O2可以在MnO2催化下快速分解得O2,除了MnO2还有CuO、Cr2O3等金属氧化物或碱性溶液等均能使H2O2快速分解;浓HNO3分解得NO2、O2混合气体,稀HNO3不分解。
答案:D
3.下列有关臭氧的说法错误的是( )
A.氧气与臭氧是两种不同的单质
B.臭氧具有强氧化性,可以作脱色剂、消毒剂
C.臭氧在高压放电条件下可由氧气制备
D.臭氧对人有利无害
解析:臭氧层中含有大量的臭氧。臭氧可以吸收紫外线,是人类和生物的保护伞,在高空臭氧吸收紫外线,可以减少对人和生物的伤害,但在低空层臭氧氧化性强,会对人和生物造成伤害。
答案:D
4.(2011年广东学业水平测试)碳元素可以存在于自然界的多种物质中,这些物质肯定不包括( )
A.石油 B.石灰石
C.天然气 D.石英砂
解析:石英砂主要成分为SiO2;故答案选D。
答案:D
5.下列应用体现了碳的导电性的有( )
A.铅笔芯中含有碳
B.干电池中用石墨棒作电极
C.用墨书写的书画年长日久也不变色
D.用炭取暖
解析:干电池中用石墨棒作电极,显然是利用碳的导电性,故选B。
答案:B
6.(2011年揭阳市学业水平测试模拟)硅元素在材料领域中扮演着重要角色。下列叙述正确的是( )
A.硅酸钠可用作木材的防火涂料
B.石英晶体的主要成分为硅酸盐
C.半导体材料的成分是二氧化硅
D.光导纤维的成分是硅单质
解析:石英晶体的主要成分为二氧化硅,B错;半导体材料的成分是晶体硅,C错;光导纤维的成分是二氧化硅,D错;故本题正确选项为A。
答案:A
7.(2010年江苏学业水平测试)世界气候大会于2009年12月在丹麦首都哥本哈根召开,商讨2012至2020年全球温室气体减排协议。下列物质属于温室气体的是( )
A.N2 B.H2
C.CO2 D.O2
解析:温室气体是CO2。
答案:C
8.下列各变化中,在木炭燃烧时不可能发生的反应是( )
A.2C+O2 2CO
B.C+O2 CO2
C.CO2+C 2CO
D.CO2 C+O2
解析:木炭燃烧时,CO2不可能发生分解,故选D。
答案:D
二、多项选择(在每小题列出的四个选项中,至少有2个选项是正确的)
16.(2011年南通市学业水平模拟改编)下列有关物质用途的说法中,正确的是( )
A.Fe2O3可用作红色涂料
B.石墨可用作绝缘材料
C.Si可用作半导体材料
D.SiO2可用于制造光导纤维
解析:石墨有良好的导电性能,B错;故本题正确选项为A、C、D。
答案:ACD
17.(2011年镇江市普通高中学业水平测试模拟改编)光纤通讯和半导体成像技术已得到了广泛应用。下列不属于光纤的主要成分的是( )
A.Si B.SiO2
C.Na2SiO3 D.CaSiO3
解析:光纤的主要成分的是SiO2,故本题正确选项为A、C、D。
答案:ACD
第八讲 非金属元素(二)氢、氧、碳、硅
1.了解常见氢单质及其重要化合物的主要性质,了解其应用。
2.了解常见氧单质及其重要化合物的主要性质,了解其应用。
3.了解常见碳单质及其重要化合物的主要性质,了解其应用和对环境质量的影响。
4.了解常见硅单质及其重要化合物的主要性质,了解其应用和对环境质量的影响。
一、氢单质
1.氢的存在与性质
(1)存在:宇宙中,氢是最丰富的元素。地球上氢主要以________态存在于________和________中。氢主要有三种核素:H(氕)、H(D、氘)、H(T、氚)。
(2)物理性质:氢在通常条件下为无色无味、不溶于水,稍溶于有机溶剂的气体。
(3)化学通性:在常温下,氢比较不活泼,但在________下,氢是非常活泼的。除稀有气体元素外,几乎所有的元素都能与氢生成化合物。非金属元素的氢化物通常称为某化氢,如氯化氢、硫化氢等。
1.(1)化合 水 有机物 (3)高温
2.有H2参加或生成的主要反应
(1)氢气在加热或高温条件下 (点燃或使用催化剂) 参与反应,是很好的还原剂。如:
N2+3H2 ________________。
H2+S ________________。
(2)卤族单质(X2)在不同条件下与H2反应生成HX:
H2+X2=2HX(X:F、Cl、Br、I)
(3)氢化物受热分解如: 2HI ________________;
H2S ________________________。
高温、高压
催化剂
2.(1)2NH3 H2S (3)I2+H2 S+H2
(4)常见产生H2的主要反应
①铝、锌、镁、铁等金属与非氧化性酸反应。
②铝与氢氧化钠溶液反应。
③钠、镁、铝、铁等金属在一定的温度下与水反应 。
④电解水:2H2O ______________________。
注意:①②适用于实验室等少量氢气的制取;④是未来清洁能源来源。
2H2↑+O2↑
二、氧和水
1.有O2参加或生成的反应
(1)非金属与O2反应生成非金属氧化物, 卤族单质(X2) __________O2直接反应, 硫与氧气反应只生成________,氮与氧气放电条件下反应生成________。
(2)氧气的实验室制备反应:氯酸钾热分解(二氧化锰催化):2KClO3 ________;高锰酸钾加热分解:2KMnO4 ___________________。
(3)常见产生O2的分解反应
过氧化氢分解(二氧化锰催化):
2H2O2 ____________________________。
1.(1)不与 SO2 NO (2)2KCl+3O2↑ K2MnO4+MnO2+O2↑ (3)①2H2O+O2↑
2.有关水的反应
(1)水在氧化还原反应中的作用
①水作氧化剂,如:水与碳在高温下反应
C+H2O ________。
②水作还原剂,如:2F2+2H2O=_________________。
③水既作氧化剂又作还原剂:2H2O ___________。
④水既不作氧化剂也不作还原剂。如:
Cl2+H2O=_____________________________。
3NO2+H2O=_____________________________。
(2)水参与的非氧化还原反应:水与二氧化硫、三氧化硫、二氧化碳等酸性氧化物化合成酸,但不能与二氧化硅化合。
2.(1)①CO+H2 ②4HF+O2 ③2H2↑+O2↑
④HCl+HClO 2HNO3+NO
三、碳及其化合物
1.碳单质
(1)碳单质的存在形式主要有:金刚石型、石墨型、球碳分子型(又称足球烯如C60、C90、C120等),其中能作电极材料的是________。 碳的化合物数量最多。
(2)碳单质有较强的还原性:完成下列主要反应方程式:
①碳与石英砂高温反应:SiO2+2C ___________。
②碳与氧化铜反应:2CuO+C _____________。
③高温下被二氧化碳氧化:C+CO2 __________。
④碳被热的浓硫酸氧化:C+2H2SO4 _______。
⑤碳被热的浓硝酸氧化:C+4HNO3(浓) ________。
1.(1)石墨 (2)①Si+2CO↑ ②2Cu+CO2 ③2CO ④2SO2↑+2H2O+CO2↑ ⑤4NO2↑+CO2↑+2H2O
2.CO2、CO比较
CO CO2
物理
性质 1.无色无味有毒
2.不溶于水
3.比空气略轻 1.无色无味
2.溶于水(常温1∶1)
3.比空气重
化学
性质 1.强还原性
2.不与碱反应 1.弱氧化性
2.与碱反应
鉴别 燃烧产物使澄清石灰水变浑浊 使澄清________变浑浊
主要
用途 冶金工业作________剂、燃料 化工原料、灭火、饮料添加剂、人工降雨
2.石灰水 还原
3.碳酸盐
(1)常见碳酸盐俗称与主要化学成分:石灰石、蛋壳、贝壳、钟乳石—________;纯碱、苏打—________ ;小苏打—________;碳铵—________(氮肥);草木灰的主要成分—______;暂时硬水的主要成分—__________和__________ ;锅垢的主要成分—________和_________。
(2)碳酸氢钠与碳酸钠性质比较
①都能与盐酸等反应生成二氧化碳,在反应时耗酸量及生成气体反应速率________。
②两种盐均能与石灰水或氢氧化钡溶液生成______沉淀。
3.(1)CaCO3 Na2CO3 NaHCO3 NH4HCO3 K2CO3 Ca(HCO3)2 Mg(HCO3)2 CaCO3 Mg(OH)2
(2)①不同 ②白色
③碳酸氢钠能跟氢氧化钠等碱反应,碳酸钠________与NaOH反应。
④碳酸钠跟氯化钙或氯化钡溶液反应生成碳酸盐______沉淀,碳酸氢钠跟氯化钙或氯化钡溶液________反应。
(3)碳酸及其盐稳定性规律: 酸<酸式盐<正盐,如: H2CO3
特别提示:1.自然现象中石灰岩洞和钟乳石形成、岩石的风化主要是碳酸钙转化为碳酸氢钙,石笋形成是碳酸氢钙转化为碳酸钙。
2.相同条件下酸与碳酸钠反应的反应速率比酸与碳酸氢钠的反应速率小。
3.除去碳酸氢钠溶液中的碳酸钠通CO2。
4.除去碳酸钠中碳酸氢钠杂质时,固体加热,溶液加NaOH。
5.除去二氧化碳中的氯化氢用饱和碳酸氢钠溶液,不用碳酸钠溶液。
四、硅及其化合物
1.硅单质
(1)晶体硅是有金属光泽的灰黑色固体,________材料。常温________酸碱反应(氢氟酸例外),加热时能被氧化剂氧化。
(2)硅单质的制备主要反应:SiO2+2C _______ (高温隔绝氧气)。
2.SiO2:是无色晶体,难溶于水,属于________氧化物,用于制光导纤维、玻璃仪器、玻璃原料、建筑材料等。
3.H2SiO3(硅酸)、H4SiO4(原硅酸):均难溶于水,H4SiO4易失水生成H2SiO3,它们受热脱水生成硅胶(SiO2)用作________剂和催化剂载体。
1.(1)半导体 不与 (2)Si+2CO↑ 2.酸性 3.干燥
4.Na2SiO3的水溶液是无色黏稠碱性液体,俗称“水玻璃”,主要用途可作肥皂填料、耐火材料和建筑材料的________剂等。
特别提示:1.电子元件、光电池、芯片等主要成分是Si。
2.水晶石、水晶玻璃、石英砂、石英玻璃、硅藻土、玛瑙与光导纤维等主要成分是SiO2 。
5.硅酸盐及其工业
①性质特征:性质__________,熔点__________,大都__________溶于水。
②主要原料:黏土(Al2O3·2SiO2·2H2O)、石英(SiO2)和长石(钾长石(KAlSi3O8)K2O·Al2O3·6SiO2或钠长石Na2O·Al2O3·6SiO2、高岭土[Al2Si2O5(OH)4] Al2O3·2SiO2·2H2O)。
③主要制品:玻璃、水泥、陶瓷、砖瓦、水玻璃(Na2SiO3的水溶液)等。
4.防腐 5.①稳定 较高 难
④水泥和玻璃的生产:
水泥 玻璃(普通)
原料 __________ __________
设备 水泥回转窑 玻璃熔炉
反应 复杂的物理化学变化 Na2CO3+SiO2Na2SiO3+CO2↑
CaCO3+SiO2CaSiO3+CO2↑
主要
成分 __________ __________
特性 水硬性
(加石膏调节硬化速度) 玻璃态物质(在一定温度范围内软化)非晶体
注意:硅在地壳中的含量排第二位,仅次于氧元素。
④石灰石、粘土 纯碱、石灰石、石英 3CaO·SiO2、2CaO· SiO2、3CaO·Al2O3 Na2O·CaO· 6SiO2
氢能源
H2将是21世纪最理想的能源,其根据不正确的是( )
A.水将成为生产H2的主要原料
B.在等质量的可燃气体中,H2燃烧时放出的热量最多
C.H2易液化,方便储存和携带
D.使用H2作燃料时有助于环境保护
解析: 选项A、B、D表述正确。选项C错误。因为H2沸点极低、难液化、分子体积小、易泄漏、常温呈气态,不方便携带。
答案:C
碳及其化合物
金刚石、石墨和碳60的性质有所不同,原因是( )
A.构成原子不同
B.各自的原子排列方式不同
C.具有不同的几何外形
D.硬度不同
解析:金刚石、石墨和碳60都是由C原子构成,A错;性质不同应该是结构不同,故B正确;C、D明显错。
答案:B
在大气层中,因CO2量不断增加,引起“温室效应”。造成CO2量增加的主要原因是( )
A.动、植物的呼吸作用造成的
B.实验室排出的CO2多了
C.森林等缘化地带被破坏,自然界吸收CO2的能力下降。
D.大量燃烧含碳的矿物燃料
解析:空气组成中,CO2占有0.03%体积,人吸入O2,呼出CO2;绿色植物在光照条件下,吸收CO2进行光合作用,故A明显不合题意;B显然也不对;石油、煤等自然资源的开发利用产生了大量CO2,所以造成温室效应是CD。
答案:CD
硅及其化合物
(2011年汕头市学业水平测试模拟)关于硅及其化合物的叙述中,不正确的是( )
A.水玻璃可作粘合剂及耐火材料
B.硅可做半导体材料
C.二氧化硅是光导纤维的原料
D.氮化硅陶瓷是做电子元件的材料
解析:氮化硅(Si3N4)陶瓷因其熔点高,对于金属及氧化物熔体具有相当的高温稳定性,越来越多被应用于热工各个领域,如陶瓷烧成、以及高温轴承等,故D错;A、B、C明显正确。
答案:D
一、单项选择
1.氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用。下列关于能源的说法错误的是( )
A.科学家研制出一种可将水分解成氢气和氧气的催化剂,这将使大量获得氢能源成为可能
B.利用氢能等清洁能源代替化石燃料,有利于节约资源、保护环境
C.为了有效发展民用氢能源,首先必须制得廉价的氢气
D.石油作为重要的可再生能源应该被尽量地利用
解析:石油是不可再生能源,D明显错。
答案:D
2.下列物质不能用来制备O2的是( )
A.KClO3 B.H2O
C.H2O2 D.稀HNO3
解析:KClO3可以在MnO2作催化剂时加热分解;H2O可以电解得到O2;H2O2可以在MnO2催化下快速分解得O2,除了MnO2还有CuO、Cr2O3等金属氧化物或碱性溶液等均能使H2O2快速分解;浓HNO3分解得NO2、O2混合气体,稀HNO3不分解。
答案:D
3.下列有关臭氧的说法错误的是( )
A.氧气与臭氧是两种不同的单质
B.臭氧具有强氧化性,可以作脱色剂、消毒剂
C.臭氧在高压放电条件下可由氧气制备
D.臭氧对人有利无害
解析:臭氧层中含有大量的臭氧。臭氧可以吸收紫外线,是人类和生物的保护伞,在高空臭氧吸收紫外线,可以减少对人和生物的伤害,但在低空层臭氧氧化性强,会对人和生物造成伤害。
答案:D
4.(2011年广东学业水平测试)碳元素可以存在于自然界的多种物质中,这些物质肯定不包括( )
A.石油 B.石灰石
C.天然气 D.石英砂
解析:石英砂主要成分为SiO2;故答案选D。
答案:D
5.下列应用体现了碳的导电性的有( )
A.铅笔芯中含有碳
B.干电池中用石墨棒作电极
C.用墨书写的书画年长日久也不变色
D.用炭取暖
解析:干电池中用石墨棒作电极,显然是利用碳的导电性,故选B。
答案:B
6.(2011年揭阳市学业水平测试模拟)硅元素在材料领域中扮演着重要角色。下列叙述正确的是( )
A.硅酸钠可用作木材的防火涂料
B.石英晶体的主要成分为硅酸盐
C.半导体材料的成分是二氧化硅
D.光导纤维的成分是硅单质
解析:石英晶体的主要成分为二氧化硅,B错;半导体材料的成分是晶体硅,C错;光导纤维的成分是二氧化硅,D错;故本题正确选项为A。
答案:A
7.(2010年江苏学业水平测试)世界气候大会于2009年12月在丹麦首都哥本哈根召开,商讨2012至2020年全球温室气体减排协议。下列物质属于温室气体的是( )
A.N2 B.H2
C.CO2 D.O2
解析:温室气体是CO2。
答案:C
8.下列各变化中,在木炭燃烧时不可能发生的反应是( )
A.2C+O2 2CO
B.C+O2 CO2
C.CO2+C 2CO
D.CO2 C+O2
解析:木炭燃烧时,CO2不可能发生分解,故选D。
答案:D
二、多项选择(在每小题列出的四个选项中,至少有2个选项是正确的)
16.(2011年南通市学业水平模拟改编)下列有关物质用途的说法中,正确的是( )
A.Fe2O3可用作红色涂料
B.石墨可用作绝缘材料
C.Si可用作半导体材料
D.SiO2可用于制造光导纤维
解析:石墨有良好的导电性能,B错;故本题正确选项为A、C、D。
答案:ACD
17.(2011年镇江市普通高中学业水平测试模拟改编)光纤通讯和半导体成像技术已得到了广泛应用。下列不属于光纤的主要成分的是( )
A.Si B.SiO2
C.Na2SiO3 D.CaSiO3
解析:光纤的主要成分的是SiO2,故本题正确选项为A、C、D。
答案:ACD
同课章节目录
