【章末题型分练】9年级上册 第2章 物质转化与材料利用 填空题
文档属性
| 名称 | 【章末题型分练】9年级上册 第2章 物质转化与材料利用 填空题 |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-10-18 07:48:02 | ||
图片预览


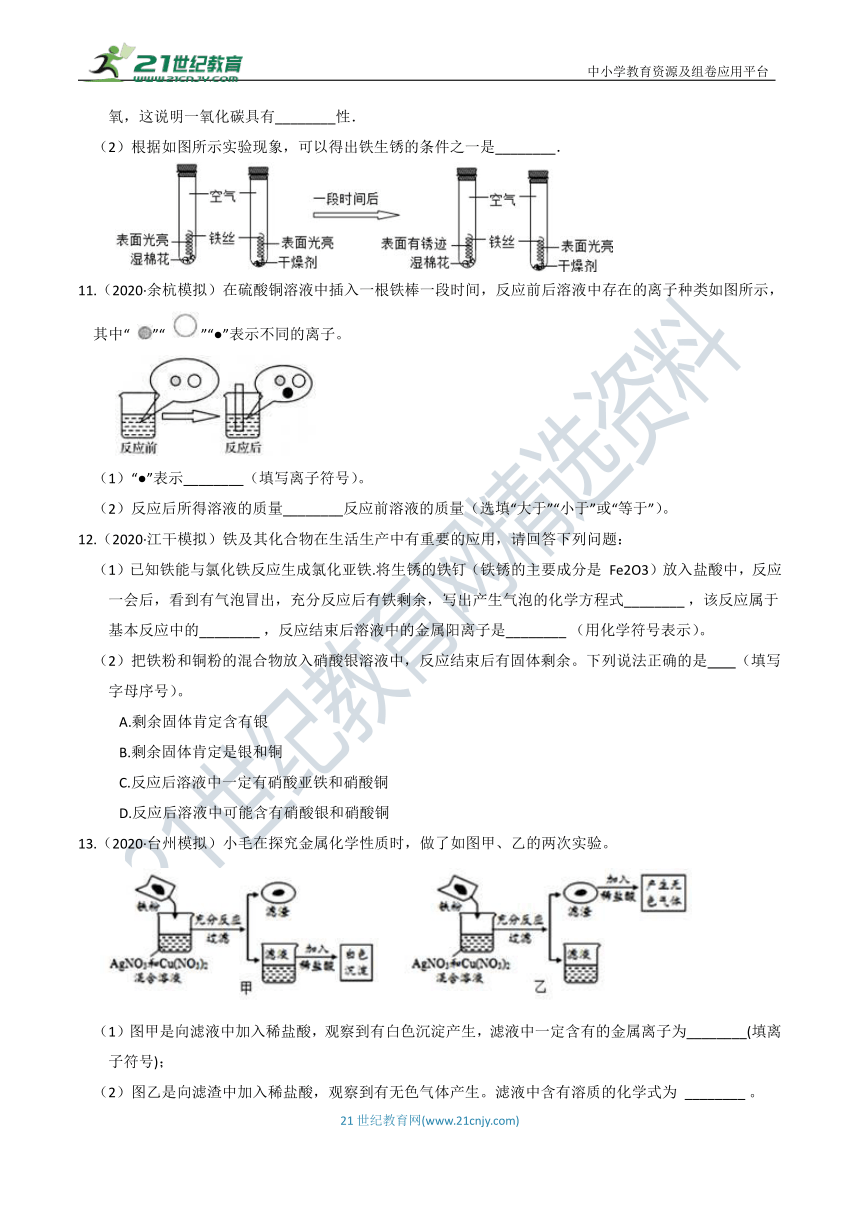


文档简介
中小学教育资源及组卷应用平台
【章末题型分练】9年级上册
第二章
填空题
一、金属材料
1.(2020八下·柯桥期末)新能源汽车中常使用锂电池,能有效改善空气质量。如图是锂元素在元素周期表中的信息:
(1)锂属于________元素(选填“金属”或“非金属”);
(2)锂的相对原子质量为________;
(3)已知锂元素和钠元素的化学性质相似,锂元素和氧元素可形成氧化锂,其化学式为________。
2.我国最早人工冶炼铁的制品是甘肃灵台出土的秦国铜柄钢剑,这说明在春秋战国时期我国已掌握了冶炼铁的技术。经分析测试该钢剑属于铁的合金,铁的合金主要有生铁和钢,生铁含碳量在________以上;钢是含碳量在________之间的铁合金,钢的含碳量越高,钢的硬度越________(选填“大”或“小”)。
3.(2020八下·江干期末)?
2019年诺贝尔化学奖授予锂电池研发科学家,表彰他们在锂电池研发领域作出的贡献。
(1)锂属于
________(金属或非金属)元素;
(2)新型磷酸亚铁LiFePO4电池具有稳定性高、安全、对环境友好等优点,放电时生成FePO4和单质锂,写出该反应的化学方程式________
4.(2020·湖州模拟)豆浆机由于快捷方便而进入千家万户,请回答相关问题。
(1)图中组成豆浆机的材料属于金属材料的是________?。(填序号)
(2)科学膳食是人类健康的保障,营养学家建议每天早晨喝一杯豆浆,主要是为了摄入________(填序号)
①维生素②蛋白质③油脂
5.(2020·温州模拟)人类的生活和生产都离不开金属。铝、铁、铜是人类广泛使用的三种金属,与我们的生活息息相关。
(1)生活中常用铜作导线,主要是利用了铜的________。
(2)铁制品锈蚀的过程,实际上是铁丝与空气中的________和水蒸气发生了化学反应。
(3)为了验证三种金属的活动性顺序,可选择Al、Cu和下列试剂中的?????
来达到实验目的。(选填字母序号)
A.Al2(SO4)3溶液
B.FeSO4溶液
C.CuSO4溶液
(4)可“用稀盐酸除去铁锈”,原理是________(用化学方程式表示)。
6.(2020八下·杭州期中)规范书写是我们学习中必须遵循的原则,小明在元素周期表中查找到如图所示的一格后,明白了不能把一氧化碳写成“Co”的原因。
(1)“Co”表示
________(填名称)元素。27表示它的________,它属于________(选填“金属元素”或“非金属元素”)。
(2)“CO”是由________和________(填名称)两种元素组成的
________(选填“单质”或“化合物”)。
7.(2019七上·衢州期中)实验表明:“物体有热胀冷缩的性质,不同物体的热胀冷缩程度不同”。利用物体的这种性质制作成可以由温度控制的开关。已知在相同条件下,铝的热膨胀比铜显著。如图所示,是一个由铜铝组成的双金属片,在30℃时是平直的,则在90℃时,双金属片将向________弯曲。(选填“铝”或“铜”)
8.(2019九上·浙江期中)我国自行研发的大型客机C919于今年5月成功试飞,请根据所学知识回答问题。
(1)选用铝合金做飞机机身而不选用纯铝,主要原因是铝合金硬度和强度________(填“大于”或“小于”)纯铝。
(2)飞机上的镀铬铁制品能防锈蚀,其防锈原理是阻止了铁与________接触。
9.(2019九上·苍南月考)合金是重要的金属材料。
(1)下列物品所使用的主要材料属于合金的是(?
)
A.青花瓷瓶
B.橡胶充气艇
C.不锈钢锅
(2)生铁是常用的合金,生铁属于________(填“纯净物”或“混合物”)。
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,说明________。
二、金属的化学性质
10.(2020九上·杭州开学考)铁的使用非常广泛,但较容易锈蚀.
(1)工业上炼铁的主要反应原理是:________,该反应中一氧化碳(CO)会夺取氧化铁(Fe2O3)中的氧,这说明一氧化碳具有________性.
(2)根据如图所示实验现象,可以得出铁生锈的条件之一是________.
11.(2020·余杭模拟)在硫酸铜溶液中插入一根铁棒一段时间,反应前后溶液中存在的离子种类如图所示,其中“
”“
”“●”表示不同的离子。
(1)“●”表示________(填写离子符号)。
(2)反应后所得溶液的质量________反应前溶液的质量(选填“大于”“小于”或“等于”)。
12.(2020·江干模拟)铁及其化合物在生活生产中有重要的应用,请回答下列问题:
(1)已知铁能与氯化铁反应生成氯化亚铁.将生锈的铁钉(铁锈的主要成分是
Fe2O3)放入盐酸中,反应一会后,看到有气泡冒出,充分反应后有铁剩余,写出产生气泡的化学方程式________?,该反应属于基本反应中的________?,反应结束后溶液中的金属阳离子是________?(用化学符号表示)。
(2)把铁粉和铜粉的混合物放入硝酸银溶液中,反应结束后有固体剩余。下列说法正确的是??????
(填写字母序号)。
A.剩余固体肯定含有银
B.剩余固体肯定是银和铜
C.反应后溶液中一定有硝酸亚铁和硝酸铜
D.反应后溶液中可能含有硝酸银和硝酸铜
13.(2020·台州模拟)小毛在探究金属化学性质时,做了如图甲、乙的两次实验。
(1)图甲是向滤液中加入稀盐酸,观察到有白色沉淀产生,滤液中一定含有的金属离子为________(填离子符号);
(2)图乙是向滤渣中加入稀盐酸,观察到有无色气体产生。滤液中含有溶质的化学式为
________?。
14.(2020·北仑模拟)如图为铁钉的一系列变化,据图回答问题。
(1)①中铁钉变红的原因________。
(2)③中除去铁锈的化学方程式为________。
(3)如果用a、b、c分别代表光亮铁钉、锈蚀铁钉、无锈铁钉,则它们的质量由大到小的顺序为________(用字母表示)。
15.(2020·黄岩模拟)小黄为了探究铁制品生锈的条件,利用如图装置进行了实验:
(1)一段时间以后,最先生锈的铁丝是________(用图中序号填写),通过这次实验能得出铁制品锈蚀和下列哪些因素有关________;
A.空气??
??B.水分??
??C.铁丝的内部结构
(2)实验结束后,小黄将10g表面生锈的铁丝(不考虑杂质的影响)浸泡在100g溶质质量分数为7.3%的稀盐酸中充分反应,观察到铁锈已完全消失,反应停止后,取出光亮的铁丝洗涤、干燥、称量,质量为3.4克,则原生锈铁丝中铁元素的质量分数是________(已知:2FeCl3+Fe=3FeCl2)。
16.(2020·慈溪模拟)铜、铁、铝是生活中常见的金属,请回答:
(1)黄铜是铜锌合金,其硬度比纯铜________(选填“大”或“小”)。
(2)“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中的________。
(3)用等质量的锌、铁、镁三种金属分別与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是???
??????。(选填字母代号)
A.曲线X、Y、Z分别表示锌、铁、镁的反应情况
B.反应后一定有剩余的金属是镁
C.反应后可能没有剩余的金属是锌和铁
17.(2019九上·奉化期末)下面是某学习小组对Zn、Fe、Al几种金属相关知识的学习与探究。请参与并回答问题:
(1)在空气中________制品(选填“铝”或“铁”)更耐腐蚀
(2)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能。例如纯铁比钢硬度________(选填“大”或“小”)
(3)某化学兴趣小组,设计了验证Al、Zn、Fe的金属活动性顺序的多种方案,每种方案所需的试剂如下
①Al、ZnSO4溶液、Fe;②Al(NO3)3溶液、Fe、ZnSO4溶液;
③Fe、Zn、Al(NO3)3溶液;④Al、Fe、Zn、稀盐酸
认为可行的方案有________(填序号)。
18.(2019九上·慈溪期末)将锌粒加入到一定量的Mg(NO3)2和Cu(NO3)2的混合溶液中,充分反应后,溶液的质量________(选填“变大”或“变小”),同时观察到的现象是________。
19.(2019九上·上城期末)某科研小组的同学在探究镁、铜、锌三种金属的有关性质时进行了如图实验:
(1)将图甲实验结束后①②试管内的物质倒入图乙的空烧杯中,一段时间后对烧杯中的物质进行过滤,滤液中的溶质一定有________;
(2)若要验证镁、锌、铜金属活动性顺序,还可以用一种试剂直接与三种金属反应就能达到目的,该试剂可以是________。
20.(2019九上·慈溪月考)根据下面部分金属的活动性顺序回答:
(1)我国第四套人民币的一元硬币为钢芯镀镍(Ni)合金,已知Ni能够发生如下反应:Ni+H2SO4═NiSO4+H2↑。根据此材料及金属活动性顺序,写出Ni与CuSO4溶液发生置换反应的化学方程式:________。
(2)已知:①X+H2SO4=XSO4+H2↑;②Y+2ZNO3=Y(NO3)2+2Z;③Y与稀硫酸不反应,则X、Y、Z三种金属的活动性由强到弱的顺序为________。
21.(2019九上·慈溪月考)实验室的某一废液中含有Cu(NO3)2、NaNO3和AgNO3三种溶质。小科同学设计了如下实验方案来分离、回收废液中的金属铜和银。根据以下实验过程和现象回答问题:
(1)加入适量铜粉后,废液中发生反应的化学方程式是________。
(2)滤液D中的溶质有________。
三、有机化合物
22.(2020·湖州模拟)我国研发的“化铋(Bi2Te3)纤维素复合热电薄膜电池”,能利用人体热量为手表等可穿戴电子设备供电。
(1)纤维素的化学式为(C6H10O5)n
,
这种物质属于________?。(选填“有机物”或“无机物”),其中碳氢元素质量比为________。
(2)Bi2Te3中确(Te)元素的化合价为-2价,则Bi2Te3中铋(Bi)元素的化合价为________。
23.(2020·宁波模拟)从2019年开始实施垃圾分类,依据对生活垃圾分类处理与综合利用的部分流程,回答下列问题:
(1)厨余垃圾“生化厌氧产沼”是指厨房垃圾经过微生物的无氧呼吸(发酵)产生CH4和二氧化碳气体,设垃圾中有机物的化学式为(CH2O)n,请写出这一反应的化学方程式________
(2)具有哪些特点的其他垃圾适合焚烧发电?________
24.(2020·天台模拟)可燃冰又称天然气水合物,是一种甲烷和水分子在低温高压情况下结合在一起的化合物,其化学式为CH4·8H2O。可燃冰是有望取代煤、石油的新能源,优化能源结构。
(1)甲烷属于________(填“有机物”或“无机物”)
(2)可燃冰中元素质量比C:H:O为________。
25.(2019九上·江山期中)科学来源于生活,生活中处处都有科学知识。
(1)下列哪些物质的主要成分是有机物
________??(填序号)。
①木炭②白酒③头发④醋酸⑤小苏打⑥蛋清⑦生石灰
(2)池塘底部常会冒出小气泡,这些小气泡俗称沼气,它与天然气、石油气、煤矿中的瓦斯一样,主要成分为甲烷。请写出其在空气中完全燃烧的化学方程式________
(3)为引导学生积极参加体育活动,提高身体素质,我市每年都对学生进行体育水平测试。学生进行测试时,所需的能量主要来自体内何种物质的氧化分解
???????????(选填字母)
A.葡萄糖
B.脂肪
C.蛋白质
D.维生素
(4)“工业用盐”的亚硝酸钠(NaNO2)当作食盐放进食物,被人食用后易引起中毒,根据化学式你推测有毒的成分是
________(填符号)
26.2008年我国“世界环境日”的主题为“绿色奥运与环境友好型社会”.
(1)北京奥运会采取的下列措施中,与“绿色奥运”理念无关的是________.
①招募志愿者为奥运提供服务??
②在奥运场地使用新型清洁能源??
③奥运工程建设中,采用太阳能、地热能等能源
(2)“祥云”火炬的燃料是丙烷(C3H8),丙烷在空气中点燃生成二氧化碳和水,符合“绿色奥运“的要求,其化学方程式是________
(3)有机物甲烷、乙烷、丁烷等的化学式有一定的规律.它们的化学式分别为:甲烷(CH4)、丙烷(C3H8)、丁烷(C4H10),请你根据规律写出乙烷的化学式________
27.由碳、氢元素组成的物质种类繁多,烷烃就是其中一类重要的物质,表中列出了几种烷烃的一些信息.
名称
甲烷
乙烷
丙烷
丁烷
戊烷
化学式
CH4
C2H6
C3H8
?
C5H12
沸点(℃)
-164
-88.6
-42.1
-0.5
36.1
相对密度
0.466
0.572
0.585
0.579
0.626
分析上表中的信息,回答下列问题:
(1)写出表中丁烷的化学式???
________.
(2)烷烃的命名与碳原子数目的增加有关,请总结一条烷烃物理性质的递变规律________.
(3)烷烃在工业上的用途非常广泛,它的进一步开发利用也成为研究话题,以下烷烃的性质描述中,属于不支持对它进一步开发利用的观点有:???????????????????????
.
A.烷烃能做燃料,反应放热极多,其中的甲烷已成为广泛使用的清洁能源
B.地球上的烷烃总含量较少,以甲烷居多,且分布随纬度的变化很大
C.常温常压下,随碳原子增多,烷烃逐渐从气态变成液态再变成固体
D.烷烃不易发生反应,制取成本较高,且只能从石油中提取.
四、物质的分类
28.(2020九上·杭州开学考)下列分别盛有不同物质的容器中,所盛物质属于纯净物的是________,单质的是________,属于化合物的是________。(均填容器代号)
29.(2020八下·拱墅期末)请沿用科学家认识事物的方式认识“空气”。
(1)从分类角度:洁净的空气属于________(填“混合物”或“纯净物”)
(2)从微观角度:用“
”表示氮原子,“
”表示氧原子。则用“
”可表示的微粒是(填名称)。
(3)从变化角度:已知:常压下,氮气沸点为-196oC,氧气沸点为-183℃。将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是木条________(填“熄灭”或“继续燃烧”)。
(4)从环保角度:下列保护空气的措施不合理的是?????
A.加高烟囱直接排放废气
B.植树造林
C.提倡步行、骑自行车等出行方式
30.(2020·南浔模拟)?
1774年,拉瓦锡完成了氧化汞加热实验,如图为反应过程示意图。
(1)从化学反应的基本类型分析,该反应属于________反应。
(2)图中属于化合物的物质有________(填化学式)。
31.(2019九上·衢州期中)?
2019年10月29日,官方报道称:中国自主研发的深海载人舱已经成功完成了建造。据悉,这一设备全称叫全海深载人潜水器万米级载人舱,是当前世界范围内空间最大、搭载人数最多的万米级载人舱,载人球壳使用钛合金材料,该材料用于深海装备拥有诸多优越性和独特性。查阅资料知:钛的金属活动性介于铝和铁之间。请回答下列问题:
(1)钛合金属于________(“纯净物”或“混合物”);
(2)将钛条放入硫酸铜溶液中应该能观察到的现象:________。
(3)钛合金用于深海装备主要是利用了下列性能中的?????????
。
A.抗压强度大
B.良好的导电性
C.熔点低
D.抗腐蚀性能强
32.(2019九上·绍兴月考)请根据表中物质回答下列有关问题:
序号
①
②
③
④
物质
醋酸
生石灰
熟石灰
纯碱
(1)上表中的物质属于碱的是________(填化学式)
(2)选用表中的物质作为反应物,写出制取氢氧化钠的化学方程式:________;该反应属于________(填写基本反应类型)反应.
33.(2019八下·诸暨期中)用下列物质的序号回答有关问题:
(1)已知“?”、“●”表示质子数不同的原子。如图表示的气体物质中,属于化合物的是________,属于单质的是________,属于混合物的是________.
(2)有下列物质:①雨水??②蒸馏水??③雨后洁净的空气??④四氧化三铁??⑤液氮??⑥高锰酸钾完全分解后的固体产物其中属于混合物是________,属于纯净物是________,属于单质的是________,属于氧化物的是________.
34.(2019八下·江干期中)微观示意图可形象地表示微粒发生的变化。
(1)请在图中第二、三个方框中,把NH3在纯氧中燃烧(4NH3+3O2
2N2+6H2O)的微观粒子补充完整:
(2)第三个方框中的物质属于________(填:单质、化合物、纯净物、混合物)。
五、物质的转化
35.(2020九上·杭州开学考)有一包固体,可能由硝酸铜、硫酸钠、氯化钠、碳酸氢钠、氢氧化钠中的一种或几种组成。为了探究该固体的组成,某化学小组设计并开展以下实验:
已知,步骤Ⅰ中固体全部消失,溶液呈蓝色。有气泡产生。步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成。请回答下列问题:
(1)原固体中一定含有的物质是________.依据是________.
(2)步骤II中产生白色沉淀的化学方程式是________.
(3)步骤Ⅲ所得蓝色滤液中一定含有的溶质是________.
36.(2020九上·柯桥开学考)在分开盛放的A、B两溶液中。共含有Na+、Cu2+、Ba2+、Mg2+、NO3-、OH-、SO42-七种离子,两溶液里所含离子各不相同,已知A溶液里含三种阳离子和两种阴离子,其余的在B溶液里,则B溶液里所含离子应该是________。
37.(2020·宁波)铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作补血剂。某硫酸厂产生的炉渣中除了有Fe2O3、FeO,还有一定量的SiO2。兴趣小组利用炉渣尝试制备FeCO3
,
其流程如下:
【已知:Fe+Fe2(SO4)3=3FeSO4;SiO2不溶于水,也不与稀硫酸反应】
(1)操作①的名称是________。
(2)溶液A中的溶质除H2SO4外,还存在________。
(3)上述流程中生成固体c的化学方程式________。
38.(2020·柯桥模拟)有一固体混合物质可能含有硫酸钾、硝酸铵、氯化钡中的一种或几种,现需要对此物质成分进行检测。甲同学向该固体混合物中加入足量的水,形成无色溶液;乙同学向该固体混合物中加入足量氢氧化钡溶液,产生白色沉淀,并放出刺激性气体。
(1)该气体为________(填名称)。
(2)根据两同学的实验现象可推定此固体混合物质的组成是________。
39.(2020·杭州模拟)要从含有氯化钠、氯化铜和氯化亚铁的某废液中,回收铜并得到铁红(主要成分Fe2O3),小金设计了如下图的实验方案,要求全过程不引入其他金属元素,请回答:
(1)步骤②中加入过量盐酸的目的是________。
(2)溶液丙中阴离子的符号是________。
40.(2020·富阳模拟)通过海水晒制可得粗盐,粗盐中除NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质。以下是一种由粗盐制备精盐的实验方案流程图:
分析该流程图,回答下列问题:
(1)试剂X为________(填写化学式)。
(2)加适量HCl溶液的目的是________。
(3)操作Y________。
(4)选择除杂的试剂不能用KOH代替NaOH溶液,理由是________。
41.(2020·浙江模拟)某白色固体A由氢氧化钠、硝酸钡、硫酸钠、碳酸钠、硫酸铜中的三种组成。为确定其成分,取少量A进行如下实验。
?
图中红色溶液呈________性,固体A中一定含有________。
42.(2020·台州模拟)有一包白色粉末,可能是CuSO4、Na2CO3、BaCl、Na2SO4、Ba(OH)2中的一种或几种,为证明其组成,小明进行了探究,方案及现象如图所示。据此推断:
(1)CO2通入无色滤液后有白色沉淀B生成,原因是________(用化学方程式表示);
(2)白色固体中一定含有________。
43.(2020·玉环模拟)有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品成分,某小组取适量样品按下列流程进行实验。
回答下列问题
(1)过滤操作中玻璃棒的作用是________;
(2)滤渣a的成分是
________;
(3)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品中不能确定是否存在的物质是________。
44.(2020·仙居模拟)某溶液中可能含有碳酸钠、硫酸钠、氯化钠、硝酸钠中的一种或几种,为测定其成分,取样,先后逐滴加入氯化钡溶液、稀硝酸,产生沉淀的质量与时间里的关系如图所示。
(1)由上述实验可知,原溶液中一定含有________?。
(2)实验中AB之间(不包括A、B端点)图像所对应的溶液中的溶质一定有________。BC段减少的沉淀是________。
答案解析部分
一、金属材料
1.【答案】
(1)金属(2)6.941或7(3)Li2O
2.【答案】
2%;0.03%~2%;大
3.【答案】
(1)金属(2)LiFeO4=FePO4+Li
4.【答案】
(1)②③(2)②
5.【答案】
(1)导电性(2)氧气(3)B(4)Fe2O3+6HCl=2FeCl3+3H2O
6.【答案】
(1)钴;原子序数;金属元素(2)碳;氧;化合物
7.【答案】
铜
8.【答案】
(1)大于(2)氧气和水或空气和水
9.【答案】
(1)C(2)混合物(3)黄铜片的硬度大于纯铜片
二、金属的化学性质
10.【答案】
(1)3CO+Fe2O3=Fe+3CO2;还原(2)水
11.【答案】
(1)Fe2+(2)小于
12.【答案】
(1)Fe+2HCl=Fe2Cl+H2↑;置换反应;Fe2+(2)A
13.【答案】
(1)Ag+、Cu?+、Fe2+(2)Fe(NO3)2
14.【答案】
(1)铁和铜盐反应生成铜单质,包裹在铁钉表面(2)6HCl+Fe2O3=2FeCl3+3H2O(3)b>a>c
15.【答案】
(1)②;BC(2)90%
16.【答案】
(1)大(2)水蒸气和氧气(3)B,C
17.【答案】
(1)铝(2)小(3)①④
18.【答案】
变大;生成红色固体物质,蓝色溶液褪色
19.【答案】
(1)硫酸镁、硫酸锌(2)硫酸锌或氯化锌或硝酸锌或酸等
20.【答案】
(1)Ni+CuSO4=NiSO4+Cu(2)X>Y>Z
21.【答案】
(1)Cu+2AgNO3=Cu(NO3)2+2Ag(2)Fe(NO3)2、NaNO3
三、有机化合物
22.【答案】
(1)有机物;36:5(2)+3
23.【答案】
(1)2(CH2O)n
nCH4↑+nCO2↑(2)燃烧后无有害气体生成
24.【答案】
(1)有机物(2)3:5:32
25.【答案】
(1)②③④⑥(2)CH4+2O2
CO2+2H2O(3)A(4)NO2—
26.【答案】
(1)①(2)C3H8+5O2
3CO2+4H2O(3)C2H6
27.【答案】
(1)C4H10(2)随着碳原子数目增加,沸点越来越高,相对密度越来越大(3)D
四、物质的分类
28.【答案】
AD;A;D
29.【答案】
(1)混合物(2)氮分子(氮气分子)(3)熄灭(4)A
30.【答案】
(1)分解(2)HgO
31.【答案】
(1)混合物(2)钛条表面覆盖一层红色物质(3)A,D
32.【答案】
(1)Ca(OH)2(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;复分解反应
33.【答案】
(1)B;A;CD(2)①③⑥;②④⑤;⑤;②④
34.【答案】
(1)(2)混合物
五、物质的转化
35.【答案】
(1)碳酸氢钠;向固体中加过量稀盐酸,无气泡产生(2)Na2SO4+Ba(NO3)2=2NaNO3+BaSO4↓
(3)盐酸、硝酸钠、硝酸钡、硝酸铜
36.【答案】
Ba2+、OH-
37.【答案】
(1)过滤(2)Fe2(SO4)3、FeSO4(3)Na2CO3+FeSO4=Na2SO4+FeCO3↓
38.【答案】
(1)氨气(2)硫酸钾、硝酸铵
39.【答案】
(1)除去过量的铁(2)Cl-、OH-
40.【答案】
(1)Na2CO3(2)除去多余的CO32-和OH-(3)蒸发结晶(4)会引进新的杂质KCl或K+
41.【答案】
碱性;氢氧化钠、硝酸钡、碳酸钠
42.【答案】
(1)CO2+Ba(OH)2=BaCO3↓+H2O(2)Na2CO3、Ba(OH)2
43.【答案】
(1)引流(2)碳酸钙、氢氧化镁(3)氯化镁
44.【答案】
(1)Na2CO3、Na2SO4(2)NaCl、BaCl2;BaCO3
21世纪教育网(www.21cnjy.com)
【章末题型分练】9年级上册
第二章
填空题
一、金属材料
1.(2020八下·柯桥期末)新能源汽车中常使用锂电池,能有效改善空气质量。如图是锂元素在元素周期表中的信息:
(1)锂属于________元素(选填“金属”或“非金属”);
(2)锂的相对原子质量为________;
(3)已知锂元素和钠元素的化学性质相似,锂元素和氧元素可形成氧化锂,其化学式为________。
2.我国最早人工冶炼铁的制品是甘肃灵台出土的秦国铜柄钢剑,这说明在春秋战国时期我国已掌握了冶炼铁的技术。经分析测试该钢剑属于铁的合金,铁的合金主要有生铁和钢,生铁含碳量在________以上;钢是含碳量在________之间的铁合金,钢的含碳量越高,钢的硬度越________(选填“大”或“小”)。
3.(2020八下·江干期末)?
2019年诺贝尔化学奖授予锂电池研发科学家,表彰他们在锂电池研发领域作出的贡献。
(1)锂属于
________(金属或非金属)元素;
(2)新型磷酸亚铁LiFePO4电池具有稳定性高、安全、对环境友好等优点,放电时生成FePO4和单质锂,写出该反应的化学方程式________
4.(2020·湖州模拟)豆浆机由于快捷方便而进入千家万户,请回答相关问题。
(1)图中组成豆浆机的材料属于金属材料的是________?。(填序号)
(2)科学膳食是人类健康的保障,营养学家建议每天早晨喝一杯豆浆,主要是为了摄入________(填序号)
①维生素②蛋白质③油脂
5.(2020·温州模拟)人类的生活和生产都离不开金属。铝、铁、铜是人类广泛使用的三种金属,与我们的生活息息相关。
(1)生活中常用铜作导线,主要是利用了铜的________。
(2)铁制品锈蚀的过程,实际上是铁丝与空气中的________和水蒸气发生了化学反应。
(3)为了验证三种金属的活动性顺序,可选择Al、Cu和下列试剂中的?????
来达到实验目的。(选填字母序号)
A.Al2(SO4)3溶液
B.FeSO4溶液
C.CuSO4溶液
(4)可“用稀盐酸除去铁锈”,原理是________(用化学方程式表示)。
6.(2020八下·杭州期中)规范书写是我们学习中必须遵循的原则,小明在元素周期表中查找到如图所示的一格后,明白了不能把一氧化碳写成“Co”的原因。
(1)“Co”表示
________(填名称)元素。27表示它的________,它属于________(选填“金属元素”或“非金属元素”)。
(2)“CO”是由________和________(填名称)两种元素组成的
________(选填“单质”或“化合物”)。
7.(2019七上·衢州期中)实验表明:“物体有热胀冷缩的性质,不同物体的热胀冷缩程度不同”。利用物体的这种性质制作成可以由温度控制的开关。已知在相同条件下,铝的热膨胀比铜显著。如图所示,是一个由铜铝组成的双金属片,在30℃时是平直的,则在90℃时,双金属片将向________弯曲。(选填“铝”或“铜”)
8.(2019九上·浙江期中)我国自行研发的大型客机C919于今年5月成功试飞,请根据所学知识回答问题。
(1)选用铝合金做飞机机身而不选用纯铝,主要原因是铝合金硬度和强度________(填“大于”或“小于”)纯铝。
(2)飞机上的镀铬铁制品能防锈蚀,其防锈原理是阻止了铁与________接触。
9.(2019九上·苍南月考)合金是重要的金属材料。
(1)下列物品所使用的主要材料属于合金的是(?
)
A.青花瓷瓶
B.橡胶充气艇
C.不锈钢锅
(2)生铁是常用的合金,生铁属于________(填“纯净物”或“混合物”)。
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,说明________。
二、金属的化学性质
10.(2020九上·杭州开学考)铁的使用非常广泛,但较容易锈蚀.
(1)工业上炼铁的主要反应原理是:________,该反应中一氧化碳(CO)会夺取氧化铁(Fe2O3)中的氧,这说明一氧化碳具有________性.
(2)根据如图所示实验现象,可以得出铁生锈的条件之一是________.
11.(2020·余杭模拟)在硫酸铜溶液中插入一根铁棒一段时间,反应前后溶液中存在的离子种类如图所示,其中“
”“
”“●”表示不同的离子。
(1)“●”表示________(填写离子符号)。
(2)反应后所得溶液的质量________反应前溶液的质量(选填“大于”“小于”或“等于”)。
12.(2020·江干模拟)铁及其化合物在生活生产中有重要的应用,请回答下列问题:
(1)已知铁能与氯化铁反应生成氯化亚铁.将生锈的铁钉(铁锈的主要成分是
Fe2O3)放入盐酸中,反应一会后,看到有气泡冒出,充分反应后有铁剩余,写出产生气泡的化学方程式________?,该反应属于基本反应中的________?,反应结束后溶液中的金属阳离子是________?(用化学符号表示)。
(2)把铁粉和铜粉的混合物放入硝酸银溶液中,反应结束后有固体剩余。下列说法正确的是??????
(填写字母序号)。
A.剩余固体肯定含有银
B.剩余固体肯定是银和铜
C.反应后溶液中一定有硝酸亚铁和硝酸铜
D.反应后溶液中可能含有硝酸银和硝酸铜
13.(2020·台州模拟)小毛在探究金属化学性质时,做了如图甲、乙的两次实验。
(1)图甲是向滤液中加入稀盐酸,观察到有白色沉淀产生,滤液中一定含有的金属离子为________(填离子符号);
(2)图乙是向滤渣中加入稀盐酸,观察到有无色气体产生。滤液中含有溶质的化学式为
________?。
14.(2020·北仑模拟)如图为铁钉的一系列变化,据图回答问题。
(1)①中铁钉变红的原因________。
(2)③中除去铁锈的化学方程式为________。
(3)如果用a、b、c分别代表光亮铁钉、锈蚀铁钉、无锈铁钉,则它们的质量由大到小的顺序为________(用字母表示)。
15.(2020·黄岩模拟)小黄为了探究铁制品生锈的条件,利用如图装置进行了实验:
(1)一段时间以后,最先生锈的铁丝是________(用图中序号填写),通过这次实验能得出铁制品锈蚀和下列哪些因素有关________;
A.空气??
??B.水分??
??C.铁丝的内部结构
(2)实验结束后,小黄将10g表面生锈的铁丝(不考虑杂质的影响)浸泡在100g溶质质量分数为7.3%的稀盐酸中充分反应,观察到铁锈已完全消失,反应停止后,取出光亮的铁丝洗涤、干燥、称量,质量为3.4克,则原生锈铁丝中铁元素的质量分数是________(已知:2FeCl3+Fe=3FeCl2)。
16.(2020·慈溪模拟)铜、铁、铝是生活中常见的金属,请回答:
(1)黄铜是铜锌合金,其硬度比纯铜________(选填“大”或“小”)。
(2)“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中的________。
(3)用等质量的锌、铁、镁三种金属分別与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是???
??????。(选填字母代号)
A.曲线X、Y、Z分别表示锌、铁、镁的反应情况
B.反应后一定有剩余的金属是镁
C.反应后可能没有剩余的金属是锌和铁
17.(2019九上·奉化期末)下面是某学习小组对Zn、Fe、Al几种金属相关知识的学习与探究。请参与并回答问题:
(1)在空气中________制品(选填“铝”或“铁”)更耐腐蚀
(2)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能。例如纯铁比钢硬度________(选填“大”或“小”)
(3)某化学兴趣小组,设计了验证Al、Zn、Fe的金属活动性顺序的多种方案,每种方案所需的试剂如下
①Al、ZnSO4溶液、Fe;②Al(NO3)3溶液、Fe、ZnSO4溶液;
③Fe、Zn、Al(NO3)3溶液;④Al、Fe、Zn、稀盐酸
认为可行的方案有________(填序号)。
18.(2019九上·慈溪期末)将锌粒加入到一定量的Mg(NO3)2和Cu(NO3)2的混合溶液中,充分反应后,溶液的质量________(选填“变大”或“变小”),同时观察到的现象是________。
19.(2019九上·上城期末)某科研小组的同学在探究镁、铜、锌三种金属的有关性质时进行了如图实验:
(1)将图甲实验结束后①②试管内的物质倒入图乙的空烧杯中,一段时间后对烧杯中的物质进行过滤,滤液中的溶质一定有________;
(2)若要验证镁、锌、铜金属活动性顺序,还可以用一种试剂直接与三种金属反应就能达到目的,该试剂可以是________。
20.(2019九上·慈溪月考)根据下面部分金属的活动性顺序回答:
(1)我国第四套人民币的一元硬币为钢芯镀镍(Ni)合金,已知Ni能够发生如下反应:Ni+H2SO4═NiSO4+H2↑。根据此材料及金属活动性顺序,写出Ni与CuSO4溶液发生置换反应的化学方程式:________。
(2)已知:①X+H2SO4=XSO4+H2↑;②Y+2ZNO3=Y(NO3)2+2Z;③Y与稀硫酸不反应,则X、Y、Z三种金属的活动性由强到弱的顺序为________。
21.(2019九上·慈溪月考)实验室的某一废液中含有Cu(NO3)2、NaNO3和AgNO3三种溶质。小科同学设计了如下实验方案来分离、回收废液中的金属铜和银。根据以下实验过程和现象回答问题:
(1)加入适量铜粉后,废液中发生反应的化学方程式是________。
(2)滤液D中的溶质有________。
三、有机化合物
22.(2020·湖州模拟)我国研发的“化铋(Bi2Te3)纤维素复合热电薄膜电池”,能利用人体热量为手表等可穿戴电子设备供电。
(1)纤维素的化学式为(C6H10O5)n
,
这种物质属于________?。(选填“有机物”或“无机物”),其中碳氢元素质量比为________。
(2)Bi2Te3中确(Te)元素的化合价为-2价,则Bi2Te3中铋(Bi)元素的化合价为________。
23.(2020·宁波模拟)从2019年开始实施垃圾分类,依据对生活垃圾分类处理与综合利用的部分流程,回答下列问题:
(1)厨余垃圾“生化厌氧产沼”是指厨房垃圾经过微生物的无氧呼吸(发酵)产生CH4和二氧化碳气体,设垃圾中有机物的化学式为(CH2O)n,请写出这一反应的化学方程式________
(2)具有哪些特点的其他垃圾适合焚烧发电?________
24.(2020·天台模拟)可燃冰又称天然气水合物,是一种甲烷和水分子在低温高压情况下结合在一起的化合物,其化学式为CH4·8H2O。可燃冰是有望取代煤、石油的新能源,优化能源结构。
(1)甲烷属于________(填“有机物”或“无机物”)
(2)可燃冰中元素质量比C:H:O为________。
25.(2019九上·江山期中)科学来源于生活,生活中处处都有科学知识。
(1)下列哪些物质的主要成分是有机物
________??(填序号)。
①木炭②白酒③头发④醋酸⑤小苏打⑥蛋清⑦生石灰
(2)池塘底部常会冒出小气泡,这些小气泡俗称沼气,它与天然气、石油气、煤矿中的瓦斯一样,主要成分为甲烷。请写出其在空气中完全燃烧的化学方程式________
(3)为引导学生积极参加体育活动,提高身体素质,我市每年都对学生进行体育水平测试。学生进行测试时,所需的能量主要来自体内何种物质的氧化分解
???????????(选填字母)
A.葡萄糖
B.脂肪
C.蛋白质
D.维生素
(4)“工业用盐”的亚硝酸钠(NaNO2)当作食盐放进食物,被人食用后易引起中毒,根据化学式你推测有毒的成分是
________(填符号)
26.2008年我国“世界环境日”的主题为“绿色奥运与环境友好型社会”.
(1)北京奥运会采取的下列措施中,与“绿色奥运”理念无关的是________.
①招募志愿者为奥运提供服务??
②在奥运场地使用新型清洁能源??
③奥运工程建设中,采用太阳能、地热能等能源
(2)“祥云”火炬的燃料是丙烷(C3H8),丙烷在空气中点燃生成二氧化碳和水,符合“绿色奥运“的要求,其化学方程式是________
(3)有机物甲烷、乙烷、丁烷等的化学式有一定的规律.它们的化学式分别为:甲烷(CH4)、丙烷(C3H8)、丁烷(C4H10),请你根据规律写出乙烷的化学式________
27.由碳、氢元素组成的物质种类繁多,烷烃就是其中一类重要的物质,表中列出了几种烷烃的一些信息.
名称
甲烷
乙烷
丙烷
丁烷
戊烷
化学式
CH4
C2H6
C3H8
?
C5H12
沸点(℃)
-164
-88.6
-42.1
-0.5
36.1
相对密度
0.466
0.572
0.585
0.579
0.626
分析上表中的信息,回答下列问题:
(1)写出表中丁烷的化学式???
________.
(2)烷烃的命名与碳原子数目的增加有关,请总结一条烷烃物理性质的递变规律________.
(3)烷烃在工业上的用途非常广泛,它的进一步开发利用也成为研究话题,以下烷烃的性质描述中,属于不支持对它进一步开发利用的观点有:???????????????????????
.
A.烷烃能做燃料,反应放热极多,其中的甲烷已成为广泛使用的清洁能源
B.地球上的烷烃总含量较少,以甲烷居多,且分布随纬度的变化很大
C.常温常压下,随碳原子增多,烷烃逐渐从气态变成液态再变成固体
D.烷烃不易发生反应,制取成本较高,且只能从石油中提取.
四、物质的分类
28.(2020九上·杭州开学考)下列分别盛有不同物质的容器中,所盛物质属于纯净物的是________,单质的是________,属于化合物的是________。(均填容器代号)
29.(2020八下·拱墅期末)请沿用科学家认识事物的方式认识“空气”。
(1)从分类角度:洁净的空气属于________(填“混合物”或“纯净物”)
(2)从微观角度:用“
”表示氮原子,“
”表示氧原子。则用“
”可表示的微粒是(填名称)。
(3)从变化角度:已知:常压下,氮气沸点为-196oC,氧气沸点为-183℃。将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是木条________(填“熄灭”或“继续燃烧”)。
(4)从环保角度:下列保护空气的措施不合理的是?????
A.加高烟囱直接排放废气
B.植树造林
C.提倡步行、骑自行车等出行方式
30.(2020·南浔模拟)?
1774年,拉瓦锡完成了氧化汞加热实验,如图为反应过程示意图。
(1)从化学反应的基本类型分析,该反应属于________反应。
(2)图中属于化合物的物质有________(填化学式)。
31.(2019九上·衢州期中)?
2019年10月29日,官方报道称:中国自主研发的深海载人舱已经成功完成了建造。据悉,这一设备全称叫全海深载人潜水器万米级载人舱,是当前世界范围内空间最大、搭载人数最多的万米级载人舱,载人球壳使用钛合金材料,该材料用于深海装备拥有诸多优越性和独特性。查阅资料知:钛的金属活动性介于铝和铁之间。请回答下列问题:
(1)钛合金属于________(“纯净物”或“混合物”);
(2)将钛条放入硫酸铜溶液中应该能观察到的现象:________。
(3)钛合金用于深海装备主要是利用了下列性能中的?????????
。
A.抗压强度大
B.良好的导电性
C.熔点低
D.抗腐蚀性能强
32.(2019九上·绍兴月考)请根据表中物质回答下列有关问题:
序号
①
②
③
④
物质
醋酸
生石灰
熟石灰
纯碱
(1)上表中的物质属于碱的是________(填化学式)
(2)选用表中的物质作为反应物,写出制取氢氧化钠的化学方程式:________;该反应属于________(填写基本反应类型)反应.
33.(2019八下·诸暨期中)用下列物质的序号回答有关问题:
(1)已知“?”、“●”表示质子数不同的原子。如图表示的气体物质中,属于化合物的是________,属于单质的是________,属于混合物的是________.
(2)有下列物质:①雨水??②蒸馏水??③雨后洁净的空气??④四氧化三铁??⑤液氮??⑥高锰酸钾完全分解后的固体产物其中属于混合物是________,属于纯净物是________,属于单质的是________,属于氧化物的是________.
34.(2019八下·江干期中)微观示意图可形象地表示微粒发生的变化。
(1)请在图中第二、三个方框中,把NH3在纯氧中燃烧(4NH3+3O2
2N2+6H2O)的微观粒子补充完整:
(2)第三个方框中的物质属于________(填:单质、化合物、纯净物、混合物)。
五、物质的转化
35.(2020九上·杭州开学考)有一包固体,可能由硝酸铜、硫酸钠、氯化钠、碳酸氢钠、氢氧化钠中的一种或几种组成。为了探究该固体的组成,某化学小组设计并开展以下实验:
已知,步骤Ⅰ中固体全部消失,溶液呈蓝色。有气泡产生。步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成。请回答下列问题:
(1)原固体中一定含有的物质是________.依据是________.
(2)步骤II中产生白色沉淀的化学方程式是________.
(3)步骤Ⅲ所得蓝色滤液中一定含有的溶质是________.
36.(2020九上·柯桥开学考)在分开盛放的A、B两溶液中。共含有Na+、Cu2+、Ba2+、Mg2+、NO3-、OH-、SO42-七种离子,两溶液里所含离子各不相同,已知A溶液里含三种阳离子和两种阴离子,其余的在B溶液里,则B溶液里所含离子应该是________。
37.(2020·宁波)铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作补血剂。某硫酸厂产生的炉渣中除了有Fe2O3、FeO,还有一定量的SiO2。兴趣小组利用炉渣尝试制备FeCO3
,
其流程如下:
【已知:Fe+Fe2(SO4)3=3FeSO4;SiO2不溶于水,也不与稀硫酸反应】
(1)操作①的名称是________。
(2)溶液A中的溶质除H2SO4外,还存在________。
(3)上述流程中生成固体c的化学方程式________。
38.(2020·柯桥模拟)有一固体混合物质可能含有硫酸钾、硝酸铵、氯化钡中的一种或几种,现需要对此物质成分进行检测。甲同学向该固体混合物中加入足量的水,形成无色溶液;乙同学向该固体混合物中加入足量氢氧化钡溶液,产生白色沉淀,并放出刺激性气体。
(1)该气体为________(填名称)。
(2)根据两同学的实验现象可推定此固体混合物质的组成是________。
39.(2020·杭州模拟)要从含有氯化钠、氯化铜和氯化亚铁的某废液中,回收铜并得到铁红(主要成分Fe2O3),小金设计了如下图的实验方案,要求全过程不引入其他金属元素,请回答:
(1)步骤②中加入过量盐酸的目的是________。
(2)溶液丙中阴离子的符号是________。
40.(2020·富阳模拟)通过海水晒制可得粗盐,粗盐中除NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质。以下是一种由粗盐制备精盐的实验方案流程图:
分析该流程图,回答下列问题:
(1)试剂X为________(填写化学式)。
(2)加适量HCl溶液的目的是________。
(3)操作Y________。
(4)选择除杂的试剂不能用KOH代替NaOH溶液,理由是________。
41.(2020·浙江模拟)某白色固体A由氢氧化钠、硝酸钡、硫酸钠、碳酸钠、硫酸铜中的三种组成。为确定其成分,取少量A进行如下实验。
?
图中红色溶液呈________性,固体A中一定含有________。
42.(2020·台州模拟)有一包白色粉末,可能是CuSO4、Na2CO3、BaCl、Na2SO4、Ba(OH)2中的一种或几种,为证明其组成,小明进行了探究,方案及现象如图所示。据此推断:
(1)CO2通入无色滤液后有白色沉淀B生成,原因是________(用化学方程式表示);
(2)白色固体中一定含有________。
43.(2020·玉环模拟)有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品成分,某小组取适量样品按下列流程进行实验。
回答下列问题
(1)过滤操作中玻璃棒的作用是________;
(2)滤渣a的成分是
________;
(3)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品中不能确定是否存在的物质是________。
44.(2020·仙居模拟)某溶液中可能含有碳酸钠、硫酸钠、氯化钠、硝酸钠中的一种或几种,为测定其成分,取样,先后逐滴加入氯化钡溶液、稀硝酸,产生沉淀的质量与时间里的关系如图所示。
(1)由上述实验可知,原溶液中一定含有________?。
(2)实验中AB之间(不包括A、B端点)图像所对应的溶液中的溶质一定有________。BC段减少的沉淀是________。
答案解析部分
一、金属材料
1.【答案】
(1)金属(2)6.941或7(3)Li2O
2.【答案】
2%;0.03%~2%;大
3.【答案】
(1)金属(2)LiFeO4=FePO4+Li
4.【答案】
(1)②③(2)②
5.【答案】
(1)导电性(2)氧气(3)B(4)Fe2O3+6HCl=2FeCl3+3H2O
6.【答案】
(1)钴;原子序数;金属元素(2)碳;氧;化合物
7.【答案】
铜
8.【答案】
(1)大于(2)氧气和水或空气和水
9.【答案】
(1)C(2)混合物(3)黄铜片的硬度大于纯铜片
二、金属的化学性质
10.【答案】
(1)3CO+Fe2O3=Fe+3CO2;还原(2)水
11.【答案】
(1)Fe2+(2)小于
12.【答案】
(1)Fe+2HCl=Fe2Cl+H2↑;置换反应;Fe2+(2)A
13.【答案】
(1)Ag+、Cu?+、Fe2+(2)Fe(NO3)2
14.【答案】
(1)铁和铜盐反应生成铜单质,包裹在铁钉表面(2)6HCl+Fe2O3=2FeCl3+3H2O(3)b>a>c
15.【答案】
(1)②;BC(2)90%
16.【答案】
(1)大(2)水蒸气和氧气(3)B,C
17.【答案】
(1)铝(2)小(3)①④
18.【答案】
变大;生成红色固体物质,蓝色溶液褪色
19.【答案】
(1)硫酸镁、硫酸锌(2)硫酸锌或氯化锌或硝酸锌或酸等
20.【答案】
(1)Ni+CuSO4=NiSO4+Cu(2)X>Y>Z
21.【答案】
(1)Cu+2AgNO3=Cu(NO3)2+2Ag(2)Fe(NO3)2、NaNO3
三、有机化合物
22.【答案】
(1)有机物;36:5(2)+3
23.【答案】
(1)2(CH2O)n
nCH4↑+nCO2↑(2)燃烧后无有害气体生成
24.【答案】
(1)有机物(2)3:5:32
25.【答案】
(1)②③④⑥(2)CH4+2O2
CO2+2H2O(3)A(4)NO2—
26.【答案】
(1)①(2)C3H8+5O2
3CO2+4H2O(3)C2H6
27.【答案】
(1)C4H10(2)随着碳原子数目增加,沸点越来越高,相对密度越来越大(3)D
四、物质的分类
28.【答案】
AD;A;D
29.【答案】
(1)混合物(2)氮分子(氮气分子)(3)熄灭(4)A
30.【答案】
(1)分解(2)HgO
31.【答案】
(1)混合物(2)钛条表面覆盖一层红色物质(3)A,D
32.【答案】
(1)Ca(OH)2(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;复分解反应
33.【答案】
(1)B;A;CD(2)①③⑥;②④⑤;⑤;②④
34.【答案】
(1)(2)混合物
五、物质的转化
35.【答案】
(1)碳酸氢钠;向固体中加过量稀盐酸,无气泡产生(2)Na2SO4+Ba(NO3)2=2NaNO3+BaSO4↓
(3)盐酸、硝酸钠、硝酸钡、硝酸铜
36.【答案】
Ba2+、OH-
37.【答案】
(1)过滤(2)Fe2(SO4)3、FeSO4(3)Na2CO3+FeSO4=Na2SO4+FeCO3↓
38.【答案】
(1)氨气(2)硫酸钾、硝酸铵
39.【答案】
(1)除去过量的铁(2)Cl-、OH-
40.【答案】
(1)Na2CO3(2)除去多余的CO32-和OH-(3)蒸发结晶(4)会引进新的杂质KCl或K+
41.【答案】
碱性;氢氧化钠、硝酸钡、碳酸钠
42.【答案】
(1)CO2+Ba(OH)2=BaCO3↓+H2O(2)Na2CO3、Ba(OH)2
43.【答案】
(1)引流(2)碳酸钙、氢氧化镁(3)氯化镁
44.【答案】
(1)Na2CO3、Na2SO4(2)NaCl、BaCl2;BaCO3
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
