人教版选修4高中化学第二节_燃烧热-能源(24张PPT)
文档属性
| 名称 | 人教版选修4高中化学第二节_燃烧热-能源(24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 367.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-17 00:00:00 | ||
图片预览






文档简介
(共24张PPT)
由于反应的情况不同,反应热可分为燃烧热、中和热等,其中以燃烧热的实际应用最广泛。
思考
?
我们知道物质燃烧都会放出热量,那么是不是物质燃烧放出的热量就叫燃烧热呢?
一、燃烧热
1
燃烧热的的概念:
25℃
101kPa时,1mol纯物质完全燃烧生成稳定化合物时所放出的热量。
2
概念理解:
(1)研究条件:
25℃
101kPa,条件不同,反应热不同
(2)燃料的物质的量规定为1mol
(3)生成稳定化合物(即生成物物不能继续燃烧)
一般如:C
--
CO2
(g)
S
–
SO2
(g)
H–
H2O(l)
(4)单位:KJ/mol
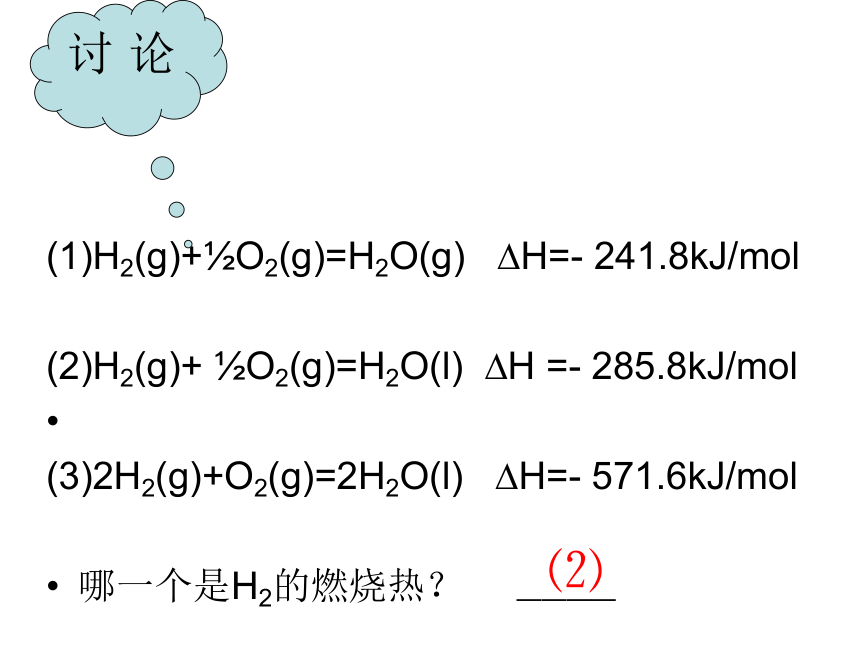
(1)H2(g)+?O2(g)=H2O(g)
?H=-
241.8kJ/mol
(2)H2(g)+
?O2(g)=H2O(l)
?H
=-
285.8kJ/mol
(3)2H2(g)+O2(g)=2H2O(l)
?H=-
571.6kJ/mol
哪一个是H2的燃烧热?
————
讨
论
⑵
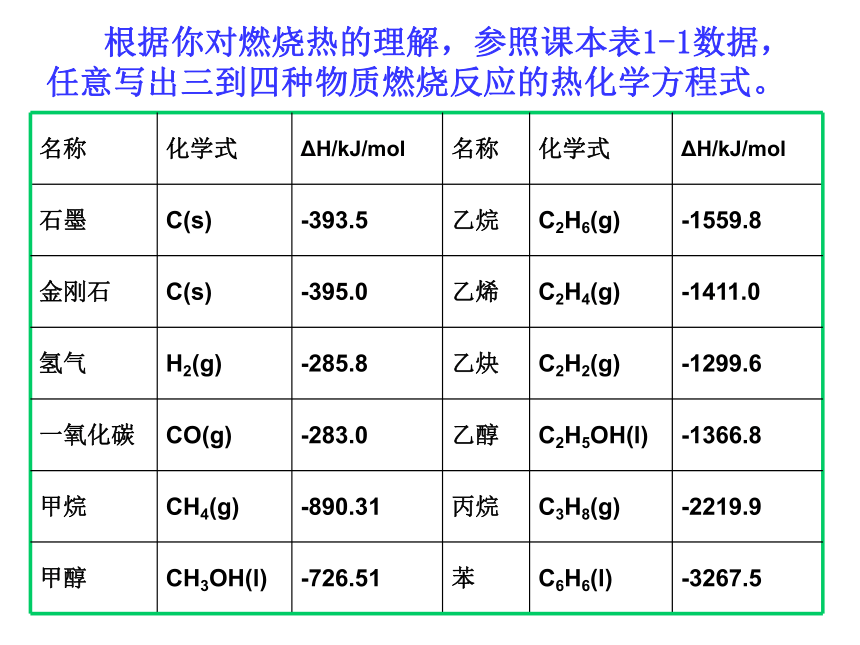
根据你对燃烧热的理解,参照课本表1-1数据,任意写出三到四种物质燃烧反应的热化学方程式。
名称
化学式
ΔH/kJ/mol
名称
化学式
ΔH/kJ/mol
石墨
C(s)
-393.5
乙烷
C2H6(g)
-1559.8
金刚石
C(s)
-395.0
乙烯
C2H4(g)
-1411.0
氢气
H2(g)
-285.8
乙炔
C2H2(g)
-1299.6
一氧化碳
CO(g)
-283.0
乙醇
C2H5OH(l)
-1366.8
甲烷
CH4(g)
-890.31
丙烷
C3H8(g)
-2219.9
甲醇
CH3OH(l)
-726.51
苯
C6H6(l)
-3267.5
3.表示的意义:
4.表示燃烧热的热化学方程式的书写:
含义:
在101KPa时,
1molCO完全燃烧时,放出
283.0KJ的热量.
如:
CO的燃烧热为283.0KJ/mol.
应以1mol物质的标准来配平其余物质的化学计量数(常出现分数)
5.一定量可燃物完全燃烧时放出的热量:
Q放=n(可燃物)ⅹ△Hc
Q放为可燃物燃烧反应放出的热量;n为可燃物
的物质的量;△Hc为可燃物的燃烧热。
燃烧放出的热量与燃烧热有什么不同?
所以,不同量的同一物质完全燃烧,放出的热量可能不同,但燃烧热相等。
(1)燃烧放出的热量与物质的多少有关,燃烧的物质越多,放出的热量就越多,而燃烧热规定是1
mol的可燃物;
(2)研究燃烧放出的热量并未限定燃烧产物的形
态,而研究燃烧热必须是生成稳定的氧化物。
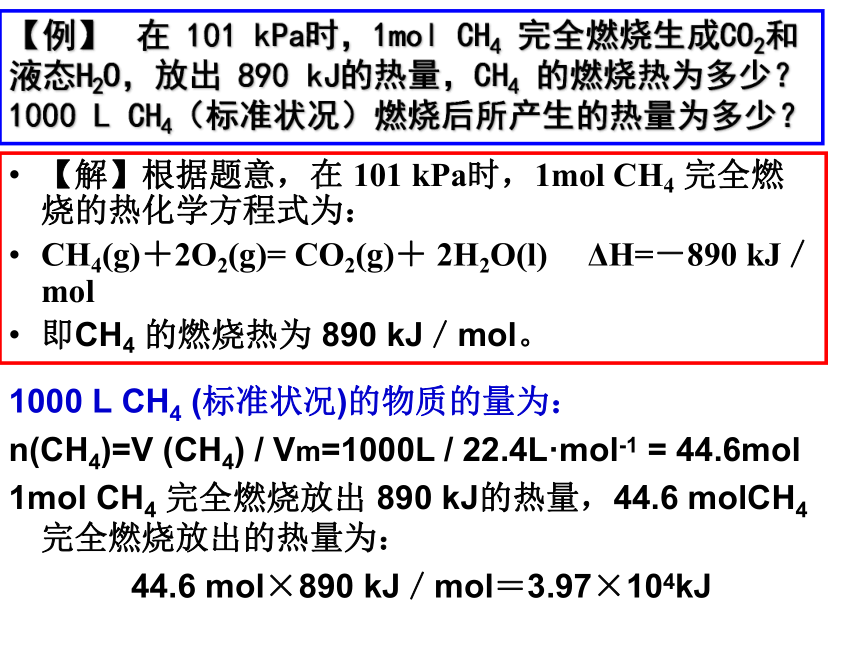
【例】?
在
101
kPa时,1mol
CH4
完全燃烧生成CO2和液态H2O,放出
890
kJ的热量,CH4
的燃烧热为多少?
1000
L
CH4(标准状况)燃烧后所产生的热量为多少?
【解】根据题意,在
101
kPa时,1mol
CH4
完全燃烧的热化学方程式为:
CH4(g)+2O2(g)=
CO2(g)+
2H2O(l)
ΔH=-890
kJ/mol
即CH4
的燃烧热为
890
kJ/mol。
1000
L
CH4
(标准状况)的物质的量为:
n(CH4)=V
(CH4)
/
Vm=1000L
/
22.4L·mol-1
=
44.6mol
1mol
CH4
完全燃烧放出
890
kJ的热量,44.6
molCH4
完全燃烧放出的热量为:
44.6
mol×890
kJ/mol=3.97×104kJ
相
同
点
燃烧热
中和热
能量变化
ΔH
不
同
点
反应物的量
生成物的量
反应热
的含义
放热反应
ΔH<0
,
单位
kJ/mol
1mol可燃物
不限量
不限量
H2O
1mol
1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同
酸碱中和生成1molH2O时放出的热量,
燃烧热与中和热的区别与联系
(2)“中和热的热化学方程式”与“中和反应的热化学方程式”的书写不同。书写中和热的热化学方程式时生成的水必须为1
mol,书写中和反应的热化学方程式时生成的水的量可为任意值。
[特别提醒]
(1)“燃烧热的热化学方程式”与“燃烧的热化学方程式”的书写不同。写燃烧热的热化学方程式时可燃物必须为1
mol,燃烧的热化学方程式不强调可燃物的物质的量,可为任意值。
1、能源就是能提供
自然资源,包括
等。
2、我国目前使用的主要能源是
,是不能
3、能源是国民经济和社会发展的重要物质基础,它的开发和利用情况,可以用来衡量一个国家或地区的经济发展和科学技术水平
4、解决能源的办法是
,即开发
和节约
,提高能源的
。
5、现在探索开发的新能源有
等,
新能源的主要优势是
。
能量
化石燃料(煤、石油、天然气)
、阳光、生物能、风能、地热能、海洋(潮汐)能
化石燃料
再生
开源节流
新的能源
现有能源
利用率
太阳能、氢能、地热能、海洋(潮汐)能、生物能
资源丰富,可以再生,污染少
二、能源
[问题]
1.什么是化石燃料?目前使用最多的燃料是什么?
2.燃料燃烧、充分燃烧的条件分别是什么?
化石燃料――煤、石油、天然气。
(1)通入充足且适量的空气;
(2)固体燃料粉碎、液体燃料喷雾以增大燃料与空气的接触面。
(3)煤炭的气化和液化,既防止污染,又提高燃烧率。
3.为什么固体燃料要粉碎后使用?
2、我国的能源状况如何?
(1)目前使用的主要
能源是何种能源?
(2)我国的能源储量。
(3)我国的人均能源拥有量。
(4)近年来我国能源的总消费量与人均消费量情况。
3、了解了我国的能源利用率,你有何感想?
能源问题
开源、节流
思考与交流
应根据什么标准来选择燃料?
物质的燃烧热
燃料的储量
燃料的开采、运输
燃料储存的条件、价格
燃料对生态环境的影响
煤作为燃料的利弊?提高煤燃烧效率的措施有哪些?
【练习8】在36g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且已知:
C(g)+1/2O2
=
CO(g)
ΔH=-110.5kJ/mol;
CO(g)+1/2O2(g)=
CO2(g)
ΔH=-283kJ/mol.
与这些碳完全燃烧相比,损失的热量是(
)
A.172.5kJ
B.1149kJ
C.283kJ
D.517.5kJ
C
【练习10】已知热化学方程式:
2H2(g)+O2(g)=2H2O(g)
ΔH1=-483.6kJ/mol,
则对于热化学方程式:2H2O(l)=2H2(g)+O2(g)
ΔH2=b,
下列说法正确的是
A.该反应的ΔH2=+483.6kJ/mol
B.|ΔH2|<|ΔH1|
C.|ΔH2|>|ΔH1|
D.热化学方程式中化学计量数表示分子个数
C
【练习11】下列说法正确的是
A.任何化学反应都伴随着能量的变化
B.0.5molH2SO4和0.5molBa(OH)2完全反应所放出
的热量称为中和热
C.在101kPa时,1mol碳燃烧放出的热量就是碳的燃烧热
D.在化学反应中需要加热的反应就是吸热反应
A
【练习12】.已知反应:
①101
kPa时2C(s)+O2(g)==2CO(g)
ΔH=-221kJ?mol-1
②稀溶液中,H+(aq)+OH-(aq)==H2O(l)
ΔH=-57.3
kJ?mol-1
下列结论正确的是(
)
A、碳的燃烧热大于110.5
kJ?mol-1
B、
①的反应热为221
kJ?mol-1
C、HCl和NaOH反应的中和热ΔH=-57.3
kJ?mol-1
,则
H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ?mol-1
D、稀醋酸与稀NaOH溶液反应生成1
mol水,放出57.3
kJ热量
A
5、下列关于热化学反应的描述中正确的是
A、HCl和NaOH反应的中和热△H=-57.3KJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)KJ/mol
B、CO(g)的燃烧热是283KJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283KJ/mol
C、需要加热才能发生的反应一定是吸热反应
D、1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
B
8、下列说法不正确的是
(
)
A.
化石燃料在任何条件下都能充分燃烧
B.
化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C.
直接燃烧煤不如将煤进行深加工后再燃烧的效果好
D.
固体煤变为气体燃料后,燃烧效率将提高
9、为了减少大气污染,许多城市正大力推广汽车清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分均为
(
)
A.碳氢化合物
B.碳水化合物
C.氢气
D.醇类
A
A
6、已知下列两个热化学方程式;
H2(g)+O2(g)=H2O(1)
△H=-285.kJ/mol
C3H8(g)+5O2
(g)=3CO2(g)+4H2O(1)
△H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是
。
(2)已知:H2O(1)=H2O(g)
△H=+44.0kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式。
C3H8(g)+5O2(g)=3CO2
(g)+4H2O(g)
△H=-2044kJ/mol
1:1
【练习】
1、下列属于一次能源的是(
),属于二次能源的是(
)
A
D
E
B
C
A
风能
B
电能
C
氢能
D
阳光
E
天然气
①一级能源与二级能源
一级能源:从自然界直接取得的能源,如:煤、石油、天然气等;
二级能源:一级能源经过加工转化后得到的能源,如:煤气、电力、沼气、
氢能等
②可再生能源与非可再生能源
可再生能源:可连续再生,永久利用的一级能源,如:水能、风能等;
非可再生能源:经过亿万年形成,短期内无法恢复的能源,如:石油、煤、
天然气等。
③常规能源与新能源
常规能源:已被广泛利用的能源,如:煤、天然气、水能等;
新能源:才刚开始被人类采用先进的方法加以利用的能源以及新发展的利用先进技术获得的能源,如:核聚变能、海洋能、太阳能等。
3.“能源分类相关图”如下图所示,四组能源选项中全部符合图中阴影部分的能源是(
)
??????????????
A.煤炭、石油、潮汐能
B.水能、生物能、天然气
C.太阳能、风能、沼气
D.地热能、海洋能、核能
C
由于反应的情况不同,反应热可分为燃烧热、中和热等,其中以燃烧热的实际应用最广泛。
思考
?
我们知道物质燃烧都会放出热量,那么是不是物质燃烧放出的热量就叫燃烧热呢?
一、燃烧热
1
燃烧热的的概念:
25℃
101kPa时,1mol纯物质完全燃烧生成稳定化合物时所放出的热量。
2
概念理解:
(1)研究条件:
25℃
101kPa,条件不同,反应热不同
(2)燃料的物质的量规定为1mol
(3)生成稳定化合物(即生成物物不能继续燃烧)
一般如:C
--
CO2
(g)
S
–
SO2
(g)
H–
H2O(l)
(4)单位:KJ/mol
(1)H2(g)+?O2(g)=H2O(g)
?H=-
241.8kJ/mol
(2)H2(g)+
?O2(g)=H2O(l)
?H
=-
285.8kJ/mol
(3)2H2(g)+O2(g)=2H2O(l)
?H=-
571.6kJ/mol
哪一个是H2的燃烧热?
————
讨
论
⑵
根据你对燃烧热的理解,参照课本表1-1数据,任意写出三到四种物质燃烧反应的热化学方程式。
名称
化学式
ΔH/kJ/mol
名称
化学式
ΔH/kJ/mol
石墨
C(s)
-393.5
乙烷
C2H6(g)
-1559.8
金刚石
C(s)
-395.0
乙烯
C2H4(g)
-1411.0
氢气
H2(g)
-285.8
乙炔
C2H2(g)
-1299.6
一氧化碳
CO(g)
-283.0
乙醇
C2H5OH(l)
-1366.8
甲烷
CH4(g)
-890.31
丙烷
C3H8(g)
-2219.9
甲醇
CH3OH(l)
-726.51
苯
C6H6(l)
-3267.5
3.表示的意义:
4.表示燃烧热的热化学方程式的书写:
含义:
在101KPa时,
1molCO完全燃烧时,放出
283.0KJ的热量.
如:
CO的燃烧热为283.0KJ/mol.
应以1mol物质的标准来配平其余物质的化学计量数(常出现分数)
5.一定量可燃物完全燃烧时放出的热量:
Q放=n(可燃物)ⅹ△Hc
Q放为可燃物燃烧反应放出的热量;n为可燃物
的物质的量;△Hc为可燃物的燃烧热。
燃烧放出的热量与燃烧热有什么不同?
所以,不同量的同一物质完全燃烧,放出的热量可能不同,但燃烧热相等。
(1)燃烧放出的热量与物质的多少有关,燃烧的物质越多,放出的热量就越多,而燃烧热规定是1
mol的可燃物;
(2)研究燃烧放出的热量并未限定燃烧产物的形
态,而研究燃烧热必须是生成稳定的氧化物。
【例】?
在
101
kPa时,1mol
CH4
完全燃烧生成CO2和液态H2O,放出
890
kJ的热量,CH4
的燃烧热为多少?
1000
L
CH4(标准状况)燃烧后所产生的热量为多少?
【解】根据题意,在
101
kPa时,1mol
CH4
完全燃烧的热化学方程式为:
CH4(g)+2O2(g)=
CO2(g)+
2H2O(l)
ΔH=-890
kJ/mol
即CH4
的燃烧热为
890
kJ/mol。
1000
L
CH4
(标准状况)的物质的量为:
n(CH4)=V
(CH4)
/
Vm=1000L
/
22.4L·mol-1
=
44.6mol
1mol
CH4
完全燃烧放出
890
kJ的热量,44.6
molCH4
完全燃烧放出的热量为:
44.6
mol×890
kJ/mol=3.97×104kJ
相
同
点
燃烧热
中和热
能量变化
ΔH
不
同
点
反应物的量
生成物的量
反应热
的含义
放热反应
ΔH<0
,
单位
kJ/mol
1mol可燃物
不限量
不限量
H2O
1mol
1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同
酸碱中和生成1molH2O时放出的热量,
燃烧热与中和热的区别与联系
(2)“中和热的热化学方程式”与“中和反应的热化学方程式”的书写不同。书写中和热的热化学方程式时生成的水必须为1
mol,书写中和反应的热化学方程式时生成的水的量可为任意值。
[特别提醒]
(1)“燃烧热的热化学方程式”与“燃烧的热化学方程式”的书写不同。写燃烧热的热化学方程式时可燃物必须为1
mol,燃烧的热化学方程式不强调可燃物的物质的量,可为任意值。
1、能源就是能提供
自然资源,包括
等。
2、我国目前使用的主要能源是
,是不能
3、能源是国民经济和社会发展的重要物质基础,它的开发和利用情况,可以用来衡量一个国家或地区的经济发展和科学技术水平
4、解决能源的办法是
,即开发
和节约
,提高能源的
。
5、现在探索开发的新能源有
等,
新能源的主要优势是
。
能量
化石燃料(煤、石油、天然气)
、阳光、生物能、风能、地热能、海洋(潮汐)能
化石燃料
再生
开源节流
新的能源
现有能源
利用率
太阳能、氢能、地热能、海洋(潮汐)能、生物能
资源丰富,可以再生,污染少
二、能源
[问题]
1.什么是化石燃料?目前使用最多的燃料是什么?
2.燃料燃烧、充分燃烧的条件分别是什么?
化石燃料――煤、石油、天然气。
(1)通入充足且适量的空气;
(2)固体燃料粉碎、液体燃料喷雾以增大燃料与空气的接触面。
(3)煤炭的气化和液化,既防止污染,又提高燃烧率。
3.为什么固体燃料要粉碎后使用?
2、我国的能源状况如何?
(1)目前使用的主要
能源是何种能源?
(2)我国的能源储量。
(3)我国的人均能源拥有量。
(4)近年来我国能源的总消费量与人均消费量情况。
3、了解了我国的能源利用率,你有何感想?
能源问题
开源、节流
思考与交流
应根据什么标准来选择燃料?
物质的燃烧热
燃料的储量
燃料的开采、运输
燃料储存的条件、价格
燃料对生态环境的影响
煤作为燃料的利弊?提高煤燃烧效率的措施有哪些?
【练习8】在36g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且已知:
C(g)+1/2O2
=
CO(g)
ΔH=-110.5kJ/mol;
CO(g)+1/2O2(g)=
CO2(g)
ΔH=-283kJ/mol.
与这些碳完全燃烧相比,损失的热量是(
)
A.172.5kJ
B.1149kJ
C.283kJ
D.517.5kJ
C
【练习10】已知热化学方程式:
2H2(g)+O2(g)=2H2O(g)
ΔH1=-483.6kJ/mol,
则对于热化学方程式:2H2O(l)=2H2(g)+O2(g)
ΔH2=b,
下列说法正确的是
A.该反应的ΔH2=+483.6kJ/mol
B.|ΔH2|<|ΔH1|
C.|ΔH2|>|ΔH1|
D.热化学方程式中化学计量数表示分子个数
C
【练习11】下列说法正确的是
A.任何化学反应都伴随着能量的变化
B.0.5molH2SO4和0.5molBa(OH)2完全反应所放出
的热量称为中和热
C.在101kPa时,1mol碳燃烧放出的热量就是碳的燃烧热
D.在化学反应中需要加热的反应就是吸热反应
A
【练习12】.已知反应:
①101
kPa时2C(s)+O2(g)==2CO(g)
ΔH=-221kJ?mol-1
②稀溶液中,H+(aq)+OH-(aq)==H2O(l)
ΔH=-57.3
kJ?mol-1
下列结论正确的是(
)
A、碳的燃烧热大于110.5
kJ?mol-1
B、
①的反应热为221
kJ?mol-1
C、HCl和NaOH反应的中和热ΔH=-57.3
kJ?mol-1
,则
H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ?mol-1
D、稀醋酸与稀NaOH溶液反应生成1
mol水,放出57.3
kJ热量
A
5、下列关于热化学反应的描述中正确的是
A、HCl和NaOH反应的中和热△H=-57.3KJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)KJ/mol
B、CO(g)的燃烧热是283KJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283KJ/mol
C、需要加热才能发生的反应一定是吸热反应
D、1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
B
8、下列说法不正确的是
(
)
A.
化石燃料在任何条件下都能充分燃烧
B.
化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C.
直接燃烧煤不如将煤进行深加工后再燃烧的效果好
D.
固体煤变为气体燃料后,燃烧效率将提高
9、为了减少大气污染,许多城市正大力推广汽车清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分均为
(
)
A.碳氢化合物
B.碳水化合物
C.氢气
D.醇类
A
A
6、已知下列两个热化学方程式;
H2(g)+O2(g)=H2O(1)
△H=-285.kJ/mol
C3H8(g)+5O2
(g)=3CO2(g)+4H2O(1)
△H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是
。
(2)已知:H2O(1)=H2O(g)
△H=+44.0kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式。
C3H8(g)+5O2(g)=3CO2
(g)+4H2O(g)
△H=-2044kJ/mol
1:1
【练习】
1、下列属于一次能源的是(
),属于二次能源的是(
)
A
D
E
B
C
A
风能
B
电能
C
氢能
D
阳光
E
天然气
①一级能源与二级能源
一级能源:从自然界直接取得的能源,如:煤、石油、天然气等;
二级能源:一级能源经过加工转化后得到的能源,如:煤气、电力、沼气、
氢能等
②可再生能源与非可再生能源
可再生能源:可连续再生,永久利用的一级能源,如:水能、风能等;
非可再生能源:经过亿万年形成,短期内无法恢复的能源,如:石油、煤、
天然气等。
③常规能源与新能源
常规能源:已被广泛利用的能源,如:煤、天然气、水能等;
新能源:才刚开始被人类采用先进的方法加以利用的能源以及新发展的利用先进技术获得的能源,如:核聚变能、海洋能、太阳能等。
3.“能源分类相关图”如下图所示,四组能源选项中全部符合图中阴影部分的能源是(
)
??????????????
A.煤炭、石油、潮汐能
B.水能、生物能、天然气
C.太阳能、风能、沼气
D.地热能、海洋能、核能
C
