人教版选修四高中化学2--影响化学反应速率的因素(26张PPT)
文档属性
| 名称 | 人教版选修四高中化学2--影响化学反应速率的因素(26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 392.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-17 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
2、影响化学反应速率的因素
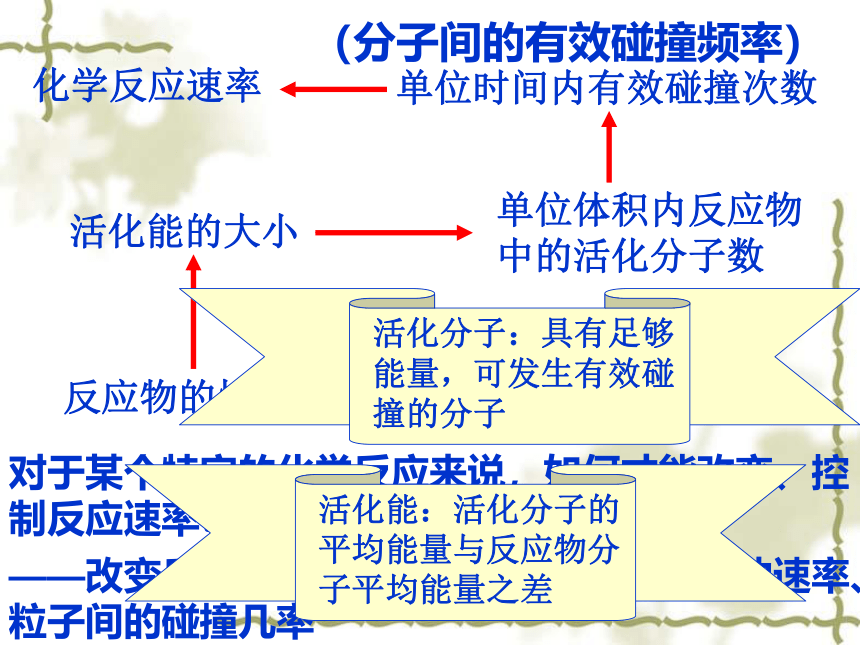
(分子间的有效碰撞频率)
化学反应速率
单位时间内有效碰撞次数
单位体积内反应物中的活化分子数
活化能的大小
反应物的性质
物质的结构
对于某个特定的化学反应来说,如何才能改变、控制反应速率?
——改变反应物的内能、活化能、粒子的运动速率、粒子间的碰撞几率
活化能:活化分子的平均能量与反应物分子平均能量之差
活化分子:具有足够能量,可发生有效碰撞的分子
思考与交流:影响化学反应速率的因素有哪些?
是如何影响的?怎样解释?
升高温度或降低温度
增大或减小反应物的浓度
对于有气体参加的化学反应来说,增大压强或减小压强
改变固体反应物的接触面
加催化剂
1)不变的因素
2)控制条件(自变量)
3)结果(因变量)
一般是随着条件的变化而发生变化的、且易于测量的物理量
——草酸溶液的浓度不同
——KMnO4溶液的浓度相同
——温度相同
——测量溶液褪色的时间
一、浓度对反应速率的影响
【实验2-2】
思考与交流:这些条件是如何影响化学反应速率的?怎样解释?
增大或减小反应物的浓度
浓度越大,反应速率越快;
浓度越小,反应速率越慢。
当反应物浓度增大时,单位体积内分子数增多,
活化分子数也相应增加,反应速率必然增大。
改变了单位体积中的活化分子总数。
对于可逆反应:2SO2
+
O2
2SO3来说:
增大SO2、O2的浓度,正、逆反应速率如何变化?
——正反应速率突然加快,逆反应速率不变
增大SO3的浓度,正、逆反应速率如何变化?
——逆反应速率突然加快,正反应速率不变
减小SO2、O2的浓度,正、逆反应速率如何变化?
——正反应速率突然减小,逆反应速率不变
减小SO3的浓度,正、逆反应速率如何变化?
——逆反应速率突然减小,正反应速率不变
二、压强对反应速率的影响
增大或减小压强,化学反应速率如何变化?为什么?
增大压强,气体物质的浓度增大,该气体所发生的反应的速率加快
。
减小压强,气体物质的浓度减小,该气体所发生的反应的速率减慢。
对于可逆反应:2SO2
+
O2
2SO3
△H<0来说:
增大压强,正、逆反应速率如何变化?
——正反应速率和逆反应速率都突然加快
减小压强,正、逆反应速率如何变化?
——正反应速率和逆反应速率都突然减慢
对于有气体参加的化学反应来说,增大压强或减小压强
增大压强,化学反应速率加快;
减小压强,化学反应速率减慢。
改变了反应物的浓度,改变了单位体积内活化分子数。
思考与交流:这些条件是如何影响化学反应速率的?怎样解释?
压强对反应速率的影响实际是因为压强的改变使浓度发生改变的结果。
三、温度对反应速率的影响
【实验2-3】
1)不变的因素
2)控制条件(自变量)
3)结果(因变量)
一般是随着条件的变化而发生变化的、且易于测量的物理量
——反应物及浓度相同
——温度不同
——测量出现浑浊的时间
升高温度或降低温度
升高温度,化学反应速率加快;
降低温度,化学反应速率减慢。
升高温度,既使分子获得了更高的能量,提高了活化分子的百分数;又提高分子间的碰撞频率。
提高了分子间有效碰撞的几率,速率增大
思考与交流:这些条件是如何影响化学反应速率的?怎样解释?
对于可逆反应:2SO2
+
O2
2SO3
△H<0来说:
升高温度,正、逆反应速率如何变化?
——正反应速率和逆反应速率都增大,但吸热反应方向的速率增大得更多
降低温度,正、逆反应速率如何变化?
——正反应速率和逆反应速率都减小,但吸热反应方向的速率减小得更多
【科学探究】
请设计实验探究溶液出现蓝色与温度的关系
1、取两支试管,先分别向两支试管中加入2
mL
KI溶液,再加入淀粉溶液,最后加入稀硫酸
2、将两支试管分别置于室温和0
℃时进行实验,并记录实验现象
1)不变的因素
2)控制条件(自变量)
3)结果(因变量)
一般是随着条件的变化而发生变化的、且易于测量的物理量
——H2O2溶液的浓度相同
——温度相同
——是否用催化剂
——测量余烬复燃所需的时间
四、【实验2-4】催化剂对反应速率的影响
加催化剂
加入催化剂可以改变化学反应速率
。
改变了活化能,从而改变了活化分子的百分数
思考与交流:这些条件是如何影响化学反应速率的?怎样解释?
能量
反应过程
E1
E2
ΔH
无催化反应
催化反应
(1)使用催化剂能改变反应速率,但反应热没变。
(2)使用适当的催化剂能减少过程中的能耗。
(3)理想的催化剂还可以大幅度提高目标产物在
最终产物中的比率。
对于可逆反应:2SO2
+
O2
2SO3
△H<0来说:
加催化剂,正、逆反应速率如何变化?
——正反应速率和逆反应速率都突然加快且增大相同的倍数
1)找出某种易于测量的某种物理量或性质的变化
2)确定变量
3)控制不变的因素
——用不同催化剂
——H2O2溶液的浓度相同
——温度相同
——测量产生气泡的快慢
①比较相同时间内所收集气体的体积
②比较收集相同体积的气体所耗的时间
不同催化剂对反应速率的影响
【科学探究1】
1)找出某种易于测量的某种物理量或性质的变化
2)确定变量
3)控制不变的因素
——是否催化剂
——草酸溶液的浓度相同
——温度相同
——测量溶液褪色所用的时间
【科学探究2】
1)找出某种易于测量的某种物理量或性质的变化
2)确定变量
3)控制不变的因素
——用不同催化剂
——淀粉溶液、碘水的浓度相同
——温度相同
——测量溶液蓝色褪去所用的时间
【科学探究3】
增大固体反应物的接触面积
粉末状的固体比块状固体的反应速率快。
改变了粒子间的碰撞几率
思考与交流:这些条件是如何影响化学反应速率的?怎样解释?
1、内因:
反应物本身的性质。
2、外因:
①温度:
②催化剂:
③浓度:
④固体物质的表面积:
⑤反应物的状态:
影响化学反应速率的因素
温度越高,反应速率越快。
催化剂可以改变化学反应速率。
反应物的浓度越大,反应速率越快。
粉末状的固体比块状固体
的反应速率快。
溶液中进行的反应,速率更快。
【归纳、小结】
1)机动车加大油门
——增大反应物(油)的浓度,增大单位体积中的活化分子总数
2)向炉膛鼓风
——增大反应物的浓度,增大单位体积中的活化分子总数
3)在糕点包装内加脱氧剂
——减小氧气的浓度,减小单位体积中的活化分子总数
4)用煤粉代替煤块
——增大反应物的接触面,增大有效碰撞几率
请列举生活中有关影响化学反应速率的事实
下列措施为什么能改变化学反应速率?
5)用温水发酵面粉
——升高温度,增大活化分子百分数
6)把食物放在冰箱里以延长保鲜期
——降低温度,减小活化分子百分数
7)H2O2分解加MnO2
——加正催化剂,减小活化能,增大活化分子的百分数
8)化学实验时常常要振荡和搅拌
——增加有效碰撞几率
【练习1】在锌和某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
序号
锌的质量/g
锌的形状
温度/℃
完全溶解于酸的时间/s
A
2
薄片
5
400
B
2
薄片
15
200
C
2
薄片
25
100
D
2
薄片
30
t1
E
2
薄片
35
50
F
2
颗粒
15
t2
G
2
粉末
15
t3
则下列说法正确的是(
)
①t1
=
75s
②t2>200>t3
③单位时间内消耗的锌的质量mG>mF>mB
A.
①
B.
①②
C.
只有②
D.
全部正确
C
【练习2】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率加快的是(
)
A
加热
B
不用稀硫酸,改用98.3%的浓硫酸
C
滴加少量CuSO4溶液
D
不用铁片,改用铁粉
B
2、影响化学反应速率的因素
(分子间的有效碰撞频率)
化学反应速率
单位时间内有效碰撞次数
单位体积内反应物中的活化分子数
活化能的大小
反应物的性质
物质的结构
对于某个特定的化学反应来说,如何才能改变、控制反应速率?
——改变反应物的内能、活化能、粒子的运动速率、粒子间的碰撞几率
活化能:活化分子的平均能量与反应物分子平均能量之差
活化分子:具有足够能量,可发生有效碰撞的分子
思考与交流:影响化学反应速率的因素有哪些?
是如何影响的?怎样解释?
升高温度或降低温度
增大或减小反应物的浓度
对于有气体参加的化学反应来说,增大压强或减小压强
改变固体反应物的接触面
加催化剂
1)不变的因素
2)控制条件(自变量)
3)结果(因变量)
一般是随着条件的变化而发生变化的、且易于测量的物理量
——草酸溶液的浓度不同
——KMnO4溶液的浓度相同
——温度相同
——测量溶液褪色的时间
一、浓度对反应速率的影响
【实验2-2】
思考与交流:这些条件是如何影响化学反应速率的?怎样解释?
增大或减小反应物的浓度
浓度越大,反应速率越快;
浓度越小,反应速率越慢。
当反应物浓度增大时,单位体积内分子数增多,
活化分子数也相应增加,反应速率必然增大。
改变了单位体积中的活化分子总数。
对于可逆反应:2SO2
+
O2
2SO3来说:
增大SO2、O2的浓度,正、逆反应速率如何变化?
——正反应速率突然加快,逆反应速率不变
增大SO3的浓度,正、逆反应速率如何变化?
——逆反应速率突然加快,正反应速率不变
减小SO2、O2的浓度,正、逆反应速率如何变化?
——正反应速率突然减小,逆反应速率不变
减小SO3的浓度,正、逆反应速率如何变化?
——逆反应速率突然减小,正反应速率不变
二、压强对反应速率的影响
增大或减小压强,化学反应速率如何变化?为什么?
增大压强,气体物质的浓度增大,该气体所发生的反应的速率加快
。
减小压强,气体物质的浓度减小,该气体所发生的反应的速率减慢。
对于可逆反应:2SO2
+
O2
2SO3
△H<0来说:
增大压强,正、逆反应速率如何变化?
——正反应速率和逆反应速率都突然加快
减小压强,正、逆反应速率如何变化?
——正反应速率和逆反应速率都突然减慢
对于有气体参加的化学反应来说,增大压强或减小压强
增大压强,化学反应速率加快;
减小压强,化学反应速率减慢。
改变了反应物的浓度,改变了单位体积内活化分子数。
思考与交流:这些条件是如何影响化学反应速率的?怎样解释?
压强对反应速率的影响实际是因为压强的改变使浓度发生改变的结果。
三、温度对反应速率的影响
【实验2-3】
1)不变的因素
2)控制条件(自变量)
3)结果(因变量)
一般是随着条件的变化而发生变化的、且易于测量的物理量
——反应物及浓度相同
——温度不同
——测量出现浑浊的时间
升高温度或降低温度
升高温度,化学反应速率加快;
降低温度,化学反应速率减慢。
升高温度,既使分子获得了更高的能量,提高了活化分子的百分数;又提高分子间的碰撞频率。
提高了分子间有效碰撞的几率,速率增大
思考与交流:这些条件是如何影响化学反应速率的?怎样解释?
对于可逆反应:2SO2
+
O2
2SO3
△H<0来说:
升高温度,正、逆反应速率如何变化?
——正反应速率和逆反应速率都增大,但吸热反应方向的速率增大得更多
降低温度,正、逆反应速率如何变化?
——正反应速率和逆反应速率都减小,但吸热反应方向的速率减小得更多
【科学探究】
请设计实验探究溶液出现蓝色与温度的关系
1、取两支试管,先分别向两支试管中加入2
mL
KI溶液,再加入淀粉溶液,最后加入稀硫酸
2、将两支试管分别置于室温和0
℃时进行实验,并记录实验现象
1)不变的因素
2)控制条件(自变量)
3)结果(因变量)
一般是随着条件的变化而发生变化的、且易于测量的物理量
——H2O2溶液的浓度相同
——温度相同
——是否用催化剂
——测量余烬复燃所需的时间
四、【实验2-4】催化剂对反应速率的影响
加催化剂
加入催化剂可以改变化学反应速率
。
改变了活化能,从而改变了活化分子的百分数
思考与交流:这些条件是如何影响化学反应速率的?怎样解释?
能量
反应过程
E1
E2
ΔH
无催化反应
催化反应
(1)使用催化剂能改变反应速率,但反应热没变。
(2)使用适当的催化剂能减少过程中的能耗。
(3)理想的催化剂还可以大幅度提高目标产物在
最终产物中的比率。
对于可逆反应:2SO2
+
O2
2SO3
△H<0来说:
加催化剂,正、逆反应速率如何变化?
——正反应速率和逆反应速率都突然加快且增大相同的倍数
1)找出某种易于测量的某种物理量或性质的变化
2)确定变量
3)控制不变的因素
——用不同催化剂
——H2O2溶液的浓度相同
——温度相同
——测量产生气泡的快慢
①比较相同时间内所收集气体的体积
②比较收集相同体积的气体所耗的时间
不同催化剂对反应速率的影响
【科学探究1】
1)找出某种易于测量的某种物理量或性质的变化
2)确定变量
3)控制不变的因素
——是否催化剂
——草酸溶液的浓度相同
——温度相同
——测量溶液褪色所用的时间
【科学探究2】
1)找出某种易于测量的某种物理量或性质的变化
2)确定变量
3)控制不变的因素
——用不同催化剂
——淀粉溶液、碘水的浓度相同
——温度相同
——测量溶液蓝色褪去所用的时间
【科学探究3】
增大固体反应物的接触面积
粉末状的固体比块状固体的反应速率快。
改变了粒子间的碰撞几率
思考与交流:这些条件是如何影响化学反应速率的?怎样解释?
1、内因:
反应物本身的性质。
2、外因:
①温度:
②催化剂:
③浓度:
④固体物质的表面积:
⑤反应物的状态:
影响化学反应速率的因素
温度越高,反应速率越快。
催化剂可以改变化学反应速率。
反应物的浓度越大,反应速率越快。
粉末状的固体比块状固体
的反应速率快。
溶液中进行的反应,速率更快。
【归纳、小结】
1)机动车加大油门
——增大反应物(油)的浓度,增大单位体积中的活化分子总数
2)向炉膛鼓风
——增大反应物的浓度,增大单位体积中的活化分子总数
3)在糕点包装内加脱氧剂
——减小氧气的浓度,减小单位体积中的活化分子总数
4)用煤粉代替煤块
——增大反应物的接触面,增大有效碰撞几率
请列举生活中有关影响化学反应速率的事实
下列措施为什么能改变化学反应速率?
5)用温水发酵面粉
——升高温度,增大活化分子百分数
6)把食物放在冰箱里以延长保鲜期
——降低温度,减小活化分子百分数
7)H2O2分解加MnO2
——加正催化剂,减小活化能,增大活化分子的百分数
8)化学实验时常常要振荡和搅拌
——增加有效碰撞几率
【练习1】在锌和某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
序号
锌的质量/g
锌的形状
温度/℃
完全溶解于酸的时间/s
A
2
薄片
5
400
B
2
薄片
15
200
C
2
薄片
25
100
D
2
薄片
30
t1
E
2
薄片
35
50
F
2
颗粒
15
t2
G
2
粉末
15
t3
则下列说法正确的是(
)
①t1
=
75s
②t2>200>t3
③单位时间内消耗的锌的质量mG>mF>mB
A.
①
B.
①②
C.
只有②
D.
全部正确
C
【练习2】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率加快的是(
)
A
加热
B
不用稀硫酸,改用98.3%的浓硫酸
C
滴加少量CuSO4溶液
D
不用铁片,改用铁粉
B
