人教版选修5高中化学第二章2.2:芳香烃(37PPT)
文档属性
| 名称 | 人教版选修5高中化学第二章2.2:芳香烃(37PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-19 00:00:00 | ||
图片预览





文档简介
(共37张PPT)
组织建设
化学
·
选修5《有机化学基础》
芳香烃
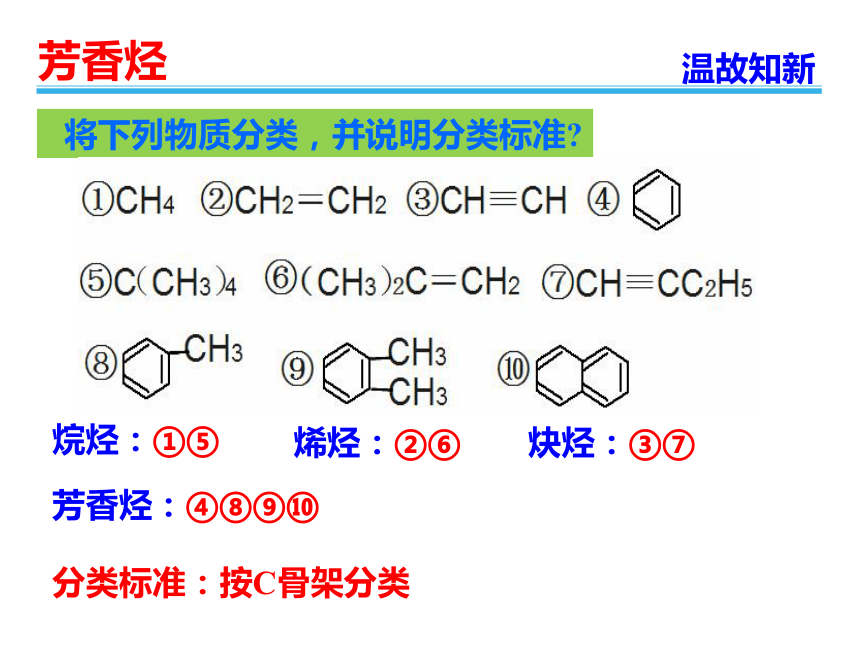
将下列物质分类,并说明分类标准?
烷烃:①⑤
烯烃:②⑥
炔烃:③⑦
芳香烃:④⑧⑨⑩
分类标准:按C骨架分类
温故知新
温故知新
芳香烃及其化合物的来源——煤的干馏,石油的催化重整
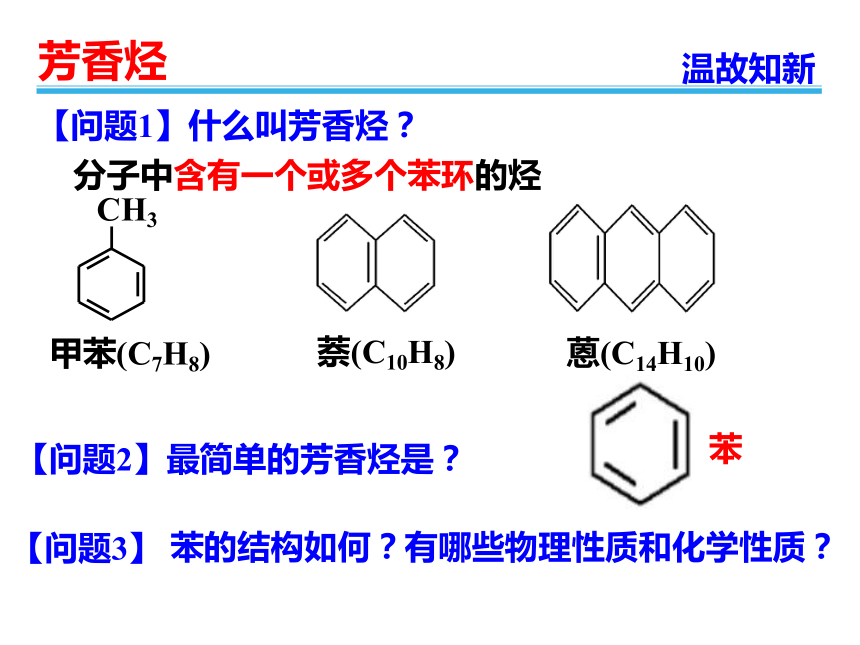
【问题1】什么叫芳香烃?
分子中含有一个或多个苯环的烃
【问题2】最简单的芳香烃是?
苯
CH3
甲苯(C7H8)
萘(C10H8)
蒽(C14H10)
【问题3】
温故知新
苯的结构如何?有哪些物理性质和化学性质?
问题导学
一、苯的结构和性质
(1)
分子式:
1、苯的结构
C6H6
1.
苯的结构
C
C
C
C
C
C
H
H
H
H
H
H
(2)结构式:
或
(3)结构简式:
平面正六边形,键角120°
(4)空间构型:
①苯分子的6个C和6个H都在同一平面,6个碳原子构成一个正六边形
②
6个碳碳键完全相同,是介于单键和双键之间的独特的键
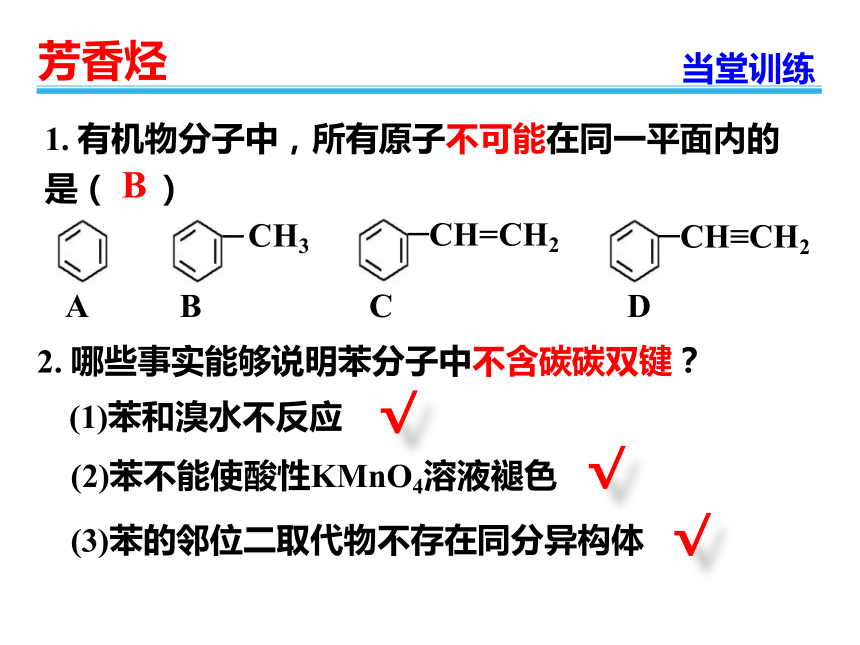
1.
有机物分子中,所有原子不可能在同一平面内的是(
)
CH=CH2
CH≡CH2
CH3
A
B
C
D
(1)苯和溴水不反应
(2)苯不能使酸性KMnO4溶液褪色
(3)苯的邻位二取代物不存在同分异构体
2.
哪些事实能够说明苯分子中不含碳碳双键?
B
当堂训练
问题导学
芳香杀手
2.
苯的物理性质
无色、有特殊气味、密度比水小、不溶于水、易溶于有机溶剂的有毒液体。
室内环境中的苯污染主要来自含苯胶黏剂、油漆、涂料和防水材料的溶剂或稀释剂
。
苯的毒性(一类致癌物)
可引起急性中毒,麻痹中枢神经,需要充分漱口,喝水,尽快洗胃。长期吸入会导致再生障碍性贫血,严重者会引起白血病。
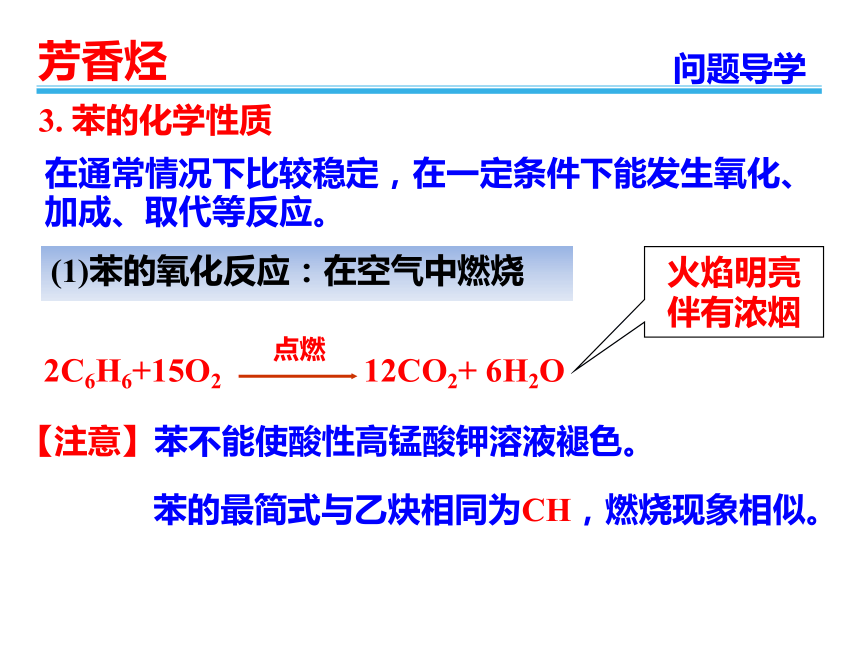
3.
苯的化学性质
在通常情况下比较稳定,在一定条件下能发生氧化、加成、取代等反应。
(1)苯的氧化反应:在空气中燃烧
2C6H6+15O2
12CO2+
6H2O
点燃
【注意】苯不能使酸性高锰酸钾溶液褪色。
火焰明亮伴有浓烟
苯的最简式与乙炔相同为CH,燃烧现象相似。
问题导学
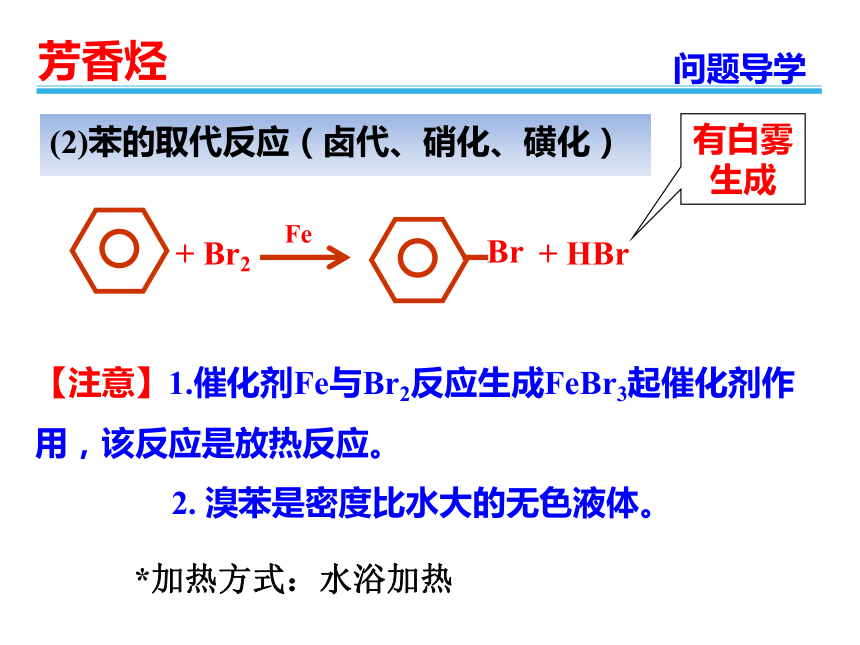
(2)苯的取代反应(卤代、硝化、磺化)
+
Br2
Br
+
HBr
Fe
2.
溴苯是密度比水大的无色液体。
加热方式:水浴加热
【注意】1.催化剂Fe与Br2反应生成FeBr3起催化剂作用,该反应是放热反应。
有白雾生成
问题导学
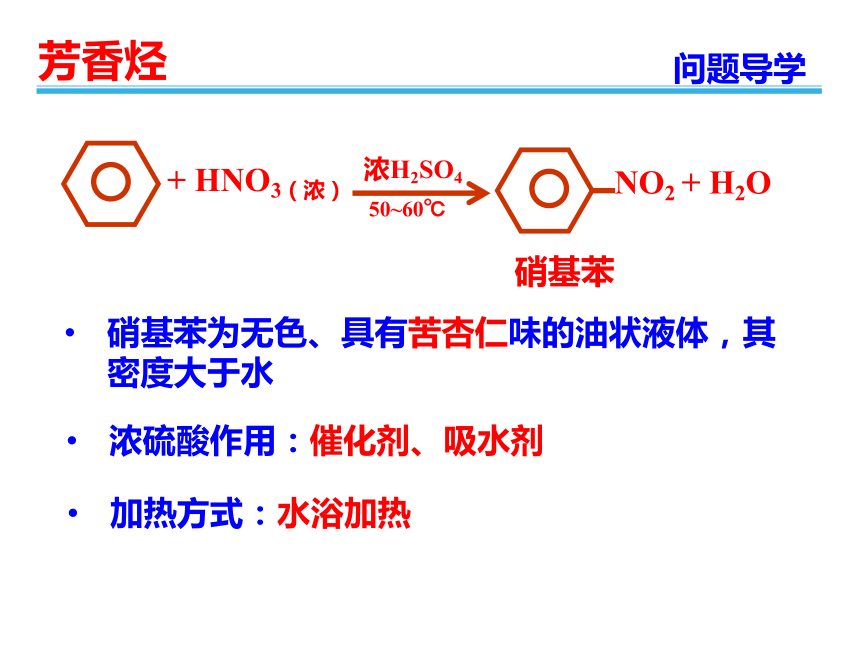
硝基苯为无色、具有苦杏仁味的油状液体,其密度大于水
+
HNO3(浓)
NO2
+
H2O
浓H2SO4
50~60℃
浓硫酸作用:催化剂、吸水剂
加热方式:水浴加热
问题导学
硝基苯
问题导学
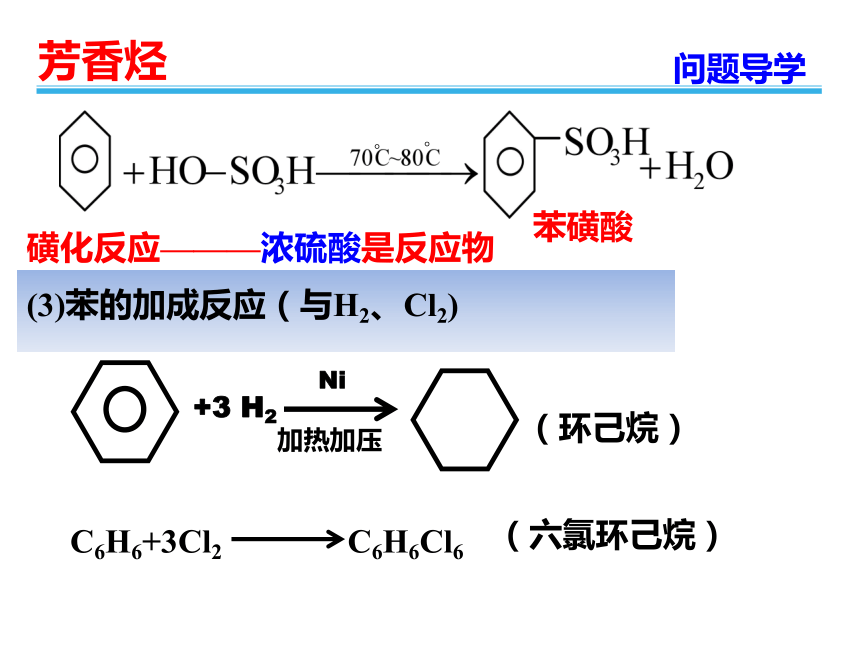
(3)苯的加成反应(与H2、Cl2)
(环己烷)
+3
H2
Ni
加热加压
磺化反应———浓硫酸是反应物
。
。
C6H6+3Cl2
C6H6Cl6
(六氯环己烷)
苯磺酸
思考与交流
反应的化学方程式
反应条件
苯与溴发生取代反应
苯与浓硝酸发生取代反应
苯与氢气发生加成反应
P
37
液溴,铁做催化剂
50℃~60℃水浴加热、浓硫酸做催化剂吸水剂
镍做催化剂,加热
C6H6+3H2
C6H12
Ni
实验探究
根据苯与溴、浓硝酸发生反应的条件,请你设计制备溴苯和硝基苯的实验方案(注意仪器的选择和试剂的加入顺序)
请同学们设计实验时,考虑以下问题:
1.选用装置
2.加入药品的顺序
3.如何控温
4.产物提纯
等
1.溴是一种易挥发有剧毒的药品
2.溴的密度比苯大
3.溴与苯的反应非常缓慢,常用铁粉作为催化剂
4.该反应是放热反应,不需要加热
【苯与溴的实验设计】
思考与交流
2Fe
+
3Br2
=
2FeBr3
+
Br2
Br
+
HBr
FeBr3
AgNO3
+HBr
=
AgBr↓
+HNO3
设计制备溴苯实验方案
【主要仪器】圆底烧瓶、长导管、锥形瓶、铁架台等
【药品】苯、液溴、铁粉、硝酸银溶液
【反应原理】取代反应。实际起催化作用的是FeBr3
实验探究
溴苯溶解溴成褐色
有几个同学设计如下的实验装置用来检验HBr气体,我们来看看是否合理?
CCl4
实验探究
设计苯的硝化反应实验方案
1.苯与硝酸的反应在50
℃
--60℃
时产物是硝基苯,温
度过高会有副产物。
2.
硫酸是该反应的催化剂,和硝酸混合时剧烈放热。
3.反应过程中硝酸会部分分解。
4
.苯和硝酸都易挥发。
硝基苯,无色,油状液体,苦杏仁味,有毒,密度大于水,难溶于水,易溶于有机溶剂。硝基苯蒸气有毒性。
实验探究
硝基苯
问题导学
【观察下列5种物质,分析它们的结构回答】
其中①、③、⑤的关系是________.
其中②、④、⑤的关系是_____________.
同分异构体
同系物
问题导学
二、苯的同系物
具有苯环(1个)结构,且在分子组成上相差一个或若干个CH2原子团的有机物。
CH3
CH2CH3
甲苯
乙苯
1.
概念:
通式:CnH2n-6(n≥6)
问题导学
物性——苯的同系物不溶于水,并比水轻。
苯的同系物溶于酒精。
同苯一样,不能与溴水反应,但能发生萃取。
2.
苯同系物的结构特征和物理性质
结构——苯环上的氢原子被烷基取代的产物
(1)氧化反应
①可燃性
②可使酸性高锰酸钾溶液褪色
3.
苯的同系物的化学性质
KMnO4(H+)溶液
-R
-COOH
问题导学
现象与苯相似,火焰明亮,冒黑烟
问题导学
实验资料
等能使酸性高锰酸钾溶液褪色
综上所述:你又能找到什么规律?
等不能使酸性高锰酸钾溶液褪色
问题导学
与酸性高锰酸钾的反应(使高锰酸钾溶液褪色)
反应机理:
|
—C—H
|
O
||
C—OH
|
酸性高锰酸钾溶液
特征:烷基上与苯环直接相连的碳直接连氢原子
H
|
—C—H
|
H
H
|
|
—C—C—
|
|
H
C
|
—C—C
|
C
×
可鉴别苯和甲苯等苯的同系物
问题导学
【实验】
1.
取一支试管,向其中加入2ml苯,再加入3-5滴酸性高锰酸钾溶液,振荡试管,观察现象。
2.
取一支试管,向其中加入2ml甲苯,再加入3-5滴酸性高锰酸钾溶液,振荡试管,观察现象。
问题导学
现象
结论
苯+酸性
高锰酸钾
甲苯+酸性
高锰酸钾
你观察到了什么现象?完成下表。
酸性高锰酸钾溶液褪色(较慢)
酸性高锰酸
钾溶液不褪色
苯不能被酸性高锰酸钾氧化
?
苯的同系物的特性
————
可使KMnO4(H+)溶液褪色
不能使溴水褪色!因萃取使水层颜色变浅。
【设计实验】:
如何鉴别苯、甲苯、CCl4?
注意:
问题导学
(二)取代反应
1.
苯的同系物的硝化反应
一种淡黄色的晶体,不溶于水。不稳定、易爆炸。它是一种烈性炸药,广泛用于国防、开矿、筑路、兴修水利等。
2,4,6-三硝基甲苯
CH3
CH3
NO2
-NO2
O2N-
+3HO-NO2
3H2O
+
浓H2SO4
30℃-40
℃
问题导学
2.
苯的同系物的卤化反应
已知:
请问:条件一和条件二分别指的是什么条件?
条件一:光照
条件二:FeCl3
问题导学
比较苯和甲苯与KMnO4溶液的作用,以及硝化反应的条件产物等,你从中得到什么启示?
【启示】
1.
侧链和苯环相互影响;
2.
侧链受苯环影响易被氧化;
3.
苯环受侧链影响易被取代。
问题导学
问题导学
(三)苯的同系物加成反应
苯的同系物也和氢气可以发生加成反应
请写出甲苯与氢气加成的化学方程式:
问题导学
1、来源:
三、芳香烃的来源及其应用
②
石油的催化重整
应用:简单的芳香烃是基本的有机化工原料。
①
煤的干馏
当堂训练
2.
稠环芳香烃
【概念】由两个或两个以上的苯环共用相邻的2个碳原子而成的一类芳香烃,称为稠环芳香烃。
萘
蒽
C10H8
C14H10
问题导学
萘是无色片状晶体,具有特殊的气味,易升华,曾经用来防蛀、驱虫,但因它有一定的毒性,现已禁止使用。萘是一种主要的化工原料。
菲
苯并芘
蒽也是一种无色的晶体,易升华,是生产染料的主要原料。
总结提升
烃
链烃
环烃
饱和链烃
不饱和链烃
脂环烃
芳香烃
烷烃
烯烃
二烯烃
炔烃
苯的同系物
稠环芳烃
其它芳烃
环烷烃等
本课小结
烷
烯
苯
与Br2作用
Br2试剂
反应条件
反应类型
与KMnO4作用
点燃
现象
结论
纯溴
溴水
纯溴
溴水
光照
取代
加成
Fe粉
取代
萃取
无反应
现象
结论
不褪色
褪色
不褪色
不被KMnO4氧化
易被KMnO4氧化
苯环难被KMnO4氧化
焰色浅,无烟
焰色亮,有烟
焰色亮,浓烟
C%低
C%较高
C%高
当堂巩固
1、已知分子式为C12H12的物质A结构简式为
则A环上的一溴代物有
(
)
A.
2种
B.
3种
C.
4种
D.
6种
B
1
3
2
1
2
3
2、等物质的量的下列烃分别完全燃烧,消耗氧气最少的是(???
)
?
A.
甲烷?????
B.
乙烯???
C.
苯??
???
D.
乙炔
3、下列各组物质,可用分液漏斗分离的是(
)
A.
酒精
B.
溴水与水
C.
硝基苯与水
D.
苯与溴苯
A
烃燃烧耗氧量规律:
C
等质量看含H量
等物质的量看C、H原子个数;
当堂巩固
组织建设
化学
·
选修5《有机化学基础》
芳香烃
将下列物质分类,并说明分类标准?
烷烃:①⑤
烯烃:②⑥
炔烃:③⑦
芳香烃:④⑧⑨⑩
分类标准:按C骨架分类
温故知新
温故知新
芳香烃及其化合物的来源——煤的干馏,石油的催化重整
【问题1】什么叫芳香烃?
分子中含有一个或多个苯环的烃
【问题2】最简单的芳香烃是?
苯
CH3
甲苯(C7H8)
萘(C10H8)
蒽(C14H10)
【问题3】
温故知新
苯的结构如何?有哪些物理性质和化学性质?
问题导学
一、苯的结构和性质
(1)
分子式:
1、苯的结构
C6H6
1.
苯的结构
C
C
C
C
C
C
H
H
H
H
H
H
(2)结构式:
或
(3)结构简式:
平面正六边形,键角120°
(4)空间构型:
①苯分子的6个C和6个H都在同一平面,6个碳原子构成一个正六边形
②
6个碳碳键完全相同,是介于单键和双键之间的独特的键
1.
有机物分子中,所有原子不可能在同一平面内的是(
)
CH=CH2
CH≡CH2
CH3
A
B
C
D
(1)苯和溴水不反应
(2)苯不能使酸性KMnO4溶液褪色
(3)苯的邻位二取代物不存在同分异构体
2.
哪些事实能够说明苯分子中不含碳碳双键?
B
当堂训练
问题导学
芳香杀手
2.
苯的物理性质
无色、有特殊气味、密度比水小、不溶于水、易溶于有机溶剂的有毒液体。
室内环境中的苯污染主要来自含苯胶黏剂、油漆、涂料和防水材料的溶剂或稀释剂
。
苯的毒性(一类致癌物)
可引起急性中毒,麻痹中枢神经,需要充分漱口,喝水,尽快洗胃。长期吸入会导致再生障碍性贫血,严重者会引起白血病。
3.
苯的化学性质
在通常情况下比较稳定,在一定条件下能发生氧化、加成、取代等反应。
(1)苯的氧化反应:在空气中燃烧
2C6H6+15O2
12CO2+
6H2O
点燃
【注意】苯不能使酸性高锰酸钾溶液褪色。
火焰明亮伴有浓烟
苯的最简式与乙炔相同为CH,燃烧现象相似。
问题导学
(2)苯的取代反应(卤代、硝化、磺化)
+
Br2
Br
+
HBr
Fe
2.
溴苯是密度比水大的无色液体。
加热方式:水浴加热
【注意】1.催化剂Fe与Br2反应生成FeBr3起催化剂作用,该反应是放热反应。
有白雾生成
问题导学
硝基苯为无色、具有苦杏仁味的油状液体,其密度大于水
+
HNO3(浓)
NO2
+
H2O
浓H2SO4
50~60℃
浓硫酸作用:催化剂、吸水剂
加热方式:水浴加热
问题导学
硝基苯
问题导学
(3)苯的加成反应(与H2、Cl2)
(环己烷)
+3
H2
Ni
加热加压
磺化反应———浓硫酸是反应物
。
。
C6H6+3Cl2
C6H6Cl6
(六氯环己烷)
苯磺酸
思考与交流
反应的化学方程式
反应条件
苯与溴发生取代反应
苯与浓硝酸发生取代反应
苯与氢气发生加成反应
P
37
液溴,铁做催化剂
50℃~60℃水浴加热、浓硫酸做催化剂吸水剂
镍做催化剂,加热
C6H6+3H2
C6H12
Ni
实验探究
根据苯与溴、浓硝酸发生反应的条件,请你设计制备溴苯和硝基苯的实验方案(注意仪器的选择和试剂的加入顺序)
请同学们设计实验时,考虑以下问题:
1.选用装置
2.加入药品的顺序
3.如何控温
4.产物提纯
等
1.溴是一种易挥发有剧毒的药品
2.溴的密度比苯大
3.溴与苯的反应非常缓慢,常用铁粉作为催化剂
4.该反应是放热反应,不需要加热
【苯与溴的实验设计】
思考与交流
2Fe
+
3Br2
=
2FeBr3
+
Br2
Br
+
HBr
FeBr3
AgNO3
+HBr
=
AgBr↓
+HNO3
设计制备溴苯实验方案
【主要仪器】圆底烧瓶、长导管、锥形瓶、铁架台等
【药品】苯、液溴、铁粉、硝酸银溶液
【反应原理】取代反应。实际起催化作用的是FeBr3
实验探究
溴苯溶解溴成褐色
有几个同学设计如下的实验装置用来检验HBr气体,我们来看看是否合理?
CCl4
实验探究
设计苯的硝化反应实验方案
1.苯与硝酸的反应在50
℃
--60℃
时产物是硝基苯,温
度过高会有副产物。
2.
硫酸是该反应的催化剂,和硝酸混合时剧烈放热。
3.反应过程中硝酸会部分分解。
4
.苯和硝酸都易挥发。
硝基苯,无色,油状液体,苦杏仁味,有毒,密度大于水,难溶于水,易溶于有机溶剂。硝基苯蒸气有毒性。
实验探究
硝基苯
问题导学
【观察下列5种物质,分析它们的结构回答】
其中①、③、⑤的关系是________.
其中②、④、⑤的关系是_____________.
同分异构体
同系物
问题导学
二、苯的同系物
具有苯环(1个)结构,且在分子组成上相差一个或若干个CH2原子团的有机物。
CH3
CH2CH3
甲苯
乙苯
1.
概念:
通式:CnH2n-6(n≥6)
问题导学
物性——苯的同系物不溶于水,并比水轻。
苯的同系物溶于酒精。
同苯一样,不能与溴水反应,但能发生萃取。
2.
苯同系物的结构特征和物理性质
结构——苯环上的氢原子被烷基取代的产物
(1)氧化反应
①可燃性
②可使酸性高锰酸钾溶液褪色
3.
苯的同系物的化学性质
KMnO4(H+)溶液
-R
-COOH
问题导学
现象与苯相似,火焰明亮,冒黑烟
问题导学
实验资料
等能使酸性高锰酸钾溶液褪色
综上所述:你又能找到什么规律?
等不能使酸性高锰酸钾溶液褪色
问题导学
与酸性高锰酸钾的反应(使高锰酸钾溶液褪色)
反应机理:
|
—C—H
|
O
||
C—OH
|
酸性高锰酸钾溶液
特征:烷基上与苯环直接相连的碳直接连氢原子
H
|
—C—H
|
H
H
|
|
—C—C—
|
|
H
C
|
—C—C
|
C
×
可鉴别苯和甲苯等苯的同系物
问题导学
【实验】
1.
取一支试管,向其中加入2ml苯,再加入3-5滴酸性高锰酸钾溶液,振荡试管,观察现象。
2.
取一支试管,向其中加入2ml甲苯,再加入3-5滴酸性高锰酸钾溶液,振荡试管,观察现象。
问题导学
现象
结论
苯+酸性
高锰酸钾
甲苯+酸性
高锰酸钾
你观察到了什么现象?完成下表。
酸性高锰酸钾溶液褪色(较慢)
酸性高锰酸
钾溶液不褪色
苯不能被酸性高锰酸钾氧化
?
苯的同系物的特性
————
可使KMnO4(H+)溶液褪色
不能使溴水褪色!因萃取使水层颜色变浅。
【设计实验】:
如何鉴别苯、甲苯、CCl4?
注意:
问题导学
(二)取代反应
1.
苯的同系物的硝化反应
一种淡黄色的晶体,不溶于水。不稳定、易爆炸。它是一种烈性炸药,广泛用于国防、开矿、筑路、兴修水利等。
2,4,6-三硝基甲苯
CH3
CH3
NO2
-NO2
O2N-
+3HO-NO2
3H2O
+
浓H2SO4
30℃-40
℃
问题导学
2.
苯的同系物的卤化反应
已知:
请问:条件一和条件二分别指的是什么条件?
条件一:光照
条件二:FeCl3
问题导学
比较苯和甲苯与KMnO4溶液的作用,以及硝化反应的条件产物等,你从中得到什么启示?
【启示】
1.
侧链和苯环相互影响;
2.
侧链受苯环影响易被氧化;
3.
苯环受侧链影响易被取代。
问题导学
问题导学
(三)苯的同系物加成反应
苯的同系物也和氢气可以发生加成反应
请写出甲苯与氢气加成的化学方程式:
问题导学
1、来源:
三、芳香烃的来源及其应用
②
石油的催化重整
应用:简单的芳香烃是基本的有机化工原料。
①
煤的干馏
当堂训练
2.
稠环芳香烃
【概念】由两个或两个以上的苯环共用相邻的2个碳原子而成的一类芳香烃,称为稠环芳香烃。
萘
蒽
C10H8
C14H10
问题导学
萘是无色片状晶体,具有特殊的气味,易升华,曾经用来防蛀、驱虫,但因它有一定的毒性,现已禁止使用。萘是一种主要的化工原料。
菲
苯并芘
蒽也是一种无色的晶体,易升华,是生产染料的主要原料。
总结提升
烃
链烃
环烃
饱和链烃
不饱和链烃
脂环烃
芳香烃
烷烃
烯烃
二烯烃
炔烃
苯的同系物
稠环芳烃
其它芳烃
环烷烃等
本课小结
烷
烯
苯
与Br2作用
Br2试剂
反应条件
反应类型
与KMnO4作用
点燃
现象
结论
纯溴
溴水
纯溴
溴水
光照
取代
加成
Fe粉
取代
萃取
无反应
现象
结论
不褪色
褪色
不褪色
不被KMnO4氧化
易被KMnO4氧化
苯环难被KMnO4氧化
焰色浅,无烟
焰色亮,有烟
焰色亮,浓烟
C%低
C%较高
C%高
当堂巩固
1、已知分子式为C12H12的物质A结构简式为
则A环上的一溴代物有
(
)
A.
2种
B.
3种
C.
4种
D.
6种
B
1
3
2
1
2
3
2、等物质的量的下列烃分别完全燃烧,消耗氧气最少的是(???
)
?
A.
甲烷?????
B.
乙烯???
C.
苯??
???
D.
乙炔
3、下列各组物质,可用分液漏斗分离的是(
)
A.
酒精
B.
溴水与水
C.
硝基苯与水
D.
苯与溴苯
A
烃燃烧耗氧量规律:
C
等质量看含H量
等物质的量看C、H原子个数;
当堂巩固
