人教版高中化学必修一3.1-金属的化学性质 课件(共29张PPT)
文档属性
| 名称 | 人教版高中化学必修一3.1-金属的化学性质 课件(共29张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-20 16:17:07 | ||
图片预览








文档简介
(共29张PPT)
第三章
金属及其化合物
第一节
金属的化学性质
高一年级
化学必修1
银白色金属
表面变暗
白色固体
表面变成溶液
白色块状物质
O2
H2O
H2O
CO2
风化
白色粉末
Na
Na2O
NaOH
NaOH潮解
Na2CO3?10H2O
Na2CO3
二.金属与水的反应
1.金属钠和水的反应
实验5:
将一小块金属钠投入滴有酚酞的水中
现
象
及
解
释
浮
游
熔
响
红
金属钠的密度小于水
产生的气体推动金属钠来回游动
反应放热,钠的熔点较低
剧烈反应,产生气体
有碱性物质生成
2Na
+
2H2O
=
2NaOH
+
H2↑
2、金属钠为什么保存在煤油中?
总结:钠的物理性质和化学性质
物理性质:银白色的固体,质软,密度比水小(0.97g/cm3),
熔点较低(97.87℃)
化学性质:
化学性质很活泼
1.与氧气反应
4Na
+
O2
=
2Na2O
2Na
+
O2
===
Na2O2
点燃
2.与水反应
2Na
+
2H2O
=
2NaOH
+
H2↑
2.铁与水蒸气的反应
铁不能与冷、热水反应,
但能否与水蒸气反应?
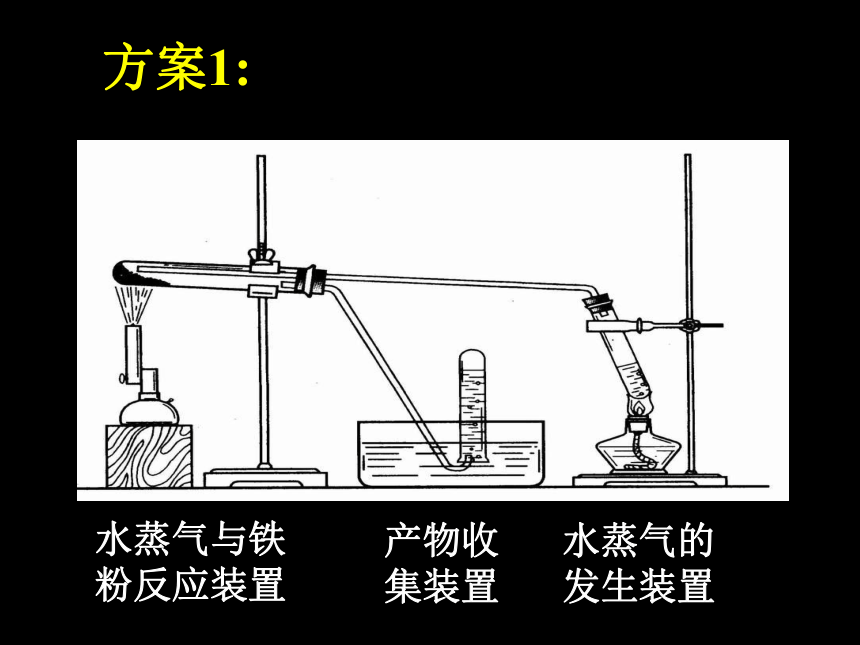
请设计一个简单的实验装置,使还原铁粉与水蒸气反应。
思考:
1.
该反应装置包括哪几部分?
水蒸气的发生装置
水蒸气与铁粉反应装置
产物的检验(收集)装置
水蒸气的发生装置
水蒸气与铁粉反应装置
产物收集装置
方案1:
方案2:
方案3:
4、实验是否安全
3Fe+4H2O
(g)
Fe3O4+4H2↑
三.铝与氢氧化钠溶液的反应
1.铝与稀盐酸的反应
化学方程式为:
2Al
+
6HCl
=
2AlCl3
+
3H2↑
离子方程式为:
2Al+6H+=2Al3+
+3H2
↑
2.铝与氢氧化钠溶液的反应
2Al+2NaOH+2H2O=2NaAlO2+3H2
↑
离子方程式为:
2Al
+
2OH-
+
2H2O
=2AlO2-
+
3H2
↑
三.铝与氢氧化钠溶液的反应
1.铝与稀盐酸的反应
2Al+6H+=2Al3+
+3H2
↑
铝既能与强酸溶液反应也能与强碱溶液反应,因此酸、碱可直接侵蚀铝的保护膜以及铝制品本身,铝制品餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物
三.铝与氢氧化钠溶液的反应
1.铝与稀盐酸的反应
2Al+6H+=2Al3+
+3H2↑
2.铝与氢氧化钠溶液的反应
2Al
+
2OH-
+
2H2O
=2AlO2-
+
3H2
↑
以上我们学习了金属的一些化学性质,通过分析不难发现,在反应中这些金属元素的化合价都发生了变化,它们从0价升为正价。
在这些变化中,金属表现了强的还原性,做还原剂
在自然界中金属多以化合态存在。只有极少数金属以游离态存在
三.铝与氢氧化钠溶液的反应
1.铝与稀盐酸的反应
化学方程式为:
2Al
+
6HCl
==
2AlCl3
+
3H2
离子方程式为:
2Al+6H+==2Al3+
+3H2
2.铝与氢氧化钠溶液的反应
2Al+2NaOH+2H2O==2NaAlO2+3H2
铝既能与强酸溶液反应也能与强碱溶液反应,因此酸、碱可直接侵蚀铝的保护膜以及铝制品本身,铝制品餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物
四、物质的量在化学方程式计算中的应用
(一)有关物理量的换算
1、物质的量的桥梁网络
(一)有关物理量的换算
2、物质的量浓度与溶质质量分数的换算
1、物质的量的桥梁网络
H2
+
Cl2
2HCl
点燃
分子数之比
1
∶
1
∶
2
物质的量之比
1mol∶
1mol
∶
2mol
质量之比
2g
∶
71g
∶
73g
体积之比
22.4L∶
22.4L
∶
44.8L
或
1L
∶
1L
∶
1L
四、物质的量在化学方程式计算中的应用
计算的依据------
化学方程式中各物质的化学计量数比等于各物质的物质的量之比
请大家阅读教材例题的解答过程,注意格式
四、物质的量在化学方程式计算中的应用
1、已知条件是什么;
思路:
2、要求的是什么?
3、应该找什么关系?
四、物质的量在化学方程式计算中的应用
对于课本上的[例题]
Zn
+
2HCl
=
ZnCl2
+
H2↑
1mol
22.4L
0.1mol
V(H2)
1mol
1mol
四、物质的量在化学方程式计算中的应用
注意:1、书写要规范
2、列式时未知量要用相应的字母表示,
3、计算时要带相应的单位进行计算
4、单位:上下一致,左右相当(也可相同)。
练习1
用一定量的Fe与足量的1mol/L的H2SO4溶液反应来制取H2。若要制得2.24L
H2(标况),试计算:
(1)参加反应的H2SO4溶液中H2SO4的物质的量
(2)参加反应的Fe的质量。
(3)将反应后的溶液稀释到500ml,则溶液中FeSO4的物质的量浓度是多少?
①写式
Fe
+
H2SO4
=
FeSO4
+
H2↑
②列量
1mol
1mol
1mol
1mol
m(Fe)
n(H2SO4)
n(FeSO4)
2.24L
②列量
56g
1mol
1mol
22.4L
③列式(根据对应化学量列出比例式)
④计算
⑤
作答
练习2
把一块表面已部分被氧化的钠0.77g放入10g水中,得到标准状况下氢气224mL。求:①若将金属钠表面的氧化物均视为氧化钠。试求氧化钠的质量。
②所得溶液中溶质的质量分数和该溶液的物质的量浓度(溶液的密度为d
g/cm3)
练习3
将250ml密度为1.1g/cm3、H2SO4的质量分数为15%的硫酸溶液跟适量的铁屑充分反应,计算:
(1)此硫酸溶液中H2SO4的物质的量浓度。
(2)?生成的H2的体积(标况)。
(3)将生成的FeSO4溶液配成400ml溶液,此溶液中FeSO4的物质的量浓度是多少?
第三章
金属及其化合物
第一节
金属的化学性质
高一年级
化学必修1
银白色金属
表面变暗
白色固体
表面变成溶液
白色块状物质
O2
H2O
H2O
CO2
风化
白色粉末
Na
Na2O
NaOH
NaOH潮解
Na2CO3?10H2O
Na2CO3
二.金属与水的反应
1.金属钠和水的反应
实验5:
将一小块金属钠投入滴有酚酞的水中
现
象
及
解
释
浮
游
熔
响
红
金属钠的密度小于水
产生的气体推动金属钠来回游动
反应放热,钠的熔点较低
剧烈反应,产生气体
有碱性物质生成
2Na
+
2H2O
=
2NaOH
+
H2↑
2、金属钠为什么保存在煤油中?
总结:钠的物理性质和化学性质
物理性质:银白色的固体,质软,密度比水小(0.97g/cm3),
熔点较低(97.87℃)
化学性质:
化学性质很活泼
1.与氧气反应
4Na
+
O2
=
2Na2O
2Na
+
O2
===
Na2O2
点燃
2.与水反应
2Na
+
2H2O
=
2NaOH
+
H2↑
2.铁与水蒸气的反应
铁不能与冷、热水反应,
但能否与水蒸气反应?
请设计一个简单的实验装置,使还原铁粉与水蒸气反应。
思考:
1.
该反应装置包括哪几部分?
水蒸气的发生装置
水蒸气与铁粉反应装置
产物的检验(收集)装置
水蒸气的发生装置
水蒸气与铁粉反应装置
产物收集装置
方案1:
方案2:
方案3:
4、实验是否安全
3Fe+4H2O
(g)
Fe3O4+4H2↑
三.铝与氢氧化钠溶液的反应
1.铝与稀盐酸的反应
化学方程式为:
2Al
+
6HCl
=
2AlCl3
+
3H2↑
离子方程式为:
2Al+6H+=2Al3+
+3H2
↑
2.铝与氢氧化钠溶液的反应
2Al+2NaOH+2H2O=2NaAlO2+3H2
↑
离子方程式为:
2Al
+
2OH-
+
2H2O
=2AlO2-
+
3H2
↑
三.铝与氢氧化钠溶液的反应
1.铝与稀盐酸的反应
2Al+6H+=2Al3+
+3H2
↑
铝既能与强酸溶液反应也能与强碱溶液反应,因此酸、碱可直接侵蚀铝的保护膜以及铝制品本身,铝制品餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物
三.铝与氢氧化钠溶液的反应
1.铝与稀盐酸的反应
2Al+6H+=2Al3+
+3H2↑
2.铝与氢氧化钠溶液的反应
2Al
+
2OH-
+
2H2O
=2AlO2-
+
3H2
↑
以上我们学习了金属的一些化学性质,通过分析不难发现,在反应中这些金属元素的化合价都发生了变化,它们从0价升为正价。
在这些变化中,金属表现了强的还原性,做还原剂
在自然界中金属多以化合态存在。只有极少数金属以游离态存在
三.铝与氢氧化钠溶液的反应
1.铝与稀盐酸的反应
化学方程式为:
2Al
+
6HCl
==
2AlCl3
+
3H2
离子方程式为:
2Al+6H+==2Al3+
+3H2
2.铝与氢氧化钠溶液的反应
2Al+2NaOH+2H2O==2NaAlO2+3H2
铝既能与强酸溶液反应也能与强碱溶液反应,因此酸、碱可直接侵蚀铝的保护膜以及铝制品本身,铝制品餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物
四、物质的量在化学方程式计算中的应用
(一)有关物理量的换算
1、物质的量的桥梁网络
(一)有关物理量的换算
2、物质的量浓度与溶质质量分数的换算
1、物质的量的桥梁网络
H2
+
Cl2
2HCl
点燃
分子数之比
1
∶
1
∶
2
物质的量之比
1mol∶
1mol
∶
2mol
质量之比
2g
∶
71g
∶
73g
体积之比
22.4L∶
22.4L
∶
44.8L
或
1L
∶
1L
∶
1L
四、物质的量在化学方程式计算中的应用
计算的依据------
化学方程式中各物质的化学计量数比等于各物质的物质的量之比
请大家阅读教材例题的解答过程,注意格式
四、物质的量在化学方程式计算中的应用
1、已知条件是什么;
思路:
2、要求的是什么?
3、应该找什么关系?
四、物质的量在化学方程式计算中的应用
对于课本上的[例题]
Zn
+
2HCl
=
ZnCl2
+
H2↑
1mol
22.4L
0.1mol
V(H2)
1mol
1mol
四、物质的量在化学方程式计算中的应用
注意:1、书写要规范
2、列式时未知量要用相应的字母表示,
3、计算时要带相应的单位进行计算
4、单位:上下一致,左右相当(也可相同)。
练习1
用一定量的Fe与足量的1mol/L的H2SO4溶液反应来制取H2。若要制得2.24L
H2(标况),试计算:
(1)参加反应的H2SO4溶液中H2SO4的物质的量
(2)参加反应的Fe的质量。
(3)将反应后的溶液稀释到500ml,则溶液中FeSO4的物质的量浓度是多少?
①写式
Fe
+
H2SO4
=
FeSO4
+
H2↑
②列量
1mol
1mol
1mol
1mol
m(Fe)
n(H2SO4)
n(FeSO4)
2.24L
②列量
56g
1mol
1mol
22.4L
③列式(根据对应化学量列出比例式)
④计算
⑤
作答
练习2
把一块表面已部分被氧化的钠0.77g放入10g水中,得到标准状况下氢气224mL。求:①若将金属钠表面的氧化物均视为氧化钠。试求氧化钠的质量。
②所得溶液中溶质的质量分数和该溶液的物质的量浓度(溶液的密度为d
g/cm3)
练习3
将250ml密度为1.1g/cm3、H2SO4的质量分数为15%的硫酸溶液跟适量的铁屑充分反应,计算:
(1)此硫酸溶液中H2SO4的物质的量浓度。
(2)?生成的H2的体积(标况)。
(3)将生成的FeSO4溶液配成400ml溶液,此溶液中FeSO4的物质的量浓度是多少?
