人教版高中化学必修一3.2《几种重要的金属化合物》授课课件(共27张ppt)
文档属性
| 名称 | 人教版高中化学必修一3.2《几种重要的金属化合物》授课课件(共27张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 584.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-21 16:17:30 | ||
图片预览







文档简介
第二节
几种重要的金属化合物
金属化合物
金属氧化物
金属氢氧化物
盐
金属化合物包括了什么?
一、钠的重要化合物:
钠是一种活泼金属,在自然界中不存在 的钠,钠元素都是以 存在的;
1、氧化钠和过氧化钠
氧化钠是___色固体,过氧化钠是___色固体。
实验现象
结论
反应生成有 ;
反应 ;
反应生成 ;
Na2O2具有 ;
1、剧烈反应, 产生大量
,且此气体能使带火星木条 ;
2、试管发烫;
3、无色酚酞变 ;
4、振荡后红色 ;
2、过氧化钠的性质
(1)过氧化钠与水反应:
a、把水滴入在盛有少量过氧化钠固体的试管中,立即用带火星木条放在试管口,检验生成的气体。
b、用手轻轻摸一摸试管外壁,有什么感觉?
c、然后向反应后的溶液中滴入酚酞,有什么现象?
漂白性
复燃
气泡
红
消失
氧气
放热
氢氧化钠
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2 =2Na2CO3+O2
——过氧化钠可用于供氧剂
过氧化钠与二氧化碳反应的化学方程式:
过氧化钠与水反应的化学方程式:
Na2O2的用途:
在呼吸面具、潜艇紧急情况时作供氧剂,作秸杆、织物的漂白剂,氧化剂。
实验探究.Na2CO3和NaHCO3的溶解性和碱性
初步结论
③滴加酚酞
②加水、溶解
①称量、滴水
NaHCO3
Na2CO3
白色粉末,变热
白色晶体,不热
迅速溶解
缓慢溶解
溶液变红
溶液变浅红
溶解度大
溶解度小
溶液都显碱性,碱性 Na2CO3 > NaHCO3
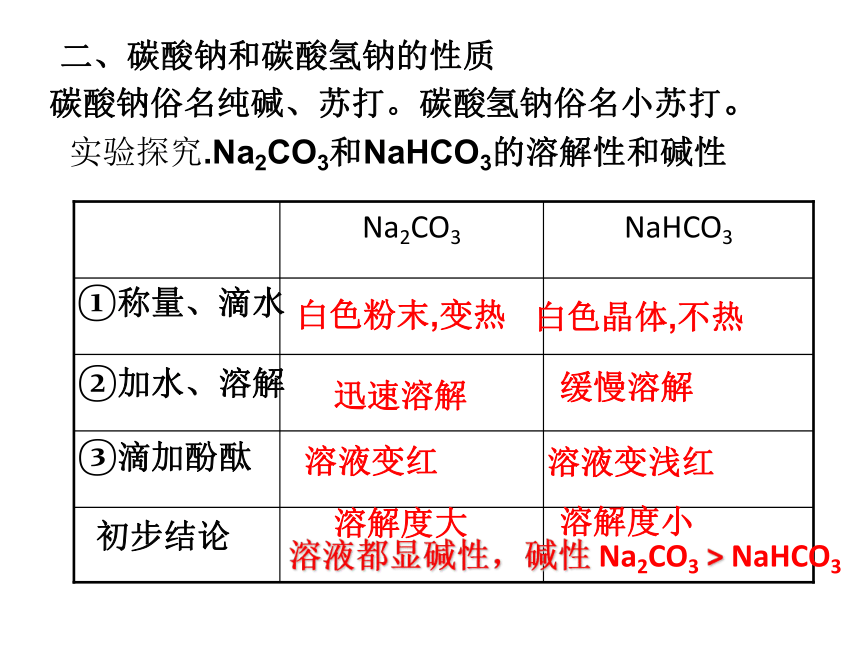
二、碳酸钠和碳酸氢钠的性质
碳酸钠俗名纯碱、苏打。碳酸氢钠俗名小苏打。
2.Na2CO3和NaHCO3的热稳定性
—————————
发生反应的化学方程式
NaHCO3
Na2CO3
结论
现象
稳定
不稳定
无明显现象
产生水珠、使澄清石灰水变浑浊的气体
思考:怎样除去Na2CO3固体中混有的NaHCO3?
充分加热到质量不再减少为止(充分加热到不再有气体产生为止)
3.Na2CO3和NaHCO3的其它性质
(1)与酸反应
反应剧烈程度:
用途:
碳酸钠:制玻璃、肥皂等
碳酸氢钠:发酵粉、胃药等
总结
Na2CO3
NaHCO3
俗 名
水溶性比较
溶液碱性比较
小苏打
纯碱 苏打
Na2CO3 > NaHCO3
热稳定性比较
与酸反应快慢比较
Na2CO3 > NaHCO3
Na2CO3 < NaHCO3
Na2CO3 > NaHCO3
5、焰色反应
实验步骤:
①将铂丝防在酒精灯外焰上灼烧至火焰颜色与原来相同;
②用铂丝蘸取待测碳酸钠溶液放在外焰上灼烧,观察火焰颜色;
③用盐酸洗净铂丝,在外焰上灼烧至火焰无色后,再蘸取碳酸钾溶液在外焰上灼烧,透过蓝色的钴玻璃观察火焰的颜色。
注意:
①每次实验必须用盐酸洗净铂丝,并灼烧至火焰与原来相同;
②钾的焰色必须透过蓝色的钴玻璃观察。(避免钠等杂质
的焰色的干扰。)
实验3-9
几种金属的焰色:
Li Na K Ca Sr Ba Cu
紫红 黄 紫 砖红 洋红 黄绿 绿
第2节 几种重要的金属化合物(2)
铝的重要化合物
地壳中含量最多的金属元素是 ;人们发现并制得铝单质比较晚,这是因为 .
红宝石(Al2O3)
蓝宝石(Al2O3)
明矾晶体KAl(SO4)2·12H2O
明矾水解产生的Al(OH)3吸附能力很强,可以用来吸附水里的杂质。
化学性质:能溶于 或 中;化学方程式分别为:
Al2O3 +6HCl=2AlCl3+3H2O
Al2O3 +2NaOH=2NaAlO2+H2O
氧化铝既能与酸反应又能与强碱溶液反应,所以氧化铝是一种 ;(也可以说氧化铝溶于酸或强碱,这个溶是指反应)
氧化铝:
物理性质:水溶性: , 熔点 ,
用途:冶炼 的原料;是一种 材料;可以制 。
两性氧化物
难溶于水
很高
铝
耐火
耐火坩埚 、耐火管、耐高温的实验仪器
酸 强碱溶液
氢氧化铝
Al2(SO4)3+6NH3?H2O=2Al(OH)3↓+3(NH4)2SO4
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
制备Al(OH)3时为什么不用NaOH等强碱溶液,而用氨水?
Al(OH)3是一种白色胶状物,几乎不溶水,能凝聚水中的悬浮物,并能吸附色素,可净水。
2、性质
1、制法:常用铝盐+氨水,化学方程式为:
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+OH-=AlO2-+2H2O
氢氧化铝既能与酸反应又能与强碱溶液反应,所以氧化铝是一种 ;(也可以说氢氧化铝溶于酸或强碱)
氨水能溶解Al(OH)3吗?
(2)Al(OH)3既能溶于酸又能溶于强碱溶液,生成盐和水。氢氧化铝与盐酸、氢氧化钠溶液反应的化学方程式为:
两性氢氧化物
(3)氢氧化铝的不稳定性,受热易 ;化学方程式为:
2Al(OH)3==Al2O3+3H2O
?
用途: ;
分解
主要用于治疗胃酸过多
三、铁的重要化合物
1、铁的氧化物
氧化亚铁
FeO
三氧化二铁 Fe2O3
四氧化三铁 Fe3O4(FeO?Fe2O3)
色、态
俗 称
——
溶解性
稳定性
与酸反应
黑色粉末
难溶于水
FeO+2H+=
Fe2++H2O
红棕色粉末
铁 红
难溶于水
不稳定
稳 定
Fe2O3+6H+=
2Fe3++3H2O
黑色晶体
磁性氧化铁
难溶于水
稳 定
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
氯化铁溶液
硫酸亚铁溶液
加入氢氧化钠溶液的现象
离子方程式
2、铁的氢氧化物
在2支试管里分别加入少量的氯化铁和硫酸亚铁溶液,
然后滴入氢氧化钠溶液,观察现象:
刚开始产生灰白色沉淀,
之后沉淀变成灰绿色,
最后变成红褐色
产生红褐色沉淀
Fe2++2OH-=Fe(OH)2↓
(隔绝空气)
Fe3++3OH-=Fe(OH)3↓
刚开始产生灰白色沉淀是什么?
最后沉淀变成红褐色,这红褐色的沉淀又是什么?
为什么会有这样的现象呢?
氢氧化亚铁极易被空气中氧气氧化成氢氧化铁
4Fe(OH)2+2H2O+O2=4Fe(OH)3
氢氧化铁
氢氧化亚铁
2、铁的氢氧化物(小结)
氢氧化亚铁Fe(OH)2
氢氧化铁Fe(OH)3
制 法
颜 色
溶解性
稳定性
与酸反应
Fe2++2OH-=Fe(OH)2↓
(隔绝空气)
Fe3++3OH-=Fe(OH)3↓
灰白 色
红褐色
难溶于水
难溶于水
受热易分解
极易被空气中氧气氧化
成氢氧化铁
4Fe(OH)2+2H2O+O2
=4Fe(OH)3
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3++3H2O
3、铁盐和亚铁盐
(1)Fe3+检验
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
变为血红色
无明显变化
通过实验可知,要区分铁盐和亚铁盐,可加入 ;
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}FeCl3溶液中加入以下试剂:
现象
反应的离子方程式
铁粉,KSCN溶液
氯水,振荡
(2)Fe3+的氧化性
溶液由黄色变为浅绿色,溶液不变为红色
溶液变为红色
2Fe3++Fe=3Fe2+
2Fe2++Cl2=2Fe3++2Cl-
课本P61最后一段怎么说的?
KSCN溶液
小结:Fe3+和Fe2+的检验
{69C7853C-536D-4A76-A0AE-DD22124D55A5}试剂
Fe2+:浅绿色
Fe3+棕 黄色或黄色
加NaOH等碱溶液
加KSCN溶液
产生红褐色沉淀
不变红色
变血红色
产生白色沉淀 灰绿色 红褐色
第三节:用途广泛的金属材料
1、金属材料包括了 和 ;
2、合金具有很多优良的性能,在许多方面 各成分金属;硬度:合金 纯金属成分;
熔点:合金 纯金属成分;
抗腐蚀性:合金 纯金属成分.
3、铜的合金有: 、 、 ;
4、铁的合金有: 和 ;钢的分类有: 、 ;碳素钢又可以分为:
、 、 、
纯金属
合金
不同于
<
>
>
白铜
黄铜
青铜
钢 生铁
低碳钢
碳素钢
合金钢
高碳钢
中碳钢
1、如何下列物质总的少量杂质(括号中为杂质)?
①Na2CO3(NaHCO3)固体
②NaHCO3(Na2CO3)
加热
向溶液中通入过量CO2
2、下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①NaHCO3 ②Al ③Al2O3 ④ Al(OH)3 ⑤AlCl3 ⑥CuO
A. ② ③ ④ ⑤ B. ① ③ ④ ⑥ C. ① ② ③ ④ D.全部
3、区别碳酸钠和碳酸氢钠的最好方法是( )
A、加热
B、两者分别与盐酸反应
C、溶于水比较溶解性
D、两者分别加入氢氧化钠溶液
4、自然界最常见的钠的化合物是()
A、氯化钠 B、氧化钠 C、过氧化钠 D、氢氧化钠
B
C
A
5、把一小块钠投入盛有煤和水的烧杯中,可以观察到( )
A、钠浮在烧杯中的液面上
B、钠沉在杯底
C、煤油会燃烧起来,产生很浓的黑烟
D、钠会在水和煤油的交界处上下浮动,直到反应结束
6、可作为防毒面具里氧气来源的是( )
A、氧化钠 B、过氧化钠 C、氢氧化钠 D、碳酸氢钠
7、要使氯化铝中的铝离子尽可能多地沉淀出来,最好加入( )
A、石灰水B、氨水C、硫酸D、氢氧化钠溶液
8、要除去氧化镁中的氧化铝,应选用( )
A、氢氧化钠溶液B、硝酸C、浓硫酸D、稀盐酸
9、能在金属表面形成一层致密的氧化膜,起到保护作用的是( )
A、铁 B、钠 C、铜 D、铝
D
B
B
A
D
10、下列说法正确的是( )
A、铝在常温下与氧气不反应
B、氢氧化铝能与盐酸反应,不能与氢氧化钠溶液反应
C、铝既能溶于酸又能溶于碱
D、氧化铝不能与碱反应
11、要证明溶液中含有Fe3+,下列方法正确的是( )
A、加入铁粉B、滴加稀硫酸C、滴加氯水D、滴加KSCN溶液
12、下列说法正确的是( )
A、 Fe3+具有还原性,能与氯气反应
B、氢氧化铁是红褐色的沉淀
C、向氯化亚铁溶液中加入氢氧化钠,最终得到白色的沉淀
D、钢不是合金,生铁才是合金
C
D
B
几种重要的金属化合物
金属化合物
金属氧化物
金属氢氧化物
盐
金属化合物包括了什么?
一、钠的重要化合物:
钠是一种活泼金属,在自然界中不存在 的钠,钠元素都是以 存在的;
1、氧化钠和过氧化钠
氧化钠是___色固体,过氧化钠是___色固体。
实验现象
结论
反应生成有 ;
反应 ;
反应生成 ;
Na2O2具有 ;
1、剧烈反应, 产生大量
,且此气体能使带火星木条 ;
2、试管发烫;
3、无色酚酞变 ;
4、振荡后红色 ;
2、过氧化钠的性质
(1)过氧化钠与水反应:
a、把水滴入在盛有少量过氧化钠固体的试管中,立即用带火星木条放在试管口,检验生成的气体。
b、用手轻轻摸一摸试管外壁,有什么感觉?
c、然后向反应后的溶液中滴入酚酞,有什么现象?
漂白性
复燃
气泡
红
消失
氧气
放热
氢氧化钠
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2 =2Na2CO3+O2
——过氧化钠可用于供氧剂
过氧化钠与二氧化碳反应的化学方程式:
过氧化钠与水反应的化学方程式:
Na2O2的用途:
在呼吸面具、潜艇紧急情况时作供氧剂,作秸杆、织物的漂白剂,氧化剂。
实验探究.Na2CO3和NaHCO3的溶解性和碱性
初步结论
③滴加酚酞
②加水、溶解
①称量、滴水
NaHCO3
Na2CO3
白色粉末,变热
白色晶体,不热
迅速溶解
缓慢溶解
溶液变红
溶液变浅红
溶解度大
溶解度小
溶液都显碱性,碱性 Na2CO3 > NaHCO3
二、碳酸钠和碳酸氢钠的性质
碳酸钠俗名纯碱、苏打。碳酸氢钠俗名小苏打。
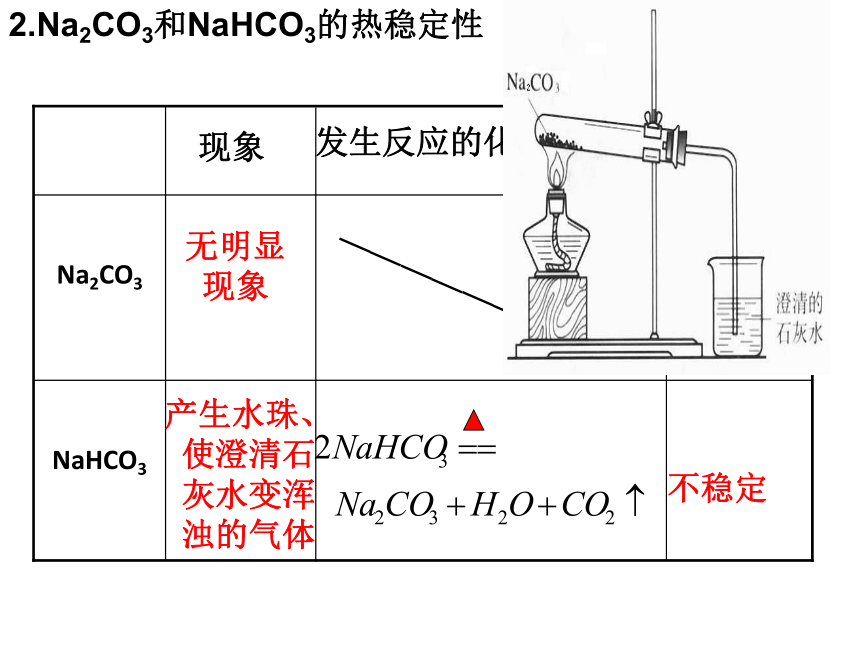
2.Na2CO3和NaHCO3的热稳定性
—————————
发生反应的化学方程式
NaHCO3
Na2CO3
结论
现象
稳定
不稳定
无明显现象
产生水珠、使澄清石灰水变浑浊的气体
思考:怎样除去Na2CO3固体中混有的NaHCO3?
充分加热到质量不再减少为止(充分加热到不再有气体产生为止)
3.Na2CO3和NaHCO3的其它性质
(1)与酸反应
反应剧烈程度:
用途:
碳酸钠:制玻璃、肥皂等
碳酸氢钠:发酵粉、胃药等
总结
Na2CO3
NaHCO3
俗 名
水溶性比较
溶液碱性比较
小苏打
纯碱 苏打
Na2CO3 > NaHCO3
热稳定性比较
与酸反应快慢比较
Na2CO3 > NaHCO3
Na2CO3 < NaHCO3
Na2CO3 > NaHCO3
5、焰色反应
实验步骤:
①将铂丝防在酒精灯外焰上灼烧至火焰颜色与原来相同;
②用铂丝蘸取待测碳酸钠溶液放在外焰上灼烧,观察火焰颜色;
③用盐酸洗净铂丝,在外焰上灼烧至火焰无色后,再蘸取碳酸钾溶液在外焰上灼烧,透过蓝色的钴玻璃观察火焰的颜色。
注意:
①每次实验必须用盐酸洗净铂丝,并灼烧至火焰与原来相同;
②钾的焰色必须透过蓝色的钴玻璃观察。(避免钠等杂质
的焰色的干扰。)
实验3-9
几种金属的焰色:
Li Na K Ca Sr Ba Cu
紫红 黄 紫 砖红 洋红 黄绿 绿
第2节 几种重要的金属化合物(2)
铝的重要化合物
地壳中含量最多的金属元素是 ;人们发现并制得铝单质比较晚,这是因为 .
红宝石(Al2O3)
蓝宝石(Al2O3)
明矾晶体KAl(SO4)2·12H2O
明矾水解产生的Al(OH)3吸附能力很强,可以用来吸附水里的杂质。
化学性质:能溶于 或 中;化学方程式分别为:
Al2O3 +6HCl=2AlCl3+3H2O
Al2O3 +2NaOH=2NaAlO2+H2O
氧化铝既能与酸反应又能与强碱溶液反应,所以氧化铝是一种 ;(也可以说氧化铝溶于酸或强碱,这个溶是指反应)
氧化铝:
物理性质:水溶性: , 熔点 ,
用途:冶炼 的原料;是一种 材料;可以制 。
两性氧化物
难溶于水
很高
铝
耐火
耐火坩埚 、耐火管、耐高温的实验仪器
酸 强碱溶液
氢氧化铝
Al2(SO4)3+6NH3?H2O=2Al(OH)3↓+3(NH4)2SO4
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
制备Al(OH)3时为什么不用NaOH等强碱溶液,而用氨水?
Al(OH)3是一种白色胶状物,几乎不溶水,能凝聚水中的悬浮物,并能吸附色素,可净水。
2、性质
1、制法:常用铝盐+氨水,化学方程式为:
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+OH-=AlO2-+2H2O
氢氧化铝既能与酸反应又能与强碱溶液反应,所以氧化铝是一种 ;(也可以说氢氧化铝溶于酸或强碱)
氨水能溶解Al(OH)3吗?
(2)Al(OH)3既能溶于酸又能溶于强碱溶液,生成盐和水。氢氧化铝与盐酸、氢氧化钠溶液反应的化学方程式为:
两性氢氧化物
(3)氢氧化铝的不稳定性,受热易 ;化学方程式为:
2Al(OH)3==Al2O3+3H2O
?
用途: ;
分解
主要用于治疗胃酸过多
三、铁的重要化合物
1、铁的氧化物
氧化亚铁
FeO
三氧化二铁 Fe2O3
四氧化三铁 Fe3O4(FeO?Fe2O3)
色、态
俗 称
——
溶解性
稳定性
与酸反应
黑色粉末
难溶于水
FeO+2H+=
Fe2++H2O
红棕色粉末
铁 红
难溶于水
不稳定
稳 定
Fe2O3+6H+=
2Fe3++3H2O
黑色晶体
磁性氧化铁
难溶于水
稳 定
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
氯化铁溶液
硫酸亚铁溶液
加入氢氧化钠溶液的现象
离子方程式
2、铁的氢氧化物
在2支试管里分别加入少量的氯化铁和硫酸亚铁溶液,
然后滴入氢氧化钠溶液,观察现象:
刚开始产生灰白色沉淀,
之后沉淀变成灰绿色,
最后变成红褐色
产生红褐色沉淀
Fe2++2OH-=Fe(OH)2↓
(隔绝空气)
Fe3++3OH-=Fe(OH)3↓
刚开始产生灰白色沉淀是什么?
最后沉淀变成红褐色,这红褐色的沉淀又是什么?
为什么会有这样的现象呢?
氢氧化亚铁极易被空气中氧气氧化成氢氧化铁
4Fe(OH)2+2H2O+O2=4Fe(OH)3
氢氧化铁
氢氧化亚铁
2、铁的氢氧化物(小结)
氢氧化亚铁Fe(OH)2
氢氧化铁Fe(OH)3
制 法
颜 色
溶解性
稳定性
与酸反应
Fe2++2OH-=Fe(OH)2↓
(隔绝空气)
Fe3++3OH-=Fe(OH)3↓
灰白 色
红褐色
难溶于水
难溶于水
受热易分解
极易被空气中氧气氧化
成氢氧化铁
4Fe(OH)2+2H2O+O2
=4Fe(OH)3
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3++3H2O
3、铁盐和亚铁盐
(1)Fe3+检验
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
变为血红色
无明显变化
通过实验可知,要区分铁盐和亚铁盐,可加入 ;
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}FeCl3溶液中加入以下试剂:
现象
反应的离子方程式
铁粉,KSCN溶液
氯水,振荡
(2)Fe3+的氧化性
溶液由黄色变为浅绿色,溶液不变为红色
溶液变为红色
2Fe3++Fe=3Fe2+
2Fe2++Cl2=2Fe3++2Cl-
课本P61最后一段怎么说的?
KSCN溶液
小结:Fe3+和Fe2+的检验
{69C7853C-536D-4A76-A0AE-DD22124D55A5}试剂
Fe2+:浅绿色
Fe3+棕 黄色或黄色
加NaOH等碱溶液
加KSCN溶液
产生红褐色沉淀
不变红色
变血红色
产生白色沉淀 灰绿色 红褐色
第三节:用途广泛的金属材料
1、金属材料包括了 和 ;
2、合金具有很多优良的性能,在许多方面 各成分金属;硬度:合金 纯金属成分;
熔点:合金 纯金属成分;
抗腐蚀性:合金 纯金属成分.
3、铜的合金有: 、 、 ;
4、铁的合金有: 和 ;钢的分类有: 、 ;碳素钢又可以分为:
、 、 、
纯金属
合金
不同于
<
>
>
白铜
黄铜
青铜
钢 生铁
低碳钢
碳素钢
合金钢
高碳钢
中碳钢
1、如何下列物质总的少量杂质(括号中为杂质)?
①Na2CO3(NaHCO3)固体
②NaHCO3(Na2CO3)
加热
向溶液中通入过量CO2
2、下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①NaHCO3 ②Al ③Al2O3 ④ Al(OH)3 ⑤AlCl3 ⑥CuO
A. ② ③ ④ ⑤ B. ① ③ ④ ⑥ C. ① ② ③ ④ D.全部
3、区别碳酸钠和碳酸氢钠的最好方法是( )
A、加热
B、两者分别与盐酸反应
C、溶于水比较溶解性
D、两者分别加入氢氧化钠溶液
4、自然界最常见的钠的化合物是()
A、氯化钠 B、氧化钠 C、过氧化钠 D、氢氧化钠
B
C
A
5、把一小块钠投入盛有煤和水的烧杯中,可以观察到( )
A、钠浮在烧杯中的液面上
B、钠沉在杯底
C、煤油会燃烧起来,产生很浓的黑烟
D、钠会在水和煤油的交界处上下浮动,直到反应结束
6、可作为防毒面具里氧气来源的是( )
A、氧化钠 B、过氧化钠 C、氢氧化钠 D、碳酸氢钠
7、要使氯化铝中的铝离子尽可能多地沉淀出来,最好加入( )
A、石灰水B、氨水C、硫酸D、氢氧化钠溶液
8、要除去氧化镁中的氧化铝,应选用( )
A、氢氧化钠溶液B、硝酸C、浓硫酸D、稀盐酸
9、能在金属表面形成一层致密的氧化膜,起到保护作用的是( )
A、铁 B、钠 C、铜 D、铝
D
B
B
A
D
10、下列说法正确的是( )
A、铝在常温下与氧气不反应
B、氢氧化铝能与盐酸反应,不能与氢氧化钠溶液反应
C、铝既能溶于酸又能溶于碱
D、氧化铝不能与碱反应
11、要证明溶液中含有Fe3+,下列方法正确的是( )
A、加入铁粉B、滴加稀硫酸C、滴加氯水D、滴加KSCN溶液
12、下列说法正确的是( )
A、 Fe3+具有还原性,能与氯气反应
B、氢氧化铁是红褐色的沉淀
C、向氯化亚铁溶液中加入氢氧化钠,最终得到白色的沉淀
D、钢不是合金,生铁才是合金
C
D
B
