人教版高一化学必修1第二章第3节氧化还原反应(共25张ppt)
文档属性
| 名称 | 人教版高一化学必修1第二章第3节氧化还原反应(共25张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 435.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-21 16:19:04 | ||
图片预览







文档简介
第三节
氧化还原反应
一、氧化还原反应
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
说明:元素化合价升降是氧化还原反应的表观特征,
可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的
化学反应是氧化还原反应。
说明:氧化还原反应的本质是电子转移。
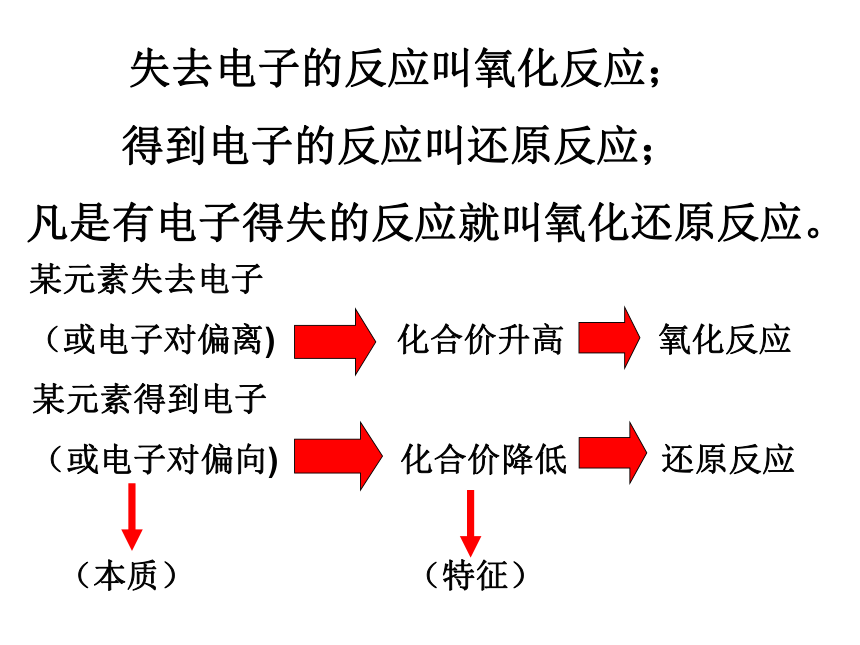
失去电子的反应叫氧化反应;
得到电子的反应叫还原反应;
凡是有电子得失的反应就叫氧化还原反应。
某元素失去电子
(或电子对偏离) 化合价升高 氧化反应
某元素得到电子
(或电子对偏向) 化合价降低 还原反应
(本质) (特征)
氧化还原反应
置 换 反 应
化合反应
分解反应
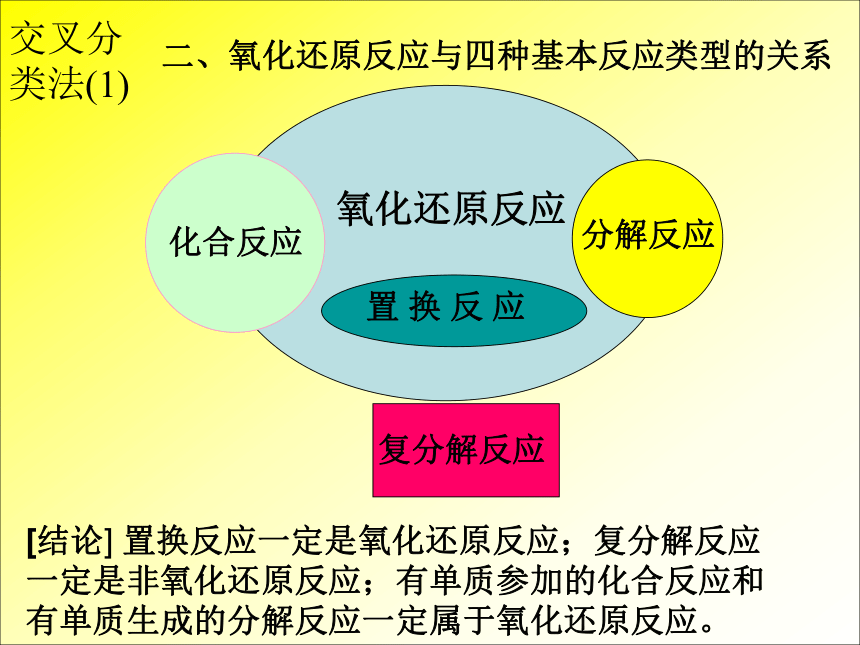
二、氧化还原反应与四种基本反应类型的关系
复分解反应
[结论] 置换反应一定是氧化还原反应;复分解反应
一定是非氧化还原反应;有单质参加的化合反应和
有单质生成的分解反应一定属于氧化还原反应。
交叉分类法(1)
化合反应
分解反应
复分解反应
置换反应
氧化还原反应
非氧化还原反应
交叉分类图(2)
思考
下列说法是否正确:
(1)没有单质参加的反应一定不是氧化还原反应?
(2)有单质参加的反应或有单质生成的反应一定为氧化还原反应?
1、氧化剂是得到电子(或电子对偏向)的物质
在反应时所含元素的化合价降低。
氧化剂具有氧化性,反应时本身被还原
2、还原剂是失去电子(或电子对偏离)的物质
在反应时所含元素的化合价升高。
还原剂具有还原性,反应时本身被氧化
三、氧化剂和还原剂的概念
3、常见的氧化剂有:
①活泼的非金属单质如:卤素单质 (X2)、 O2、S等。
②高价金属阳离子如:Fe3+、Cu2+等。
③高价或较高价含氧化合物如:MnO2、浓H2SO4、HNO3、酸化KMnO4。
4、常见的还原剂有:
①活泼或较活泼的金属:如K、Na、Al、Fe等。
②一些非金属单质:如H2、C、Si等。
③较低态的化合物:CO、SO2、H2S等。
四、氧化产物和还原产物
氧化产物:还原剂失去电子被氧化后的生成物
还原产物:氧化剂得电子被还原后的生成物
例.指出下列反应中的氧化剂和还原剂,氧化产物和还原产物.
MnO2+4HCl=MnCl2+Cl2 +2H2O
几个概念间的关系:(1)
还原产物
氧化剂
具有氧化性
得电子
化合价降低
发生还原反应(被还原)
反应物
性 质
实 质
特征
反应产物
反 应
还原剂
具有还原性
失电子
化合价升高
发生氧化反应(被氧化)
氧化产物
还原剂 + 氧化剂 == 氧化产物+还原产物
失去电子,化合价升高, 被氧化
得到电子,化合价降低,被还原
各概念之间的相互关系:(2)
1、氧化还原反应的表示方法------双线桥
2CuO + C == 2Cu + CO2 ↑
得2×2e-,化合价降低,被还原
+2
0
0
+4
高温
失4e-,化合价升高,被氧化
书写步骤:
1.标出变化了的元素化合价;
2.箭头总是从反应物指向生成物;
4.标明电子的得与失,且总数相等。
3.箭头两端对准同一元素;
五、氧化还原反应的表示方法
CuO + H2 == Cu + H2O
+2
0
0
+1
得到2 e-,化合价降低,被还原
失去2 × e-,化合价升高,被氧化
氧化剂
还原剂
还原产物
氧化产物
五、氧化还原反应的描述方法
2、氧化还原反应的表示方法------单线桥法
用一根线桥表示电子转移的方向和数目
2e-
2Na + Cl2=== 2NaCl
书写步骤: 1.标出变化了的元素化合价;
2.箭头总是从还原剂指向氧化剂;
3.箭头的方向表示电子转移的方向;
4.不用标电子的得与失;
5.线桥不用跨过等号。
共同点:都能表示电子转移的方向和数目
例题:
用双线桥表示同种元素的电子得失
失 6e-,化合价升高,被氧化
双箭号从反应物指向生成物
且起止为同一元素。
注明得与失。
2 Fe + 3 Cl2 = 2 FeCl3
得 6e-,化合价降低,被还原
0
+3
0
-1
0
+3
0
-1
2 Fe + 3 Cl2 = 2 FeCl3
6e-
用单线桥表示不同种元素的电子转移
箭号起点为失电子元素,
终点为得电子元素。
不标得与失。
课堂练习
用双线桥表示同种元素的电子得失
失 12e-,化合价升高,被氧化
双箭号从反应物指向生成物
且起止为同一元素。
注明得与失。
2KClO3 = 2KCl + 3 O2
得 12e-,化合价降低,被还原
+5
-1
-2
-2
+5
-1
2 KClO3 = 2 KCl +3 O2
12e-
用单线桥表示不同种元素的电子转移
箭号起点为失电子元素,
终点为得电子元素。
不标得与失。
0
0
化学反应
按反应物和生成物的种类和类别分
化合反应
分解反应
置换反应
复分解反应
按反应中是否有离子参加分
离子反应
非离子反应
按反应中是否有电子转移分
氧化还原反应
非氧化还原反应
课堂练习:
1.下列各类反应中,全部是氧化还原反应的是
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
2.下列各说法正确的是
A.在氧化还原反应中,某元素由化合态变为单质,此元素可能被还原,也可能被氧化
B.在氧化还原反应中,可通过比较失去电子数的多少确定还原剂的强弱
C.在氧化还原反应中,非金属单质一定是氧化剂,金属单质一定是还原剂
D.化合物分解的产物有单质,则该分解反应必属于氧化还原反应
C
AD
3、下列叙述中,正确的是
(A) 金属元素失电子越多其还原性越强
(B)在氧化还原反应中,非金属单质一定
是氧化剂
(C)某元素从化合态变为游离态时,该元素
一定被还原
(D)金属阳离子被还原不一定得到金属单质
D
(E)一种元素被氧化,一定有另一种元素被还原
练习:
Fe2O3高温下通CO气体,写出化学方程式:
______________________________________________
指出______元素化合价降低,_____(得、失)电子,
_______发生还原反应,___________是氧化剂,
___________是氧化产物。
______元素化合价升高,_____(得、失)电子,
_______发生氧化反应, __________是还原剂,
__________ 是还原产物。
Fe2O3 + 3 CO 2Fe + 3CO2
高温
Fe
失
Fe2O3
Fe2O3
CO2
C
得
CO
CO
Fe
得氧的反应
失氧的反应
有得失氧的反应
化合价升高的反应
化合价降低的反应
有化合价升降的反应
得到(偏向)电子的反应
失去(偏离)电子的反应
有得失(偏向、离)电子的反应
氧化反应
还原反应
氧化还原反应
请对下列各反应进行分类:
非氧化还原反应
氧化剂和还原剂
氧化剂和还原剂作为反应物共同参加氧化还原反应。
在反应中,电子从还原剂转移到氧化剂.
氧化剂和还原剂的关系
小 结
氧化还原反应的特征:元素化合价有升降
氧化还原反应的本质:电子转移
口诀:失---升---氧
得---降---还
电子的转移方向:
还原剂 氧化剂
e-
(价 )
(价 )
氧化还原反应
一、氧化还原反应
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
说明:元素化合价升降是氧化还原反应的表观特征,
可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的
化学反应是氧化还原反应。
说明:氧化还原反应的本质是电子转移。
失去电子的反应叫氧化反应;
得到电子的反应叫还原反应;
凡是有电子得失的反应就叫氧化还原反应。
某元素失去电子
(或电子对偏离) 化合价升高 氧化反应
某元素得到电子
(或电子对偏向) 化合价降低 还原反应
(本质) (特征)
氧化还原反应
置 换 反 应
化合反应
分解反应
二、氧化还原反应与四种基本反应类型的关系
复分解反应
[结论] 置换反应一定是氧化还原反应;复分解反应
一定是非氧化还原反应;有单质参加的化合反应和
有单质生成的分解反应一定属于氧化还原反应。
交叉分类法(1)
化合反应
分解反应
复分解反应
置换反应
氧化还原反应
非氧化还原反应
交叉分类图(2)
思考
下列说法是否正确:
(1)没有单质参加的反应一定不是氧化还原反应?
(2)有单质参加的反应或有单质生成的反应一定为氧化还原反应?
1、氧化剂是得到电子(或电子对偏向)的物质
在反应时所含元素的化合价降低。
氧化剂具有氧化性,反应时本身被还原
2、还原剂是失去电子(或电子对偏离)的物质
在反应时所含元素的化合价升高。
还原剂具有还原性,反应时本身被氧化
三、氧化剂和还原剂的概念
3、常见的氧化剂有:
①活泼的非金属单质如:卤素单质 (X2)、 O2、S等。
②高价金属阳离子如:Fe3+、Cu2+等。
③高价或较高价含氧化合物如:MnO2、浓H2SO4、HNO3、酸化KMnO4。
4、常见的还原剂有:
①活泼或较活泼的金属:如K、Na、Al、Fe等。
②一些非金属单质:如H2、C、Si等。
③较低态的化合物:CO、SO2、H2S等。
四、氧化产物和还原产物
氧化产物:还原剂失去电子被氧化后的生成物
还原产物:氧化剂得电子被还原后的生成物
例.指出下列反应中的氧化剂和还原剂,氧化产物和还原产物.
MnO2+4HCl=MnCl2+Cl2 +2H2O
几个概念间的关系:(1)
还原产物
氧化剂
具有氧化性
得电子
化合价降低
发生还原反应(被还原)
反应物
性 质
实 质
特征
反应产物
反 应
还原剂
具有还原性
失电子
化合价升高
发生氧化反应(被氧化)
氧化产物
还原剂 + 氧化剂 == 氧化产物+还原产物
失去电子,化合价升高, 被氧化
得到电子,化合价降低,被还原
各概念之间的相互关系:(2)
1、氧化还原反应的表示方法------双线桥
2CuO + C == 2Cu + CO2 ↑
得2×2e-,化合价降低,被还原
+2
0
0
+4
高温
失4e-,化合价升高,被氧化
书写步骤:
1.标出变化了的元素化合价;
2.箭头总是从反应物指向生成物;
4.标明电子的得与失,且总数相等。
3.箭头两端对准同一元素;
五、氧化还原反应的表示方法
CuO + H2 == Cu + H2O
+2
0
0
+1
得到2 e-,化合价降低,被还原
失去2 × e-,化合价升高,被氧化
氧化剂
还原剂
还原产物
氧化产物
五、氧化还原反应的描述方法
2、氧化还原反应的表示方法------单线桥法
用一根线桥表示电子转移的方向和数目
2e-
2Na + Cl2=== 2NaCl
书写步骤: 1.标出变化了的元素化合价;
2.箭头总是从还原剂指向氧化剂;
3.箭头的方向表示电子转移的方向;
4.不用标电子的得与失;
5.线桥不用跨过等号。
共同点:都能表示电子转移的方向和数目
例题:
用双线桥表示同种元素的电子得失
失 6e-,化合价升高,被氧化
双箭号从反应物指向生成物
且起止为同一元素。
注明得与失。
2 Fe + 3 Cl2 = 2 FeCl3
得 6e-,化合价降低,被还原
0
+3
0
-1
0
+3
0
-1
2 Fe + 3 Cl2 = 2 FeCl3
6e-
用单线桥表示不同种元素的电子转移
箭号起点为失电子元素,
终点为得电子元素。
不标得与失。
课堂练习
用双线桥表示同种元素的电子得失
失 12e-,化合价升高,被氧化
双箭号从反应物指向生成物
且起止为同一元素。
注明得与失。
2KClO3 = 2KCl + 3 O2
得 12e-,化合价降低,被还原
+5
-1
-2
-2
+5
-1
2 KClO3 = 2 KCl +3 O2
12e-
用单线桥表示不同种元素的电子转移
箭号起点为失电子元素,
终点为得电子元素。
不标得与失。
0
0
化学反应
按反应物和生成物的种类和类别分
化合反应
分解反应
置换反应
复分解反应
按反应中是否有离子参加分
离子反应
非离子反应
按反应中是否有电子转移分
氧化还原反应
非氧化还原反应
课堂练习:
1.下列各类反应中,全部是氧化还原反应的是
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
2.下列各说法正确的是
A.在氧化还原反应中,某元素由化合态变为单质,此元素可能被还原,也可能被氧化
B.在氧化还原反应中,可通过比较失去电子数的多少确定还原剂的强弱
C.在氧化还原反应中,非金属单质一定是氧化剂,金属单质一定是还原剂
D.化合物分解的产物有单质,则该分解反应必属于氧化还原反应
C
AD
3、下列叙述中,正确的是
(A) 金属元素失电子越多其还原性越强
(B)在氧化还原反应中,非金属单质一定
是氧化剂
(C)某元素从化合态变为游离态时,该元素
一定被还原
(D)金属阳离子被还原不一定得到金属单质
D
(E)一种元素被氧化,一定有另一种元素被还原
练习:
Fe2O3高温下通CO气体,写出化学方程式:
______________________________________________
指出______元素化合价降低,_____(得、失)电子,
_______发生还原反应,___________是氧化剂,
___________是氧化产物。
______元素化合价升高,_____(得、失)电子,
_______发生氧化反应, __________是还原剂,
__________ 是还原产物。
Fe2O3 + 3 CO 2Fe + 3CO2
高温
Fe
失
Fe2O3
Fe2O3
CO2
C
得
CO
CO
Fe
得氧的反应
失氧的反应
有得失氧的反应
化合价升高的反应
化合价降低的反应
有化合价升降的反应
得到(偏向)电子的反应
失去(偏离)电子的反应
有得失(偏向、离)电子的反应
氧化反应
还原反应
氧化还原反应
请对下列各反应进行分类:
非氧化还原反应
氧化剂和还原剂
氧化剂和还原剂作为反应物共同参加氧化还原反应。
在反应中,电子从还原剂转移到氧化剂.
氧化剂和还原剂的关系
小 结
氧化还原反应的特征:元素化合价有升降
氧化还原反应的本质:电子转移
口诀:失---升---氧
得---降---还
电子的转移方向:
还原剂 氧化剂
e-
(价 )
(价 )
