人教版高一化学必修1第二章第3节氧化还原反应(共51张ppt)
文档属性
| 名称 | 人教版高一化学必修1第二章第3节氧化还原反应(共51张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 580.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-21 16:19:44 | ||
图片预览










文档简介
氧化还原反应
一、氧化还原反应的基本概念
1、氧化还原反应的概念:
(1)本质:有电子的转移(得失或偏移)
(2)特征:有元素化合价升降
有元素化合价升降的化学反应
(这是概念判断的依据)
【例1】 下列反应中不属于氧化还原反应的是( )
A 、Cl2+H2O==HCl+HClO
B、3CO+Fe2O3==2Fe+3CO2
C、CaCO3+SiO2==CaSiO3+CO2↑
D、3CuS+8HNO3==3Cu(NO3)2+2NO↑+3S↓+4H2O
C
练习1:判断下列那些为氧化还原反应,并说出理由
①IBr + H2O = HBr + HIO;
②KOH+Cl2=KCl +KClO+H2O ;
③NaH+H2O =NaOH+H2 ;
④CaO2+H2O =Ca(OH)2 +H2O2 ;
⑤5C2H5OH +2KMnO4+3H2SO4 →5CH3CHO +K2SO4+2MnSO4 +8H2O 。
氧化反应:
还原反应:
氧 化 性:
还 原 性:
氧 化 剂:
还 原 剂:
氧化产物:
还原产物:
物质所含元素化合价升高的反应(失去电子的反应)
物质所含元素化合价降低的反应(得到电子的反应)
物质(元素、离子)具有得到电子的性质或能力
物质(元素、离子)具有失去电子的性质或能力
得到电子(或电子对偏向)或元素化合价降低的反应物
还原剂失去电子被氧化后的产物
氧化剂得到电子被还原后的产物
相关概念的辨析
失去电子(或电子对偏离)或元素化合价升高的反应物
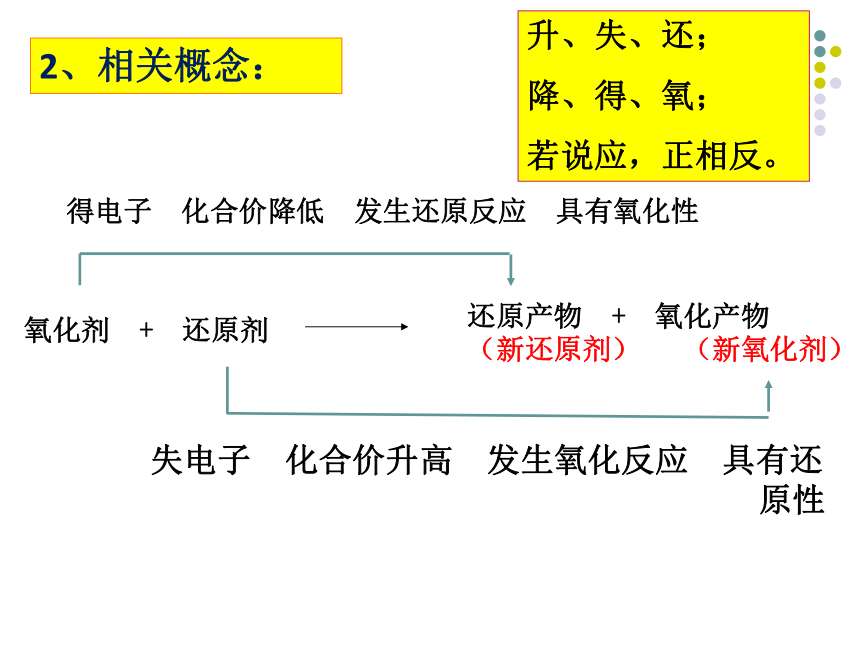
2、相关概念:
得电子 化合价降低 发生还原反应 具有氧化性
氧化剂 + 还原剂
还原产物 + 氧化产物
(新还原剂) (新氧化剂)
失电子 化合价升高 发生氧化反应 具有还
原性
升、失、还;
降、得、氧;
若说应,正相反。
相互联系:
还原性
氧化性
具有
氧化剂
表现
化合价降低
得到电子
被还原
还原反应
生成
还原产物
具有
性质
反应物
(同时存在)
特征
(总数相等)
实质
过程
(同时进行同时消失)
反应
产物
(同时生成)
性质
氧化性
还原性
具有
还原剂
表现
化合价升高
失去电子
被氧化
氧化反应
生成
氧化产物
具有
升、失、还;降、得、氧;若说应,正相反。
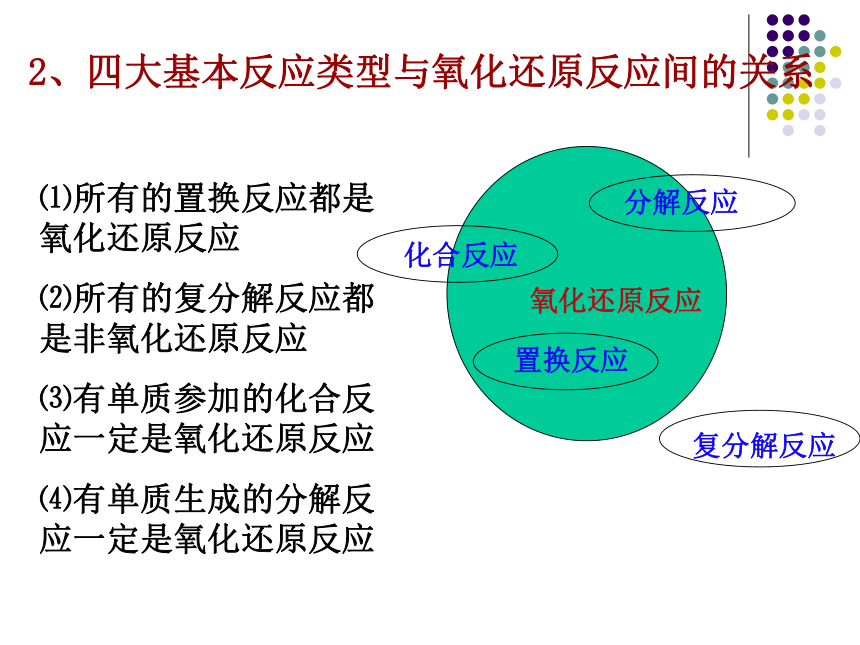
2、四大基本反应类型与氧化还原反应间的关系
氧化还原反应
化合反应
复分解反应
分解反应
置换反应
⑴所有的置换反应都是氧化还原反应
⑵所有的复分解反应都是非氧化还原反应
⑶有单质参加的化合反应一定是氧化还原反应
⑷有单质生成的分解反应一定是氧化还原反应
9
【例2】在 CaH2+2H2O=Ca(OH)2+2H2↑
的反应中,下列叙述正确的是( )
(1)H2是氧化产物
(2)H2是还原产物
(3)H2O是氧化剂
(4)CaH2中氢元素,既被氧化又被还原;
(5)氧化产物和还原产物质量比为1:1
A、①②④ B、③④⑤
C、①②③⑤ D、④
C
10
【例3】在11P+15CuSO4+24H2O=
5Cu3P+6H3PO4+15H2SO4
的反应中,P元素发生的变化是( )
A. 被氧化.
B. 被还原
C. 既被氧化又被还原
D.既未被氧化又未被还原
C
下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )
A. O3+2KI+H2O=2KOH+I2+O2
B. 2CH3COOH+Ca(ClO)2=2HClO+Ca(CH3COO)2
C. I2+2NaClO3=2NaIO3+Cl2
D. 4HCl+MnO2=MnCl2+Cl2↑+H2O
A D
【例4】
(1)用双线桥表示电子转移的结果和氧化还原反应的各种关系
重点:(1)双箭号(从反应物指向生成物)
(2)箭号起、止所指为同一种元素
(3)标出得与失电子及总数(氧化剂得电子总数等于还原剂失电子总数)
3、氧化还原反应中电子转移的表示方法:
(2)用单线桥表示电子转移情况
表示氧化剂和还原剂之间元素的电子转移情况时,将氧化剂中降价元素与还原剂中升价元素用直线连接起来,箭头从还原剂指向氧化剂,线上标出电子转移总数,称为“单线桥法”
重点:(1)单箭号(在反应物之间)
(2)箭号起点为失电子元素,终点为得电子元素(从还原剂指向氧化剂)
(3)只标转移电子总数,不标得与失。
14
【例5】 用双线桥法表示下列反应的电子转移方向和数目,并指出氧化剂、还原剂、氧化产物、还原产物。
参考答案:
1)3Cu+8HNO3(稀)=== 3Cu(NO3)2+2NO↑+4H2O
?
3Cu+8HNO3(稀) === 3Cu(NO3)2+2NO↑+4H2O
?
失去3 × 2e-
得到2× 3e-
15
化合价升高,失去6×2e-
还原剂
氧化剂
还原产物
氧化产物
化合价降低,得到2×6e-
0
+5
-2
-1
MnO2
△
2KClO3====2KCl + 3O2↑
2)氯酸钾与二氧化锰混合加热
16
3S + 6KOH == 2K2S + K2SO3+3H2O
化合价降低,得到2×2e-
还原剂
氧化剂
氧化产物
还原产物
化合价升高,失去4e-
+4
0
-2
3)硫与KOH溶液反应
有关氧化还原反应的下列叙述正确的是 ( )
A、氧化剂发生还原反应,还原剂发生氧化反应
B、凡有单质参加或生成的反应均为氧化还原反应
C、一个氧化还原反应中,氧化剂和还原剂一定是两种
不同的物质
D、H2与Cl2发生化学反应时,氢元素失去电子,化合
价升高被氧化
【例6】
A
4.常见的氧化剂、还原剂及其产物
(1)常见氧化剂及其产物
(2)常见还原剂及其产物
小结:
强氧化剂与强还原性相遇时,一般都会发生氧化还原反应。
如:H2SO4(浓)与金属、H2S、S2-、HI、I-、HBr、Br-、Fe2+、P等。
Cl2与金属、H2S、S2-、HI、I-、HBr、Br-、Fe2+、H2、SO2、 、H2SO3等。
HNO3与金属、H2S、S2-、HI、I-、HBr、Br-、Fe2+、P、SO2、 、H2SO3等。
5、氧化性和还原性强弱的判断
氧化性、还原性强弱的判断,是高考考查的重点。根据不同条件判断的依据是不一样的。其中比较重要的有:
⑴根据氧化还原反应进行判断---强弱律
⑵根据金属活动顺序表和周期律判断
⑶根据反应条件或反应剧烈程度判断
⑷根据不同还原剂(或氧化剂)与同一种氧化剂(或还原剂)反应,产物的价态来判断
⑸根据电化学知识进行判断
(一)根据方程式判断氧化还原性强弱
氧化性、还原性强弱比较规律:
对于任何氧化还原反应,都满足下列规律:
A
B
b
a
氧化性:A(氧化剂) >a(氧化产物)
还原性:B (还原剂)> b(还原产物)
氧化剂 + 还原剂 = 氧化剂的还原产物 + 还原剂的氧化产物
失电子、化合价升高、被氧化,发生氧化反应
得电子、化合价降低、被还原,发生还原反应
重要题型:
例1.根据下列三个方程式( )
I2+SO2+2H2O=H2SO4+2HI;2FeCl2+Cl2=2FeCl3;
2FeCl3+2HI=2FeCl2+2HCl+I2有关物质的还原性强弱顺序是
A I->Fe2+>Cl->SO2 B Cl->Fe2+>SO2> I-
C Fe2+>I->SO2 D SO2>I->Fe2+>Cl-
D
例2. 已知I-、Fe2+、和H2O2均有还原性,它们在酸性溶液中还原性强弱顺序为: H2O2 < Fe2+ < I- < SO2。则下列反应不能发生的是( )
A 2Fe3++SO2+2H2O=2Fe2+ +SO42-+4H+
B H2O2 +H2SO4=SO2+O2+2H2O
C I2+SO2+2H2O=H2SO4+2HI
D 2Fe3++2I-=2Fe2++I2
B
(1)根据金属活动顺序表
K Ca Na Mg Al Zn Fe Sn Pb (H2) Cu Hg Ag
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ H+ Cu2+ Hg2+ Ag+
失电子能力逐渐增强,还原性逐渐增强
其阳离子得电子能力逐渐增强,氧化性逐渐增强
(二)根据金属和非金属活动顺序表判断
K+ <Al3+ < Fe2+ < Cu2+ < Fe3+ < Ag+
氧化性增强
识记:
(2)根据非金属活动顺序判断
F2 Cl2 Br2 I2 S
F- Cl- Br- I- S2-
氧化性逐渐减弱
还原性逐渐增强
金属单质的还原性随金属性增强而增强,其离子的氧化性相应减弱
非金属单质的氧化性随非金属性增强而增强,其离子的还原性相应减弱
(三)根据元素周期表判断
(四)根据元素化合价高低来判断氧化性强弱
一般地说,同种变价元素的几种物质,它们的氧化能力是由高价态到低价态逐渐减弱,还原能力则依次逐渐增强。
判断氧化性强弱: Fe3+与Fe2+;
KMnO4与MnO2
还原性强弱:S2-、S与SO3
氧化性: Fe3+>Fe2+
KMnO4>MnO2 ;
还原性: S2->S>SO3
氯元素的化合价
+7
?
+5
?
+3
?
+1
0
-1
只有氧化性
兼有氧化性和还原性
只有还原性
兼有氧化性和还原性
兼有氧化性和还原性
兼有氧化性和还原性
特例:
氧化性:HClO> HClO2 > HClO3 > HClO4
(五)根据与同一种物质反应的情况判断氧化性强弱
如:2Fe+3Cl2 = 2FeCl3 Fe+2HCl = FeCl2+H2↑
Cl2能将Fe氧化至+3价,而HCl只能将Fe氧化为+2价,故氧化能力Cl2>HCl。
又如:
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
同是将浓盐酸氧化为Cl2,MnO2必须在加热条件下才能进行,而KMnO4在常温下即可进行,说明氧化能力KMnO4>MnO2。
(1)物质的浓度越高,氧化性或还原性越强。
(2)温度越高,氧化性或还原性越强。
(3)酸性越强,氧化性越强;碱性越强,还原性越强。
(六)外界条件对某些物质氧化性或还原性强弱的影响
浓HNO3的氧化性强于稀HNO3;H2SO4(浓) > H2SO4(稀)
C、CO、H2常温下不显还原性;
再如KMnO4氧化性:酸性 > 中性 > 碱性
(七)根据电极反应判断
(1)两种不同的金属构成原电池时,做负极的金属的还原性比正极金属的还原性强。
(2)用惰性电极电解混合溶液时,在阴极先放电的金属离子的氧化性强;在阳极先放电的阴离子的还原性强。
【典例精析】
例1 [2010·南昌二模]有关化学反应:Zn+2HNO3+NH4NO3===N2↑+3H2O+Zn(NO3)2的叙述正确的是( )
A. HNO3只体现酸性
B.氧化产物只有Zn(NO3)2,还原产物只有N2
C.还原产物与氧化产物物质的量之比为1∶2
D.生成1 mol N2转移电子总数3.01×1024个
例1 D [解析]本题考查氧化还原反应的分析,中档题。A项产物Zn(NO3)2中的NO,一个来自于NH4NO3,一个来自于HNO3;N2中一个N来自HNO3,一个来自NH,所以HNO3体现氧化性和酸性,A错;B项,Zn(NO3)2是氧化产物,N2既是氧化产物,又是还原产物,错;C项,还原产物为0.5 mol N2,氧化产物为0.5 mol N2和1 mol Zn(NO3)2,错;D项,化合价降低的只有+5价的N,降至0价,生成1 mol N2转移电子总数为3.01×1024个,正确。
变式题
[2010·海南卷]下列物质中既有氧化性又有还原性的是( )
A.HClO B.Al2O3 C.N2O3 D.SiO2
C
判断下列反应能否发生?若能发生写出离子反应方程式,并比较氧化性强弱。
☆ 2Fe3+ + 2I- = 2Fe2+ + I2
☆ 2Fe2++ Br2 = 2Fe3+ + 2Br-
☆ MnO4-+ 5Fe2++ 8H+ = 5Fe3+ + Mn2+ + 4H2O
氧化性:Br2 > Fe3+; MnO4- > Fe3+ > I2
氧化性: MnO4-> MnO2 > Cl2 > Br2 > Fe3+ > I2
☆ KI溶液滴入FeCl3溶液中
☆ Br2水滴入FeSO4溶液中
☆ KMnO4溶液和FeSO4溶液混合
将Fe,Cu粉与FeCl3,FeCl2,CuCl2的混合溶液放在某一容器里,根据下述情况判断哪些阳离子或金属单质同时存在,哪些不能同时存在。
(1)反应后铁有剩余,则容器里可能有_______
(2)反应后有Cu2+和Cu,则容器里不可能有_______
(3)反应后有Cu2+,Fe3+,则容器里不可能有______
Fe Cu Fe2+
Fe Fe3+
Fe Cu
练习:
6.氧化还原规律
(1)守恒规律
氧化还原反应中化合价升降总数相等,得失电子数相等,
即:氧化剂得电子总数=还原剂失电子总数
应用:有关氧化还原反应的计算及配平氧化还原反应方程式。
(2)价态规律
元素处于最高价态时,只有氧化性,但不一定具有强氧化性;
元素处于最低价态时,只有还原性,但不一定具有强还原性;
元素处于中间价态时,既有氧化性又有还原性,但主要呈现一种性质。
物质含有多种元素,其性质是这些元素性质的综合体现。
应用:判断元素或物质有无氧化性、还原性。
(3)强弱规律(一般遵循“两强制两弱”原理)
氧化剂 + 还原剂 = 还原产物 + 氧化产物
(强氧化性)(强还原性)(弱还原性)(弱氧化性)
┌──────────┐
└───────────┘
+ne-
-ne-
应用: ①比较物质间氧化性或还原性的强弱;
②在适宜条件下,用氧化性强的物质制备氧化性弱的物质或用还原性强的物质制备还原性弱的物质。
相对较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。
(4)转化规律
①氧化还原反应中,以元素相邻价态间的转化最容易;
②同种元素不同价态之间的氧化还原反应,化合价的变化遵循:
高价+低价 ─────→ 中间价(归中反应)
中间价──────→高价+低价(歧化反应)
③同种元素,相邻价态间不发生氧化还原反应。
应用:分析判断氧化还原反应能否发生。
(5)难易规律 (或先后规律)
①越易失电子的物质,失后就越难得电子,越易得电子的物质,得后就越难失电子。(注意:难失电子的物质不一定易得电子,难得电子的物质也不一定易失电子。如稀有气体既难失电子,又难得电子。)
②一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;
一种还原剂同时和几种氧化剂相遇时,氧化性最强的优先发生反应。
应用:判断物质的稳定性及反应顺序。
41
6 氧化还原反应方程式配平
(1)、配平的原则
①电子转移守恒;
②离子电荷守恒;
③原子个数守恒。
(2)、配平的步骤:
化合价
相等
质量
电荷
电子
(3)氧化还原反应的配平方法
(1)正向配平法
如果被氧化、被还原的元素分别是两种反应物间的氧化还原
反应,通常从左边反应物进行配平。
④配平
K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+K2SO4+3Fe2(SO4)3+7H2O
⑤检查
(2)逆向配平法
对于自身发生的氧化还原反应或反应物只有一种,一般从生
成物配平较简便。(歧化反应、分解反应、部分参加氧化还原反应)
(3)待定系数法
有些复杂的氧化还原反应,利用化合价升降来配平不方便,
这时可采用数学原理,先假设其化学计量数,之后利用元素守
恒确定各化学计量数,这种方法常称作“待定系数法”。
④3S+6KOH=2K2S+K2SO3+3H2O
⑤检查
依据“O”守恒列式可求得:a : b =15 : 44
⑴、 Pb(N3)2 + Cr(MnO4)2 =
Cr2O3+ MnO2+ Pb3O4+ NO↑
a b
b/2 2b a/3 6a
(4)缺项配平法
这类方程式通常少写一种反应物(或离子)或生成物(或离子)
的化式,要求确定其化学式。先使得失电子数配平,再观察两边电荷。若反应物这边缺正电荷,一般加(H+),生成物一边加水;若反应物这边缺负电荷,一般加(OH-),生成物一边则加水.然后进行两边电荷数配平。 (一般需加酸、碱、水)
⑵、 1 P4O + a Cl2 → 3/2 P2Cl5 + 1 POCl3
4 21 = 6 4
依据“Cl”守恒列式可求得:a =21/4
由方程式右边多3个SO和氢元素,推知缺项物质应为H2SO4,
进一步观察得
2KMnO4+5KNO2+3H2SO4=2MnSO4+K2SO4+5KNO3+3H2O
(5)零价法:
适宜于还原剂中两种元素价态难以确定但均属于升高的氧化还原反应。
Fe3P+ HNO3—— Fe(NO3)3+ NO+ H3PO4+ H2O
FeS2 + O2 —— Fe2O3 + SO2
An + Bx- = Bm + Ay-
Na2Sx + NaClO + = NaCl+ Na2SO4+ H2O
(6) 字母配平
1Fe(NO3)2 =
1C3H5NO9 =
(7) 分解反应,设“1”法
1/2Fe2O3 + 2NO2 ↑ + 1/4O2
4 = 12 6 1 10
3CO2↑ +3/2N2↑+ 1/4O2↑+5/2H2O ↑
一、氧化还原反应的基本概念
1、氧化还原反应的概念:
(1)本质:有电子的转移(得失或偏移)
(2)特征:有元素化合价升降
有元素化合价升降的化学反应
(这是概念判断的依据)
【例1】 下列反应中不属于氧化还原反应的是( )
A 、Cl2+H2O==HCl+HClO
B、3CO+Fe2O3==2Fe+3CO2
C、CaCO3+SiO2==CaSiO3+CO2↑
D、3CuS+8HNO3==3Cu(NO3)2+2NO↑+3S↓+4H2O
C
练习1:判断下列那些为氧化还原反应,并说出理由
①IBr + H2O = HBr + HIO;
②KOH+Cl2=KCl +KClO+H2O ;
③NaH+H2O =NaOH+H2 ;
④CaO2+H2O =Ca(OH)2 +H2O2 ;
⑤5C2H5OH +2KMnO4+3H2SO4 →5CH3CHO +K2SO4+2MnSO4 +8H2O 。
氧化反应:
还原反应:
氧 化 性:
还 原 性:
氧 化 剂:
还 原 剂:
氧化产物:
还原产物:
物质所含元素化合价升高的反应(失去电子的反应)
物质所含元素化合价降低的反应(得到电子的反应)
物质(元素、离子)具有得到电子的性质或能力
物质(元素、离子)具有失去电子的性质或能力
得到电子(或电子对偏向)或元素化合价降低的反应物
还原剂失去电子被氧化后的产物
氧化剂得到电子被还原后的产物
相关概念的辨析
失去电子(或电子对偏离)或元素化合价升高的反应物
2、相关概念:
得电子 化合价降低 发生还原反应 具有氧化性
氧化剂 + 还原剂
还原产物 + 氧化产物
(新还原剂) (新氧化剂)
失电子 化合价升高 发生氧化反应 具有还
原性
升、失、还;
降、得、氧;
若说应,正相反。
相互联系:
还原性
氧化性
具有
氧化剂
表现
化合价降低
得到电子
被还原
还原反应
生成
还原产物
具有
性质
反应物
(同时存在)
特征
(总数相等)
实质
过程
(同时进行同时消失)
反应
产物
(同时生成)
性质
氧化性
还原性
具有
还原剂
表现
化合价升高
失去电子
被氧化
氧化反应
生成
氧化产物
具有
升、失、还;降、得、氧;若说应,正相反。
2、四大基本反应类型与氧化还原反应间的关系
氧化还原反应
化合反应
复分解反应
分解反应
置换反应
⑴所有的置换反应都是氧化还原反应
⑵所有的复分解反应都是非氧化还原反应
⑶有单质参加的化合反应一定是氧化还原反应
⑷有单质生成的分解反应一定是氧化还原反应
9
【例2】在 CaH2+2H2O=Ca(OH)2+2H2↑
的反应中,下列叙述正确的是( )
(1)H2是氧化产物
(2)H2是还原产物
(3)H2O是氧化剂
(4)CaH2中氢元素,既被氧化又被还原;
(5)氧化产物和还原产物质量比为1:1
A、①②④ B、③④⑤
C、①②③⑤ D、④
C
10
【例3】在11P+15CuSO4+24H2O=
5Cu3P+6H3PO4+15H2SO4
的反应中,P元素发生的变化是( )
A. 被氧化.
B. 被还原
C. 既被氧化又被还原
D.既未被氧化又未被还原
C
下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )
A. O3+2KI+H2O=2KOH+I2+O2
B. 2CH3COOH+Ca(ClO)2=2HClO+Ca(CH3COO)2
C. I2+2NaClO3=2NaIO3+Cl2
D. 4HCl+MnO2=MnCl2+Cl2↑+H2O
A D
【例4】
(1)用双线桥表示电子转移的结果和氧化还原反应的各种关系
重点:(1)双箭号(从反应物指向生成物)
(2)箭号起、止所指为同一种元素
(3)标出得与失电子及总数(氧化剂得电子总数等于还原剂失电子总数)
3、氧化还原反应中电子转移的表示方法:
(2)用单线桥表示电子转移情况
表示氧化剂和还原剂之间元素的电子转移情况时,将氧化剂中降价元素与还原剂中升价元素用直线连接起来,箭头从还原剂指向氧化剂,线上标出电子转移总数,称为“单线桥法”
重点:(1)单箭号(在反应物之间)
(2)箭号起点为失电子元素,终点为得电子元素(从还原剂指向氧化剂)
(3)只标转移电子总数,不标得与失。
14
【例5】 用双线桥法表示下列反应的电子转移方向和数目,并指出氧化剂、还原剂、氧化产物、还原产物。
参考答案:
1)3Cu+8HNO3(稀)=== 3Cu(NO3)2+2NO↑+4H2O
?
3Cu+8HNO3(稀) === 3Cu(NO3)2+2NO↑+4H2O
?
失去3 × 2e-
得到2× 3e-
15
化合价升高,失去6×2e-
还原剂
氧化剂
还原产物
氧化产物
化合价降低,得到2×6e-
0
+5
-2
-1
MnO2
△
2KClO3====2KCl + 3O2↑
2)氯酸钾与二氧化锰混合加热
16
3S + 6KOH == 2K2S + K2SO3+3H2O
化合价降低,得到2×2e-
还原剂
氧化剂
氧化产物
还原产物
化合价升高,失去4e-
+4
0
-2
3)硫与KOH溶液反应
有关氧化还原反应的下列叙述正确的是 ( )
A、氧化剂发生还原反应,还原剂发生氧化反应
B、凡有单质参加或生成的反应均为氧化还原反应
C、一个氧化还原反应中,氧化剂和还原剂一定是两种
不同的物质
D、H2与Cl2发生化学反应时,氢元素失去电子,化合
价升高被氧化
【例6】
A
4.常见的氧化剂、还原剂及其产物
(1)常见氧化剂及其产物
(2)常见还原剂及其产物
小结:
强氧化剂与强还原性相遇时,一般都会发生氧化还原反应。
如:H2SO4(浓)与金属、H2S、S2-、HI、I-、HBr、Br-、Fe2+、P等。
Cl2与金属、H2S、S2-、HI、I-、HBr、Br-、Fe2+、H2、SO2、 、H2SO3等。
HNO3与金属、H2S、S2-、HI、I-、HBr、Br-、Fe2+、P、SO2、 、H2SO3等。
5、氧化性和还原性强弱的判断
氧化性、还原性强弱的判断,是高考考查的重点。根据不同条件判断的依据是不一样的。其中比较重要的有:
⑴根据氧化还原反应进行判断---强弱律
⑵根据金属活动顺序表和周期律判断
⑶根据反应条件或反应剧烈程度判断
⑷根据不同还原剂(或氧化剂)与同一种氧化剂(或还原剂)反应,产物的价态来判断
⑸根据电化学知识进行判断
(一)根据方程式判断氧化还原性强弱
氧化性、还原性强弱比较规律:
对于任何氧化还原反应,都满足下列规律:
A
B
b
a
氧化性:A(氧化剂) >a(氧化产物)
还原性:B (还原剂)> b(还原产物)
氧化剂 + 还原剂 = 氧化剂的还原产物 + 还原剂的氧化产物
失电子、化合价升高、被氧化,发生氧化反应
得电子、化合价降低、被还原,发生还原反应
重要题型:
例1.根据下列三个方程式( )
I2+SO2+2H2O=H2SO4+2HI;2FeCl2+Cl2=2FeCl3;
2FeCl3+2HI=2FeCl2+2HCl+I2有关物质的还原性强弱顺序是
A I->Fe2+>Cl->SO2 B Cl->Fe2+>SO2> I-
C Fe2+>I->SO2 D SO2>I->Fe2+>Cl-
D
例2. 已知I-、Fe2+、和H2O2均有还原性,它们在酸性溶液中还原性强弱顺序为: H2O2 < Fe2+ < I- < SO2。则下列反应不能发生的是( )
A 2Fe3++SO2+2H2O=2Fe2+ +SO42-+4H+
B H2O2 +H2SO4=SO2+O2+2H2O
C I2+SO2+2H2O=H2SO4+2HI
D 2Fe3++2I-=2Fe2++I2
B
(1)根据金属活动顺序表
K Ca Na Mg Al Zn Fe Sn Pb (H2) Cu Hg Ag
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ H+ Cu2+ Hg2+ Ag+
失电子能力逐渐增强,还原性逐渐增强
其阳离子得电子能力逐渐增强,氧化性逐渐增强
(二)根据金属和非金属活动顺序表判断
K+ <Al3+ < Fe2+ < Cu2+ < Fe3+ < Ag+
氧化性增强
识记:
(2)根据非金属活动顺序判断
F2 Cl2 Br2 I2 S
F- Cl- Br- I- S2-
氧化性逐渐减弱
还原性逐渐增强
金属单质的还原性随金属性增强而增强,其离子的氧化性相应减弱
非金属单质的氧化性随非金属性增强而增强,其离子的还原性相应减弱
(三)根据元素周期表判断
(四)根据元素化合价高低来判断氧化性强弱
一般地说,同种变价元素的几种物质,它们的氧化能力是由高价态到低价态逐渐减弱,还原能力则依次逐渐增强。
判断氧化性强弱: Fe3+与Fe2+;
KMnO4与MnO2
还原性强弱:S2-、S与SO3
氧化性: Fe3+>Fe2+
KMnO4>MnO2 ;
还原性: S2->S>SO3
氯元素的化合价
+7
?
+5
?
+3
?
+1
0
-1
只有氧化性
兼有氧化性和还原性
只有还原性
兼有氧化性和还原性
兼有氧化性和还原性
兼有氧化性和还原性
特例:
氧化性:HClO> HClO2 > HClO3 > HClO4
(五)根据与同一种物质反应的情况判断氧化性强弱
如:2Fe+3Cl2 = 2FeCl3 Fe+2HCl = FeCl2+H2↑
Cl2能将Fe氧化至+3价,而HCl只能将Fe氧化为+2价,故氧化能力Cl2>HCl。
又如:
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
同是将浓盐酸氧化为Cl2,MnO2必须在加热条件下才能进行,而KMnO4在常温下即可进行,说明氧化能力KMnO4>MnO2。
(1)物质的浓度越高,氧化性或还原性越强。
(2)温度越高,氧化性或还原性越强。
(3)酸性越强,氧化性越强;碱性越强,还原性越强。
(六)外界条件对某些物质氧化性或还原性强弱的影响
浓HNO3的氧化性强于稀HNO3;H2SO4(浓) > H2SO4(稀)
C、CO、H2常温下不显还原性;
再如KMnO4氧化性:酸性 > 中性 > 碱性
(七)根据电极反应判断
(1)两种不同的金属构成原电池时,做负极的金属的还原性比正极金属的还原性强。
(2)用惰性电极电解混合溶液时,在阴极先放电的金属离子的氧化性强;在阳极先放电的阴离子的还原性强。
【典例精析】
例1 [2010·南昌二模]有关化学反应:Zn+2HNO3+NH4NO3===N2↑+3H2O+Zn(NO3)2的叙述正确的是( )
A. HNO3只体现酸性
B.氧化产物只有Zn(NO3)2,还原产物只有N2
C.还原产物与氧化产物物质的量之比为1∶2
D.生成1 mol N2转移电子总数3.01×1024个
例1 D [解析]本题考查氧化还原反应的分析,中档题。A项产物Zn(NO3)2中的NO,一个来自于NH4NO3,一个来自于HNO3;N2中一个N来自HNO3,一个来自NH,所以HNO3体现氧化性和酸性,A错;B项,Zn(NO3)2是氧化产物,N2既是氧化产物,又是还原产物,错;C项,还原产物为0.5 mol N2,氧化产物为0.5 mol N2和1 mol Zn(NO3)2,错;D项,化合价降低的只有+5价的N,降至0价,生成1 mol N2转移电子总数为3.01×1024个,正确。
变式题
[2010·海南卷]下列物质中既有氧化性又有还原性的是( )
A.HClO B.Al2O3 C.N2O3 D.SiO2
C
判断下列反应能否发生?若能发生写出离子反应方程式,并比较氧化性强弱。
☆ 2Fe3+ + 2I- = 2Fe2+ + I2
☆ 2Fe2++ Br2 = 2Fe3+ + 2Br-
☆ MnO4-+ 5Fe2++ 8H+ = 5Fe3+ + Mn2+ + 4H2O
氧化性:Br2 > Fe3+; MnO4- > Fe3+ > I2
氧化性: MnO4-> MnO2 > Cl2 > Br2 > Fe3+ > I2
☆ KI溶液滴入FeCl3溶液中
☆ Br2水滴入FeSO4溶液中
☆ KMnO4溶液和FeSO4溶液混合
将Fe,Cu粉与FeCl3,FeCl2,CuCl2的混合溶液放在某一容器里,根据下述情况判断哪些阳离子或金属单质同时存在,哪些不能同时存在。
(1)反应后铁有剩余,则容器里可能有_______
(2)反应后有Cu2+和Cu,则容器里不可能有_______
(3)反应后有Cu2+,Fe3+,则容器里不可能有______
Fe Cu Fe2+
Fe Fe3+
Fe Cu
练习:
6.氧化还原规律
(1)守恒规律
氧化还原反应中化合价升降总数相等,得失电子数相等,
即:氧化剂得电子总数=还原剂失电子总数
应用:有关氧化还原反应的计算及配平氧化还原反应方程式。
(2)价态规律
元素处于最高价态时,只有氧化性,但不一定具有强氧化性;
元素处于最低价态时,只有还原性,但不一定具有强还原性;
元素处于中间价态时,既有氧化性又有还原性,但主要呈现一种性质。
物质含有多种元素,其性质是这些元素性质的综合体现。
应用:判断元素或物质有无氧化性、还原性。
(3)强弱规律(一般遵循“两强制两弱”原理)
氧化剂 + 还原剂 = 还原产物 + 氧化产物
(强氧化性)(强还原性)(弱还原性)(弱氧化性)
┌──────────┐
└───────────┘
+ne-
-ne-
应用: ①比较物质间氧化性或还原性的强弱;
②在适宜条件下,用氧化性强的物质制备氧化性弱的物质或用还原性强的物质制备还原性弱的物质。
相对较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。
(4)转化规律
①氧化还原反应中,以元素相邻价态间的转化最容易;
②同种元素不同价态之间的氧化还原反应,化合价的变化遵循:
高价+低价 ─────→ 中间价(归中反应)
中间价──────→高价+低价(歧化反应)
③同种元素,相邻价态间不发生氧化还原反应。
应用:分析判断氧化还原反应能否发生。
(5)难易规律 (或先后规律)
①越易失电子的物质,失后就越难得电子,越易得电子的物质,得后就越难失电子。(注意:难失电子的物质不一定易得电子,难得电子的物质也不一定易失电子。如稀有气体既难失电子,又难得电子。)
②一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;
一种还原剂同时和几种氧化剂相遇时,氧化性最强的优先发生反应。
应用:判断物质的稳定性及反应顺序。
41
6 氧化还原反应方程式配平
(1)、配平的原则
①电子转移守恒;
②离子电荷守恒;
③原子个数守恒。
(2)、配平的步骤:
化合价
相等
质量
电荷
电子
(3)氧化还原反应的配平方法
(1)正向配平法
如果被氧化、被还原的元素分别是两种反应物间的氧化还原
反应,通常从左边反应物进行配平。
④配平
K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+K2SO4+3Fe2(SO4)3+7H2O
⑤检查
(2)逆向配平法
对于自身发生的氧化还原反应或反应物只有一种,一般从生
成物配平较简便。(歧化反应、分解反应、部分参加氧化还原反应)
(3)待定系数法
有些复杂的氧化还原反应,利用化合价升降来配平不方便,
这时可采用数学原理,先假设其化学计量数,之后利用元素守
恒确定各化学计量数,这种方法常称作“待定系数法”。
④3S+6KOH=2K2S+K2SO3+3H2O
⑤检查
依据“O”守恒列式可求得:a : b =15 : 44
⑴、 Pb(N3)2 + Cr(MnO4)2 =
Cr2O3+ MnO2+ Pb3O4+ NO↑
a b
b/2 2b a/3 6a
(4)缺项配平法
这类方程式通常少写一种反应物(或离子)或生成物(或离子)
的化式,要求确定其化学式。先使得失电子数配平,再观察两边电荷。若反应物这边缺正电荷,一般加(H+),生成物一边加水;若反应物这边缺负电荷,一般加(OH-),生成物一边则加水.然后进行两边电荷数配平。 (一般需加酸、碱、水)
⑵、 1 P4O + a Cl2 → 3/2 P2Cl5 + 1 POCl3
4 21 = 6 4
依据“Cl”守恒列式可求得:a =21/4
由方程式右边多3个SO和氢元素,推知缺项物质应为H2SO4,
进一步观察得
2KMnO4+5KNO2+3H2SO4=2MnSO4+K2SO4+5KNO3+3H2O
(5)零价法:
适宜于还原剂中两种元素价态难以确定但均属于升高的氧化还原反应。
Fe3P+ HNO3—— Fe(NO3)3+ NO+ H3PO4+ H2O
FeS2 + O2 —— Fe2O3 + SO2
An + Bx- = Bm + Ay-
Na2Sx + NaClO + = NaCl+ Na2SO4+ H2O
(6) 字母配平
1Fe(NO3)2 =
1C3H5NO9 =
(7) 分解反应,设“1”法
1/2Fe2O3 + 2NO2 ↑ + 1/4O2
4 = 12 6 1 10
3CO2↑ +3/2N2↑+ 1/4O2↑+5/2H2O ↑
