人教版高一化学必修一1.2化学计量在实验中的应用 (共30张ppt)
文档属性
| 名称 | 人教版高一化学必修一1.2化学计量在实验中的应用 (共30张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 655.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-21 00:00:00 | ||
图片预览










文档简介
第三课时 物质的量浓度
1、什么叫溶液?溶液是由什么组成的?
一种或几种物质分散到另一种物质里形成均一的、稳定的混合物,叫做溶液。溶液由溶质和溶剂组成。
2、什么是溶液中溶质的质量分数?
溶质的质量分数= ×100%
溶质质量
溶液质量
思考:
思考:
3、怎样才能从1杯40%的NaOH溶液中取出一部分溶液,并要求取出的溶液中包含有8g的NaOH呢?
W(NaOH)=m(NaOH)/m[NaOH(aq)]
m[NaOH(aq)]= m(NaOH)/W(NaOH)
=8g/40%
=20g
然后对溶液进行称量
难
不精确
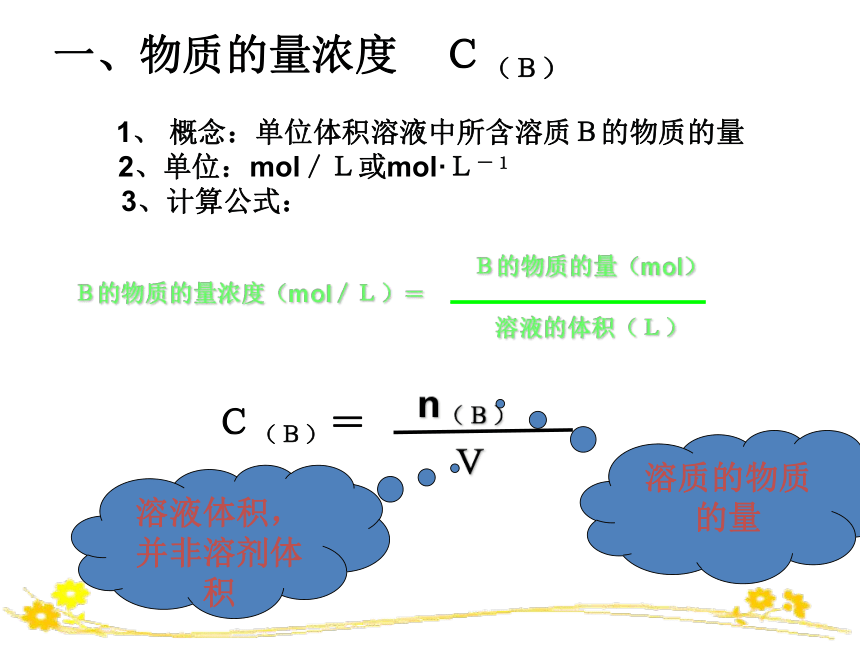
一、物质的量浓度 C(B)
1、 概念:单位体积溶液中所含溶质B的物质的量
2、单位:mol/L或mol·L-1
3、计算公式:
B的物质的量浓度(mol/L)=
B的物质的量(mol)
溶液的体积(L)
C(B)=
n(B)
V
溶液体积,并非溶剂体积
溶质的物质的量
只要溶液体积相同,物质的量浓度相同,所含溶质的物质的量必然相同。
思考:
1L 1mol/L NaCl 溶液与1L 1mol/L CaCl2 溶液所含离子数是否相同?Cl-的物质的量浓度分别为多少?
10L 1mol/L 酒精溶液与10L 1mol/L 蔗糖溶液所含
溶质分子数是否相同?
思考:
离子的物质的量浓度只与溶液物质的量浓度及每摩尔溶质在溶液中电离出离子的多少有关,而与溶液的体积无关。
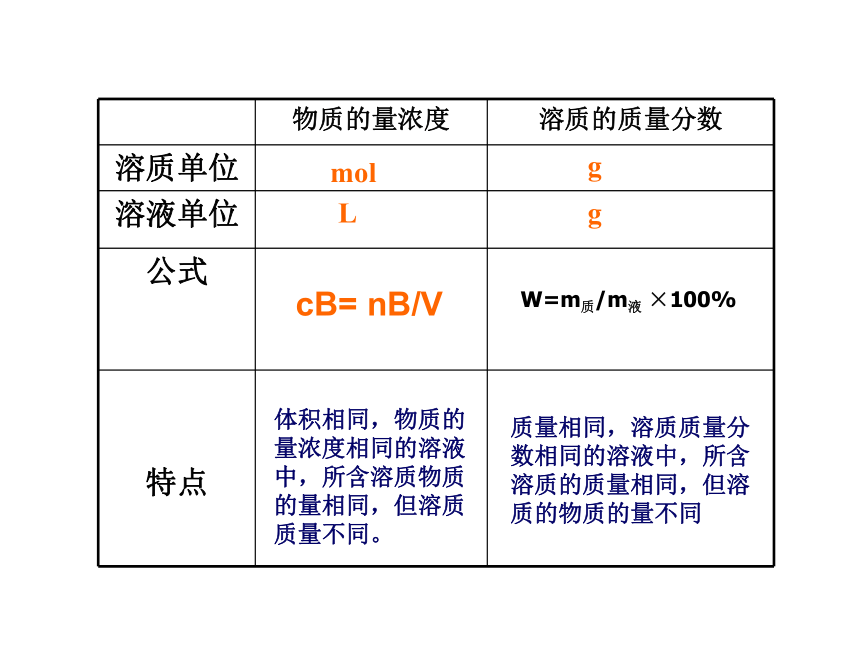
物质的量浓度
溶质的质量分数
溶质单位
溶液单位
公式
特点
mol
g
L
g
体积相同,物质的量浓度相同的溶液中,所含溶质物质的量相同,但溶质质量不同。
质量相同,溶质质量分数相同的溶液中,所含溶质的质量相同,但溶质的物质的量不同
W=m质/m液 ×100%
cB= nB/V
例:已知 NaNO3 Na2CO3 Na3PO4 三种溶液中 Na+ 浓度相等,溶液的体积比为 3:2:1,求溶液中溶质的物质的量之比。
∵ C ( Na+ ) 相等
∴ C ( NaNO3 ) : C ( Na2CO3 ) : C ( Na3PO4 )
= 1 : 1/2 : 1/3 = 6 : 3 : 2
∵ V ( NaNO3 ) : V ( Na2CO3 ) : V (Na3PO4 ) = 3 : 2 : 1
∴ n ( NaNO3 ) : n ( Na2CO3 ) : n ( Na3PO4 )
= 6×3 : 3×2 : 2×1
= 9 : 3 : 1
有关物质的量浓度的计算
1.在物质的量浓度溶液中溶质微粒数目的计算
解:
2.基本量的换算
例 :在200mL稀盐酸里溶有0.73g HCl ,计算溶液的物质的量浓度。
解: n (HCl) =
7.3g
36.5g/mol
= 0. 02 mol
V (HCl) =
200mL
1000mL/L
= 0. 2 L
C (HCl) =
0.02 mol
0.2L
= 0. 1 mol/L
答: 这种盐酸的浓度是 0.1 mol/L
例:计算配制 500 mL 0.1 mol/L 的NaOH 溶液所需NaOH的质量。
V (NaOH) =
500mL
= 0. 5 L
n (NaOH) = 0. 1 mol/L × 0. 5 L = 0. 05 mol
m (NaOH) = 0. 05 mol × 40 g/mol = 2g
答: 配制500mL 0.1mol/LNaOH溶液需NaOH 2g 。
解:
3.溶液中溶质的质量分数与物质的量浓度的换算
溶质的质量
=溶液的密度(g/mL或g/cm3)×溶液的体积(mL)×溶质的质量分数
=物质的量浓度(mol/L)×溶液的体积(L)×溶质的摩尔质量(g/mol)
【分析 】设溶液的体积为1L ,溶液的质量分数为ω ,密度为ρ g/cm3,溶质的摩尔质量为 M g/mol
则有: C =
而 ω =
C mol/L×1L ×M g/mol
1000mL × ρ g/cm3
物质的量浓度与 溶质质量分数 的换算必须以密度为桥梁。
1000mL× ρ g/cm3 × ω ÷ M g/mol
1L
=
1000mL× ρ g/cm3 × ω
M g/mol × 1L
× 100%
【例 】98%的密度为 1. 84 g/cm3 的浓硫酸,其物质
的量浓度为多少?
C ( H2SO4 ) =
1000mL×1. 84 g/cm3 × 98%
98 g/mol × 1L
= 18. 4 mol/L
解:
答:浓硫酸的物质的量浓度为 18 .4 mol/L
思考
从 1L 1mol/L NaCl 溶液中,分别取出 100mL、10mL 和 1mL ,它们的物质的量浓度是否相等?所含溶质是否相等?
因为溶液具有均一、稳定的特征,所以从一定物质的量浓度的溶液中取出任意体积的溶液,其浓度不变,所含溶质的质量(物质的量)因体积不同而不同。
二、溶液配制
实验仪器
实验步骤
误差分析
托盘天平、量筒、
烧杯、玻璃棒、
容量瓶、
胶头滴管、药匙(固体溶质使用)
1、实验仪器
实 物 展 示
容量瓶的规格
常用的有:
50ml. 100ml. 250ml. 500ml. 1000ml
配制溶液时,选用和所配溶液体积相等或稍大的容量瓶进行配液.
容量瓶使用注意事项
1.使用前检查是否漏水
2.使用前用蒸馏水洗净
3.不准将溶质直接转移入容量瓶加水溶解
4.溶液注入容量瓶前需恢复到室温,这是因为溶质在烧杯内稀释或溶解时常有热效应(如NaOH、H2SO4)。未等溶液冷却就定容,会使浓度偏高。
称量时能将NaCl固体直接放置于托盘上吗?
2、步骤及所用仪器
① 求算
② 称量(托盘天平或量筒)
用滤纸,NaOH等具腐蚀性的应用表面皿或者烧杯
溶解:将溶质倒入小烧杯,加入适量的水搅拌溶解,冷却致室温.
某同学为了加快溶解速度,溶解时所加的水为150mL,你认为可以吗?
移液和洗涤:将上述冷却后的溶液 转入指定容积的容量瓶,并用蒸馏水洗涤小烧杯和玻璃棒2—3次,将洗涤液一并注入容量瓶。
如何将烧杯
中的液体转移到容量瓶中?
为什么要洗涤玻璃棒和烧杯?
定容:在容量瓶中继续加水至距刻度线1—2cm处,改用胶头滴管滴加至刻度(液体凹液面最低处与刻度线相切)。
250mL
加水加少了
加水加多了
摇匀:把定容好的容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动几次,混合均匀。
装瓶贴签(容量瓶不能保存溶液)
误差分析:
C(B)=
n(B)
V
根据上述公式推断实验过程中,分析实验
过程中哪些操作会引起n(B)或V(aq)的变化,如果可以使其变化,则对C(B)造成误差.
=
mB
MBV(aq)
1)称量时左盘高,右盘低
2)称量时称量物放在右盘,而砝码放在左盘
1、称量产生误差
3)量筒量取液体药品时仰视读数
4)量筒量取液体药品时俯视读数
2、溶解、转移、洗涤产生误差
6)未洗涤溶解用的玻璃棒和烧杯
7)洗涤液未转入容量瓶中而倒入废液缸中
5)溶解过程中有少量液体溅出烧杯
9)定容时俯视刻度
10)定容时液面低于刻度线
11)未等溶液冷却就定容
8)定容时仰视刻度
12)定容后发现液面高于刻度线后,用滴管吸出少量溶液
3、定溶误差
13)摇匀后发现液面低于刻度再加水
14.原容量瓶洗净后未干燥
15.容量瓶中含有少量的水
16.往容量瓶中加水时有少量加到瓶外
均无影响
思考:
若定容时不小心液面超过了刻度线,怎么办?
能用胶头滴管把多余的液体取出吗?
不能!必须重新配制!
÷NA
m n N
÷M
×M
×NA
质量
粒子数目
V(气体体积)
÷Vm
×Vm
cB(溶液)
×V(aq)
÷V(aq)
小结
作业
1、同步:P19-20
1——9
2、课本:P17-18
7、9
1、什么叫溶液?溶液是由什么组成的?
一种或几种物质分散到另一种物质里形成均一的、稳定的混合物,叫做溶液。溶液由溶质和溶剂组成。
2、什么是溶液中溶质的质量分数?
溶质的质量分数= ×100%
溶质质量
溶液质量
思考:
思考:
3、怎样才能从1杯40%的NaOH溶液中取出一部分溶液,并要求取出的溶液中包含有8g的NaOH呢?
W(NaOH)=m(NaOH)/m[NaOH(aq)]
m[NaOH(aq)]= m(NaOH)/W(NaOH)
=8g/40%
=20g
然后对溶液进行称量
难
不精确
一、物质的量浓度 C(B)
1、 概念:单位体积溶液中所含溶质B的物质的量
2、单位:mol/L或mol·L-1
3、计算公式:
B的物质的量浓度(mol/L)=
B的物质的量(mol)
溶液的体积(L)
C(B)=
n(B)
V
溶液体积,并非溶剂体积
溶质的物质的量
只要溶液体积相同,物质的量浓度相同,所含溶质的物质的量必然相同。
思考:
1L 1mol/L NaCl 溶液与1L 1mol/L CaCl2 溶液所含离子数是否相同?Cl-的物质的量浓度分别为多少?
10L 1mol/L 酒精溶液与10L 1mol/L 蔗糖溶液所含
溶质分子数是否相同?
思考:
离子的物质的量浓度只与溶液物质的量浓度及每摩尔溶质在溶液中电离出离子的多少有关,而与溶液的体积无关。
物质的量浓度
溶质的质量分数
溶质单位
溶液单位
公式
特点
mol
g
L
g
体积相同,物质的量浓度相同的溶液中,所含溶质物质的量相同,但溶质质量不同。
质量相同,溶质质量分数相同的溶液中,所含溶质的质量相同,但溶质的物质的量不同
W=m质/m液 ×100%
cB= nB/V
例:已知 NaNO3 Na2CO3 Na3PO4 三种溶液中 Na+ 浓度相等,溶液的体积比为 3:2:1,求溶液中溶质的物质的量之比。
∵ C ( Na+ ) 相等
∴ C ( NaNO3 ) : C ( Na2CO3 ) : C ( Na3PO4 )
= 1 : 1/2 : 1/3 = 6 : 3 : 2
∵ V ( NaNO3 ) : V ( Na2CO3 ) : V (Na3PO4 ) = 3 : 2 : 1
∴ n ( NaNO3 ) : n ( Na2CO3 ) : n ( Na3PO4 )
= 6×3 : 3×2 : 2×1
= 9 : 3 : 1
有关物质的量浓度的计算
1.在物质的量浓度溶液中溶质微粒数目的计算
解:
2.基本量的换算
例 :在200mL稀盐酸里溶有0.73g HCl ,计算溶液的物质的量浓度。
解: n (HCl) =
7.3g
36.5g/mol
= 0. 02 mol
V (HCl) =
200mL
1000mL/L
= 0. 2 L
C (HCl) =
0.02 mol
0.2L
= 0. 1 mol/L
答: 这种盐酸的浓度是 0.1 mol/L
例:计算配制 500 mL 0.1 mol/L 的NaOH 溶液所需NaOH的质量。
V (NaOH) =
500mL
= 0. 5 L
n (NaOH) = 0. 1 mol/L × 0. 5 L = 0. 05 mol
m (NaOH) = 0. 05 mol × 40 g/mol = 2g
答: 配制500mL 0.1mol/LNaOH溶液需NaOH 2g 。
解:
3.溶液中溶质的质量分数与物质的量浓度的换算
溶质的质量
=溶液的密度(g/mL或g/cm3)×溶液的体积(mL)×溶质的质量分数
=物质的量浓度(mol/L)×溶液的体积(L)×溶质的摩尔质量(g/mol)
【分析 】设溶液的体积为1L ,溶液的质量分数为ω ,密度为ρ g/cm3,溶质的摩尔质量为 M g/mol
则有: C =
而 ω =
C mol/L×1L ×M g/mol
1000mL × ρ g/cm3
物质的量浓度与 溶质质量分数 的换算必须以密度为桥梁。
1000mL× ρ g/cm3 × ω ÷ M g/mol
1L
=
1000mL× ρ g/cm3 × ω
M g/mol × 1L
× 100%
【例 】98%的密度为 1. 84 g/cm3 的浓硫酸,其物质
的量浓度为多少?
C ( H2SO4 ) =
1000mL×1. 84 g/cm3 × 98%
98 g/mol × 1L
= 18. 4 mol/L
解:
答:浓硫酸的物质的量浓度为 18 .4 mol/L
思考
从 1L 1mol/L NaCl 溶液中,分别取出 100mL、10mL 和 1mL ,它们的物质的量浓度是否相等?所含溶质是否相等?
因为溶液具有均一、稳定的特征,所以从一定物质的量浓度的溶液中取出任意体积的溶液,其浓度不变,所含溶质的质量(物质的量)因体积不同而不同。
二、溶液配制
实验仪器
实验步骤
误差分析
托盘天平、量筒、
烧杯、玻璃棒、
容量瓶、
胶头滴管、药匙(固体溶质使用)
1、实验仪器
实 物 展 示
容量瓶的规格
常用的有:
50ml. 100ml. 250ml. 500ml. 1000ml
配制溶液时,选用和所配溶液体积相等或稍大的容量瓶进行配液.
容量瓶使用注意事项
1.使用前检查是否漏水
2.使用前用蒸馏水洗净
3.不准将溶质直接转移入容量瓶加水溶解
4.溶液注入容量瓶前需恢复到室温,这是因为溶质在烧杯内稀释或溶解时常有热效应(如NaOH、H2SO4)。未等溶液冷却就定容,会使浓度偏高。
称量时能将NaCl固体直接放置于托盘上吗?
2、步骤及所用仪器
① 求算
② 称量(托盘天平或量筒)
用滤纸,NaOH等具腐蚀性的应用表面皿或者烧杯
溶解:将溶质倒入小烧杯,加入适量的水搅拌溶解,冷却致室温.
某同学为了加快溶解速度,溶解时所加的水为150mL,你认为可以吗?
移液和洗涤:将上述冷却后的溶液 转入指定容积的容量瓶,并用蒸馏水洗涤小烧杯和玻璃棒2—3次,将洗涤液一并注入容量瓶。
如何将烧杯
中的液体转移到容量瓶中?
为什么要洗涤玻璃棒和烧杯?
定容:在容量瓶中继续加水至距刻度线1—2cm处,改用胶头滴管滴加至刻度(液体凹液面最低处与刻度线相切)。
250mL
加水加少了
加水加多了
摇匀:把定容好的容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动几次,混合均匀。
装瓶贴签(容量瓶不能保存溶液)
误差分析:
C(B)=
n(B)
V
根据上述公式推断实验过程中,分析实验
过程中哪些操作会引起n(B)或V(aq)的变化,如果可以使其变化,则对C(B)造成误差.
=
mB
MBV(aq)
1)称量时左盘高,右盘低
2)称量时称量物放在右盘,而砝码放在左盘
1、称量产生误差
3)量筒量取液体药品时仰视读数
4)量筒量取液体药品时俯视读数
2、溶解、转移、洗涤产生误差
6)未洗涤溶解用的玻璃棒和烧杯
7)洗涤液未转入容量瓶中而倒入废液缸中
5)溶解过程中有少量液体溅出烧杯
9)定容时俯视刻度
10)定容时液面低于刻度线
11)未等溶液冷却就定容
8)定容时仰视刻度
12)定容后发现液面高于刻度线后,用滴管吸出少量溶液
3、定溶误差
13)摇匀后发现液面低于刻度再加水
14.原容量瓶洗净后未干燥
15.容量瓶中含有少量的水
16.往容量瓶中加水时有少量加到瓶外
均无影响
思考:
若定容时不小心液面超过了刻度线,怎么办?
能用胶头滴管把多余的液体取出吗?
不能!必须重新配制!
÷NA
m n N
÷M
×M
×NA
质量
粒子数目
V(气体体积)
÷Vm
×Vm
cB(溶液)
×V(aq)
÷V(aq)
小结
作业
1、同步:P19-20
1——9
2、课本:P17-18
7、9
