人教版 高二化学 必修一2.3-氧化还原反应(共23张PPT)
文档属性
| 名称 | 人教版 高二化学 必修一2.3-氧化还原反应(共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 661.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-21 21:37:10 | ||
图片预览







文档简介
(共23张PPT)
第三节
氧化还原反应
第二章
化学物质及其变化
第一课时
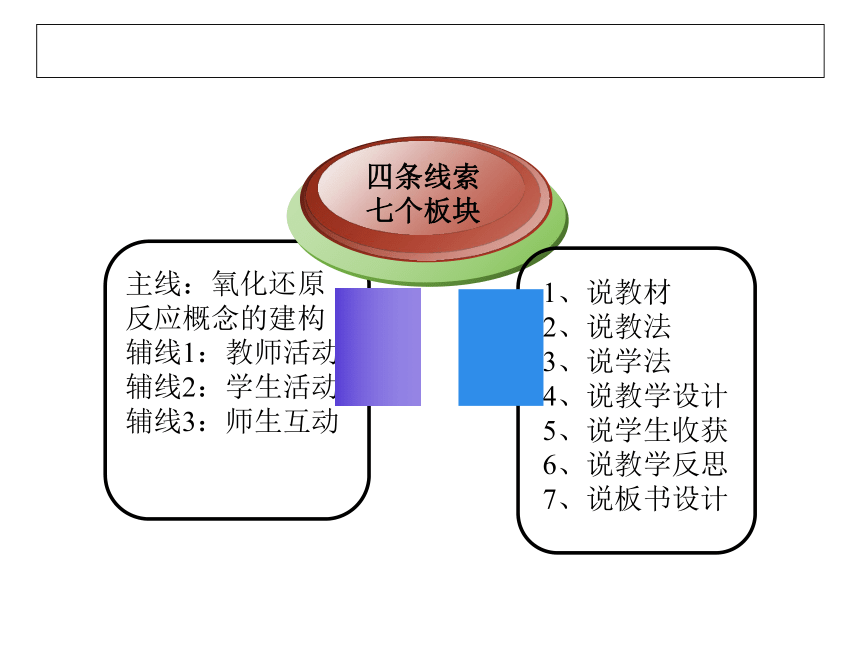
说课结构
主线:氧化还原反应概念的建构
辅线1:教师活动
辅线2:学生活动
辅线3:师生互动
四条线索
七个板块
1、说教材
2、说教法
3、说学法
4、说教学设计
5、说学生收获
6、说教学反思
7、说板书设计
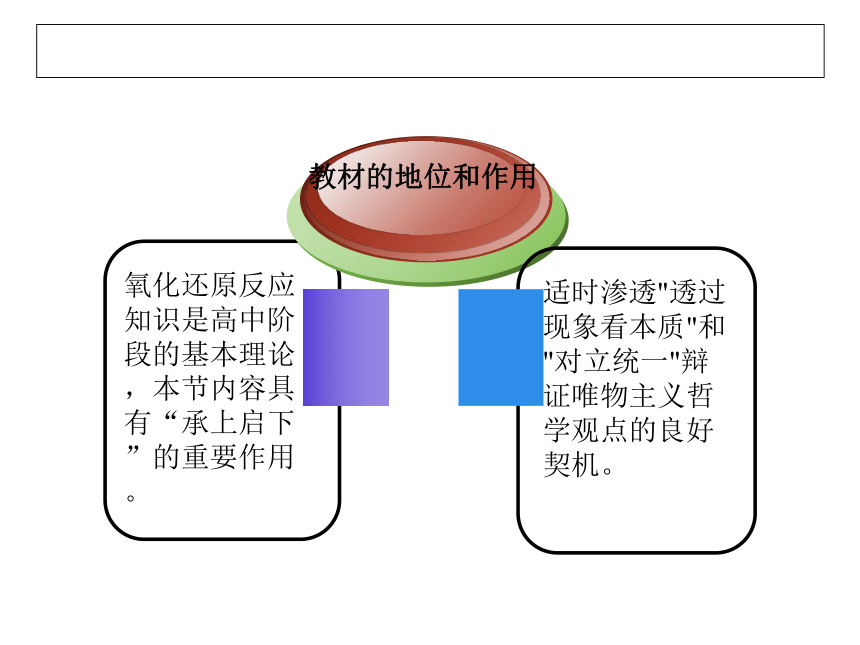
说教材
氧化还原反应知识是高中阶段的基本理论,本节内容具有“承上启下”的重要作用。
教材的地位和作用
适时渗透"透过现象看本质"和"对立统一"辩证唯物主义哲学观点的良好契机。
教法指导:
激发学生兴趣,引导他们积极思维,热情参与,独立自主地解决问题
。
学法指导:
讨论法、自主探究法、悬念法、类比法。
说教学方法
教法学法指导
创设情景
讨论
过失引发火灾
清徐一化工厂管理人被拘10日
中国消防在线
|
时间:
文章来源:
清徐大队\太原支队\山西总队
|
作者:
山西
李涛
位于山西清徐县东高百村的东高白福利化工厂发生火灾,接到报警后,大中队官兵迅速出动,在第一时间内到达火灾现场将火扑灭,没有造成任何人员伤亡。
灭火救援行动结束后,火灾现场勘查工作随即展开,经调查,火灾由于管理不善化工厂内金属钠着火引起,烧毁库房1间,杂物若干,造成财产损失数千元。
什么是燃烧?金属钠着火
有什么现象?
创设情景
讨论
销毁钠
一、氧化反应
燃素说:一切可燃物均含有燃素,燃烧是
分解反应,释放出燃素。
氧化说:燃烧是可燃物与氧的化合过程。
拉瓦锡
引入化学史
创设情景
讨论
思考
创设情景
讨论
演示:Na与Cl2的反应
思考与交流:这个反应是燃烧吗?是氧化反应吗?
引入化学史
思考
从化学反应本质(化合价和原子结构)上比较下列两个反应是否有相似性。
2Na
+
O2
=Na2O2
2Na
+
Cl2=
2NaCl
相似性:
Na
Na+
(1)Na元素化合价都从0上升到+1.
(2)Na都失去电子。
0
+1
0
+1
失去2×e-,化合价升高
失去2×e-,化合价升高
引入化学史
提问
创设情景
讨论
思考
讨论
化合价和电子之间是什么关系呢?
点燃
点燃
NaCl的形成过程
从电子角度分析:
失去电子,化合价升高的反应是氧化反应。
引入化学史
提问
讲解
创设情景
讨论
思考
讨论
归纳
定滑轮
化合价
失去电子
得到电子
e-
化合价
Na
Cl
失去e-
失去e-后
得到e-后
Na+
[
Cl
]-
Cl
-
Na+
升高
降低
二、还原反应
H2+
CuO
=
Cu
+
H2O
+2
0
得到2e-,化合价降低,被还原,发生还原反应
得到电子,化合价降低的反应是还原反应。
想一想:这个反应发生了氧化反应吗?从得失电子的角
度分析,氧化反应和还原反应是相互独立的吗?
0
+1
失去2×e-,化合价升高,被氧化,发生氧化反应
引入化学史
提问
讲解
提问
创设情景
讨论
思考
讨论
归纳
分析
三、氧化还原反应
2Na
+
Cl2=
2NaCl
0
0
+1
-1
失去2×e-,化合价升高,被氧化,发生氧化反应
得到2×e-,化合价降低,被还原,发生还原反应
结论:
在一个反应中,得到电子的过程必然伴随着电子的失去。也就是说,氧化反应必然与还原反应同时发生,他们是一个反应的两个方面,是一对矛盾,但又是统一的。
引入化学史
提问
讲解
提问
创设情景
讨论
思考
讨论
归纳
分析
总结
点燃
氧化还原反应的定义:
有电子转移(得失或偏移)的反应是氧化还原反应。
注意:
(1)化合价升降是氧化还原反应的普遍
特征,也是氧化还原反应的判断依据。
(2)氧化还原反应的实质是电子的转移(得失或偏移)。
引入化学史
提问
讲解
提问
创设情景
讨论
思考
讨论
归纳
分析
总结
H
Cl
H
Cl
HCl形成过程中的
电子偏移
练习:判断下列反应哪些是氧化还原反应,并从化合价,电子得失等方面分析该反应。
(1)H2
+
Cl2
=
2HCl
(2)CuO
+
2HCl
=
CuCl2
+
H2O
(3)Ca(OH)2+CO2=CaCO3
+
H2O
(4)2H2S
+
SO2
=
3S
+
2H2O
引入化学史
提问
讲解
提问
创设情景
练习
讨论
思考
讨论
归纳
分析
总结
评价
点燃
学生自我评价
学生对有些元素化合价不熟
学生收获
过程与方法
知识目标
情感目标
说学生收获
学生收获
知识收获
巩固化学反应分类思想
以价态升降和电子转移的观点理解氧化还原反应
会用价态升降和电子转移的观点分析基本的氧化还原方程式
理解氧化还原反应中的一些规律
学生收获
思维能力的培养:由表及里,培养了思维的深刻性
。
过程与方法
分析讨论归纳能力和口头表达能力得到提升。
学生收获
“透过现象看本质”和“对立统一的”辩证唯物主义哲学观点。
情感态度价值观收获
培养学生用发展的眼光、科学的态度、勇于探索、敢于怀疑的品质学习化学,激发了学生学习化学的热情。
(1)本节课主要采用了教师引导,学生讨论的教学方法,很好地完成本节课的教学。(2)培养锻炼了分析推理的能力。(3)借助多媒体,建立模型。(4)“兴趣是最好的老师”,引入化学史,激发了学生探索科学的兴趣。
我的反思
(1)“最精湛的教学艺术,遵循的最高准则就是让学生提问题。”(美国学者布鲁巴克)学生主动提问少。
改进:(1)鼓励学生,激发学生兴趣。
板书设计
一、氧化反应
Na到Na2O2,失去电子,化合价升高,被氧化,发生氧化反应。
失去电子,化合价升高的反应是氧化反应。
二、还原反应
CuO到Cu,得到电子,化合价降低,被还原,发生还原反应。
得到电子,化合价降低的反应是还原反应。
三、氧化还原反应
有电子转移(得失或偏移)的反应是氧化还原反应。
(1)化合价升降是氧化还原反应的普遍
特征,也是氧化还原反应的判断依据。
(2)氧化还原反应的实质是电子的电子转移(得失或偏移)。
2Na
+
Cl2=
2NaCl
0
0
+1
-1
失去2×e-,化合价升高,被氧化,发生氧化反应
得到2×e-,化合价降低,被还原,发生还原反应
作业:1.课后习题9。
2.列举生活中的氧化还原反应。(查阅资料完成)
3.自我评价。(附表)
第三节
氧化还原反应
第二章
化学物质及其变化
第一课时
说课结构
主线:氧化还原反应概念的建构
辅线1:教师活动
辅线2:学生活动
辅线3:师生互动
四条线索
七个板块
1、说教材
2、说教法
3、说学法
4、说教学设计
5、说学生收获
6、说教学反思
7、说板书设计
说教材
氧化还原反应知识是高中阶段的基本理论,本节内容具有“承上启下”的重要作用。
教材的地位和作用
适时渗透"透过现象看本质"和"对立统一"辩证唯物主义哲学观点的良好契机。
教法指导:
激发学生兴趣,引导他们积极思维,热情参与,独立自主地解决问题
。
学法指导:
讨论法、自主探究法、悬念法、类比法。
说教学方法
教法学法指导
创设情景
讨论
过失引发火灾
清徐一化工厂管理人被拘10日
中国消防在线
|
时间:
文章来源:
清徐大队\太原支队\山西总队
|
作者:
山西
李涛
位于山西清徐县东高百村的东高白福利化工厂发生火灾,接到报警后,大中队官兵迅速出动,在第一时间内到达火灾现场将火扑灭,没有造成任何人员伤亡。
灭火救援行动结束后,火灾现场勘查工作随即展开,经调查,火灾由于管理不善化工厂内金属钠着火引起,烧毁库房1间,杂物若干,造成财产损失数千元。
什么是燃烧?金属钠着火
有什么现象?
创设情景
讨论
销毁钠
一、氧化反应
燃素说:一切可燃物均含有燃素,燃烧是
分解反应,释放出燃素。
氧化说:燃烧是可燃物与氧的化合过程。
拉瓦锡
引入化学史
创设情景
讨论
思考
创设情景
讨论
演示:Na与Cl2的反应
思考与交流:这个反应是燃烧吗?是氧化反应吗?
引入化学史
思考
从化学反应本质(化合价和原子结构)上比较下列两个反应是否有相似性。
2Na
+
O2
=Na2O2
2Na
+
Cl2=
2NaCl
相似性:
Na
Na+
(1)Na元素化合价都从0上升到+1.
(2)Na都失去电子。
0
+1
0
+1
失去2×e-,化合价升高
失去2×e-,化合价升高
引入化学史
提问
创设情景
讨论
思考
讨论
化合价和电子之间是什么关系呢?
点燃
点燃
NaCl的形成过程
从电子角度分析:
失去电子,化合价升高的反应是氧化反应。
引入化学史
提问
讲解
创设情景
讨论
思考
讨论
归纳
定滑轮
化合价
失去电子
得到电子
e-
化合价
Na
Cl
失去e-
失去e-后
得到e-后
Na+
[
Cl
]-
Cl
-
Na+
升高
降低
二、还原反应
H2+
CuO
=
Cu
+
H2O
+2
0
得到2e-,化合价降低,被还原,发生还原反应
得到电子,化合价降低的反应是还原反应。
想一想:这个反应发生了氧化反应吗?从得失电子的角
度分析,氧化反应和还原反应是相互独立的吗?
0
+1
失去2×e-,化合价升高,被氧化,发生氧化反应
引入化学史
提问
讲解
提问
创设情景
讨论
思考
讨论
归纳
分析
三、氧化还原反应
2Na
+
Cl2=
2NaCl
0
0
+1
-1
失去2×e-,化合价升高,被氧化,发生氧化反应
得到2×e-,化合价降低,被还原,发生还原反应
结论:
在一个反应中,得到电子的过程必然伴随着电子的失去。也就是说,氧化反应必然与还原反应同时发生,他们是一个反应的两个方面,是一对矛盾,但又是统一的。
引入化学史
提问
讲解
提问
创设情景
讨论
思考
讨论
归纳
分析
总结
点燃
氧化还原反应的定义:
有电子转移(得失或偏移)的反应是氧化还原反应。
注意:
(1)化合价升降是氧化还原反应的普遍
特征,也是氧化还原反应的判断依据。
(2)氧化还原反应的实质是电子的转移(得失或偏移)。
引入化学史
提问
讲解
提问
创设情景
讨论
思考
讨论
归纳
分析
总结
H
Cl
H
Cl
HCl形成过程中的
电子偏移
练习:判断下列反应哪些是氧化还原反应,并从化合价,电子得失等方面分析该反应。
(1)H2
+
Cl2
=
2HCl
(2)CuO
+
2HCl
=
CuCl2
+
H2O
(3)Ca(OH)2+CO2=CaCO3
+
H2O
(4)2H2S
+
SO2
=
3S
+
2H2O
引入化学史
提问
讲解
提问
创设情景
练习
讨论
思考
讨论
归纳
分析
总结
评价
点燃
学生自我评价
学生对有些元素化合价不熟
学生收获
过程与方法
知识目标
情感目标
说学生收获
学生收获
知识收获
巩固化学反应分类思想
以价态升降和电子转移的观点理解氧化还原反应
会用价态升降和电子转移的观点分析基本的氧化还原方程式
理解氧化还原反应中的一些规律
学生收获
思维能力的培养:由表及里,培养了思维的深刻性
。
过程与方法
分析讨论归纳能力和口头表达能力得到提升。
学生收获
“透过现象看本质”和“对立统一的”辩证唯物主义哲学观点。
情感态度价值观收获
培养学生用发展的眼光、科学的态度、勇于探索、敢于怀疑的品质学习化学,激发了学生学习化学的热情。
(1)本节课主要采用了教师引导,学生讨论的教学方法,很好地完成本节课的教学。(2)培养锻炼了分析推理的能力。(3)借助多媒体,建立模型。(4)“兴趣是最好的老师”,引入化学史,激发了学生探索科学的兴趣。
我的反思
(1)“最精湛的教学艺术,遵循的最高准则就是让学生提问题。”(美国学者布鲁巴克)学生主动提问少。
改进:(1)鼓励学生,激发学生兴趣。
板书设计
一、氧化反应
Na到Na2O2,失去电子,化合价升高,被氧化,发生氧化反应。
失去电子,化合价升高的反应是氧化反应。
二、还原反应
CuO到Cu,得到电子,化合价降低,被还原,发生还原反应。
得到电子,化合价降低的反应是还原反应。
三、氧化还原反应
有电子转移(得失或偏移)的反应是氧化还原反应。
(1)化合价升降是氧化还原反应的普遍
特征,也是氧化还原反应的判断依据。
(2)氧化还原反应的实质是电子的电子转移(得失或偏移)。
2Na
+
Cl2=
2NaCl
0
0
+1
-1
失去2×e-,化合价升高,被氧化,发生氧化反应
得到2×e-,化合价降低,被还原,发生还原反应
作业:1.课后习题9。
2.列举生活中的氧化还原反应。(查阅资料完成)
3.自我评价。(附表)
