人教版高中化学选修三 1.1原子结构(共23张PPT)
文档属性
| 名称 | 人教版高中化学选修三 1.1原子结构(共23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-21 00:00:00 | ||
图片预览






文档简介
(共23张PPT)
原子结构
请你回答:
原子的基本特点是什么?
原子是化学变化中的最小粒子。
问题一
原子能不能再分呢?
回顾历史
1、公元前5世纪,希腊哲学家德谟克利特等人认为
:万物是由大量的不可分割的微粒构成的,即原子。
2、19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
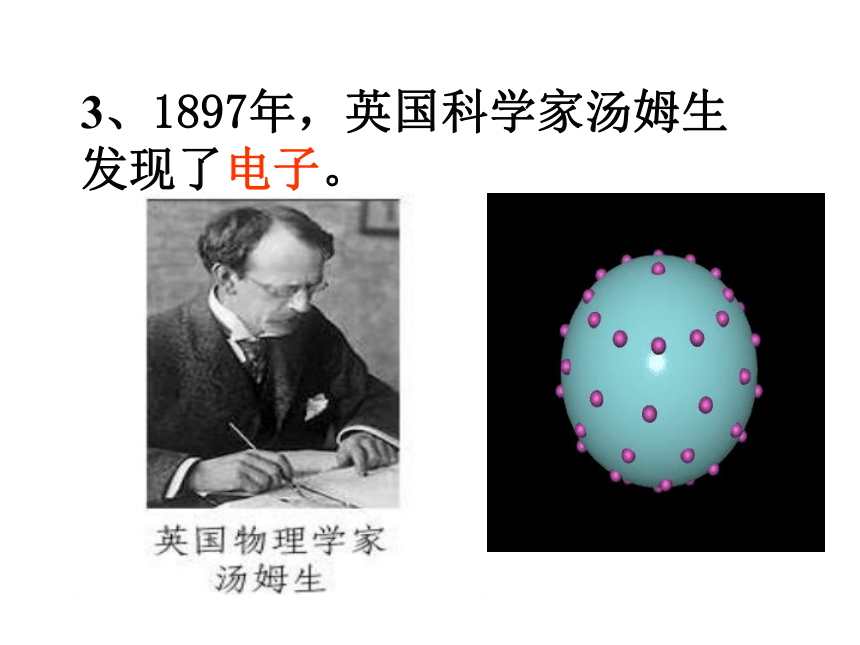
3、1897年,英国科学家汤姆生发现了电子。
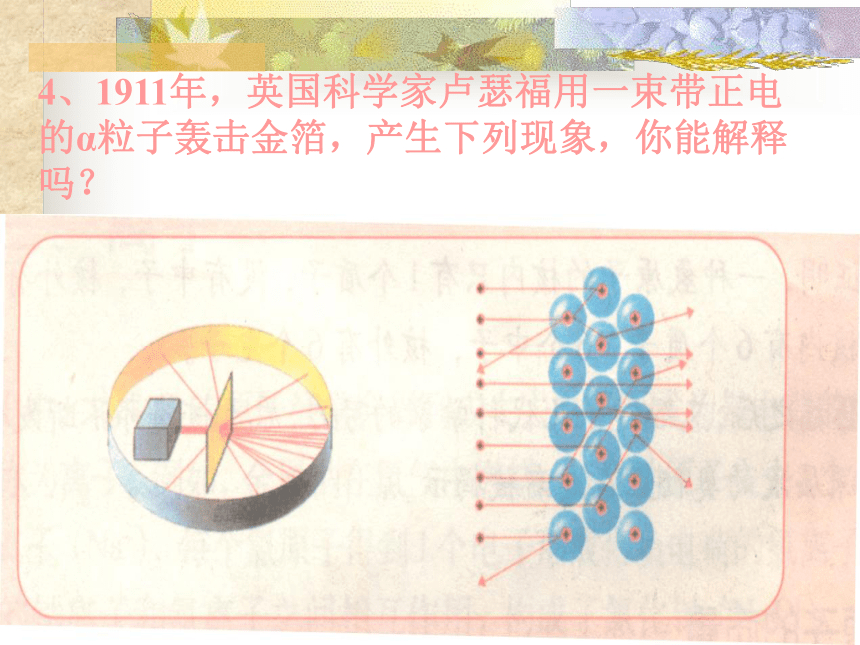
4、1911年,英国科学家卢瑟福用一束带正电的α粒子轰击金箔,产生下列现象,你能解释吗?
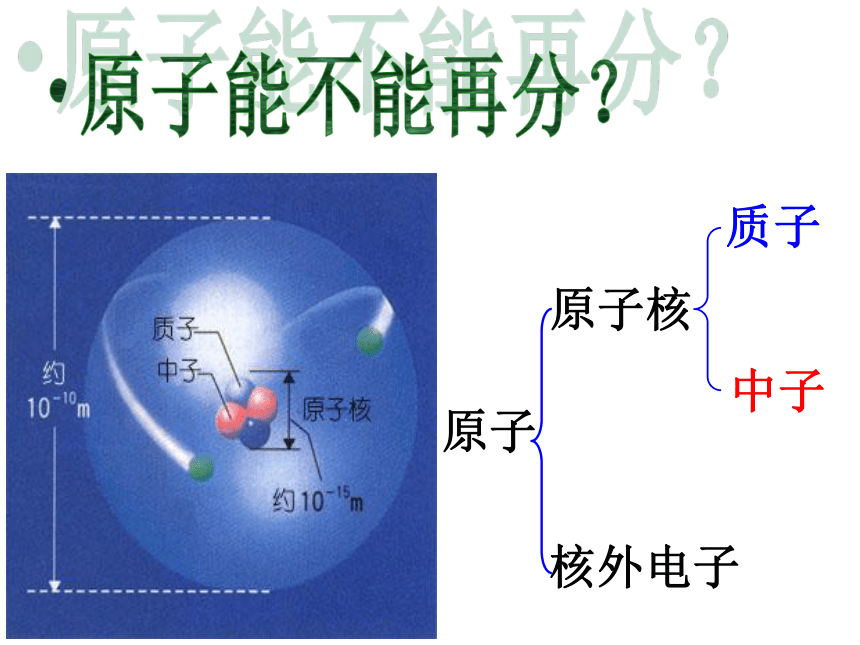
原子
原子核
核外电子
质子
中子
原子能不能再分?
原子体积小,质量也小。
原子很小,一个原子跟一个乒乓球体积之比,相当于乒乓球跟地球体积之比。原子核比原子又小得多,如果把原子比作一个庞大的体育场,而原子核只相当于一只蚂蚁。因此,原子里有很大的空间,电子就在这个空间里作高速的运动。
1个质子带一个单位正
电荷;
1个电子带一个单位负
电荷。
中子不带电;
质子、中子、电子的电性和电量怎样?
1个质子带1个单位正电
荷,中子不带电,因此原子
核带正电荷。
原子核所带的正电荷数
目叫做核电荷数,它在数值
上等于原子核所含的质子数目。
问题:
铁、铜等金属都是原子直接构成的,原子中存在带电荷的粒子(质子和电子),原子是否显电性?
在原子中,由于质子(原子核)与电子所带电荷数相等,但电性相反,所以整个原子不显电性。
原子不显电性的原因:
[实验
]
1、用手接触铁、铜等金属是否会触电?
2、用电工的电笔测铁、铜是否带电?
原子种类
原子核
核外电子数
核电
荷数
质子数
中子数
氢
1
1
0
1
碳
6
6
6
6
氧
8
8
8
8
钠
11
11
12
11
铁
26
26
30
26
从表中可以得出:
1、原子中,质子数=核外电子数;
2、核内质子数就是核电荷数;
3、质
子
数
不
一
定
等
于
中
子
数,
原
子
中
不
一
定
含
有
中
子;
4、构成原子的必要粒子是质子和电
子,决定原子种类的是核内质子数,
它必不可少。
……
(核电荷数=质子数=核外电子数)
构成碳原子的粒子有6个质子,6个中子和6个电子。其中6个质子和6个中子构成了原子核作为原子的中心,而6个电子在核外一定空间内绕核做高速运动。
例:以碳原子为例描述原子的构成
一
个
碳
原
子
的
质
量:
1.993×10-2
6
千
克
1、原
子
的
实
际
质
量
0.000000000000000
00
000000001993
千
克
二、
相
对
原
子
质
量
⑴定义:国际上以一种碳原子(碳12)质量的1/12作为标准,其他原子的质量跟它比较所得的值,就是这种原子的相对原子质量。
⑵
实
质:相对原子质量是一个比值,不是原子的实际质量。它没有质量单位,
但其国际单位为1,符号为Ar。
2、
相
对
原
子
质
量
⑶、相对原子质量的计算公式:
某原子的相对
原子质量
=
一个该原子的质量
一个(碳12)原子的质量
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
铁
26
30
26
56
⑷、相对原子质量与质子数和中子数的关系:
相对原子质量
=质子数
+
中子数
(
数值上
)
原子的质量主要集中在原子核上。
相对原子质量
=
质子数
+
中子数
1、氧原子的相对原子质量为16,质子数为8,那么它的中子数是多少?
2、钠原子的相对原子质量为23,中子数为12,那么它的质子数是多少?核外电子数是多少?
3、在原子的组成中,
带正电,
不带电,
带负电,
绕着
做高速运动。
占据原子的
绝大部分体积,
集中原子的主
要质量
。
相对原
子质量等于质子数
和
之
和
。
质子
电子
中子
电子
原子核
电子
原子核
中子数
原子结构
请你回答:
原子的基本特点是什么?
原子是化学变化中的最小粒子。
问题一
原子能不能再分呢?
回顾历史
1、公元前5世纪,希腊哲学家德谟克利特等人认为
:万物是由大量的不可分割的微粒构成的,即原子。
2、19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
3、1897年,英国科学家汤姆生发现了电子。
4、1911年,英国科学家卢瑟福用一束带正电的α粒子轰击金箔,产生下列现象,你能解释吗?
原子
原子核
核外电子
质子
中子
原子能不能再分?
原子体积小,质量也小。
原子很小,一个原子跟一个乒乓球体积之比,相当于乒乓球跟地球体积之比。原子核比原子又小得多,如果把原子比作一个庞大的体育场,而原子核只相当于一只蚂蚁。因此,原子里有很大的空间,电子就在这个空间里作高速的运动。
1个质子带一个单位正
电荷;
1个电子带一个单位负
电荷。
中子不带电;
质子、中子、电子的电性和电量怎样?
1个质子带1个单位正电
荷,中子不带电,因此原子
核带正电荷。
原子核所带的正电荷数
目叫做核电荷数,它在数值
上等于原子核所含的质子数目。
问题:
铁、铜等金属都是原子直接构成的,原子中存在带电荷的粒子(质子和电子),原子是否显电性?
在原子中,由于质子(原子核)与电子所带电荷数相等,但电性相反,所以整个原子不显电性。
原子不显电性的原因:
[实验
]
1、用手接触铁、铜等金属是否会触电?
2、用电工的电笔测铁、铜是否带电?
原子种类
原子核
核外电子数
核电
荷数
质子数
中子数
氢
1
1
0
1
碳
6
6
6
6
氧
8
8
8
8
钠
11
11
12
11
铁
26
26
30
26
从表中可以得出:
1、原子中,质子数=核外电子数;
2、核内质子数就是核电荷数;
3、质
子
数
不
一
定
等
于
中
子
数,
原
子
中
不
一
定
含
有
中
子;
4、构成原子的必要粒子是质子和电
子,决定原子种类的是核内质子数,
它必不可少。
……
(核电荷数=质子数=核外电子数)
构成碳原子的粒子有6个质子,6个中子和6个电子。其中6个质子和6个中子构成了原子核作为原子的中心,而6个电子在核外一定空间内绕核做高速运动。
例:以碳原子为例描述原子的构成
一
个
碳
原
子
的
质
量:
1.993×10-2
6
千
克
1、原
子
的
实
际
质
量
0.000000000000000
00
000000001993
千
克
二、
相
对
原
子
质
量
⑴定义:国际上以一种碳原子(碳12)质量的1/12作为标准,其他原子的质量跟它比较所得的值,就是这种原子的相对原子质量。
⑵
实
质:相对原子质量是一个比值,不是原子的实际质量。它没有质量单位,
但其国际单位为1,符号为Ar。
2、
相
对
原
子
质
量
⑶、相对原子质量的计算公式:
某原子的相对
原子质量
=
一个该原子的质量
一个(碳12)原子的质量
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
铁
26
30
26
56
⑷、相对原子质量与质子数和中子数的关系:
相对原子质量
=质子数
+
中子数
(
数值上
)
原子的质量主要集中在原子核上。
相对原子质量
=
质子数
+
中子数
1、氧原子的相对原子质量为16,质子数为8,那么它的中子数是多少?
2、钠原子的相对原子质量为23,中子数为12,那么它的质子数是多少?核外电子数是多少?
3、在原子的组成中,
带正电,
不带电,
带负电,
绕着
做高速运动。
占据原子的
绝大部分体积,
集中原子的主
要质量
。
相对原
子质量等于质子数
和
之
和
。
质子
电子
中子
电子
原子核
电子
原子核
中子数
