人教版高中化学选修四第二章《化学反应速率和化学平衡》单元测试
文档属性
| 名称 | 人教版高中化学选修四第二章《化学反应速率和化学平衡》单元测试 |  | |
| 格式 | zip | ||
| 文件大小 | 136.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-21 21:39:29 | ||
图片预览



文档简介
《化学反应速率和化学平衡》
一、单选题
1.二氧化硫的催化氧化反应:2SO2(g)+O2(g)2SO3(g)是工业制硫酸的重要反应之一。下列说法错误的是
A.煅烧硫铁矿(主要成分FeS2)可获得SO2,将矿石粉碎成细小颗粒可以提高反应的转化率
B.已知该催化氧化反应K(300℃)>K(350℃),则该反应正向是放热反应
C.该反应加入催化剂是为了加快反应速率
D.保持温度不变,平衡后增大O2的浓度,该反应的平衡常数K不变
2.有一处于平衡状态的可逆反应:X(s)+3Y(g)2Z(g)
ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温
②低温
③高压
④低压
⑤加催化剂
⑥分离出Z
A.①③⑤
B.②③⑤
C.②③⑥
D.②④⑥
3.在容积固定的密闭容器中存在反应:A(g)+3B(g)2C(g)
△H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断正确的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
C.图Ⅱ研究的是压强对反应的影响,且甲的压强较大
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较低
4.某温度下,在一固定容积的密闭容器中进行反应:A2
+B22AB。该条件下,A2、B2、AB均为气体。下列情况一定能说明该反应已达到化学平衡状态的是(
)
A.气体的密度不再改变时
B.气体的总物质的量不再改变时
C.混合气体中各组分的含量不再改变时
D.每消耗1molB2同时有2molAB生成时
5.反应4A(s)+3B(g)═2C(g)+D(g),2min内B的浓度减少0.6mol/L,下列描述正确的是( )
A.2min末时的反应速率,用B表示为0.3mol/(L?min)
B.v(B):v(C):v(D)=3:2:1
C.在这2min内A和B的转化率之比一定为4:3
D.v(A)=0.4
mol/(L?min)
6.下列变化不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.工业上合成氨要用高温,催化剂
C.红棕色的NO2加压后颜色先变深再变浅
D.CO2(g)CO2(aq)ΔH<0,降温增压可增大二氧化碳气体在水中的溶解度
7.在密闭容器中发生如下反应:mA(g)+nB(g)?pC(g),达到平衡后,保持温度不变,将容器的体积缩小到原来的一半,达到新平衡时,C的浓度变为原来的1.9倍。下列说法中错误的是(
)
A.m+m<p
B.平衡向逆反应方向移动
C.A的转化率降低
D.A的体积分数减小
8.定条件下存在反应:H2(g)+I2(g)
2HI(g)
△H<0.现有三个相同的1L恒容绝热(与外界没有热量交换)态闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入lmolH2和1molⅠ2(g),在Ⅱ中充入2molHl(g),在Ⅲ中充入2molH2和2molI2
(g),700℃条件下开始反应。达到平衡时,下列说法正确的是()
A.容器Ⅰ、Ⅱ中反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色浅
D.容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化之和小于1
9.在2L密闭容器内,某气体反应物在2s内由8mol变为7.2mol,则用该气体表示该反应的平均反应速率为
A.0.4
mol·L?1·s?1
B.0.3
mol·L?1·s?1
C.0.2
mol·L?1·s?1
D.0.1
mol·L?1·s?1
10.下列反应中,熵减小的是( )
A.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g)
B.2N2O5(g)=4NO2(g)+O2(g)
C.MgCO3(s)=MgO(s)+CO2(g)
D.2CO(g)=2C(s)+O2(g)
11.下列说法正确的是
A.活化能接近于零的反应,当反应物相互接触时,反应瞬间完成,而且温度对其反应速率几乎没有影响
B.温度和压强都是通过增大活化分子百分数来加快化学反应速率
C.人们把能够发生有效碰撞的分子叫做活化分子,把活化分子具有的能量叫活化能
D.活化能的大小不仅意味着一般分子成为活化分子的难易,也会对化学反应前后的能量变化产生影响
12.5.6g铁粉投入到盛有100mL?2mol?L-1稀硫酸的烧杯中,2min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是(
)
A.v(H2SO4)=0.5mol?
(L?min)-1
B.v(H2SO4)=1
mol?
(L?min)-1
C.v(Fe)=0.5mol?
(L?min)-1
D.v(FeSO4)=1mol?
(L?min)-1
13.化学与生产、生活密切相关。下列事实与化学反应速率无关的( )
A.食品、蔬菜贮存在冰箱和冰柜里,能延长保鲜时间
B.家用铁锅、铁铲等餐具保持干燥,能减缓生锈
C.制造蜂窝煤时加入生石灰,减少SO2排放
D.煤气换成天然气时,要调整灶具进气(或出气)管
二、实验题
14.硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
(查阅资料)
i.Na2S2O3易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
ⅱ.Na2S2O3易被氧化,BaSO3难溶于水,可溶于稀盐酸。
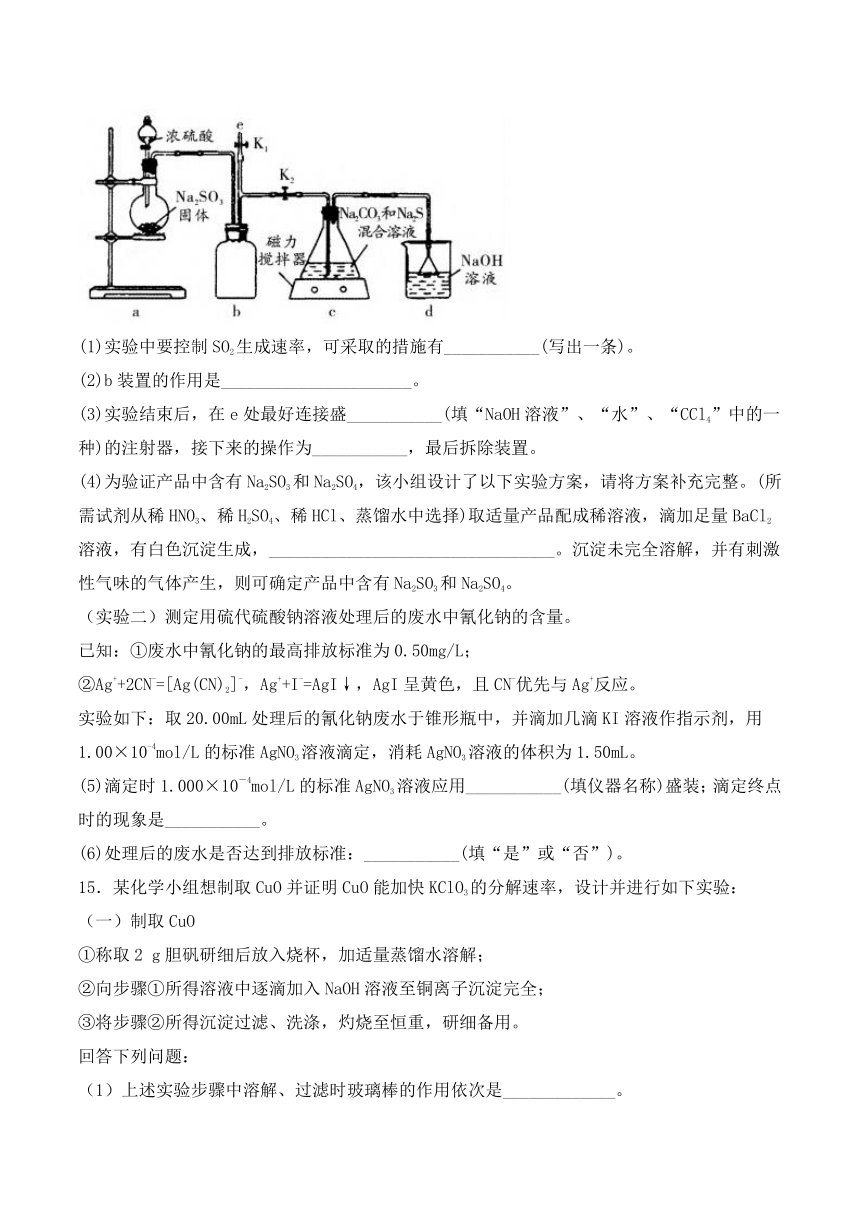
(实验一)实验室通过如如图所示装置制备Na2S2O3。
(1)实验中要控制SO2生成速率,可采取的措施有___________(写出一条)。
(2)b装置的作用是______________________。
(3)实验结束后,在e处最好连接盛___________(填“NaOH溶液”、“水”、“CCl4”中的一种)的注射器,接下来的操作为___________,最后拆除装置。
(4)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_________________________________。沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(实验二)测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(5)滴定时1.000×10-4mol/L的标准AgNO3溶液应用___________(填仪器名称)盛装;滴定终点时的现象是___________。
(6)处理后的废水是否达到排放标准:___________(填“是”或“否”)。
15.某化学小组想制取CuO并证明CuO能加快KClO3的分解速率,设计并进行如下实验:
(一)制取CuO
①称取2
g胆矾研细后放入烧杯,加适量蒸馏水溶解;
②向步骤①所得溶液中逐滴加入NaOH溶液至铜离子沉淀完全;
③将步骤②所得沉淀过滤、洗涤,灼烧至恒重,研细备用。
回答下列问题:
(1)上述实验步骤中溶解、过滤时玻璃棒的作用依次是_____________。
(2)步骤③中灼烧前后,沉淀颜色的变化为_______。
(3)利用化学方法证明铜离子已经沉淀完全的操作是____________。
(二)证明CuO能加快KClO3的分解速率,并与MnO2的催化效率进行比较
用下图装置进行实验,且均以生成相同状况下20
mL氧气为准,其它可能影响实验的因素均已忽略,相关数据见下表:
实验序号
KClO3质量
其它物质质量
待测数据
①
1.5
g
无其他物质
②
1.5
g
CuO
0.5
g
③
1.5
g
MnO2
0.5
g
(4)上述实验中的待测数据指_____________;该实验除以上思路外,还可以通过测定______________来比较CuO和MnO2的催化效率。
(5)本实验装置图中量气装置由乳胶管和仪器A_______________(填名称)及50
mL___________(填“酸式”或“碱式”)滴定管改造后组装而成;
(6)为探究CuO在实验②中是否起催化作用,需补做如下实验:
a.CuO的质量有没有改变;
b.CuO的化学性质有没有改变。
简述验证CuO质量是否改变的操作过程_________________________。
三、推断题
16.重铬酸钾(K2Cr2O7)是高中化学常见的的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备。铬铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等。
已知:
①NaFeO2常温遇大量水会强烈水解,高温时不与水反应
②2CrO42-(黄色)+2H+Cr2O72-(橙色)+H2O
③+6价的铬元素在强酸性条件下具有强氧化性,还原产物为Cr3+,强碱性条件下几乎没有氧化性;请回答下列问题:
(1)将矿石粉碎的目的是___________________________。
(2)高温灼烧时生成NaFeO2的化学方程式____________________________________。
(3)①滤渣1中有红褐色物质,滤渣1的成分为__________________(写化学式,下同),写出生成该物质反应的离子方程式___________________________。
②滤渣2的主要成分是__________________。
(4)若向Na2CrO4溶液中加入浓盐酸进行酸化,出现的现象为__________________
(5)生产后的废水中主要含有一定量的Cr2O72-,通常加一定量的绿矾进行净化并调节pH约为6,可生成两种难溶于水的沉淀,请写出该反应的离子方程式___________________________。
17.(一)在容积为5L的密闭容器中,通入5
mol
N2和8
mol
H2,在一定条件下反应生成NH3,当反应进行到2
min时,测得容器内有4
mol
NH3。则:
(1)2
min时,容器内n(N2)==
________
,c(H2)==
___________
。
(2)2
min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为
_______
。
(二)A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C及B与D分别是同主族元素;已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又知A、C两元素原子序数之和是B、D两元素原子序数之和的一半。请回答下列问题:
(1)写出由A、B、C三元素形成的化合物的电子式__________
,
(2)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式________________________。
四、计算题
18.煤的气化是高效、清洁的利用煤炭的重要途径之一。
①?C(s)+?O2?(g)?=?CO2?(g)
ΔH?=?-393.5?kJ·mol-1
②?CO(g)?+O2?(g)?=?CO2?(g)???ΔH?=?-283.0?kJ·mol-1
③?H2(g)?+O2?(g)?=?H2O?(g)???ΔH?=?-241.8?kJ·mol-1
(1)则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是_______,该反应的化学平衡常数K随温度的升高将_______(填“增大”、“减小”或“不变”)。
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)CO2(g)+H2(g)
ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
H2O
CO
CO2
H2
甲
n/mol
0.10
0.30
0.10
0.50
乙
n/mol
0.20
0.20
0
0
起始时,甲容器中反应向?____________(填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为___________。
19.(1)下表中的数据表示破坏1
mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
化学键
C—H
C—F
H—F
F—F
键能
414
489
565
158
根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)=
CF4(g)+4HF(g)
△H=____。
(2)已知在448℃时,反应H2(g)+I2(g)2HI(g)的平衡常数K1为49,则反应HI(g)H2(g)+I2(g)==的平衡常数K3为__________。
(4)在一定条件下将CO2与H2混合转化为甲醇CH3OH是一种新型脱碳技术,这一反应同时生成H2O,实现了绿色环保、节能减排、废物利用等目的。在一恒温恒容密闭容器中充入1
mol
CO2和3
mol
H2,进行上述反应。测得CO2和CH3OH(g)的物质的量浓度随时间的变化如图Ⅲ所示。
①该反应方程式为______________
②0~10
min内,氢气的平均反应速率为________;
③该温度下,反应的平衡常数为________(保留三位有效数字);
④10
min后,向该容器中再充入1
mol
CO2和3
mol
H2,则再次达到平衡时CH3OH(g)的体积分数________(填“增大”、“减小”或“不变”)。
20.
(1)在反应A(g)+3B(g)=2C(g)中,若以物质A表示该反应的化学反应速率为0.2
mol·L-1·min-1,则以物质B表示此反应的化学反应速率为________mol·L-1·min-1。
(2)在2
L的密闭容器中,充入2
mol
N2和3
mol
H2,在一定条件下发生反应,3
s后测得N2的物质的量为1.9
mol,则以H2的浓度变化表示的反应速率为________。
/
参考答案
1.A2.C3.B4.C5.B6.B7.D8.D9.C10.D11.A12.A13.C
14.控制反应温度、调节酸的滴加速度或调节酸的浓度等
安全瓶,防止倒吸
NaOH溶液
关闭K2,打开K1
过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸
酸式滴定管
滴入最后一滴硝酸银溶液,出现黄色沉淀,且半分钟内沉淀不消失
否
15.搅拌、引流
由蓝色变为黑色
静置,向上层清液中滴加NaOH溶液,无明显现象
生成20mL氧气所需的时间
相同时间内产生氧气的体积大小
干燥管(球形干燥管)
碱式
反应结束后取下试管冷却至室温,加足量蒸馏水并充分振荡,过滤、洗涤、干燥、称量,看固体质量是否等于0.5g
16.增大接触面积,加快反应速率
4FeO
+
O2
+
4NaOH=
4FeO2
+
2H2O(条件高温)
Fe(OH)3
FeO2-
+
2H2O
=
Fe(OH)3+
OH-
Al(OH)3
、H2SiO3
有黄绿色气体生成
Cr2O72-
+
6Fe2+
+
17H2O
=
2Cr(OH)3↓
+
Fe(OH)3↓
+
10H+
17.3
mol
0.4
mol/L
9:13
HSO3-
+
H+
====SO2↑+H2O
18.C(s)+H2O(g)=CO(g)+H2(g)
ΔH=+131.3kJ·mol-1
增大
逆反应
50%
19.1928kl/mol
1/7
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
0.225mol/(L·min)
5.33
增大
20.0.6
0.05
mol·L-1·s-1
一、单选题
1.二氧化硫的催化氧化反应:2SO2(g)+O2(g)2SO3(g)是工业制硫酸的重要反应之一。下列说法错误的是
A.煅烧硫铁矿(主要成分FeS2)可获得SO2,将矿石粉碎成细小颗粒可以提高反应的转化率
B.已知该催化氧化反应K(300℃)>K(350℃),则该反应正向是放热反应
C.该反应加入催化剂是为了加快反应速率
D.保持温度不变,平衡后增大O2的浓度,该反应的平衡常数K不变
2.有一处于平衡状态的可逆反应:X(s)+3Y(g)2Z(g)
ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温
②低温
③高压
④低压
⑤加催化剂
⑥分离出Z
A.①③⑤
B.②③⑤
C.②③⑥
D.②④⑥
3.在容积固定的密闭容器中存在反应:A(g)+3B(g)2C(g)
△H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断正确的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
C.图Ⅱ研究的是压强对反应的影响,且甲的压强较大
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较低
4.某温度下,在一固定容积的密闭容器中进行反应:A2
+B22AB。该条件下,A2、B2、AB均为气体。下列情况一定能说明该反应已达到化学平衡状态的是(
)
A.气体的密度不再改变时
B.气体的总物质的量不再改变时
C.混合气体中各组分的含量不再改变时
D.每消耗1molB2同时有2molAB生成时
5.反应4A(s)+3B(g)═2C(g)+D(g),2min内B的浓度减少0.6mol/L,下列描述正确的是( )
A.2min末时的反应速率,用B表示为0.3mol/(L?min)
B.v(B):v(C):v(D)=3:2:1
C.在这2min内A和B的转化率之比一定为4:3
D.v(A)=0.4
mol/(L?min)
6.下列变化不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.工业上合成氨要用高温,催化剂
C.红棕色的NO2加压后颜色先变深再变浅
D.CO2(g)CO2(aq)ΔH<0,降温增压可增大二氧化碳气体在水中的溶解度
7.在密闭容器中发生如下反应:mA(g)+nB(g)?pC(g),达到平衡后,保持温度不变,将容器的体积缩小到原来的一半,达到新平衡时,C的浓度变为原来的1.9倍。下列说法中错误的是(
)
A.m+m<p
B.平衡向逆反应方向移动
C.A的转化率降低
D.A的体积分数减小
8.定条件下存在反应:H2(g)+I2(g)
2HI(g)
△H<0.现有三个相同的1L恒容绝热(与外界没有热量交换)态闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入lmolH2和1molⅠ2(g),在Ⅱ中充入2molHl(g),在Ⅲ中充入2molH2和2molI2
(g),700℃条件下开始反应。达到平衡时,下列说法正确的是()
A.容器Ⅰ、Ⅱ中反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色浅
D.容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化之和小于1
9.在2L密闭容器内,某气体反应物在2s内由8mol变为7.2mol,则用该气体表示该反应的平均反应速率为
A.0.4
mol·L?1·s?1
B.0.3
mol·L?1·s?1
C.0.2
mol·L?1·s?1
D.0.1
mol·L?1·s?1
10.下列反应中,熵减小的是( )
A.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g)
B.2N2O5(g)=4NO2(g)+O2(g)
C.MgCO3(s)=MgO(s)+CO2(g)
D.2CO(g)=2C(s)+O2(g)
11.下列说法正确的是
A.活化能接近于零的反应,当反应物相互接触时,反应瞬间完成,而且温度对其反应速率几乎没有影响
B.温度和压强都是通过增大活化分子百分数来加快化学反应速率
C.人们把能够发生有效碰撞的分子叫做活化分子,把活化分子具有的能量叫活化能
D.活化能的大小不仅意味着一般分子成为活化分子的难易,也会对化学反应前后的能量变化产生影响
12.5.6g铁粉投入到盛有100mL?2mol?L-1稀硫酸的烧杯中,2min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是(
)
A.v(H2SO4)=0.5mol?
(L?min)-1
B.v(H2SO4)=1
mol?
(L?min)-1
C.v(Fe)=0.5mol?
(L?min)-1
D.v(FeSO4)=1mol?
(L?min)-1
13.化学与生产、生活密切相关。下列事实与化学反应速率无关的( )
A.食品、蔬菜贮存在冰箱和冰柜里,能延长保鲜时间
B.家用铁锅、铁铲等餐具保持干燥,能减缓生锈
C.制造蜂窝煤时加入生石灰,减少SO2排放
D.煤气换成天然气时,要调整灶具进气(或出气)管
二、实验题
14.硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
(查阅资料)
i.Na2S2O3易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
ⅱ.Na2S2O3易被氧化,BaSO3难溶于水,可溶于稀盐酸。
(实验一)实验室通过如如图所示装置制备Na2S2O3。
(1)实验中要控制SO2生成速率,可采取的措施有___________(写出一条)。
(2)b装置的作用是______________________。
(3)实验结束后,在e处最好连接盛___________(填“NaOH溶液”、“水”、“CCl4”中的一种)的注射器,接下来的操作为___________,最后拆除装置。
(4)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_________________________________。沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(实验二)测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(5)滴定时1.000×10-4mol/L的标准AgNO3溶液应用___________(填仪器名称)盛装;滴定终点时的现象是___________。
(6)处理后的废水是否达到排放标准:___________(填“是”或“否”)。
15.某化学小组想制取CuO并证明CuO能加快KClO3的分解速率,设计并进行如下实验:
(一)制取CuO
①称取2
g胆矾研细后放入烧杯,加适量蒸馏水溶解;
②向步骤①所得溶液中逐滴加入NaOH溶液至铜离子沉淀完全;
③将步骤②所得沉淀过滤、洗涤,灼烧至恒重,研细备用。
回答下列问题:
(1)上述实验步骤中溶解、过滤时玻璃棒的作用依次是_____________。
(2)步骤③中灼烧前后,沉淀颜色的变化为_______。
(3)利用化学方法证明铜离子已经沉淀完全的操作是____________。
(二)证明CuO能加快KClO3的分解速率,并与MnO2的催化效率进行比较
用下图装置进行实验,且均以生成相同状况下20
mL氧气为准,其它可能影响实验的因素均已忽略,相关数据见下表:
实验序号
KClO3质量
其它物质质量
待测数据
①
1.5
g
无其他物质
②
1.5
g
CuO
0.5
g
③
1.5
g
MnO2
0.5
g
(4)上述实验中的待测数据指_____________;该实验除以上思路外,还可以通过测定______________来比较CuO和MnO2的催化效率。
(5)本实验装置图中量气装置由乳胶管和仪器A_______________(填名称)及50
mL___________(填“酸式”或“碱式”)滴定管改造后组装而成;
(6)为探究CuO在实验②中是否起催化作用,需补做如下实验:
a.CuO的质量有没有改变;
b.CuO的化学性质有没有改变。
简述验证CuO质量是否改变的操作过程_________________________。
三、推断题
16.重铬酸钾(K2Cr2O7)是高中化学常见的的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备。铬铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等。
已知:
①NaFeO2常温遇大量水会强烈水解,高温时不与水反应
②2CrO42-(黄色)+2H+Cr2O72-(橙色)+H2O
③+6价的铬元素在强酸性条件下具有强氧化性,还原产物为Cr3+,强碱性条件下几乎没有氧化性;请回答下列问题:
(1)将矿石粉碎的目的是___________________________。
(2)高温灼烧时生成NaFeO2的化学方程式____________________________________。
(3)①滤渣1中有红褐色物质,滤渣1的成分为__________________(写化学式,下同),写出生成该物质反应的离子方程式___________________________。
②滤渣2的主要成分是__________________。
(4)若向Na2CrO4溶液中加入浓盐酸进行酸化,出现的现象为__________________
(5)生产后的废水中主要含有一定量的Cr2O72-,通常加一定量的绿矾进行净化并调节pH约为6,可生成两种难溶于水的沉淀,请写出该反应的离子方程式___________________________。
17.(一)在容积为5L的密闭容器中,通入5
mol
N2和8
mol
H2,在一定条件下反应生成NH3,当反应进行到2
min时,测得容器内有4
mol
NH3。则:
(1)2
min时,容器内n(N2)==
________
,c(H2)==
___________
。
(2)2
min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为
_______
。
(二)A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C及B与D分别是同主族元素;已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又知A、C两元素原子序数之和是B、D两元素原子序数之和的一半。请回答下列问题:
(1)写出由A、B、C三元素形成的化合物的电子式__________
,
(2)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式________________________。
四、计算题
18.煤的气化是高效、清洁的利用煤炭的重要途径之一。
①?C(s)+?O2?(g)?=?CO2?(g)
ΔH?=?-393.5?kJ·mol-1
②?CO(g)?+O2?(g)?=?CO2?(g)???ΔH?=?-283.0?kJ·mol-1
③?H2(g)?+O2?(g)?=?H2O?(g)???ΔH?=?-241.8?kJ·mol-1
(1)则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是_______,该反应的化学平衡常数K随温度的升高将_______(填“增大”、“减小”或“不变”)。
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)CO2(g)+H2(g)
ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
H2O
CO
CO2
H2
甲
n/mol
0.10
0.30
0.10
0.50
乙
n/mol
0.20
0.20
0
0
起始时,甲容器中反应向?____________(填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为___________。
19.(1)下表中的数据表示破坏1
mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
化学键
C—H
C—F
H—F
F—F
键能
414
489
565
158
根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)=
CF4(g)+4HF(g)
△H=____。
(2)已知在448℃时,反应H2(g)+I2(g)2HI(g)的平衡常数K1为49,则反应HI(g)H2(g)+I2(g)==的平衡常数K3为__________。
(4)在一定条件下将CO2与H2混合转化为甲醇CH3OH是一种新型脱碳技术,这一反应同时生成H2O,实现了绿色环保、节能减排、废物利用等目的。在一恒温恒容密闭容器中充入1
mol
CO2和3
mol
H2,进行上述反应。测得CO2和CH3OH(g)的物质的量浓度随时间的变化如图Ⅲ所示。
①该反应方程式为______________
②0~10
min内,氢气的平均反应速率为________;
③该温度下,反应的平衡常数为________(保留三位有效数字);
④10
min后,向该容器中再充入1
mol
CO2和3
mol
H2,则再次达到平衡时CH3OH(g)的体积分数________(填“增大”、“减小”或“不变”)。
20.
(1)在反应A(g)+3B(g)=2C(g)中,若以物质A表示该反应的化学反应速率为0.2
mol·L-1·min-1,则以物质B表示此反应的化学反应速率为________mol·L-1·min-1。
(2)在2
L的密闭容器中,充入2
mol
N2和3
mol
H2,在一定条件下发生反应,3
s后测得N2的物质的量为1.9
mol,则以H2的浓度变化表示的反应速率为________。
/
参考答案
1.A2.C3.B4.C5.B6.B7.D8.D9.C10.D11.A12.A13.C
14.控制反应温度、调节酸的滴加速度或调节酸的浓度等
安全瓶,防止倒吸
NaOH溶液
关闭K2,打开K1
过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸
酸式滴定管
滴入最后一滴硝酸银溶液,出现黄色沉淀,且半分钟内沉淀不消失
否
15.搅拌、引流
由蓝色变为黑色
静置,向上层清液中滴加NaOH溶液,无明显现象
生成20mL氧气所需的时间
相同时间内产生氧气的体积大小
干燥管(球形干燥管)
碱式
反应结束后取下试管冷却至室温,加足量蒸馏水并充分振荡,过滤、洗涤、干燥、称量,看固体质量是否等于0.5g
16.增大接触面积,加快反应速率
4FeO
+
O2
+
4NaOH=
4FeO2
+
2H2O(条件高温)
Fe(OH)3
FeO2-
+
2H2O
=
Fe(OH)3+
OH-
Al(OH)3
、H2SiO3
有黄绿色气体生成
Cr2O72-
+
6Fe2+
+
17H2O
=
2Cr(OH)3↓
+
Fe(OH)3↓
+
10H+
17.3
mol
0.4
mol/L
9:13
HSO3-
+
H+
====SO2↑+H2O
18.C(s)+H2O(g)=CO(g)+H2(g)
ΔH=+131.3kJ·mol-1
增大
逆反应
50%
19.1928kl/mol
1/7
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
0.225mol/(L·min)
5.33
增大
20.0.6
0.05
mol·L-1·s-1
