人教版九年级下册化学 9.2-溶解度-同步练习(含解析)
文档属性
| 名称 | 人教版九年级下册化学 9.2-溶解度-同步练习(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 143.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-21 13:55:51 | ||
图片预览




文档简介
9.2溶解度
一、单选题
1.甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示。下列说法正确的是(
)
A.t1℃时,甲、乙两物质的饱和溶液中溶质的质量分数相等,且都等于
60%
B.t2℃时,甲、乙两种物质的饱和溶液,降温至t1℃,析出晶体质量,甲不一定大于乙
C.t1℃时,将甲、乙两种物质的饱和溶液升温至t2℃时,溶质的质量分数甲大于乙
D.t1℃时,将甲、乙两种物质的饱和溶液分别降温到0℃,乙析出晶
体比甲析出晶体多
2.t℃时,Na2CO3溶解度为Ag,现有饱和Na2CO3溶液(100+A)g,溶质质量分数为a%,向该溶液中投入无水碳酸钠Ag,静置后析出碳酸钠晶体(Na2CO3·10H2O)Bg,加水使晶体全部溶解,所得溶液质量分数为a%,则加入水的质量为(
)
A.(100+A)g
B.100g
C.g
D.(10
-A·a%)g
3.下列关于海水晒盐原理的分析正确的是
A.使水蒸发得到食盐
B.使海水降温析出食盐晶体
C.海水发生分解反应制得食盐
D.使海水升温得到食盐
4.下列通过实验得出的结论不正确的是(
)
A.实验一说明微观粒子(如分子)总是在不断运动着
B.实验二说明燃烧的条件之一是温度达到可燃物的着火点
C.实验三说明可燃物在氧气里燃烧比在空气里燃烧要剧烈
D.实验四说明不同的物质在同一溶剂中的溶解性是不同的
5.30℃时将等质量的两份饱和石灰水,一份冷却到20℃,另一份加入少量的生石灰,温度仍然保持在30℃,则这两种情况下均不改变的是
A.溶液中溶质的质量分数
B.溶质的质量
C.溶质的溶解度
D.溶剂的质量
6.下列有关溶液的叙述正确的是
A.稀溶液一定是不饱和溶液
B.泥水中,泥是溶质,水是溶剂
C.溶质的溶解度都随温度的升高而增大
D.物质的溶解过程通常会伴随着能量的变化
7.下列有关溶液的说法正确的是
A.溶液是均一,稳定的,所以均一、稳定的物质一定是溶液
B.两种液体混合经充分振荡后一定得到溶液
C.将10%的KNO3,溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.将25gKCl溶液蒸干得到5gKCl固体,则原溶液中溶质的质量分数为20%
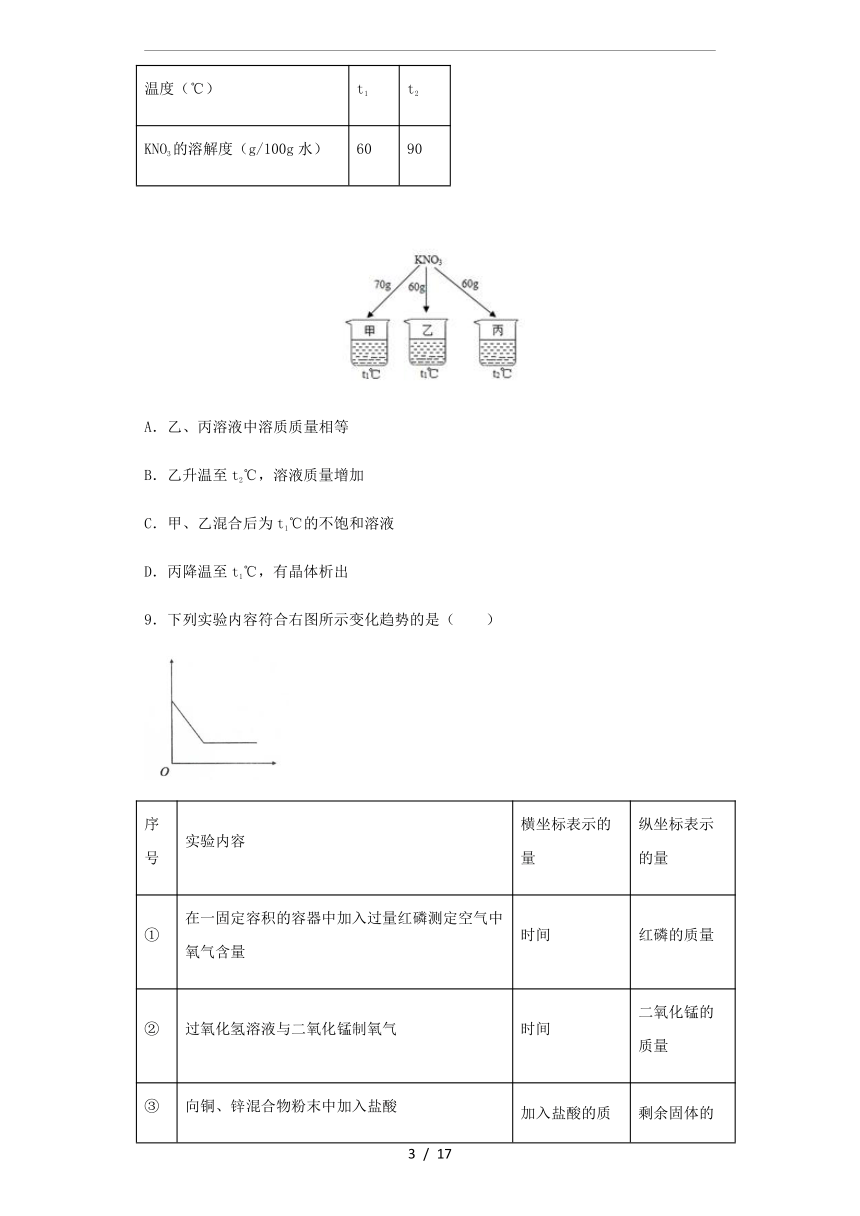
8.如图所示,在分别盛有100g水的烧杯中放入KNO3充分溶解,则说法正确的是( )
温度(℃)
t1
t2
KNO3的溶解度(g/100g水)
60
90
A.乙、丙溶液中溶质质量相等
B.乙升温至t2℃,溶液质量增加
C.甲、乙混合后为t1℃的不饱和溶液
D.丙降温至t1℃,有晶体析出
9.下列实验内容符合右图所示变化趋势的是(
)
序号
实验内容
横坐标表示的量
纵坐标表示的量
①
在一固定容积的容器中加入过量红磷测定空气中氧气含量
时间
红磷的质量
②
过氧化氢溶液与二氧化锰制氧气
时间
二氧化锰的质量
③
向铜、锌混合物粉末中加入盐酸
加入盐酸的质量
剩余固体的质量
④
某温度下,向硝酸钾饱和溶液中加入硝酸钾
加入硝酸钾的质量
溶质的质量分数
A.①②
B.①③
C.②③
D.③④
二、简答题
10.如图是a、b、c三种物质的溶解度曲线,请据图回答:
(1)P点的意义是________________;
(2)t2℃时,将50ga物质加入到50g水中并充分搅拌,形成溶液的质量为_________g。
(3)将t2℃时a、b、c三种物质的饱和溶液降低温度到t1℃时,这三种溶液中溶质质量分数由大到小的顺序是______________(填字母)。
11.图是A、B、C三种固体物质的溶解度曲线图,请回答:
①A物质中混有少量B物质时,可采用______方法得到较纯的A物质;
②t2℃时将相同质量的A、B、C三种物质分别加入到100g水中,充分溶解后,只有一种固体物质完全溶解了,这种物质是______;
③t1℃时A、B、C三种物质的饱和溶液同时升温到t2℃,此时溶液中溶质质量分数的大小关系是______.
12.开放性实践活动中,A、B、C三组同学,将葵花籽放入食盐水中浸泡12小时,捞出葵花籽,沥干水分后,用烤炉烤熟,制得咸瓜子。已知:室温为20oC,在此温度下,食盐的溶解度为36g。
(1)“捞出葵花籽,沥干水分”应用的实验操作是_________。
(2)A组同学配制的食盐水中,溶质的质量分数为______%。
(3)B、C两组同学炒制的瓜子咸度是否相同并说明理由_________。
三、填空题
13.如图是硝酸钾的溶解度曲线,回答下列问题:
(1)图中点A所对应的是该温度下硝酸钾的
________(填“饱和”或“不饱和”)溶液。
(2)当温度为_____℃时,硝酸钾的溶解度为45.8g。
14.溶液与人们的生产、生活密切相关
(1)将少量下列物质分别放入水中,充分搅拌,可以得到无色溶液的是_____(填字母)
A.硫酸铜
B.汽油
C.面粉
D.白糖
(2)盛水的烧杯中加入下列物质,形成溶液的过程中,温度没有明显变化的是_____(填字母)
A.氢氧化钠
B.硝酸铵
C.氯化钠
D.浓硫酸
(3)将一定量、同体积的水和汽油,分别加入等质量的固体碘中,观察到碘溶于酒精并得到棕色溶液,而碘不溶于水。由此可知,物质的溶解性与_____有关。
(4)沾在衣服上的油污可用_____溶解除去
15.小明非常喜欢学习化学,并乐于活用化学知识。请你试着和小明一起去体会活用化学知识的快乐:
(1)小明注意到汽水在没有开瓶盖以前几乎不到有气泡,但打开瓶盖之后却有大量气泡冒出,这说明了气体的溶解度____________。
(2)小明经常帮妈妈洗碗,他每次都能容易地把“油乎乎”的菜盘洗干净,请你猜猜看,他可能在水中加了_______
作用是
________。
(3)当镁与稀盐酸反应时,如果用手触摸试管外壁,会感觉到的____________现象。当镁与稀盐酸溶液充分反应后,得到饱和溶液,再将其蒸发或_________________处理,则容器内会有固体析出,该固体的化学式为__________
(4)
请根据下列探究实验,回答问题。
①欲探究铁、银、铜的活泼性,最佳实验方案是____________
A.
将铁、银分别加入到硫酸铜溶液中
B.
将铁、铜分别加入到硝酸银溶液中
C.
将铁、铜、银分别加入到盐酸溶液中
D.
将银、铜分别加入到硫酸亚铁溶液
②欲除去铜粉中的铁粉有多种方法,请列举其中一种__________。
③欲确定金属铁、铜的硬度大小,正确的方法是:__________
16.如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
⑴P点的含义是__________________________________________________。
⑵t2℃时30g
a物质加入到50
g水中不断搅拌,能形成溶液的质量____________.
⑶t2℃时a、b、c三种物质的溶解度按由大到小的顺序排列是__________________________________________(填写物质序号)。
⑷将t2℃时等质量a、b、c三种物质饱和溶液的温度降低到t1℃时,三种溶液中析出晶体的质量多少的顺序是____________________________(填写选项序号)。
A.c>a=bB.a=b>cC.a>b>cD.b>a>c
/
参考答案
1.B
【解析】
【详解】
A、由溶解度曲线可知,t1℃时,甲、乙两物质的溶解度相等为60g。故t1℃时,甲、乙两物质的饱和溶液中溶质的质量分数相等,且都等于×100%=
37.5%,选项错误;
B、由于甲、乙两种物质的饱和溶液的质量不确定,故t2℃时,甲、乙两种物质的饱和溶液,降温至t1℃,析出晶体质量,甲不一定大于乙,选项正确;
C、由溶解度曲线可知,t1℃时,甲、乙两物质的溶解度相等,溶质质量分数相等,溶解度随温度的升高而增大。由t1℃升温至t2℃时,温度升高,甲、乙两种溶液中溶质、溶剂质量不变,故溶质质量分数不变,选项错误;
D、由于甲、乙两种物质的饱和溶液的质量不确定,故t1℃时,将甲、乙两种物质的饱和溶液分别降温到0℃,甲、乙析出晶体的质量无法比较,选项错误。故选B。
【点睛】
掌握溶解度曲线的意义,溶质质量分数及其有关计算,饱和溶液及物质的结晶等相关知识是解题关键。
2.B
【解析】
【详解】
t℃时,Na2CO3溶解度为Ag,现有饱和Na2CO3溶液(100+A)g,溶质质量分数为a%;向该溶液中投入无水碳酸钠Ag,静置后析出碳酸钠晶体(Na2CO3·10H2O)Bg;加水使晶体全部溶解,所得溶液质量分数为a%,说明所得溶液还是该温度下的饱和溶液,所以就相当于计算该温度下溶解Ag无水碳酸钠所需要的水的质量,该温度下,Na2CO3溶解度为Ag,说明加入100g水该温度下正好饱和,所以加入水的质量为100g,故选B。
3.A
【解析】
【详解】
A、食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来,选项正确;
B、食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来,而不是利用降温析出食盐晶体,选项错误;
C、食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来,而不是利用海水在阳光下发生分解反应制得食盐,选项错误;
D、食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来,而不是利用阳光照射使海水升温得到食盐,选项错误,故选A。
【点睛】
溶解度受温度影响较小的固体物质,使其结晶时一般采用蒸发溶剂的方法,溶解度所温度升高且受温度影响较大的固体物质,使其结晶时一般采用冷却热饱和溶液的方法。
4.D
【解析】
【详解】
A、浓氨水具有挥发性,氨气溶于水生成减小物质,酚酞遇碱变红色,可以说明分子总是在不断运动着,故A正确;
B、铜片上的白磷燃烧,红磷不燃烧,说明燃烧的条件之一是温度达到可燃物的着火点,故B正确;
C、硫在空气中燃烧是淡蓝色火焰,在氧气中燃烧是蓝紫色火焰,说明可燃物在氧气里燃烧比在空气里燃烧要剧烈,故C正确;
D、碘不能溶于水,可以溶于汽油,说明同种物质在不同溶剂中的溶解性是不同的,故D错误。
故选:D。
5.A
【解析】
【详解】
A、由题意可知,30℃时将等质量的两份饱和石灰水,一份冷却到20℃,氢氧化钙的溶解度变大,溶液由饱和变成了不饱和溶液,溶液的质量分数不变;另一份加入少量生石灰,温度仍保持在30℃,因氧化钙与水反应而使溶剂的质量减少,部分溶质析出,因温度不变仍为该温度下的饱和溶液,溶质的质量分数不变,故A正确;
B、加入生石灰的溶液,因氧化钙与水反应而使溶剂的质量减少,因温度不变仍为该温度下的饱和溶液,部分溶质析出,溶质的质量减小,故B错误;
C、不同温度的氢氧化钙溶解度不同,故C错误;
D、加入生石灰的溶液,因氧化钙与水反应而使溶剂的质量减少,故D错误。故选A。
6.D
【解析】
【详解】
A.
物质的溶解性受温度、溶质的种类、溶剂的种类影响,在溶质、溶剂的种类、温度不完全相同的情况下,稀溶液不一定是不饱和溶液,浓溶液也不一定是饱和溶液,选项错误;
B.
溶液是均一稳定的混合物,被溶解的物质是溶质,起溶解作用的是溶剂,泥水是悬浊液,所以其中的泥不是溶质,选项错误;
C.
大多数溶质的溶解度随温度的升高而增大,少数物质的溶解度随温度升高而减小,如氢氧化钙,选项错误;
D.
微观上,物质的溶解过程包括扩散和水合两个过程,扩散过程吸收热量,水合过程释放热量,所以溶解过程通常会伴随着能量的变化,选项正确。故选D。
7.D
【解析】
【详解】
A.
溶液是均一,稳定的,但均一、稳定的物质不一定是溶液,如:水是均一、稳定的物质,但水不是溶液,此选项错误;
B.
两种液体混合经充分振荡后形成的混合物如果不具有均一性、稳定性,就不是溶液,此选项错误;
C.
溶液具有均一性,将10%的KNO3溶液倒出一半,剩余溶液中溶质的质量分数仍为10%,此选项错误;
D.
将25gKCl溶液蒸干得到5gKCl固体,则原溶液中溶质的质量分数为:×100%=20%,此选项正确。故选D。
【点睛】
溶液是具有均一性、稳定性的混合物。
8.A
【解析】
【分析】
溶解度是指在一定温度下,某固体物质100g溶剂里达到饱和时所溶解的质量。
【详解】
A.
根据溶解度可知,乙、丙溶液中溶质质量相等,都是60g,选项正确;
B.
乙升温至t2℃时溶解度变大,但溶液中的溶质、溶剂的质量没有改变,所以溶液质量不变,选项错误;
C.
甲、乙均为t1℃时的饱和溶液,所以混合后为t1℃的饱和溶液,选项错误;
D.
丙和乙中溶质的质量都是60g,溶剂都是100g,t1℃时硝酸钾的溶解度为60g,故降温至t1℃,溶液刚好饱和,无晶体析出,选项错误。故选A。
9.B
【解析】
【详解】
①
在一固定容积的容器中加入过量红磷测定空气中氧气含量时,磷燃烧生成五氧化二磷,红磷的量逐渐减少,反应结束时,红磷有剩余,选项正确;
②
过氧化氢溶液与二氧化锰制氧气,二氧化锰是过氧化氢分解的催化剂,质量不变,选项错误;
③
向铜、锌混合物粉末中加入盐酸,加入盐酸,锌和盐酸反应生成易溶于水的氯化锌,铜不反应,剩余固体的质量逐渐减少,最终固体为铜,选项正确;
④
某温度下,向硝酸钾饱和溶液中加入硝酸钾,硝酸钾不再溶解,溶质的质量分数不变,选项错误。故选B。
10.在t1℃时,a、c两物质的溶解度相同
75
b>a>c
【解析】
【详解】
(1)根据溶解度曲线可知,P点是t1℃时,
a、c两物质的溶解度曲线的交点,其含义是:在t1℃时,a、c两物质的溶解度相同;
(2)根据溶解度曲线可知,t2℃时a
的溶解度为50
g,即t2℃时100g水中最多溶解50ga,t2℃时,50g水中最多溶解25ga,将50ga物质放入50g水中充分溶解得到溶液的质量=25g+50g=75g;
(3)将t2℃时,a、b、c三种物质的饱和溶液降温到t1℃时,a、b的溶解度减小,c的溶解度随温度的降低而增大,a、b有晶体析出,质量分数变小,溶液仍为饱和溶液,c没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质分数=,溶解度越大,质量分数越大,t1℃时b的溶解度大于a的溶解度大于t2℃时c的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是b>a>c。
【点睛】
第(1)题答题时,不要遗忘温度条件,不能写成“a、c两物质的溶解度相同”,缺少温度条件无法比较溶解度的大小。
11.降温结晶
A
A=B>C
【解析】
【详解】
①由于A和B的溶解度都随温度的升高而增大,但A的溶解度受温度的影响较大,因此分离混有少量B的A,可采取就降温结晶即冷却热饱和溶液的方法;
②由溶解度曲线图可知t2℃时,A、B、C三种物质的溶解度大小关系为A>B>C,将相同质量的A、B、C三种物质分别加入到100g水中,充分溶解后,只有一种固体物质完全溶解了,这种物质只能是A;
③一定温度下饱和溶液的溶质分数=,溶解度越大,质量分数越大,在t1℃时,三种物质的溶解度大小关系为:A=B>C,所以三种物质饱和溶液中溶质的质量分数的大小关系为:A=B>C;t1℃时A、B、C三种物质的饱和溶液同时升温到t2℃,A、B的溶解度都随温度的升高而增大,因此升温时饱和溶液就会变成不饱和溶液,但溶液中溶质的质量分数不变,而C的溶解度随温度的升高而降低,因此升温时溶液中就会有晶体析出,溶液中溶质的质量分数就会减小,因此升温后三种物质的溶液溶质的质量分数的大小关系为:A=B>C;
12.过滤
20
是,B、C两组同学配制的食盐溶液均为饱和溶液,溶质的质量分数相同,浸泡时间相同,且葵花籽的质量相等,故咸度相同
【解析】
【详解】
(1)“捞出葵花籽,沥干水分”是将固体与液体分离,应用的实验操作是过滤;
(2)已知:室温为20oC,在此温度下,食盐的溶解度为36g。所以该温度下,25g食盐能完全溶解在100g水中,所得溶液中溶质的质量分数=;
(3)已知:室温为20oC,在此温度下,食盐的溶解度为36g。所以该温度下,40g氯化钠和50g氯化钠放入100g水中所得溶液均为该温度下的饱和溶液,溶质的质量分数相同,浸泡时间相同,且葵花籽的质量相等,故咸度相同。
13.不饱和
30
【解析】
【详解】
(1)对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液。图中点A在溶解度曲线以下,因此所对应的是该温度下硝酸钾的不饱和溶液;
(2)根据溶解度曲线可知,当温度为30℃时,硝酸钾的溶解度为45.8g。
14.D
C
溶剂种类
汽油
【解析】
【详解】
(1)硫酸铜溶于水形成的溶液是蓝色,汽油、面粉难溶于水,白糖溶于水形成的溶液是无色;
(2)氢氧化钠、浓硫酸溶于水放出大量的热,溶液温度升高;硝酸铵溶于水吸收大量的热,溶液温度降低;氯化钠溶于水,溶液温度基本不变,所以温度没有明显变化的是C;
(3)将一定量、同体积的水和汽油,分别加入等质量的固体碘中,观察到碘溶于酒精并得到棕色溶液,而碘不溶于水,由此可知,物质的溶解性与溶剂的种类有关;
(4)汽油可以溶解油污,所以可用汽油除去沾在衣服上的油污。
15.随压强减小而减小(或随压强增大而增大)
Na2CO3(或洗洁精)
碳酸钠能与油脂反应(或洗洁精对油污起到了乳化作用)
发热
降温
MgCl2
A
加入稀硫酸(或加入硫酸铜或用磁铁吸引)
相互刻划,比较划出痕迹的难易和深浅
【解析】
【详解】
(1)二氧化碳的溶解度随温度的升高而减小,随压强的增大而增大;打开瓶塞的过程是瓶内压强的改变过程,压强的改变导致气体溶解度的改变;打开瓶盖之后却有大量气泡冒出,说明压强减小后气体的溶解度变小。故填:随压强减小而减小(或随压强增大而增大);
(2)小明经常帮妈妈洗碗,她每次都能很容易地把“油乎乎”的菜盘洗干净,她可能在水中加了洗洁精,因为洗洁精具有乳化作用;或碳酸钠,碳酸钠能与油脂反应;故填:Na2CO3(或洗洁精);碳酸钠能与油脂反应(或洗洁精对油污起到了乳化作用);
(3)镁与稀盐酸反应会放热,使溶液的温度升高,氯化镁的饱和溶液蒸发溶剂或降温可使溶质氯化镁析出,故填:发热;降温;MgCl2;
(4)①通过比较分析,方案A最好,即简洁易操作,现象还明显,铁能置换出铜,证明铁比铜强,银不能和硫酸铜反应,证明铜比银活动性强;
②铁能被磁铁吸引,铜不能;铁能和稀硫酸及硫酸铜反应,铜不能。故可以采用磁铁吸引,加入硫酸,加入硫酸铜等方法除去铜粉中的铁粉;
③欲确定金属铁、铜的硬度大小,可采用相互刻划,比较划出痕迹的难易和深浅的方法。
故答案为:①A。
②加入稀硫酸(或加入硫酸铜或用磁铁吸引);
③相互刻划,比较划出痕迹的难易和深浅。
16.t10C时,a、c两物质的溶解度相等
75g
abc
C
【解析】
【详解】
(1)由溶解度曲线可知,横坐标表示温度,纵坐标表示溶解度,P点是a、c两曲线的交点,横纵坐标相等,故P点的含义是t10C时,a、c两物质的溶解度相等;
(2)
由溶解度曲线可知,
t2℃时30g
a物质的溶解度为50g,即t2℃时,100g溶解50ga物质达到饱和,故50
g水中溶解25ga物质达到饱和,能形成溶液的质量75g;
(3)
由溶解度曲线可知,t2℃时a、b、c三种物质的纵坐标高低顺序为abc,即t2℃时a、b、c三种物质的溶解度按由大到小的顺序排列是abc;
(4)
将t2℃时等质量a、b、c三种物质饱和溶液的温度降到t1℃时,因c物质的溶解度随温度的降低而增大,故c的饱和溶液变为了不饱和溶液,不会析出晶体,a、b两物质的溶解度随温度的降低而减小,故a、b的饱和溶液析出了晶体,但a物质的溶解度曲线随温度变化趋势比b物质的溶解度曲线随温度大,所以,三种溶液中析出晶体的质量多少的顺序是a>b>c,故选C
【点睛】
此题难点在第四小问,解题关键要分析三种物质的溶解度曲线随温度的变化趋势,温度对溶解度的影响大小。
一、单选题
1.甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示。下列说法正确的是(
)
A.t1℃时,甲、乙两物质的饱和溶液中溶质的质量分数相等,且都等于
60%
B.t2℃时,甲、乙两种物质的饱和溶液,降温至t1℃,析出晶体质量,甲不一定大于乙
C.t1℃时,将甲、乙两种物质的饱和溶液升温至t2℃时,溶质的质量分数甲大于乙
D.t1℃时,将甲、乙两种物质的饱和溶液分别降温到0℃,乙析出晶
体比甲析出晶体多
2.t℃时,Na2CO3溶解度为Ag,现有饱和Na2CO3溶液(100+A)g,溶质质量分数为a%,向该溶液中投入无水碳酸钠Ag,静置后析出碳酸钠晶体(Na2CO3·10H2O)Bg,加水使晶体全部溶解,所得溶液质量分数为a%,则加入水的质量为(
)
A.(100+A)g
B.100g
C.g
D.(10
-A·a%)g
3.下列关于海水晒盐原理的分析正确的是
A.使水蒸发得到食盐
B.使海水降温析出食盐晶体
C.海水发生分解反应制得食盐
D.使海水升温得到食盐
4.下列通过实验得出的结论不正确的是(
)
A.实验一说明微观粒子(如分子)总是在不断运动着
B.实验二说明燃烧的条件之一是温度达到可燃物的着火点
C.实验三说明可燃物在氧气里燃烧比在空气里燃烧要剧烈
D.实验四说明不同的物质在同一溶剂中的溶解性是不同的
5.30℃时将等质量的两份饱和石灰水,一份冷却到20℃,另一份加入少量的生石灰,温度仍然保持在30℃,则这两种情况下均不改变的是
A.溶液中溶质的质量分数
B.溶质的质量
C.溶质的溶解度
D.溶剂的质量
6.下列有关溶液的叙述正确的是
A.稀溶液一定是不饱和溶液
B.泥水中,泥是溶质,水是溶剂
C.溶质的溶解度都随温度的升高而增大
D.物质的溶解过程通常会伴随着能量的变化
7.下列有关溶液的说法正确的是
A.溶液是均一,稳定的,所以均一、稳定的物质一定是溶液
B.两种液体混合经充分振荡后一定得到溶液
C.将10%的KNO3,溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.将25gKCl溶液蒸干得到5gKCl固体,则原溶液中溶质的质量分数为20%
8.如图所示,在分别盛有100g水的烧杯中放入KNO3充分溶解,则说法正确的是( )
温度(℃)
t1
t2
KNO3的溶解度(g/100g水)
60
90
A.乙、丙溶液中溶质质量相等
B.乙升温至t2℃,溶液质量增加
C.甲、乙混合后为t1℃的不饱和溶液
D.丙降温至t1℃,有晶体析出
9.下列实验内容符合右图所示变化趋势的是(
)
序号
实验内容
横坐标表示的量
纵坐标表示的量
①
在一固定容积的容器中加入过量红磷测定空气中氧气含量
时间
红磷的质量
②
过氧化氢溶液与二氧化锰制氧气
时间
二氧化锰的质量
③
向铜、锌混合物粉末中加入盐酸
加入盐酸的质量
剩余固体的质量
④
某温度下,向硝酸钾饱和溶液中加入硝酸钾
加入硝酸钾的质量
溶质的质量分数
A.①②
B.①③
C.②③
D.③④
二、简答题
10.如图是a、b、c三种物质的溶解度曲线,请据图回答:
(1)P点的意义是________________;
(2)t2℃时,将50ga物质加入到50g水中并充分搅拌,形成溶液的质量为_________g。
(3)将t2℃时a、b、c三种物质的饱和溶液降低温度到t1℃时,这三种溶液中溶质质量分数由大到小的顺序是______________(填字母)。
11.图是A、B、C三种固体物质的溶解度曲线图,请回答:
①A物质中混有少量B物质时,可采用______方法得到较纯的A物质;
②t2℃时将相同质量的A、B、C三种物质分别加入到100g水中,充分溶解后,只有一种固体物质完全溶解了,这种物质是______;
③t1℃时A、B、C三种物质的饱和溶液同时升温到t2℃,此时溶液中溶质质量分数的大小关系是______.
12.开放性实践活动中,A、B、C三组同学,将葵花籽放入食盐水中浸泡12小时,捞出葵花籽,沥干水分后,用烤炉烤熟,制得咸瓜子。已知:室温为20oC,在此温度下,食盐的溶解度为36g。
(1)“捞出葵花籽,沥干水分”应用的实验操作是_________。
(2)A组同学配制的食盐水中,溶质的质量分数为______%。
(3)B、C两组同学炒制的瓜子咸度是否相同并说明理由_________。
三、填空题
13.如图是硝酸钾的溶解度曲线,回答下列问题:
(1)图中点A所对应的是该温度下硝酸钾的
________(填“饱和”或“不饱和”)溶液。
(2)当温度为_____℃时,硝酸钾的溶解度为45.8g。
14.溶液与人们的生产、生活密切相关
(1)将少量下列物质分别放入水中,充分搅拌,可以得到无色溶液的是_____(填字母)
A.硫酸铜
B.汽油
C.面粉
D.白糖
(2)盛水的烧杯中加入下列物质,形成溶液的过程中,温度没有明显变化的是_____(填字母)
A.氢氧化钠
B.硝酸铵
C.氯化钠
D.浓硫酸
(3)将一定量、同体积的水和汽油,分别加入等质量的固体碘中,观察到碘溶于酒精并得到棕色溶液,而碘不溶于水。由此可知,物质的溶解性与_____有关。
(4)沾在衣服上的油污可用_____溶解除去
15.小明非常喜欢学习化学,并乐于活用化学知识。请你试着和小明一起去体会活用化学知识的快乐:
(1)小明注意到汽水在没有开瓶盖以前几乎不到有气泡,但打开瓶盖之后却有大量气泡冒出,这说明了气体的溶解度____________。
(2)小明经常帮妈妈洗碗,他每次都能容易地把“油乎乎”的菜盘洗干净,请你猜猜看,他可能在水中加了_______
作用是
________。
(3)当镁与稀盐酸反应时,如果用手触摸试管外壁,会感觉到的____________现象。当镁与稀盐酸溶液充分反应后,得到饱和溶液,再将其蒸发或_________________处理,则容器内会有固体析出,该固体的化学式为__________
(4)
请根据下列探究实验,回答问题。
①欲探究铁、银、铜的活泼性,最佳实验方案是____________
A.
将铁、银分别加入到硫酸铜溶液中
B.
将铁、铜分别加入到硝酸银溶液中
C.
将铁、铜、银分别加入到盐酸溶液中
D.
将银、铜分别加入到硫酸亚铁溶液
②欲除去铜粉中的铁粉有多种方法,请列举其中一种__________。
③欲确定金属铁、铜的硬度大小,正确的方法是:__________
16.如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
⑴P点的含义是__________________________________________________。
⑵t2℃时30g
a物质加入到50
g水中不断搅拌,能形成溶液的质量____________.
⑶t2℃时a、b、c三种物质的溶解度按由大到小的顺序排列是__________________________________________(填写物质序号)。
⑷将t2℃时等质量a、b、c三种物质饱和溶液的温度降低到t1℃时,三种溶液中析出晶体的质量多少的顺序是____________________________(填写选项序号)。
A.c>a=bB.a=b>cC.a>b>cD.b>a>c
/
参考答案
1.B
【解析】
【详解】
A、由溶解度曲线可知,t1℃时,甲、乙两物质的溶解度相等为60g。故t1℃时,甲、乙两物质的饱和溶液中溶质的质量分数相等,且都等于×100%=
37.5%,选项错误;
B、由于甲、乙两种物质的饱和溶液的质量不确定,故t2℃时,甲、乙两种物质的饱和溶液,降温至t1℃,析出晶体质量,甲不一定大于乙,选项正确;
C、由溶解度曲线可知,t1℃时,甲、乙两物质的溶解度相等,溶质质量分数相等,溶解度随温度的升高而增大。由t1℃升温至t2℃时,温度升高,甲、乙两种溶液中溶质、溶剂质量不变,故溶质质量分数不变,选项错误;
D、由于甲、乙两种物质的饱和溶液的质量不确定,故t1℃时,将甲、乙两种物质的饱和溶液分别降温到0℃,甲、乙析出晶体的质量无法比较,选项错误。故选B。
【点睛】
掌握溶解度曲线的意义,溶质质量分数及其有关计算,饱和溶液及物质的结晶等相关知识是解题关键。
2.B
【解析】
【详解】
t℃时,Na2CO3溶解度为Ag,现有饱和Na2CO3溶液(100+A)g,溶质质量分数为a%;向该溶液中投入无水碳酸钠Ag,静置后析出碳酸钠晶体(Na2CO3·10H2O)Bg;加水使晶体全部溶解,所得溶液质量分数为a%,说明所得溶液还是该温度下的饱和溶液,所以就相当于计算该温度下溶解Ag无水碳酸钠所需要的水的质量,该温度下,Na2CO3溶解度为Ag,说明加入100g水该温度下正好饱和,所以加入水的质量为100g,故选B。
3.A
【解析】
【详解】
A、食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来,选项正确;
B、食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来,而不是利用降温析出食盐晶体,选项错误;
C、食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来,而不是利用海水在阳光下发生分解反应制得食盐,选项错误;
D、食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来,而不是利用阳光照射使海水升温得到食盐,选项错误,故选A。
【点睛】
溶解度受温度影响较小的固体物质,使其结晶时一般采用蒸发溶剂的方法,溶解度所温度升高且受温度影响较大的固体物质,使其结晶时一般采用冷却热饱和溶液的方法。
4.D
【解析】
【详解】
A、浓氨水具有挥发性,氨气溶于水生成减小物质,酚酞遇碱变红色,可以说明分子总是在不断运动着,故A正确;
B、铜片上的白磷燃烧,红磷不燃烧,说明燃烧的条件之一是温度达到可燃物的着火点,故B正确;
C、硫在空气中燃烧是淡蓝色火焰,在氧气中燃烧是蓝紫色火焰,说明可燃物在氧气里燃烧比在空气里燃烧要剧烈,故C正确;
D、碘不能溶于水,可以溶于汽油,说明同种物质在不同溶剂中的溶解性是不同的,故D错误。
故选:D。
5.A
【解析】
【详解】
A、由题意可知,30℃时将等质量的两份饱和石灰水,一份冷却到20℃,氢氧化钙的溶解度变大,溶液由饱和变成了不饱和溶液,溶液的质量分数不变;另一份加入少量生石灰,温度仍保持在30℃,因氧化钙与水反应而使溶剂的质量减少,部分溶质析出,因温度不变仍为该温度下的饱和溶液,溶质的质量分数不变,故A正确;
B、加入生石灰的溶液,因氧化钙与水反应而使溶剂的质量减少,因温度不变仍为该温度下的饱和溶液,部分溶质析出,溶质的质量减小,故B错误;
C、不同温度的氢氧化钙溶解度不同,故C错误;
D、加入生石灰的溶液,因氧化钙与水反应而使溶剂的质量减少,故D错误。故选A。
6.D
【解析】
【详解】
A.
物质的溶解性受温度、溶质的种类、溶剂的种类影响,在溶质、溶剂的种类、温度不完全相同的情况下,稀溶液不一定是不饱和溶液,浓溶液也不一定是饱和溶液,选项错误;
B.
溶液是均一稳定的混合物,被溶解的物质是溶质,起溶解作用的是溶剂,泥水是悬浊液,所以其中的泥不是溶质,选项错误;
C.
大多数溶质的溶解度随温度的升高而增大,少数物质的溶解度随温度升高而减小,如氢氧化钙,选项错误;
D.
微观上,物质的溶解过程包括扩散和水合两个过程,扩散过程吸收热量,水合过程释放热量,所以溶解过程通常会伴随着能量的变化,选项正确。故选D。
7.D
【解析】
【详解】
A.
溶液是均一,稳定的,但均一、稳定的物质不一定是溶液,如:水是均一、稳定的物质,但水不是溶液,此选项错误;
B.
两种液体混合经充分振荡后形成的混合物如果不具有均一性、稳定性,就不是溶液,此选项错误;
C.
溶液具有均一性,将10%的KNO3溶液倒出一半,剩余溶液中溶质的质量分数仍为10%,此选项错误;
D.
将25gKCl溶液蒸干得到5gKCl固体,则原溶液中溶质的质量分数为:×100%=20%,此选项正确。故选D。
【点睛】
溶液是具有均一性、稳定性的混合物。
8.A
【解析】
【分析】
溶解度是指在一定温度下,某固体物质100g溶剂里达到饱和时所溶解的质量。
【详解】
A.
根据溶解度可知,乙、丙溶液中溶质质量相等,都是60g,选项正确;
B.
乙升温至t2℃时溶解度变大,但溶液中的溶质、溶剂的质量没有改变,所以溶液质量不变,选项错误;
C.
甲、乙均为t1℃时的饱和溶液,所以混合后为t1℃的饱和溶液,选项错误;
D.
丙和乙中溶质的质量都是60g,溶剂都是100g,t1℃时硝酸钾的溶解度为60g,故降温至t1℃,溶液刚好饱和,无晶体析出,选项错误。故选A。
9.B
【解析】
【详解】
①
在一固定容积的容器中加入过量红磷测定空气中氧气含量时,磷燃烧生成五氧化二磷,红磷的量逐渐减少,反应结束时,红磷有剩余,选项正确;
②
过氧化氢溶液与二氧化锰制氧气,二氧化锰是过氧化氢分解的催化剂,质量不变,选项错误;
③
向铜、锌混合物粉末中加入盐酸,加入盐酸,锌和盐酸反应生成易溶于水的氯化锌,铜不反应,剩余固体的质量逐渐减少,最终固体为铜,选项正确;
④
某温度下,向硝酸钾饱和溶液中加入硝酸钾,硝酸钾不再溶解,溶质的质量分数不变,选项错误。故选B。
10.在t1℃时,a、c两物质的溶解度相同
75
b>a>c
【解析】
【详解】
(1)根据溶解度曲线可知,P点是t1℃时,
a、c两物质的溶解度曲线的交点,其含义是:在t1℃时,a、c两物质的溶解度相同;
(2)根据溶解度曲线可知,t2℃时a
的溶解度为50
g,即t2℃时100g水中最多溶解50ga,t2℃时,50g水中最多溶解25ga,将50ga物质放入50g水中充分溶解得到溶液的质量=25g+50g=75g;
(3)将t2℃时,a、b、c三种物质的饱和溶液降温到t1℃时,a、b的溶解度减小,c的溶解度随温度的降低而增大,a、b有晶体析出,质量分数变小,溶液仍为饱和溶液,c没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质分数=,溶解度越大,质量分数越大,t1℃时b的溶解度大于a的溶解度大于t2℃时c的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是b>a>c。
【点睛】
第(1)题答题时,不要遗忘温度条件,不能写成“a、c两物质的溶解度相同”,缺少温度条件无法比较溶解度的大小。
11.降温结晶
A
A=B>C
【解析】
【详解】
①由于A和B的溶解度都随温度的升高而增大,但A的溶解度受温度的影响较大,因此分离混有少量B的A,可采取就降温结晶即冷却热饱和溶液的方法;
②由溶解度曲线图可知t2℃时,A、B、C三种物质的溶解度大小关系为A>B>C,将相同质量的A、B、C三种物质分别加入到100g水中,充分溶解后,只有一种固体物质完全溶解了,这种物质只能是A;
③一定温度下饱和溶液的溶质分数=,溶解度越大,质量分数越大,在t1℃时,三种物质的溶解度大小关系为:A=B>C,所以三种物质饱和溶液中溶质的质量分数的大小关系为:A=B>C;t1℃时A、B、C三种物质的饱和溶液同时升温到t2℃,A、B的溶解度都随温度的升高而增大,因此升温时饱和溶液就会变成不饱和溶液,但溶液中溶质的质量分数不变,而C的溶解度随温度的升高而降低,因此升温时溶液中就会有晶体析出,溶液中溶质的质量分数就会减小,因此升温后三种物质的溶液溶质的质量分数的大小关系为:A=B>C;
12.过滤
20
是,B、C两组同学配制的食盐溶液均为饱和溶液,溶质的质量分数相同,浸泡时间相同,且葵花籽的质量相等,故咸度相同
【解析】
【详解】
(1)“捞出葵花籽,沥干水分”是将固体与液体分离,应用的实验操作是过滤;
(2)已知:室温为20oC,在此温度下,食盐的溶解度为36g。所以该温度下,25g食盐能完全溶解在100g水中,所得溶液中溶质的质量分数=;
(3)已知:室温为20oC,在此温度下,食盐的溶解度为36g。所以该温度下,40g氯化钠和50g氯化钠放入100g水中所得溶液均为该温度下的饱和溶液,溶质的质量分数相同,浸泡时间相同,且葵花籽的质量相等,故咸度相同。
13.不饱和
30
【解析】
【详解】
(1)对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液。图中点A在溶解度曲线以下,因此所对应的是该温度下硝酸钾的不饱和溶液;
(2)根据溶解度曲线可知,当温度为30℃时,硝酸钾的溶解度为45.8g。
14.D
C
溶剂种类
汽油
【解析】
【详解】
(1)硫酸铜溶于水形成的溶液是蓝色,汽油、面粉难溶于水,白糖溶于水形成的溶液是无色;
(2)氢氧化钠、浓硫酸溶于水放出大量的热,溶液温度升高;硝酸铵溶于水吸收大量的热,溶液温度降低;氯化钠溶于水,溶液温度基本不变,所以温度没有明显变化的是C;
(3)将一定量、同体积的水和汽油,分别加入等质量的固体碘中,观察到碘溶于酒精并得到棕色溶液,而碘不溶于水,由此可知,物质的溶解性与溶剂的种类有关;
(4)汽油可以溶解油污,所以可用汽油除去沾在衣服上的油污。
15.随压强减小而减小(或随压强增大而增大)
Na2CO3(或洗洁精)
碳酸钠能与油脂反应(或洗洁精对油污起到了乳化作用)
发热
降温
MgCl2
A
加入稀硫酸(或加入硫酸铜或用磁铁吸引)
相互刻划,比较划出痕迹的难易和深浅
【解析】
【详解】
(1)二氧化碳的溶解度随温度的升高而减小,随压强的增大而增大;打开瓶塞的过程是瓶内压强的改变过程,压强的改变导致气体溶解度的改变;打开瓶盖之后却有大量气泡冒出,说明压强减小后气体的溶解度变小。故填:随压强减小而减小(或随压强增大而增大);
(2)小明经常帮妈妈洗碗,她每次都能很容易地把“油乎乎”的菜盘洗干净,她可能在水中加了洗洁精,因为洗洁精具有乳化作用;或碳酸钠,碳酸钠能与油脂反应;故填:Na2CO3(或洗洁精);碳酸钠能与油脂反应(或洗洁精对油污起到了乳化作用);
(3)镁与稀盐酸反应会放热,使溶液的温度升高,氯化镁的饱和溶液蒸发溶剂或降温可使溶质氯化镁析出,故填:发热;降温;MgCl2;
(4)①通过比较分析,方案A最好,即简洁易操作,现象还明显,铁能置换出铜,证明铁比铜强,银不能和硫酸铜反应,证明铜比银活动性强;
②铁能被磁铁吸引,铜不能;铁能和稀硫酸及硫酸铜反应,铜不能。故可以采用磁铁吸引,加入硫酸,加入硫酸铜等方法除去铜粉中的铁粉;
③欲确定金属铁、铜的硬度大小,可采用相互刻划,比较划出痕迹的难易和深浅的方法。
故答案为:①A。
②加入稀硫酸(或加入硫酸铜或用磁铁吸引);
③相互刻划,比较划出痕迹的难易和深浅。
16.t10C时,a、c两物质的溶解度相等
75g
abc
C
【解析】
【详解】
(1)由溶解度曲线可知,横坐标表示温度,纵坐标表示溶解度,P点是a、c两曲线的交点,横纵坐标相等,故P点的含义是t10C时,a、c两物质的溶解度相等;
(2)
由溶解度曲线可知,
t2℃时30g
a物质的溶解度为50g,即t2℃时,100g溶解50ga物质达到饱和,故50
g水中溶解25ga物质达到饱和,能形成溶液的质量75g;
(3)
由溶解度曲线可知,t2℃时a、b、c三种物质的纵坐标高低顺序为abc,即t2℃时a、b、c三种物质的溶解度按由大到小的顺序排列是abc;
(4)
将t2℃时等质量a、b、c三种物质饱和溶液的温度降到t1℃时,因c物质的溶解度随温度的降低而增大,故c的饱和溶液变为了不饱和溶液,不会析出晶体,a、b两物质的溶解度随温度的降低而减小,故a、b的饱和溶液析出了晶体,但a物质的溶解度曲线随温度变化趋势比b物质的溶解度曲线随温度大,所以,三种溶液中析出晶体的质量多少的顺序是a>b>c,故选C
【点睛】
此题难点在第四小问,解题关键要分析三种物质的溶解度曲线随温度的变化趋势,温度对溶解度的影响大小。
同课章节目录
