高中化学选修四2-2《影响化学反应速率的因素》人教版(38张PPT)
文档属性
| 名称 | 高中化学选修四2-2《影响化学反应速率的因素》人教版(38张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-24 18:31:43 | ||
图片预览






文档简介
(共38张PPT)
有利的——越快越好!
有害的——越慢越好!
能否控制化学反应速率呢?
影响化学反应速率的因素
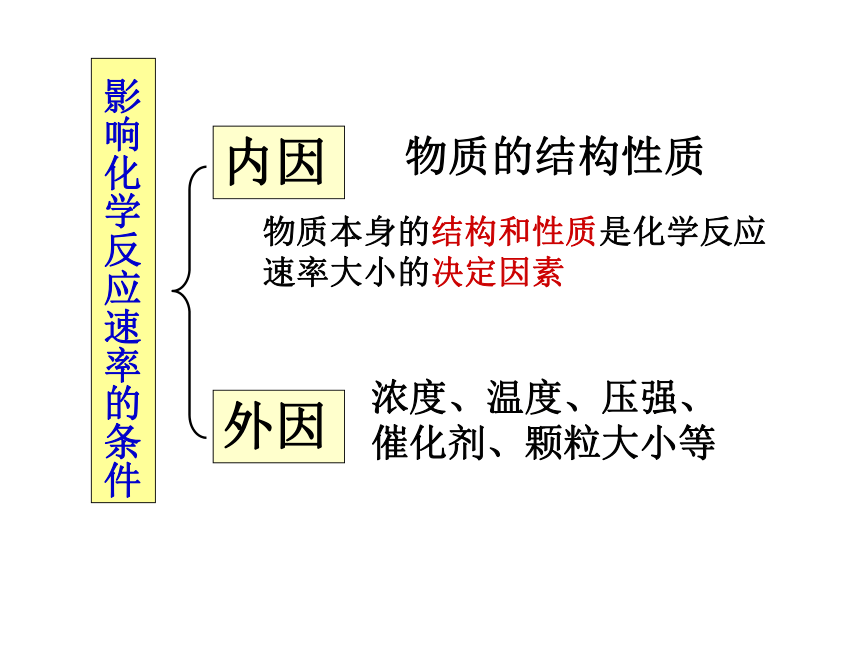
影响化学反应速率的条件
内因
外因
物质的结构性质
浓度、温度、压强、
催化剂、颗粒大小等
物质本身的结构和性质是化学反应
速率大小的决定因素
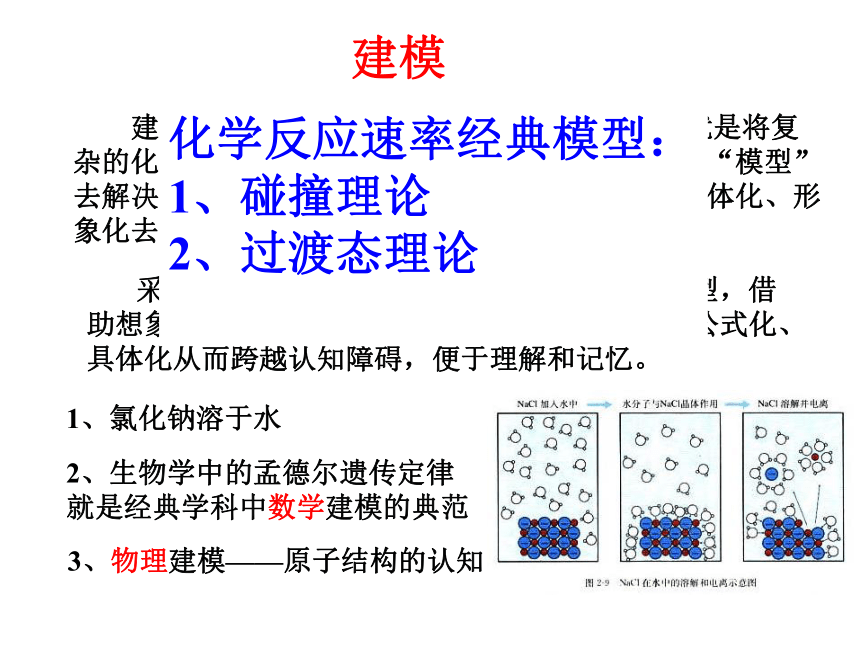
建模就是建立“模式”、“模型”,建模思想就是将复杂的化学问题精简掉非本质的东西,抽象出具体的“模型”去解决问题的思维方式,即将一些抽象化的问题具体化、形象化去解决相关问题。
采用科学的建模思想,转化为已有具体知识模型,借助想象和理解构建形象生动的模型、将一些问题公式化、具体化从而跨越认知障碍,便于理解和记忆。
建模
1、氯化钠溶于水
2、生物学中的孟德尔遗传定律
就是经典学科中数学建模的典范
3、物理建模——原子结构的认知
化学反应速率经典模型:
1、碰撞理论
2、过渡态理论
回忆:
⑴、化学反应的实质是:
旧的化学键断裂,新的化学键形成
⑵、化学反应发生的先决条件:
反应物分子相互接触和碰撞
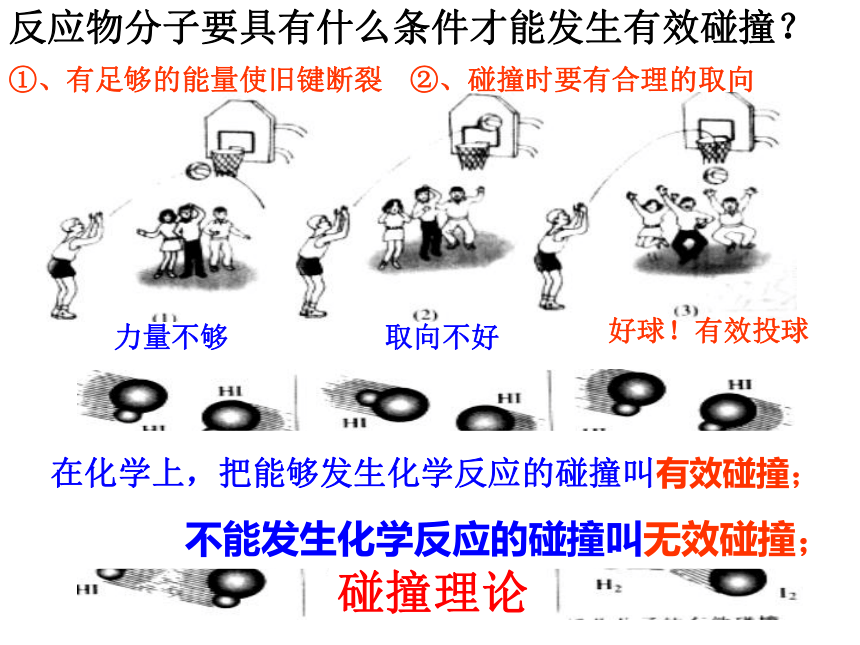
注意:反应物分子之间的碰撞次数很大,但并不是每一次碰撞均可发生化学反应。
力量不够
取向不好
好球!有效投球
反应物分子要具有什么条件才能发生有效碰撞?
①、有足够的能量使旧键断裂
②、碰撞时要有合理的取向
在化学上,把能够发生化学反应的碰撞叫有效碰撞;
不能发生化学反应的碰撞叫无效碰撞;
碰撞理论
一、活化分子
1、 定义:
具有一定的能量,在碰撞过程中足以令旧化学键断裂,而发生反应(即发生“有效碰撞”)的分子称为活化分子。
单位体积内活化分子数越多,反应速率越快
活化分子数(n活)
反应物分子总数(n总)
==
活化分子百分数(活%)
2、活化分子百分数:
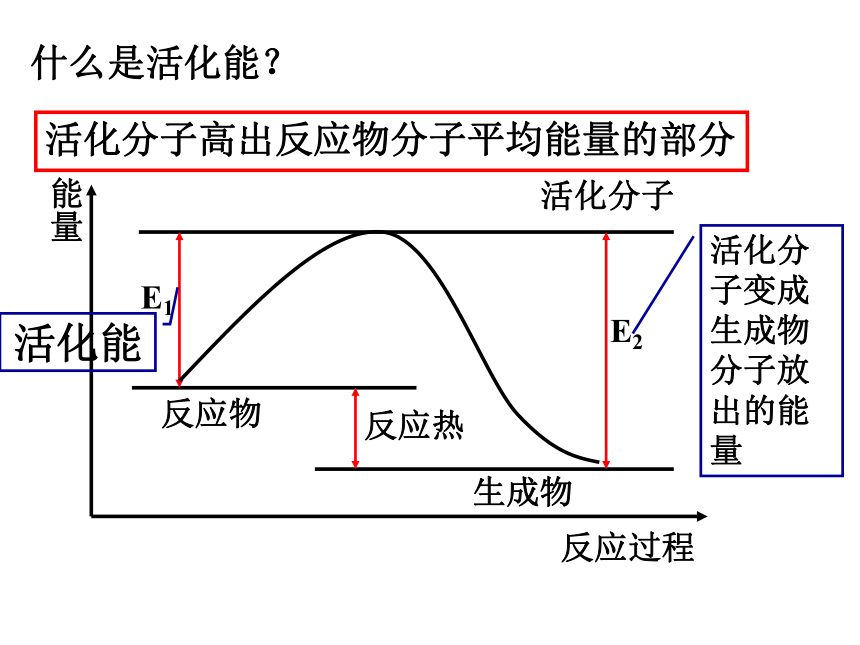
什么是活化能?
活化分子高出反应物分子平均能量的部分
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
讨论2H2+O2=2H2O
1.H2 与O2间分子要发生反应则分子间首先要_____
碰撞
2.是不是每一次碰撞都能发生化学反应呢?
3.能发生化学反应的碰撞称为有效碰撞
4.发生有效碰撞的条件是什么?
分子有足够的能量
合适的取向
5.具有足够高的能量,能发生有效碰撞的分子叫做活化分子
发生有效碰撞的分子一定是活化分子,
但活化分子的碰撞不一定是有效碰撞。
结论:
碰撞理论
活化分子百分数: (活化分子数/反应物分子数)×100%
化学反应速率主要取决于:
普通
分子
活化能
活化
分子
合理
取向碰撞
有效
碰撞
新物质
单位体积内活化分子数
有效碰撞的几率
四、外界条件对反应速率的影响
内因:反应物本身的性质
外因:浓度、温度、压强、催化剂
1、浓度对反应速率的影响
[实验2-2]
[现象]
KMnO4 + H2C2O4
结果:H2C2O4溶液浓度大,KMnO4先褪色
结论:在其他条件不变时,增大反应物浓度,可以增大反应速率
结果:H2C2O4溶液浓度大,KMnO4先褪色
2KMnO4 + 5H2C2O4 +3H2SO4=K2SO4 +2MnSO4 +10CO2↑+8H2O
影响因素:浓度
1、浓度
浓度
增大
→单位体积内n总↑
T不变,活%不变
n活↑
→有效碰撞↑
→V↑
在其他条件不变时,增大反应物浓度,可以增大反应速率 。
a、此规律只适用于气体或溶液的反应,对于固体 或液体的反应物,一般情况下其浓度是常数,因此改变它们的量一般不会改变化学反应速率。
c、随着化学反应的进行,反应物的浓度会逐渐减小,因此一般反应速率也会逐渐减小。
d、反应速率快慢与浓度有关,而与物质的总量无关
注意!
b、一般来说,固体反应物表面积越大,反应速率越大,固体反应物表面积越小,反应速率越小。
练1:
一定条件下,在CaCO3(块状)+2HCl=CaCl2+H2O+CO2 反应中,为了加快反应的速率,下列那些方法可行:
A、增加HCl的浓度 B、加水
C、增加同浓度盐酸的量 D、改加CaCO3粉末
练2:如反应:3KSCN+FeCl3 = Fe(SCN)3+3KCl
若在上述反应体系中加入KCl晶体,为什么不会影响化学反应速率?
因为反应实质为:Fe3++3SCN- = Fe(SCN)3
AD
在恒温、恒容的密闭容器中进行反应
A(g)=B(g)+C(g)。若反应物的浓度从3mol/L降至1.8mol/L需30s,那么反应物浓度由0.8mol/L降至0.2mol/L所需反应的时间为( )
A.15s B.大于15s
C.小于15s D.无法确定
B
υ=k[A]m[B]n
A(g) +B(g)=C (g)+D (g)
硫代硫酸钠(Na2S2O3)与稀硫酸发生如下反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O
下列四种情况中最早出现浑浊的是( )
A10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
B10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4 各5 mL,加水10mL
C 20℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
D20℃ 时0.2mol /L Na2S2O3和0.1 mol /L H2SO4各5 mL,加水10 mL
C
压强对反应速率的影响
练3:
若将物质的量相等的HI气体分别放在等容积的两个针桶中,一个保持体积不变,另一个压缩为原来的1/2。其它条件不变,则HI的分解反应速率谁快?
2、压强
压强增大
→ 体积减小
其他条件不变
→V↑
→C增大
压强对于反应速率的影响是通过对浓度的影响实现的
P增大→C成比例增大,P减小→C成比例减小(紧扣对C的影响)
发散思考:压强对于任意化学反应的速率都有影响吗?
此规律只适用于有气体参加的反应。
其他条件不变,增大压强,气体体积缩小,浓度增大,反应速率加快。
对于气体有下列几种情况:
前提 改变条件 压强变化 浓度变化 反应速率变化
恒温时
恒容时
恒容时
恒压时
增大压强
体积减少
C增大
V增大
充入气体
反应物
反应物
浓度增大
增大压强
V增大
充入
“无关气体”
增大压强
V不变
C不变
充入
“无关气体”
压强不变
C减小
V减小
练4、对于反应N2+O2=2NO在密闭容器中进行,下列条件哪些不能加快该反应的化学反应速率( )
A、缩小体积使压强增大
B、体积不变充入 N2 使压强增大
C、体积不变充入 O2使压强增大
D、使体积增大到原来的2倍
E、体积不变充入氦气使压强增大
压强对反应速率的影响
DE
结果:温度高的溶液先出现浑浊
一般说来,温度每升高10℃,速率增加2-4倍。
T↑
→普通分子变为活化分子
→活%↑
→ n活↑
→V↑
3、温度
其他条件不变,温度升高,反应速率加快
注意: 该规律适用于任何反应。
影响
外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数
升高温度
不变
增加
增加
加快
1、温度对反应速率的影响,无论是放热反应,还是吸热反应都适用。
3、温度对反应速率的影响,无论固体、液体、气体都适用。
2、对于可逆反应,升高体系的温度,正反应速率和逆反应的反应速率都增大,但增大程度不同。对吸热反应方向的速率影响比较大。
备注
你能举出生活中利用改变温度改变反应速率的例子吗
冰箱延长食物保鲜期
一般说来,温度每升高10℃,速率增加2-4倍。
练5、把除去氧化膜的 Mg 条,投入到盛有稀盐酸的试管中,发现 H2 的产生速率(v)与时间(t)的变化情况如右图所示,
t1 ~ t2 速率变化的主要原因是: _______ ;
t2 ~ t3 速率变化的主要原因是:_________。
v
t1 t2 t3 t
例2、对于反应M+N→P,如果温度每升高10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为 ( ) A.2min B.3min C.6min D.9min
温度控制
浓度控制
A
结论:加入催化剂可以加快反应的速率
4、催化剂对化学反应速率的影响
结论
催化剂能够改变化学反应速率
催化剂有正、负之分。
能加快化学反应速率的催化剂叫正催化剂
能减慢化学反应速率的催化剂叫负催化剂
4、催化剂对化学反应速率的影响
食用油脂里加入0.02%~0.04%没食子酸正丙酯,就可以有效地防止酸败
正催化剂能加快反应速率的原因。
它能够降低化学反应所需要的能量,使更多的反应物分子成为活化分子,增加了单位体积内活化分子的质量分数。
催化剂
反应所需能量降低
活化分子增多
反应速率加快
对于可逆反应,同一催化剂能同等程度的改变正逆反应速率。
正催化剂
→降低反应的活化能
→V↑
4、催化剂
→ n活↑
——改变反应的途径
→活%↑
n总不变
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
能量
能量
衣物上的油渍用普通洗衣粉很难洗去,但如果用加有酶
的洗衣粉,则较容易就能洗去。为什么?
注意:
使用催化剂同等程度的增大(减慢)、正逆反应速率,从而改变反应到达平衡所需时间。
没特别指明一般指正催化剂
催化剂只能催化可能发生的反应,对不发生的反应无作用
催化剂具有一定的选择性
小结:影响化学反应速率的外因
影响
外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大反应物浓度
增大压强
升高温度
使用催化剂
增加
增加
不变
增加
加快
不变
不变
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
其他如光照、反应物固体的颗粒大小、电磁波、超声波、溶剂的性质等,也会对化学反应的速率产生影响。
各条件对速率的影响大小是:
催化剂 >>温度>浓度=压强(体积变化引起的)。
各种影响都有其局限性,要针对具体反应
具体分析。
总结:
增大反应物的浓度使反应速率加快的主要原因( )
对于气体参与体系增大压强使反应速率加快的主要原因是( )
升高温度使反应速率加快的主要原因是( )
使用催化剂使反应速率加快的主要原因是( )
A、活化分子百分数不变,但提高单位体积内活化分子的总数
B、 增大分子的运动速率而使有效碰撞增加
C、 升高反应物分子的能量,使活化分子的百分数增加
D、降低反应所需的能量,使活化分子百分数增加
A
A
C
D
将一定浓度的盐酸倒入碳酸钙中,若作如下改变的情况,其中能使最初的化学反应速率增大的是 ( )
A、盐酸的浓度不变,而使盐酸的用量一倍
B、盐酸的浓度增大一倍,而使盐酸的用量减少到原来一半
C、盐酸的浓度和用量都不变,增加碳酸钙的量
D、盐酸和碳酸钙不变,增大压强一倍
E、加入CaCl2溶液
F、加入CaCl2固体
G、将CaCO3用CaCO3粉末代替
BG
有利的——越快越好!
有害的——越慢越好!
能否控制化学反应速率呢?
影响化学反应速率的因素
影响化学反应速率的条件
内因
外因
物质的结构性质
浓度、温度、压强、
催化剂、颗粒大小等
物质本身的结构和性质是化学反应
速率大小的决定因素
建模就是建立“模式”、“模型”,建模思想就是将复杂的化学问题精简掉非本质的东西,抽象出具体的“模型”去解决问题的思维方式,即将一些抽象化的问题具体化、形象化去解决相关问题。
采用科学的建模思想,转化为已有具体知识模型,借助想象和理解构建形象生动的模型、将一些问题公式化、具体化从而跨越认知障碍,便于理解和记忆。
建模
1、氯化钠溶于水
2、生物学中的孟德尔遗传定律
就是经典学科中数学建模的典范
3、物理建模——原子结构的认知
化学反应速率经典模型:
1、碰撞理论
2、过渡态理论
回忆:
⑴、化学反应的实质是:
旧的化学键断裂,新的化学键形成
⑵、化学反应发生的先决条件:
反应物分子相互接触和碰撞
注意:反应物分子之间的碰撞次数很大,但并不是每一次碰撞均可发生化学反应。
力量不够
取向不好
好球!有效投球
反应物分子要具有什么条件才能发生有效碰撞?
①、有足够的能量使旧键断裂
②、碰撞时要有合理的取向
在化学上,把能够发生化学反应的碰撞叫有效碰撞;
不能发生化学反应的碰撞叫无效碰撞;
碰撞理论
一、活化分子
1、 定义:
具有一定的能量,在碰撞过程中足以令旧化学键断裂,而发生反应(即发生“有效碰撞”)的分子称为活化分子。
单位体积内活化分子数越多,反应速率越快
活化分子数(n活)
反应物分子总数(n总)
==
活化分子百分数(活%)
2、活化分子百分数:
什么是活化能?
活化分子高出反应物分子平均能量的部分
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
讨论2H2+O2=2H2O
1.H2 与O2间分子要发生反应则分子间首先要_____
碰撞
2.是不是每一次碰撞都能发生化学反应呢?
3.能发生化学反应的碰撞称为有效碰撞
4.发生有效碰撞的条件是什么?
分子有足够的能量
合适的取向
5.具有足够高的能量,能发生有效碰撞的分子叫做活化分子
发生有效碰撞的分子一定是活化分子,
但活化分子的碰撞不一定是有效碰撞。
结论:
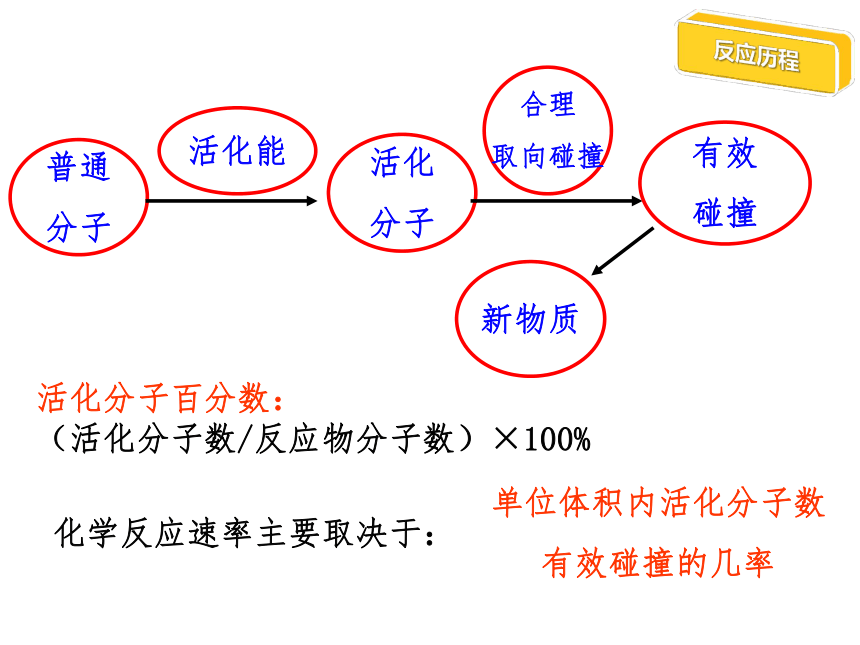
碰撞理论
活化分子百分数: (活化分子数/反应物分子数)×100%
化学反应速率主要取决于:
普通
分子
活化能
活化
分子
合理
取向碰撞
有效
碰撞
新物质
单位体积内活化分子数
有效碰撞的几率
四、外界条件对反应速率的影响
内因:反应物本身的性质
外因:浓度、温度、压强、催化剂
1、浓度对反应速率的影响
[实验2-2]
[现象]
KMnO4 + H2C2O4
结果:H2C2O4溶液浓度大,KMnO4先褪色
结论:在其他条件不变时,增大反应物浓度,可以增大反应速率
结果:H2C2O4溶液浓度大,KMnO4先褪色
2KMnO4 + 5H2C2O4 +3H2SO4=K2SO4 +2MnSO4 +10CO2↑+8H2O
影响因素:浓度
1、浓度
浓度
增大
→单位体积内n总↑
T不变,活%不变
n活↑
→有效碰撞↑
→V↑
在其他条件不变时,增大反应物浓度,可以增大反应速率 。
a、此规律只适用于气体或溶液的反应,对于固体 或液体的反应物,一般情况下其浓度是常数,因此改变它们的量一般不会改变化学反应速率。
c、随着化学反应的进行,反应物的浓度会逐渐减小,因此一般反应速率也会逐渐减小。
d、反应速率快慢与浓度有关,而与物质的总量无关
注意!
b、一般来说,固体反应物表面积越大,反应速率越大,固体反应物表面积越小,反应速率越小。
练1:
一定条件下,在CaCO3(块状)+2HCl=CaCl2+H2O+CO2 反应中,为了加快反应的速率,下列那些方法可行:
A、增加HCl的浓度 B、加水
C、增加同浓度盐酸的量 D、改加CaCO3粉末
练2:如反应:3KSCN+FeCl3 = Fe(SCN)3+3KCl
若在上述反应体系中加入KCl晶体,为什么不会影响化学反应速率?
因为反应实质为:Fe3++3SCN- = Fe(SCN)3
AD
在恒温、恒容的密闭容器中进行反应
A(g)=B(g)+C(g)。若反应物的浓度从3mol/L降至1.8mol/L需30s,那么反应物浓度由0.8mol/L降至0.2mol/L所需反应的时间为( )
A.15s B.大于15s
C.小于15s D.无法确定
B
υ=k[A]m[B]n
A(g) +B(g)=C (g)+D (g)
硫代硫酸钠(Na2S2O3)与稀硫酸发生如下反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O
下列四种情况中最早出现浑浊的是( )
A10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
B10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4 各5 mL,加水10mL
C 20℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
D20℃ 时0.2mol /L Na2S2O3和0.1 mol /L H2SO4各5 mL,加水10 mL
C
压强对反应速率的影响
练3:
若将物质的量相等的HI气体分别放在等容积的两个针桶中,一个保持体积不变,另一个压缩为原来的1/2。其它条件不变,则HI的分解反应速率谁快?
2、压强
压强增大
→ 体积减小
其他条件不变
→V↑
→C增大
压强对于反应速率的影响是通过对浓度的影响实现的
P增大→C成比例增大,P减小→C成比例减小(紧扣对C的影响)
发散思考:压强对于任意化学反应的速率都有影响吗?
此规律只适用于有气体参加的反应。
其他条件不变,增大压强,气体体积缩小,浓度增大,反应速率加快。
对于气体有下列几种情况:
前提 改变条件 压强变化 浓度变化 反应速率变化
恒温时
恒容时
恒容时
恒压时
增大压强
体积减少
C增大
V增大
充入气体
反应物
反应物
浓度增大
增大压强
V增大
充入
“无关气体”
增大压强
V不变
C不变
充入
“无关气体”
压强不变
C减小
V减小
练4、对于反应N2+O2=2NO在密闭容器中进行,下列条件哪些不能加快该反应的化学反应速率( )
A、缩小体积使压强增大
B、体积不变充入 N2 使压强增大
C、体积不变充入 O2使压强增大
D、使体积增大到原来的2倍
E、体积不变充入氦气使压强增大
压强对反应速率的影响
DE
结果:温度高的溶液先出现浑浊
一般说来,温度每升高10℃,速率增加2-4倍。
T↑
→普通分子变为活化分子
→活%↑
→ n活↑
→V↑
3、温度
其他条件不变,温度升高,反应速率加快
注意: 该规律适用于任何反应。
影响
外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数
升高温度
不变
增加
增加
加快
1、温度对反应速率的影响,无论是放热反应,还是吸热反应都适用。
3、温度对反应速率的影响,无论固体、液体、气体都适用。
2、对于可逆反应,升高体系的温度,正反应速率和逆反应的反应速率都增大,但增大程度不同。对吸热反应方向的速率影响比较大。
备注
你能举出生活中利用改变温度改变反应速率的例子吗
冰箱延长食物保鲜期
一般说来,温度每升高10℃,速率增加2-4倍。
练5、把除去氧化膜的 Mg 条,投入到盛有稀盐酸的试管中,发现 H2 的产生速率(v)与时间(t)的变化情况如右图所示,
t1 ~ t2 速率变化的主要原因是: _______ ;
t2 ~ t3 速率变化的主要原因是:_________。
v
t1 t2 t3 t
例2、对于反应M+N→P,如果温度每升高10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为 ( ) A.2min B.3min C.6min D.9min
温度控制
浓度控制
A
结论:加入催化剂可以加快反应的速率
4、催化剂对化学反应速率的影响
结论
催化剂能够改变化学反应速率
催化剂有正、负之分。
能加快化学反应速率的催化剂叫正催化剂
能减慢化学反应速率的催化剂叫负催化剂
4、催化剂对化学反应速率的影响
食用油脂里加入0.02%~0.04%没食子酸正丙酯,就可以有效地防止酸败
正催化剂能加快反应速率的原因。
它能够降低化学反应所需要的能量,使更多的反应物分子成为活化分子,增加了单位体积内活化分子的质量分数。
催化剂
反应所需能量降低
活化分子增多
反应速率加快
对于可逆反应,同一催化剂能同等程度的改变正逆反应速率。
正催化剂
→降低反应的活化能
→V↑
4、催化剂
→ n活↑
——改变反应的途径
→活%↑
n总不变
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
能量
能量
衣物上的油渍用普通洗衣粉很难洗去,但如果用加有酶
的洗衣粉,则较容易就能洗去。为什么?
注意:
使用催化剂同等程度的增大(减慢)、正逆反应速率,从而改变反应到达平衡所需时间。
没特别指明一般指正催化剂
催化剂只能催化可能发生的反应,对不发生的反应无作用
催化剂具有一定的选择性
小结:影响化学反应速率的外因
影响
外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大反应物浓度
增大压强
升高温度
使用催化剂
增加
增加
不变
增加
加快
不变
不变
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
其他如光照、反应物固体的颗粒大小、电磁波、超声波、溶剂的性质等,也会对化学反应的速率产生影响。
各条件对速率的影响大小是:
催化剂 >>温度>浓度=压强(体积变化引起的)。
各种影响都有其局限性,要针对具体反应
具体分析。
总结:
增大反应物的浓度使反应速率加快的主要原因( )
对于气体参与体系增大压强使反应速率加快的主要原因是( )
升高温度使反应速率加快的主要原因是( )
使用催化剂使反应速率加快的主要原因是( )
A、活化分子百分数不变,但提高单位体积内活化分子的总数
B、 增大分子的运动速率而使有效碰撞增加
C、 升高反应物分子的能量,使活化分子的百分数增加
D、降低反应所需的能量,使活化分子百分数增加
A
A
C
D
将一定浓度的盐酸倒入碳酸钙中,若作如下改变的情况,其中能使最初的化学反应速率增大的是 ( )
A、盐酸的浓度不变,而使盐酸的用量一倍
B、盐酸的浓度增大一倍,而使盐酸的用量减少到原来一半
C、盐酸的浓度和用量都不变,增加碳酸钙的量
D、盐酸和碳酸钙不变,增大压强一倍
E、加入CaCl2溶液
F、加入CaCl2固体
G、将CaCO3用CaCO3粉末代替
BG
