人教版必修二高中化学第三节-化学反应的速率和限度(45张PPT)
文档属性
| 名称 | 人教版必修二高中化学第三节-化学反应的速率和限度(45张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-24 18:36:24 | ||
图片预览











文档简介
(共45张PPT)
第三节
化学反应的
速率和限度
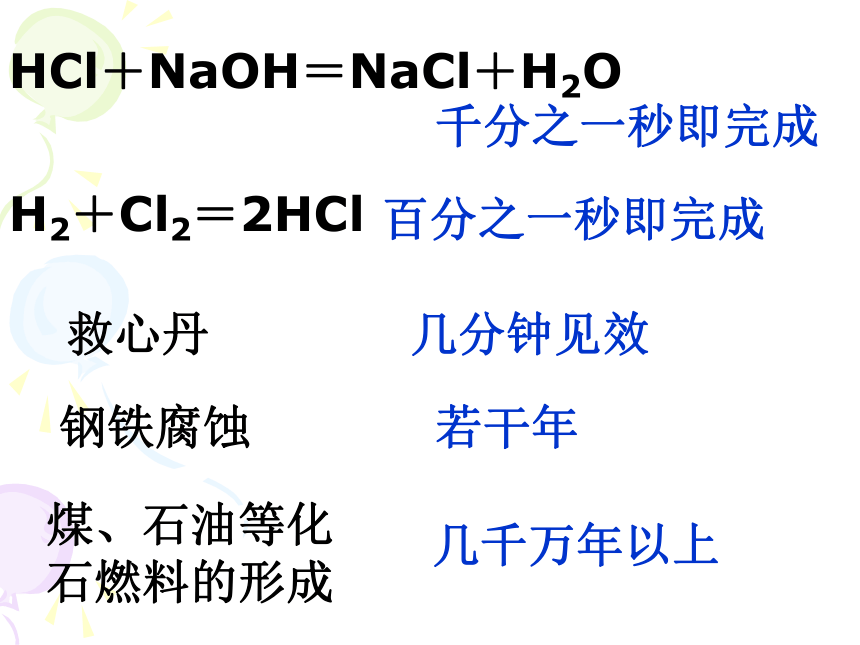
化学反应有快有慢:
HCl+NaOH=NaCl+H2O
千分之一秒即完成
H2+Cl2=2HCl
百分之一秒即完成
救心丹
几分钟见效
钢铁腐蚀
若干年
煤、石油等化石燃料的形成
几千万年以上
定义:
化学反应速率用单位时间(如每秒,每分,每小时)内反应物浓度的减小或生成物浓度的增大来表示。
计算式:
一、化学反应速率
(物质的量浓度)
练习巩固
在
N2
+
3H2
2
NH3反应中,自开始至2秒,氨的浓度由0变为0.
6
mol/L,则以氨气表示的化学反应速率是多少?
=
0.3mol/(L·s)
v
(NH3)
=
△c
(NH3)
△t
=
(0.
6
–
0
)mol/L
2s
例题:反应4NH3+5O2
4NO+6H2O
在5升的密闭容器中进行,30秒后,NO
的物质的量增加了0.3mol,此反应的平均反应速率用NO来表示为多少?
问题1:若用O2的浓度变化来表示此反应速率是多少?
若用NH3
来表示呢?
问题2:此反应化学反应速率用不同物质表示为什么数值不同?数值上有何规律?
v(NO)=0.002mol/L·s
v(O2)=0.0025mol/L·s
v(NH3)=0.002mol/L·s
化学反应速率的特点—
①同一反应,可用不同物质在单位时间
内浓度的变化来表示,但必须指明是
用哪种反应物或哪种生成物来表示。
②用不同物质在单位时间内浓度变化表
示时,速率比等于方程式中的系数比
③均取正值,且是某一段时间内的平均
速率。
练习
向一个容积为1L的密闭容器中放入2moLSO2和1moLO2,在一定条件下反应,2S末,测得容器内有0.8moLSO2,求2S内SO2,O2,SO3的反应速率和反应速率比.
练习2
在一定条件下,mA+nB=pC的反应中,各物质的化学反应速率为V(A)=amol·L-1·s-1,
V(B)=a/2mol·L-1·s-1,
V(C)=amol·L-1·s-1,
则该反应的化学方程式是
。
2A+B=2C
练习
则该反应速率的快慢顺序为:
反应
A
+
3B
=
2C
+
2D
在四种不同条件下的反应速率为:
(1)ν(A)=0.3mol/(L·s
)
(2)
ν(B)=0.6mol/(L·s)
(3)
ν(C)=0.4mol/(L·s)
(4)
ν(D)=0.45mol/(L·s)
(1)>(4)>(2)=(3)
反思:比较反应的快慢,应取同一参照物
在相同条件下,等质量(金属颗粒大小相
同)的下列金属与足量1mol/L
盐酸反应时,
速率最快的是
A
镁
B
铝
C
钠
D
铁
二、影响化学反应速率的因素
§化学反应速率是由反应物的性质决定的;
内因是主要因素
外因因素:
实验2-5
现象
结论
热水中
常温
冷水中
产生气泡速率增大,
带火星火柴
复燃
升高温度,
反应速率增大
有气泡冒出
产生气泡速率减小
降低温度,
反应速率减小
2H2O2
=
2H2O
+O2
规律:当其它条件不变时,升高温度,化学反应速率增大。降低温度,化学反应速率减小。
实验测得,温度每升高10度,化学反应速率通常增大原来的2~4倍。
注意:温度对反应速率的影响不受反应物状态的限制。
(1)温度对化学反应速率的影响
实验2-6
现象
结论
加入MnO2
加入FeCl3
不加其他试剂
气泡冒出速率增大
气泡冒出速率增大
有气泡冒出,较慢
MnO2能加快
反应速率
FeCl3能加快
反应速率
无催化剂
反应较慢
外因因素:
规律:催化剂能改变化学反应的速率。
有的催化剂能加快化学反应的速率,叫正催化剂;有的催化剂能减慢化学反应速率,叫负催化剂。在实践中,如没有特殊说明,凡说催化剂都是指正催化剂。
催化剂中毒:催化剂的催化性能往往因接触少量的杂质而明显下降甚至遭破坏,这种现象叫催化剂中毒。
催化剂只有在一定的温度下才能最大限度的显示其催化作用,不同的催化剂对温度的要求不一样。
(2)催化剂对化学反应速率的影响
规律:当其它条件不变时,增大反应物的浓度,化学反应速率增大。减小反应物的浓度,化学反应速率减慢。
(3)浓度对化学反应速率的影响
规律:当其它条件不变时,增大固体反应物的表面积,化学反应速率增大。减小固体反应物的表面积,化学反应速率减慢。
(4)固体反应物的表面积对化学反应速率的
影响
(5)其他条件对化学反应速率的影响
练习:
1、在2L的密闭容器中,发生下列反应:
3A(g)+
B(g)=2C(g)+D(g)。若最初加入的A
和B
都是4mol,在前10s
A
的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量为
。
3.2mol
某温度时在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析:
1、反应开始2min内的X、Y、Z的化学反应速率
2、该反应的化学方程式为:___________。
把镁条投入到盛有盐酸的敞口容器中,产
生氢气的速率变化如图,分析其原因:
为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制如图曲线。请分析讨论以下问题。
(1)在0~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的是__________时间段,收集到气体最多的是_________时间段。
(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
(3)在t4后,为什么收集到的气体的体积不再增加?
⑵开始时C(H+)大,该反应的反应速率大;
t1—t2由于反应放热温度升高,所以速率迅速增大;最后是因为C(H+)减小了,反应速率减慢.
练习:在25℃时,向100mL含HCl
14.6g的盐酸中,放入5.6g铁粉,反应进行到2s时收集到氢气1.12L(标况),之后反应又进行了4s,铁粉全溶解。若不考虑体积变化,则:
(1)前2s内用FeCl2表示的平均反应速率为
;
(2)后4s内用HCl表示的平均反应速率为
;
(3)前2s与后4s比较,反应速率
较快,其原因可能
。
0.25mol/L·s
0.25mol/L·s
前2s
前2s时段盐酸浓度比后4s时段大
第三节
化学反应的
速率和限度
我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
§
氯水是氯气的水溶液,氯气能与水反应,而且这是一个可逆反应。请大家回忆氯水中含有哪些微粒。
氯水的成份:
分子:Cl2
、HClO
、H2O
离子:H+
、
Cl-
、ClO-
等
Cl2
能
与H2O发生可逆反应:
Cl2
+
H2O
HClO
+
HCl
H2
+
I2
2HI
正反应
逆反应
什么叫做可逆反应?
在同一条件下,既向正反应方向进行,
同时又向逆反应方向进行的反应.
典型的可逆反应有:
N2+3H2
2NH3
催化剂
高温高压
2SO2+O2
2SO3
催化剂
高温
SO2
+H2O
H2SO3
NH3
+H2O
NH3
·H2O
启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
N2
+
H2
NH3
在一固定容积的密闭容器里,加1molN2和
3mol
H2
(合适催化剂),能发生什么反应?
(1)开始时c(N2)
、c(H2)大,
c(NH3)
=0
开始阶段有什么特征?
只有正反应,v(逆)=0
催化剂
N2
+
3
H2
2NH3
高温
N2
+
H2
NH3
(2)瞬间后c(N2)
、c(H2
)变小
,
c(NH3)≠0
瞬间过后有什么特征?
正逆反应都进行,v(逆)
≠0,v(正)>
v(逆)
(3)c(N2)
、c(H2)逐渐变小,c(NH3)逐渐增大,
三种物质的浓度达到一个特定值。
一定时间段内有什么特征?
v(正)=
v(逆)
≠0
N2
+
H2
NH3
由于v(正)=
v(逆)
≠0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化.
从外表上看,反应好象“停止”。
可逆反应的这种特殊状态就是我们今天要研究的化学平衡状态。
反应速率
v(正)
v(逆)
t1
时间(t)
0
(1)0~t1:v(正)>v(逆)
(2)t1:
v(正)=v(逆)
平衡状态
N2+3H2
2NH3
催化剂
高温高压
交流与讨论
1、定义
在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
前提(适用范围):可逆反应
内在本质:v(正)=
v(逆)
≠0
外在标志:反应混合物中各组分
的浓度保持不变
二、化学平衡状态
2、化学平衡状态的特征
(3)动:动态平衡(v(正)=
v(逆)
≠0)
(2)等:v(正)=
v(逆)
(4)定:反应混合物中各组分的浓度保持 定,各组分的含量保持不变。
(5)变:条件改变,原平衡被破坏,在新
的条件下建立新的平衡。
(1)逆
此条件下进行到什么时候达到了这个反应的限度?
此时的反应是否停止了?
此时为何3种物质的浓度保持不变?
某温度和压强下的密闭容器中,2SO2+O2
2SO3
△
催化剂
时间
(min)
物质的量
浓度(mol/L)
0
10
20
30
40
50
60
70
SO2
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
O2
0.5
0.35
0.25
0.18
0.1
0.05
0.05
0.05
SO3
0
0.3
0.5
0.65
0.8
0.9
0.9
0.9
练习
可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等
D
对于可逆反应M+N
Q达到平衡状态时,
下列说法正确的是(
)
A.
M、N、Q三种物质的浓度一定相等
B.
M、N全部变成了Q
C.
M、N、Q的浓度都保持不变
D.
反应已经停止
C
下列说法可以证明反应N2+3H2
2NH3
已达平衡状态的是
(
)
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成
A、C
随堂练习
在一定温度下,可逆反应A(g)+3B(g)
2C(g)
达到平衡的标志是( )
A. A的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2
C
14CO2
+
C
CO,达到化学平衡后,
平衡混合物中含14C的粒子有
。
14CO2、14C、14CO
3、化学平衡状态的判定
对于可逆反应m
A(g)
n
B(g)
+
p
C(g)
在一定条件下达到平衡状态有以下几个标志
(1)A的生成速率和分解速率相等
(2)单位时间生成n
mol
B和p
mol
C的同时,生成m
mol
A
(3)A、B、C的物质的量不再改变
(4)A、B、C的浓度不再改变
(5)A、B、C的百分含量不再改变
练习:
在密闭容器中充入4mol
HI,在一定温度下,反应
2HI
(g)
H2
(g)+I2
(g)
达到平衡时,有30%的HI分解,则
平衡时混合气体中氢气的物质的量为多少,
混合气体总物质的量为多少?
化学平衡计算的一般步骤:
“三步曲”
1.写出有关平衡的化学方程式
2.找出各物质的
起始量
转化量
平衡量
3
根据已知条件列式
反应物的转化率
在合成氨工业中,由a
mol氮气,
b
mol氢气混合反应达到平衡,有
c
mol
氨气生成,则氨气在反应混合物中所占的体积分数为
c
/
(a+b-c)
×
100%
定义:可逆反应中,旧化学平衡的破坏,新化学平衡建立过程叫做化学平衡的移动。
V正≠V逆
V正=V逆≠0
条件改变
平衡1
不平衡
平衡2
建立新平衡
破坏旧平衡
V正=V逆≠0
一定时间
§
影响化学平衡的条件
一、化学平衡的移动
V正
>
V逆
平衡向正反应方向移动
V正
=
V逆
平衡不移动
V正
<
V逆
平衡向逆反应方向移动
探究实验1
FeCl3
+
3
KSCN
Fe(SCN)3
+
3KCl
(黄色)
(无色)
(红色)
(无色)
现象:
向第一支试管里加入几滴
FeCl3
溶液,颜色加深。
向第二支试管里加入几滴
KSCN
溶液,颜色加深。
1、浓度对化学平衡的影响
1、浓度对化学平衡的影响
分析
t1
t2
t3
应用
增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动;
结论
在生产上,往往采用增大容易取得的或成本较低的反应物浓度的方法,使成本较高的原料得到充分利用。
2SO2
+
O2
2SO3
增大反应物的浓度对化学平衡的影响
【思考练习】
1、
Fe(NO3)2溶液呈浅绿色,其中存在着下列平衡:Fe2++2H2O
Fe(OH)2+2H+
往该溶液中滴加盐酸,发生的变化(
)
(A)
平衡向逆反应方向移动
(B)
平衡向正反应方向移动
(C)
溶液由浅绿色变成黄色
(D)
Fe2+物质的量增大
A
D
2、温度对化学平衡的影响
例如:2NO2
4N2O2
+Q
为放热反应
红棕色
无色
结论:其它条件不变的情况下,温度升高,平衡向吸热反应方向移动;温度降低,平衡向放热反应方向移动。
催化剂对化学平衡无影响
催化剂同等程度的加快或减慢正、逆反应速率(V正=V逆);对化学平衡无影响。
t时间
(b)
V速率
V正
V逆
0
V逆
V正
′
′
催化剂能缩短平衡到达的时间
合成氨反应3H2+N2
2NH3(放热反应),原平衡体系的温度为50℃,现将体系置于100℃的环境中,
问:(1)平衡向何方向移动?
(2)达平衡后体系温度为多少?
第三节
化学反应的
速率和限度
化学反应有快有慢:
HCl+NaOH=NaCl+H2O
千分之一秒即完成
H2+Cl2=2HCl
百分之一秒即完成
救心丹
几分钟见效
钢铁腐蚀
若干年
煤、石油等化石燃料的形成
几千万年以上
定义:
化学反应速率用单位时间(如每秒,每分,每小时)内反应物浓度的减小或生成物浓度的增大来表示。
计算式:
一、化学反应速率
(物质的量浓度)
练习巩固
在
N2
+
3H2
2
NH3反应中,自开始至2秒,氨的浓度由0变为0.
6
mol/L,则以氨气表示的化学反应速率是多少?
=
0.3mol/(L·s)
v
(NH3)
=
△c
(NH3)
△t
=
(0.
6
–
0
)mol/L
2s
例题:反应4NH3+5O2
4NO+6H2O
在5升的密闭容器中进行,30秒后,NO
的物质的量增加了0.3mol,此反应的平均反应速率用NO来表示为多少?
问题1:若用O2的浓度变化来表示此反应速率是多少?
若用NH3
来表示呢?
问题2:此反应化学反应速率用不同物质表示为什么数值不同?数值上有何规律?
v(NO)=0.002mol/L·s
v(O2)=0.0025mol/L·s
v(NH3)=0.002mol/L·s
化学反应速率的特点—
①同一反应,可用不同物质在单位时间
内浓度的变化来表示,但必须指明是
用哪种反应物或哪种生成物来表示。
②用不同物质在单位时间内浓度变化表
示时,速率比等于方程式中的系数比
③均取正值,且是某一段时间内的平均
速率。
练习
向一个容积为1L的密闭容器中放入2moLSO2和1moLO2,在一定条件下反应,2S末,测得容器内有0.8moLSO2,求2S内SO2,O2,SO3的反应速率和反应速率比.
练习2
在一定条件下,mA+nB=pC的反应中,各物质的化学反应速率为V(A)=amol·L-1·s-1,
V(B)=a/2mol·L-1·s-1,
V(C)=amol·L-1·s-1,
则该反应的化学方程式是
。
2A+B=2C
练习
则该反应速率的快慢顺序为:
反应
A
+
3B
=
2C
+
2D
在四种不同条件下的反应速率为:
(1)ν(A)=0.3mol/(L·s
)
(2)
ν(B)=0.6mol/(L·s)
(3)
ν(C)=0.4mol/(L·s)
(4)
ν(D)=0.45mol/(L·s)
(1)>(4)>(2)=(3)
反思:比较反应的快慢,应取同一参照物
在相同条件下,等质量(金属颗粒大小相
同)的下列金属与足量1mol/L
盐酸反应时,
速率最快的是
A
镁
B
铝
C
钠
D
铁
二、影响化学反应速率的因素
§化学反应速率是由反应物的性质决定的;
内因是主要因素
外因因素:
实验2-5
现象
结论
热水中
常温
冷水中
产生气泡速率增大,
带火星火柴
复燃
升高温度,
反应速率增大
有气泡冒出
产生气泡速率减小
降低温度,
反应速率减小
2H2O2
=
2H2O
+O2
规律:当其它条件不变时,升高温度,化学反应速率增大。降低温度,化学反应速率减小。
实验测得,温度每升高10度,化学反应速率通常增大原来的2~4倍。
注意:温度对反应速率的影响不受反应物状态的限制。
(1)温度对化学反应速率的影响
实验2-6
现象
结论
加入MnO2
加入FeCl3
不加其他试剂
气泡冒出速率增大
气泡冒出速率增大
有气泡冒出,较慢
MnO2能加快
反应速率
FeCl3能加快
反应速率
无催化剂
反应较慢
外因因素:
规律:催化剂能改变化学反应的速率。
有的催化剂能加快化学反应的速率,叫正催化剂;有的催化剂能减慢化学反应速率,叫负催化剂。在实践中,如没有特殊说明,凡说催化剂都是指正催化剂。
催化剂中毒:催化剂的催化性能往往因接触少量的杂质而明显下降甚至遭破坏,这种现象叫催化剂中毒。
催化剂只有在一定的温度下才能最大限度的显示其催化作用,不同的催化剂对温度的要求不一样。
(2)催化剂对化学反应速率的影响
规律:当其它条件不变时,增大反应物的浓度,化学反应速率增大。减小反应物的浓度,化学反应速率减慢。
(3)浓度对化学反应速率的影响
规律:当其它条件不变时,增大固体反应物的表面积,化学反应速率增大。减小固体反应物的表面积,化学反应速率减慢。
(4)固体反应物的表面积对化学反应速率的
影响
(5)其他条件对化学反应速率的影响
练习:
1、在2L的密闭容器中,发生下列反应:
3A(g)+
B(g)=2C(g)+D(g)。若最初加入的A
和B
都是4mol,在前10s
A
的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量为
。
3.2mol
某温度时在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析:
1、反应开始2min内的X、Y、Z的化学反应速率
2、该反应的化学方程式为:___________。
把镁条投入到盛有盐酸的敞口容器中,产
生氢气的速率变化如图,分析其原因:
为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制如图曲线。请分析讨论以下问题。
(1)在0~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的是__________时间段,收集到气体最多的是_________时间段。
(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
(3)在t4后,为什么收集到的气体的体积不再增加?
⑵开始时C(H+)大,该反应的反应速率大;
t1—t2由于反应放热温度升高,所以速率迅速增大;最后是因为C(H+)减小了,反应速率减慢.
练习:在25℃时,向100mL含HCl
14.6g的盐酸中,放入5.6g铁粉,反应进行到2s时收集到氢气1.12L(标况),之后反应又进行了4s,铁粉全溶解。若不考虑体积变化,则:
(1)前2s内用FeCl2表示的平均反应速率为
;
(2)后4s内用HCl表示的平均反应速率为
;
(3)前2s与后4s比较,反应速率
较快,其原因可能
。
0.25mol/L·s
0.25mol/L·s
前2s
前2s时段盐酸浓度比后4s时段大
第三节
化学反应的
速率和限度
我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
§
氯水是氯气的水溶液,氯气能与水反应,而且这是一个可逆反应。请大家回忆氯水中含有哪些微粒。
氯水的成份:
分子:Cl2
、HClO
、H2O
离子:H+
、
Cl-
、ClO-
等
Cl2
能
与H2O发生可逆反应:
Cl2
+
H2O
HClO
+
HCl
H2
+
I2
2HI
正反应
逆反应
什么叫做可逆反应?
在同一条件下,既向正反应方向进行,
同时又向逆反应方向进行的反应.
典型的可逆反应有:
N2+3H2
2NH3
催化剂
高温高压
2SO2+O2
2SO3
催化剂
高温
SO2
+H2O
H2SO3
NH3
+H2O
NH3
·H2O
启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
N2
+
H2
NH3
在一固定容积的密闭容器里,加1molN2和
3mol
H2
(合适催化剂),能发生什么反应?
(1)开始时c(N2)
、c(H2)大,
c(NH3)
=0
开始阶段有什么特征?
只有正反应,v(逆)=0
催化剂
N2
+
3
H2
2NH3
高温
N2
+
H2
NH3
(2)瞬间后c(N2)
、c(H2
)变小
,
c(NH3)≠0
瞬间过后有什么特征?
正逆反应都进行,v(逆)
≠0,v(正)>
v(逆)
(3)c(N2)
、c(H2)逐渐变小,c(NH3)逐渐增大,
三种物质的浓度达到一个特定值。
一定时间段内有什么特征?
v(正)=
v(逆)
≠0
N2
+
H2
NH3
由于v(正)=
v(逆)
≠0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化.
从外表上看,反应好象“停止”。
可逆反应的这种特殊状态就是我们今天要研究的化学平衡状态。
反应速率
v(正)
v(逆)
t1
时间(t)
0
(1)0~t1:v(正)>v(逆)
(2)t1:
v(正)=v(逆)
平衡状态
N2+3H2
2NH3
催化剂
高温高压
交流与讨论
1、定义
在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
前提(适用范围):可逆反应
内在本质:v(正)=
v(逆)
≠0
外在标志:反应混合物中各组分
的浓度保持不变
二、化学平衡状态
2、化学平衡状态的特征
(3)动:动态平衡(v(正)=
v(逆)
≠0)
(2)等:v(正)=
v(逆)
(4)定:反应混合物中各组分的浓度保持 定,各组分的含量保持不变。
(5)变:条件改变,原平衡被破坏,在新
的条件下建立新的平衡。
(1)逆
此条件下进行到什么时候达到了这个反应的限度?
此时的反应是否停止了?
此时为何3种物质的浓度保持不变?
某温度和压强下的密闭容器中,2SO2+O2
2SO3
△
催化剂
时间
(min)
物质的量
浓度(mol/L)
0
10
20
30
40
50
60
70
SO2
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
O2
0.5
0.35
0.25
0.18
0.1
0.05
0.05
0.05
SO3
0
0.3
0.5
0.65
0.8
0.9
0.9
0.9
练习
可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等
D
对于可逆反应M+N
Q达到平衡状态时,
下列说法正确的是(
)
A.
M、N、Q三种物质的浓度一定相等
B.
M、N全部变成了Q
C.
M、N、Q的浓度都保持不变
D.
反应已经停止
C
下列说法可以证明反应N2+3H2
2NH3
已达平衡状态的是
(
)
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成
A、C
随堂练习
在一定温度下,可逆反应A(g)+3B(g)
2C(g)
达到平衡的标志是( )
A. A的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2
C
14CO2
+
C
CO,达到化学平衡后,
平衡混合物中含14C的粒子有
。
14CO2、14C、14CO
3、化学平衡状态的判定
对于可逆反应m
A(g)
n
B(g)
+
p
C(g)
在一定条件下达到平衡状态有以下几个标志
(1)A的生成速率和分解速率相等
(2)单位时间生成n
mol
B和p
mol
C的同时,生成m
mol
A
(3)A、B、C的物质的量不再改变
(4)A、B、C的浓度不再改变
(5)A、B、C的百分含量不再改变
练习:
在密闭容器中充入4mol
HI,在一定温度下,反应
2HI
(g)
H2
(g)+I2
(g)
达到平衡时,有30%的HI分解,则
平衡时混合气体中氢气的物质的量为多少,
混合气体总物质的量为多少?
化学平衡计算的一般步骤:
“三步曲”
1.写出有关平衡的化学方程式
2.找出各物质的
起始量
转化量
平衡量
3
根据已知条件列式
反应物的转化率
在合成氨工业中,由a
mol氮气,
b
mol氢气混合反应达到平衡,有
c
mol
氨气生成,则氨气在反应混合物中所占的体积分数为
c
/
(a+b-c)
×
100%
定义:可逆反应中,旧化学平衡的破坏,新化学平衡建立过程叫做化学平衡的移动。
V正≠V逆
V正=V逆≠0
条件改变
平衡1
不平衡
平衡2
建立新平衡
破坏旧平衡
V正=V逆≠0
一定时间
§
影响化学平衡的条件
一、化学平衡的移动
V正
>
V逆
平衡向正反应方向移动
V正
=
V逆
平衡不移动
V正
<
V逆
平衡向逆反应方向移动
探究实验1
FeCl3
+
3
KSCN
Fe(SCN)3
+
3KCl
(黄色)
(无色)
(红色)
(无色)
现象:
向第一支试管里加入几滴
FeCl3
溶液,颜色加深。
向第二支试管里加入几滴
KSCN
溶液,颜色加深。
1、浓度对化学平衡的影响
1、浓度对化学平衡的影响
分析
t1
t2
t3
应用
增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动;
结论
在生产上,往往采用增大容易取得的或成本较低的反应物浓度的方法,使成本较高的原料得到充分利用。
2SO2
+
O2
2SO3
增大反应物的浓度对化学平衡的影响
【思考练习】
1、
Fe(NO3)2溶液呈浅绿色,其中存在着下列平衡:Fe2++2H2O
Fe(OH)2+2H+
往该溶液中滴加盐酸,发生的变化(
)
(A)
平衡向逆反应方向移动
(B)
平衡向正反应方向移动
(C)
溶液由浅绿色变成黄色
(D)
Fe2+物质的量增大
A
D
2、温度对化学平衡的影响
例如:2NO2
4N2O2
+Q
为放热反应
红棕色
无色
结论:其它条件不变的情况下,温度升高,平衡向吸热反应方向移动;温度降低,平衡向放热反应方向移动。
催化剂对化学平衡无影响
催化剂同等程度的加快或减慢正、逆反应速率(V正=V逆);对化学平衡无影响。
t时间
(b)
V速率
V正
V逆
0
V逆
V正
′
′
催化剂能缩短平衡到达的时间
合成氨反应3H2+N2
2NH3(放热反应),原平衡体系的温度为50℃,现将体系置于100℃的环境中,
问:(1)平衡向何方向移动?
(2)达平衡后体系温度为多少?
