京改版化学九年级下册10.2-金属的化学性质(共21张PPT)
文档属性
| 名称 | 京改版化学九年级下册10.2-金属的化学性质(共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 619.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-24 18:38:43 | ||
图片预览








文档简介
(共21张PPT)
金属的化学性质
一、金属与氧气的反应
回顾与讨论:
请同学们回忆在氧气的化学性质中,我们研究了哪几种金属和氧气的反应?你还能回忆起这些反应的现象吗?
铁丝、镁带和氧气的反应
3Fe
+
2O2
Fe3O4
2Mg
+
O2
2MgO
点燃
点燃
1、铝在常温下能与氧气反应
4Al
+
3O2
=
2Al2O3
2、铜在高温时能与氧气反应
2Cu
+
O2
=
2CuO
实验表明:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同。
镁、铝在常温下就能与氧气反应。
铁、铜在常温下不能与氧气反应,
但在高温时能与氧气反应。
金即使在高温时不能与氧气反应。
活动性:镁、铝
>
铁、铜
>
金
镁、锌、铁、铜与盐酸反应比较
二、金属与酸的反应
金属与盐酸反应的比较
金属活动性由强减弱
(Mg
Zn
Fe)
(
H
)
Cu
通过上述探究你能比较出镁、锌、铁、铜的金属活动性强弱吗?
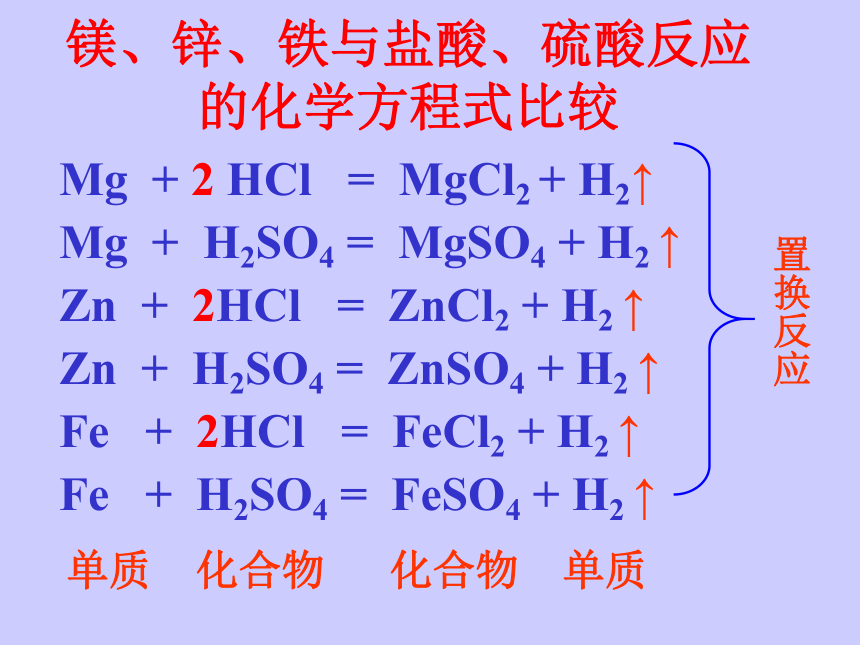
镁、锌、铁与盐酸、硫酸反应的化学方程式比较
Mg
+
2
HCl
=
MgCl2
+
H2↑
Mg
+
H2SO4
=
MgSO4
+
H2
↑
Zn
+
2HCl
=
ZnCl2
+
H2
↑
Zn
+
H2SO4
=
ZnSO4
+
H2
↑
Fe
+
2HCl
=
FeCl2
+
H2
↑
Fe
+
H2SO4
=
FeSO4
+
H2
↑
置换反应
单质
化合物
化合物
单质
请归纳已学过的化学反应基本类型。
化合反应:A
+
B
+
…
→
AB…
分解反应:AB…
→A
+
B
+
…
置换反应:A
+BC
→AC
+
B
复分解反应:AB
+
CD
→
AD
+
CB
三、金属与金属化合物溶液的反应
实验探究:
1.把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过一会取出,观察,有什么现象?
2.把一根洁净的铜丝浸入硝酸银溶液中,过一会取出,观察,有什么现象发生?
3.把另一根洁净的铜丝浸入硫酸铝溶液中,过一会取出,观察,有什么现象发生?
铝丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
Al
+
CuSO4
=
Al2(SO4)3
+
Cu
Cu
+
AgNO3
=Cu(NO3)2
+
Ag
2、铜丝浸入硝酸银溶液中
2
3
3
2
2
3、铜丝浸入硫酸铝溶液中不反应
1、铝丝浸入硫酸铜溶液中
交流与讨论
?
通过上述探究,你能得出铝、铜、银的金属活动性顺序吗?
Al
Cu
Ag
金属活动性由强减弱
金属活动性顺序:
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
?
?
金属活动性由强逐渐减弱
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢
3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
这是重点吆!
1.实验室的废酸液不能直接倒入下水道,是因为
;工人师傅在切割钢板时,常用硫酸铜溶液画线是因为
。
2.小兰家中收藏一件清末的铝制佛像,该佛像至今保存十分完好。其主要原因是(
)
A.铝不易发生化学反应
B.铝的氧化物容易发生还原反应
C.铝不易被氧化
D.铝易氧化,但氧化铝具有保护内部铝的作用
中考题演练:
D
3、出土的古文物中,金器保存完好,铜器表面有锈迹,而铁器锈迹斑斑。这表明金、铜、铁的金属活动性从强到弱的顺序是(
)
A、金
铜
铁
B、铁
金
铜
C、铁
铜
金
D、铜
金
铁
4、X、Y两种金属都能与硝酸银溶液反应,置换出银;X跟稀硫酸不反应,Y跟稀硫酸起反应生成氢气,由此判断X、Y两金属可能依次是(
)
A、Cu
Zn
B、Fe
Zn
C、Cu
Hg
D、Fe
Hg
C
A
5、出土的古文物中,金器保存完好,铜器表面有锈迹,而铁器锈迹斑斑。这表明金、铜、铁的金属活动性从强到弱的顺序是(
)
A、金
铜
铁
B、铁
金
铜
C、铁
铜
金
D、铜
金
铁
C
6.填写下列表格(括号内为杂质)
混合物
除去杂质的化学方程式
主要操作步骤
铜粉(Fe)
FeCl2溶液(CuCl2)
Fe+2HCl=FeCl2+H2↑
Fe+CuSO4=FeSO4+Cu
溶解、过滤、洗涤
溶解、过滤
7、计算:
把镁和铜的混合物20g和足量稀硫酸反应,生成氢气0.4g,求原混合物中铜的质量。
再见!
金属的化学性质
一、金属与氧气的反应
回顾与讨论:
请同学们回忆在氧气的化学性质中,我们研究了哪几种金属和氧气的反应?你还能回忆起这些反应的现象吗?
铁丝、镁带和氧气的反应
3Fe
+
2O2
Fe3O4
2Mg
+
O2
2MgO
点燃
点燃
1、铝在常温下能与氧气反应
4Al
+
3O2
=
2Al2O3
2、铜在高温时能与氧气反应
2Cu
+
O2
=
2CuO
实验表明:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同。
镁、铝在常温下就能与氧气反应。
铁、铜在常温下不能与氧气反应,
但在高温时能与氧气反应。
金即使在高温时不能与氧气反应。
活动性:镁、铝
>
铁、铜
>
金
镁、锌、铁、铜与盐酸反应比较
二、金属与酸的反应
金属与盐酸反应的比较
金属活动性由强减弱
(Mg
Zn
Fe)
(
H
)
Cu
通过上述探究你能比较出镁、锌、铁、铜的金属活动性强弱吗?
镁、锌、铁与盐酸、硫酸反应的化学方程式比较
Mg
+
2
HCl
=
MgCl2
+
H2↑
Mg
+
H2SO4
=
MgSO4
+
H2
↑
Zn
+
2HCl
=
ZnCl2
+
H2
↑
Zn
+
H2SO4
=
ZnSO4
+
H2
↑
Fe
+
2HCl
=
FeCl2
+
H2
↑
Fe
+
H2SO4
=
FeSO4
+
H2
↑
置换反应
单质
化合物
化合物
单质
请归纳已学过的化学反应基本类型。
化合反应:A
+
B
+
…
→
AB…
分解反应:AB…
→A
+
B
+
…
置换反应:A
+BC
→AC
+
B
复分解反应:AB
+
CD
→
AD
+
CB
三、金属与金属化合物溶液的反应
实验探究:
1.把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过一会取出,观察,有什么现象?
2.把一根洁净的铜丝浸入硝酸银溶液中,过一会取出,观察,有什么现象发生?
3.把另一根洁净的铜丝浸入硫酸铝溶液中,过一会取出,观察,有什么现象发生?
铝丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
Al
+
CuSO4
=
Al2(SO4)3
+
Cu
Cu
+
AgNO3
=Cu(NO3)2
+
Ag
2、铜丝浸入硝酸银溶液中
2
3
3
2
2
3、铜丝浸入硫酸铝溶液中不反应
1、铝丝浸入硫酸铜溶液中
交流与讨论
?
通过上述探究,你能得出铝、铜、银的金属活动性顺序吗?
Al
Cu
Ag
金属活动性由强减弱
金属活动性顺序:
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
?
?
金属活动性由强逐渐减弱
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢
3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
这是重点吆!
1.实验室的废酸液不能直接倒入下水道,是因为
;工人师傅在切割钢板时,常用硫酸铜溶液画线是因为
。
2.小兰家中收藏一件清末的铝制佛像,该佛像至今保存十分完好。其主要原因是(
)
A.铝不易发生化学反应
B.铝的氧化物容易发生还原反应
C.铝不易被氧化
D.铝易氧化,但氧化铝具有保护内部铝的作用
中考题演练:
D
3、出土的古文物中,金器保存完好,铜器表面有锈迹,而铁器锈迹斑斑。这表明金、铜、铁的金属活动性从强到弱的顺序是(
)
A、金
铜
铁
B、铁
金
铜
C、铁
铜
金
D、铜
金
铁
4、X、Y两种金属都能与硝酸银溶液反应,置换出银;X跟稀硫酸不反应,Y跟稀硫酸起反应生成氢气,由此判断X、Y两金属可能依次是(
)
A、Cu
Zn
B、Fe
Zn
C、Cu
Hg
D、Fe
Hg
C
A
5、出土的古文物中,金器保存完好,铜器表面有锈迹,而铁器锈迹斑斑。这表明金、铜、铁的金属活动性从强到弱的顺序是(
)
A、金
铜
铁
B、铁
金
铜
C、铁
铜
金
D、铜
金
铁
C
6.填写下列表格(括号内为杂质)
混合物
除去杂质的化学方程式
主要操作步骤
铜粉(Fe)
FeCl2溶液(CuCl2)
Fe+2HCl=FeCl2+H2↑
Fe+CuSO4=FeSO4+Cu
溶解、过滤、洗涤
溶解、过滤
7、计算:
把镁和铜的混合物20g和足量稀硫酸反应,生成氢气0.4g,求原混合物中铜的质量。
再见!
