高中化学人教版选修四 3-2 水的电离和溶液的酸碱性课件(20张ppt)
文档属性
| 名称 | 高中化学人教版选修四 3-2 水的电离和溶液的酸碱性课件(20张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 628.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-25 19:20:06 | ||
图片预览








文档简介
回顾:
1、常见的强电解质、弱电解质有哪些?
2、影响弱电解质电离平衡的因素有哪些?
3、电离平衡常数的意义是什么?它受哪些因素影响?
什么东西越洗越黑?
水的电离和溶液的酸碱性
1.了解水的电离平衡及影响因素。
2.了解水的离子积并能进行相关简单计算。
3.了解溶液的酸碱性与pH的关系。
学习目标:
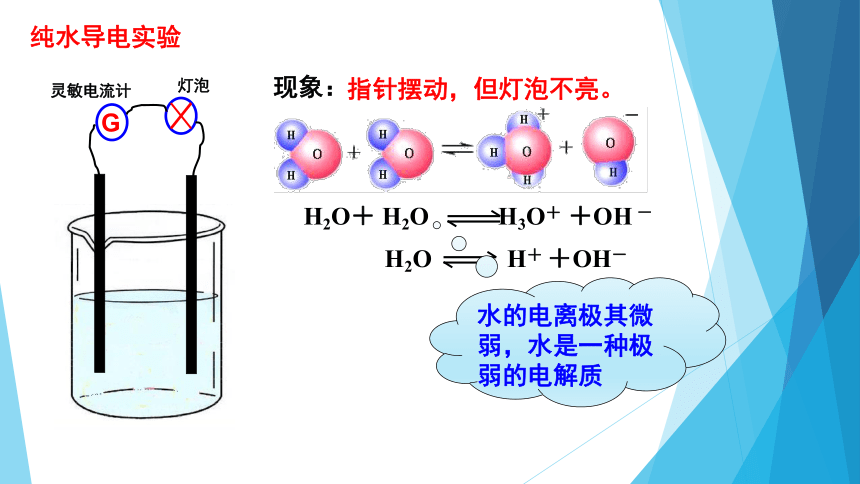
纯水导电实验
G
灵敏电流计
灯泡
现象:
指针摆动,但灯泡不亮。
H2O+ H2O H3O+ +OH - -
H2O H+ +OH-
水的电离极其微弱,水是一种极弱的电解质
讨论1:哪些因素会影响水的电离平衡?分别如何影响?
温度
H2O H+ +OH-
浓度
思考:为什么金属镁与冷水反应慢、与热水反应快?
水的离子积
Kw=c(H+)?c(OH-)
注意:1. Kw只与温度有关(与浓度无关)
温度升高, Kw增大
练一练:室温时,实验测得1L水中只有1×10-7mol水电离,求Kw
讨论2:酸溶液、碱溶液中C(H+) 、C(OH-)还相等吗?它们会有什么关系?
3. Kw不仅适用于纯水,还适用于酸 碱盐的稀溶液
2. Kw=10-14只是在室温下对应的值
注意:1. Kw只与温度有关(与浓度无关)
温度升高, Kw增大
①酸溶液中Kw=c酸(H+)×c水(OH-)
(忽略水电离出的H+浓度)
②碱溶液中Kw=c水(H+)×c碱(OH-)
(忽略水电离出的OH-浓度)
注意:水电离产生的c水(H+) =c水(OH-)
例1、在25℃ 0.01mol/L盐酸溶液中:
c(H+) = , c(OH-) = ;
c(H+)水= , c(OH-)水= 。
练习、在25℃ 0.01mol/L NaOH溶液中:
c(H+)= , c(OH-)= ;
c(H+)水= , c(OH-)水= 。
讨论3:溶液的酸碱性由什么因素决定呢?(参考课本46页思考交流第二题)
用pH表示溶液酸碱性
pH = - lgc(H+)
某溶液中 c(H+) = 1×10-7
pH = - lg10-7 = 7
常温下
溶液的酸碱性
c(H+) 和 c(OH-) 的关系
pH
酸性
中性
碱性
思考:当C(H+)= 10-6mol/L时,此时溶液一定是酸性溶液吗? pH=7的溶液一定呈中性吗?
课堂小结
水电离,程度低
两离子, 1:1
升温促电离
酸碱都会抑
离子积,是常数
用十四,看温度
酸碱性,大者定
其他判断看环境
当堂巩固
1、判断正误:
(1)任何水溶液中都存在水的电离平衡( )
(2)任何水溶液中(不论酸、碱或中性)都存在Kw=10-14 ( )
(3)水中c(H+)增大,水的电离平衡一定向正反应方向移动( )
(4)水电离的 c(H+) =1×10-13mol/L的溶液 一定呈碱性( )
2、将纯水加热到较高温度,下列叙述正确的是( )
A. Kw增大,pH减小,呈酸性
B. Kw不变,pH不变,呈中性
C. Kw减小,pH增大,呈碱性
D. Kw增大,pH减小,呈中性
当堂巩固
1、常见的强电解质、弱电解质有哪些?
2、影响弱电解质电离平衡的因素有哪些?
3、电离平衡常数的意义是什么?它受哪些因素影响?
什么东西越洗越黑?
水的电离和溶液的酸碱性
1.了解水的电离平衡及影响因素。
2.了解水的离子积并能进行相关简单计算。
3.了解溶液的酸碱性与pH的关系。
学习目标:
纯水导电实验
G
灵敏电流计
灯泡
现象:
指针摆动,但灯泡不亮。
H2O+ H2O H3O+ +OH - -
H2O H+ +OH-
水的电离极其微弱,水是一种极弱的电解质
讨论1:哪些因素会影响水的电离平衡?分别如何影响?
温度
H2O H+ +OH-
浓度
思考:为什么金属镁与冷水反应慢、与热水反应快?
水的离子积
Kw=c(H+)?c(OH-)
注意:1. Kw只与温度有关(与浓度无关)
温度升高, Kw增大
练一练:室温时,实验测得1L水中只有1×10-7mol水电离,求Kw
讨论2:酸溶液、碱溶液中C(H+) 、C(OH-)还相等吗?它们会有什么关系?
3. Kw不仅适用于纯水,还适用于酸 碱盐的稀溶液
2. Kw=10-14只是在室温下对应的值
注意:1. Kw只与温度有关(与浓度无关)
温度升高, Kw增大
①酸溶液中Kw=c酸(H+)×c水(OH-)
(忽略水电离出的H+浓度)
②碱溶液中Kw=c水(H+)×c碱(OH-)
(忽略水电离出的OH-浓度)
注意:水电离产生的c水(H+) =c水(OH-)
例1、在25℃ 0.01mol/L盐酸溶液中:
c(H+) = , c(OH-) = ;
c(H+)水= , c(OH-)水= 。
练习、在25℃ 0.01mol/L NaOH溶液中:
c(H+)= , c(OH-)= ;
c(H+)水= , c(OH-)水= 。
讨论3:溶液的酸碱性由什么因素决定呢?(参考课本46页思考交流第二题)
用pH表示溶液酸碱性
pH = - lgc(H+)
某溶液中 c(H+) = 1×10-7
pH = - lg10-7 = 7
常温下
溶液的酸碱性
c(H+) 和 c(OH-) 的关系
pH
酸性
中性
碱性
思考:当C(H+)= 10-6mol/L时,此时溶液一定是酸性溶液吗? pH=7的溶液一定呈中性吗?
课堂小结
水电离,程度低
两离子, 1:1
升温促电离
酸碱都会抑
离子积,是常数
用十四,看温度
酸碱性,大者定
其他判断看环境
当堂巩固
1、判断正误:
(1)任何水溶液中都存在水的电离平衡( )
(2)任何水溶液中(不论酸、碱或中性)都存在Kw=10-14 ( )
(3)水中c(H+)增大,水的电离平衡一定向正反应方向移动( )
(4)水电离的 c(H+) =1×10-13mol/L的溶液 一定呈碱性( )
2、将纯水加热到较高温度,下列叙述正确的是( )
A. Kw增大,pH减小,呈酸性
B. Kw不变,pH不变,呈中性
C. Kw减小,pH增大,呈碱性
D. Kw增大,pH减小,呈中性
当堂巩固
