人教版九年级化学第三单元课题2原子的结构课件 (共46张PPT)
文档属性
| 名称 | 人教版九年级化学第三单元课题2原子的结构课件 (共46张PPT) |
|
|
| 格式 | ppt | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-28 00:00:00 | ||
图片预览








文档简介
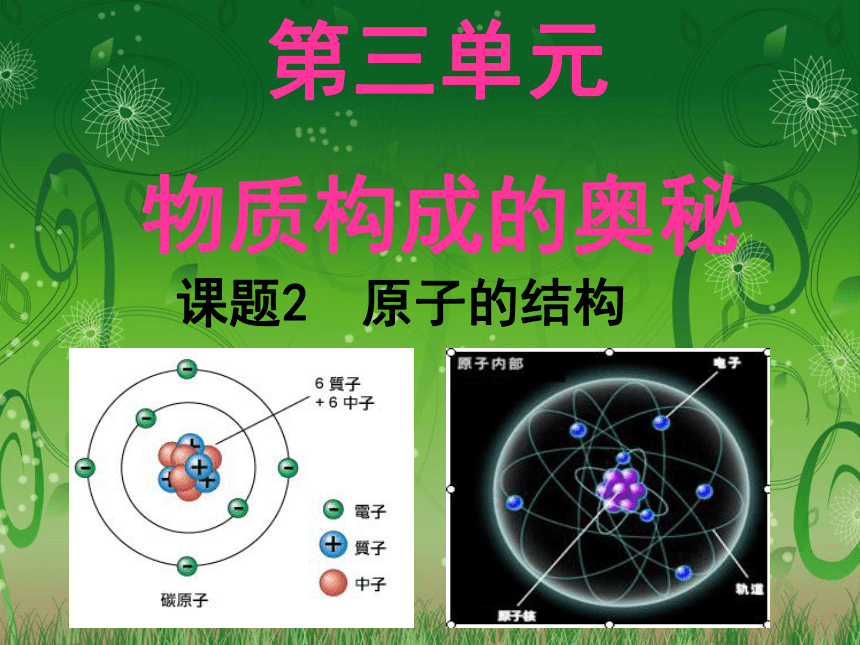
课题2 原子的结构
第三单元
物质构成的奥秘
学习目标:
1、认识原子的构成,了解原子核外电子是分层排布的.(重点)
2、知道原子结构示意图的含义,初步学会分析原子结构示意图.(重点)
自学指导:
阅读课本P53——P55,独立完成练习册第17页课前预习导学案的一到二题。
时间:5分钟。
在过氧化氢分解制氧气的实验中,过氧化氢 破裂为氢 和氧 ,该反应的文字表达为: __。可见,分子很小,但在化学反应中可以 ,而 在化学变化中不可再分,所以说 是化学变化中的最小的粒子。
(提示:填“分子”或“原子”)
分子
原子
原子
再分
原子
原子
过氧化氢 水 + 氧气
二氧化锰
能力源于运用
知识回顾
那原子还能再分吗?
原子是怎样构成的?
一
【智慧阅读】结合原子结构的探索历程,阅读书P53讨论:
1. 原子是实心球体吗?原子的体积大小怎样?
2. 原子是由哪几个部分构成的?
3. 原子核由哪几种粒子构成?
4. 原子中各种粒子带电情况如何?
5. 什么叫核电荷数?它与质子数有什么关系?
+
+
+
原子不是实心球体,它的体积很小。
原子由原子核和核外电子构成。
原子核由质子和中子构成。
每个质子带一个单位正电荷,每个电子带一个单位负电荷,中子不带电。
原子核所带的正电荷数即核电荷数,其等于质子数。
一、原子的构成
原 子
核外电子
原子核
质 子
中 子
(带正电)
(不带电)
(带负电)
(带正电)
(不带电)
1、原子的结构
原子种类
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
氯
17
18
17
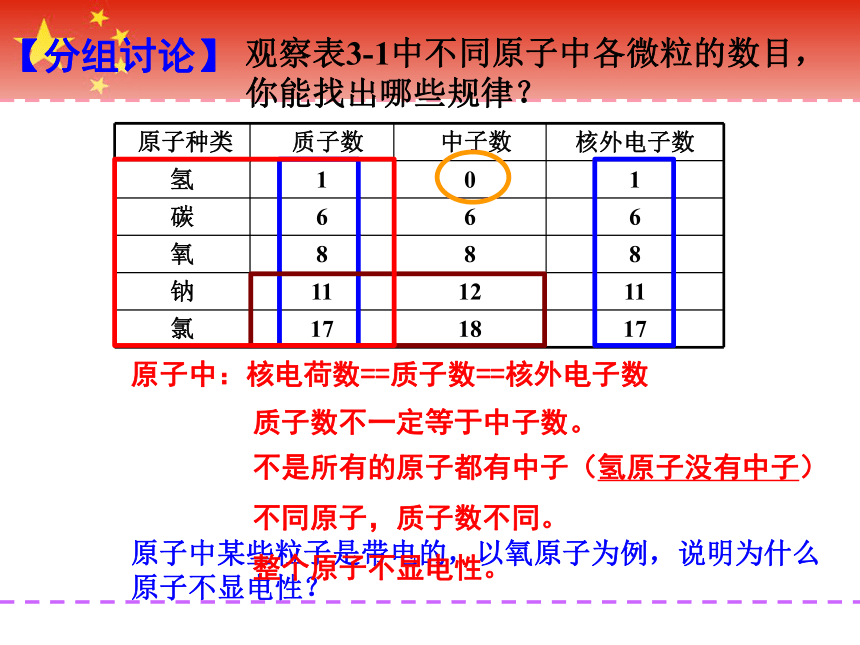
观察表3-1中不同原子中各微粒的数目,你能找出哪些规律?
原子中:核电荷数==质子数==核外电子数
不是所有的原子都有中子(氢原子没有中子)
不同原子,质子数不同。
质子数不一定等于中子数。
原子中某些粒子是带电的,以氧原子为例,说明为什么原子不显电性?
整个原子不显电性。
【分组讨论】
原子种类
质子数
中子数
核外电子数
核电荷数
原子序数
氢
1
0
1
1
1
碳
6
6
6
6
6
氧
8
8
8
8
8
钠
11
12
11
11
11
氯
17
18
17
17
17
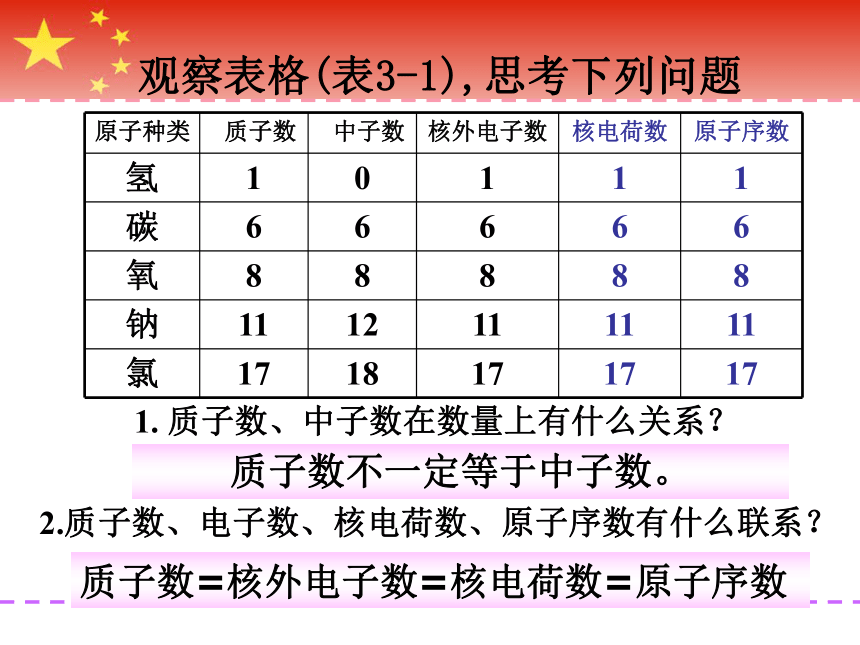
观察表格(表3-1),思考下列问题
1. 质子数、中子数在数量上有什么关系?
2.质子数、电子数、核电荷数、原子序数有什么联系?
质子数不一定等于中子数。
质子数=核外电子数=核电荷数=原子序数
原子种类
核电荷数
质子数
中子数
核外电子数
氧
8
8
硫
16
16
镁
12
12
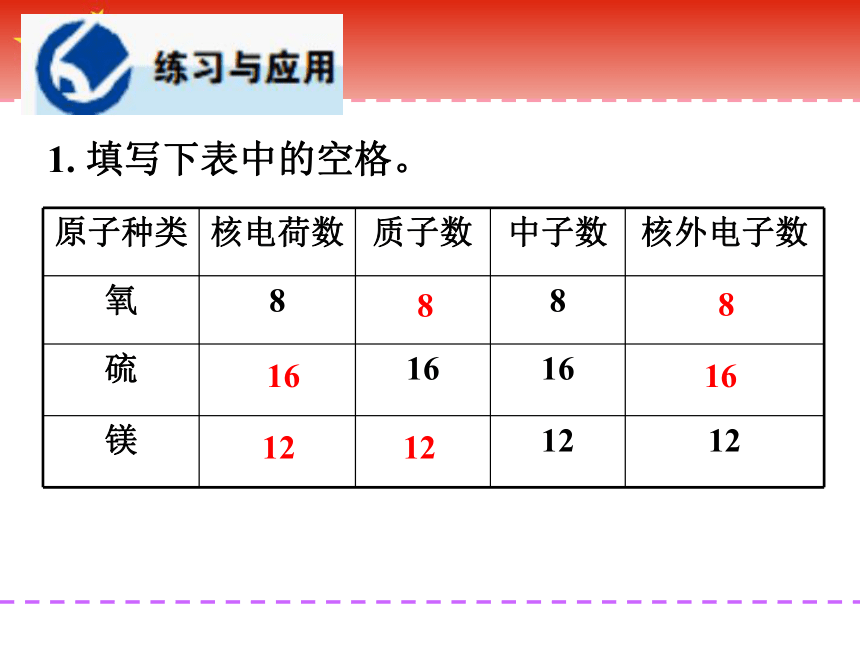
1. 填写下表中的空格。
8
8
16
16
12
12
1.原子是由居于原子中心、带_____的原子核和核外带_____的电子构成,原子核是由_____和_____构成。由于它们所带的电荷_____,电性____,所以整个原子_____(填显或不显)电性。
2.能保持物质的化学性质的最小粒子是____;化学变化中的最小粒子是_____;原子中带正电荷的粒子是_ _________;不显电性的粒子有 、 、 。
3.据报道,1994年12月科学家发现了一种新元素,它的原子核内有111个质子, 161个中子,则该元素核外电子数是_____ 。
正电
负电
质子
中子
相等
相反
不显
分子
原子
质子和原子核
中子
111
原子
分子
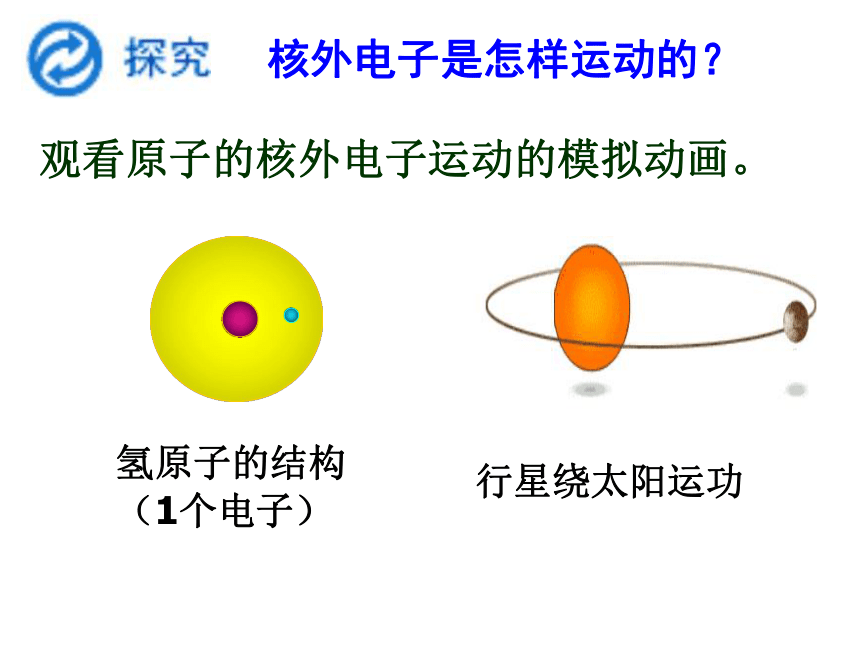
核外电子是怎样运动的?
观看原子的核外电子运动的模拟动画。
氢原子的结构
(1个电子)
行星绕太阳运功
第一层
第二层
第三层
钠原子的结构
(11个电子)
二、原子核外电子的排布
1、高速运动
2、无规则运动
3、分层运动
电子经常出现的区域叫电子层;核外电子的这种分层运动又叫分层排布。
(2)第一层最多排2个电子,第二层最多排8个电子。
(3)最外层最多排8个电子。(只有一个电子层时最多 2个电子)
(1)电子的能量不同,能量低的离核近,能量高的离核远。
4.核外电子分层排布的规律
(4)先排第一层,排满第一层再排第二层,依次类推。
11
+
原子核
质子带正电
质子数
电子层
1
2
8
第二层
第一层
第三层
最外层
该层的电子数目
钠原子结构示意图
次外层
5.原子结构示意图
例如:O和P的原子结构示意图:
O
P
下列原子结构示意图书写正确的是( )
A B C D
+3
3
2
6
4
2
+14
7
5
2
+10
8
C
氢 H 氦He
锂 Li 铍 Be 硼 B 碳 C 氮N 氧O 氟 F 氖Ne
钠Na 镁Mg 铝Al 硅Si 磷P 硫 S 氯Cl 氩Ar
金属原子
非金属原子
稀有气体原子
找找规律
这三大类原子的原子最外层电子数有什么规律?
元素的分类
最外层电子数
稳定性
得失电子趋势
化学性质
一般<4
易失去电子
一般>4
易得到电子
容易发生化学反应
等于8
(氦等于2)
不易得失电子
难发生化学反应
金属元素
非金属元素
稀有气体元素
稳定
不稳定
不稳定
6.原子的性质与原子最外层电子数的关系
【结论】原子的化学性质取决于最外层电子数。最外层电子数相同,原子的化学性质相似
⑴同一横行,电子层数相同。
⑵同一横行,从左到右,最外层电子数依次增加。
⑶同一纵行,最外层电子数相同。
(4)同一纵行,从上到下,电子层数依次增加。
知识拓展
1、“嫦蛾一号”的任务之一是探测月球上的氦-3资源,He-3的原子结构示意图为 ,图中x为( )。
A.1 B. 2 C. 3 D. 4
+2
x
B
2、下列原子结构示意图所表示的原子,化学性质最稳定的是( )。
+10
2
8
2
8
7
+17
2
2
8
+12
1
2
8
+11
A
B
C
D
A
4. (多选)具有相似化学性质的组别是( )。
A.
D.
C.
B.
3.这是磷原子的结构示意图 ,该原子的核电荷数是__,共有__个电子层,第二电子层上有__个电子,最外层上的电子数是__。
15
3
8
5
CD
5.已知碘元素(1)原子结构示意图为 ,请回答下列问题:
⑴ x 的值为__;
⑵(多选)一般情况下,元素原子最外层电子数相同,具有相似化学性质.碘元素的化学性质与下列元素的化学性质最相似的是( ).
A.
B.
C.
D.
53
AB
在分子、原子、质子、中子、电子、原子核这些粒子中,选择合适的答案,填在空格上。
(1)能保持物质化学性质的最小粒子有:
(2)在化学变化中最小的粒子是:
(3)不显电性的粒子有:
(4)带正电的粒子有:
(5)带负电的粒子有:
(6)质量最小的粒子有:
(7)构成原子的微粒有:
(8)原子的质量主要集中在:
比一比速度、准确度
分子 原子
原子
分子 原子 中子
质子、原子核
电子
电子
原子核(质子 中子)、电子
原子核
课题2 原子的结构
第二课时
11
+
原子核
质子带正电
质子数
电子层
1
2
8
第二层
第一层
第三层
最外层
该层的电子数目
钠原子结构示意图
次外层
原子结构示意图
温故而知新
氢 H 氦He
锂 Li 铍 Be 硼 B 碳 C 氮N 氧O 氟 F 氖Ne
钠Na 镁Mg 铝Al 硅Si 磷P 硫 S 氯Cl 氩Ar
金属原子
非金属原子
稀有气体原子
找找规律
这三大类原子的原子最外层电子数有什么规律?
原子的分类
最外层电子数
稳定性
得失电子趋势
化学性质
一般<4
易失去电子
一般>4
易得到电子
容易发生化学反应
等于8
(氦等于2)
不易得失电子
难发生化学反应
金属原子
非金属原子
稀有气体原子
稳定
不稳定
不稳定
原子的性质与原子最外层电子数的关系
【结论】原子的化学性质取决于最外层电子数。最外层电子数相同,原子的化学性质相似
学习目标:
1、了解离子形成过程和离子的概念,知道离子是构成物质的一种微粒。(难点)
2、了解相对原子质量的概念,依据其定义进行简单的化学计算。(重点)
自学指导:
阅读课本P55——P56,独 立完成练习册课前第18页预习导学案的一到二题。
时间:5分钟。
钠原子最外层有1个电子、氯原子最外层有7个电子,最外层都没有达到相对稳定结构,它们发生化学反应时,怎样才能达到相对稳定结构?
想一想
钠原子
氯原子
钠与氯气反应
钠+氯气 氯化钠
加热
Na原子与Cl原子在化学变化中怎样达到相对稳定结构?
钠原子
氯原子
2
1
8
+11
Na
2
7
8
+17
Cl
+11
2
8
Na+
失去1电子
8
2
8
+17
Cl-
Na+
Cl-
静电作用
阳离子
阴离子
不带电的化合物NaCl
质子数 电子数
质子数 电子数
11
10
17
18
>
<
带一个单位正电荷
带一个单位负电荷
Na+
Cl-
钠原子
氯原子
钠离子
氯离子
Na
Na+
失去
1个电子
Mg
失去
2个电子
Mg2+
Al
失去
3个电子
Al3+
原子
阳离子
金属原子 阳离子
失去电子
原子结构
离子结构
钠原子
钠离子
镁原子
镁离子
铝原子
铝离子
Cl
S
P
得到
1个电子
8
Cl -
得到
2个电子
8
S2-
得到
3个电子
P3-
8
原子
阴离子
原子结构
离子结构
氯原子
氯离子
硫原子
硫离子
磷原子
磷离子
非金属原子 阴离子
得到电子
三、离 子:
1、定义:
2、分类:
阳离子:带正电荷的原子(或原子团)
阴离子:带负电荷的原子(或原子团)
3、离子的形成:
原子
阳离子
失去电子
(1)阳离子:
得到电子
原子
阴离子
(2)阴离子:
带电荷的原子(或原子团)叫做离子
(1)书写:在元素符号的右上角标出离子所带的电荷数及正负。
5、离子符号:
注 意
② 电荷数为1时,1省略不写。
① 数字在前,正负号在后。
③ 电荷数=原子得失的电子数目。
(2)意义:
例:O2-
① 表示一个氧离子
② 表示每个氧离子带2个单位的负电荷
4、离子的结构特点:
(2)阴离子:
(1)阳离子:
负电荷数=得到的电子数
正电荷数=失去的电子数
质子数>电子数
质子数<电子数,
原子中: 质子数 核外电子数
阳离子: 质子数 核外电子数
阴离子: 质子数 核外电子数
=
>
<
8
2
+11
8
+17
8
2
6
+16
8
2
8
2
+8
练习:哪些表示原子、阳离子、阴离子?
1
+11
8
2
8
2
+10
原子
原子
阴离子
阴离子
原子
阳离子
1.某原子最外层上有2个电子,则此﹙ ﹚
A:一定是非金属原子 B:一定是金属原子
C:一定是稀有气体原子 D:以上说法都不正确
D
2.某原子的原子结构示意图为 ,该元素原子原子核内有_____个质子,核外共有_____个电子层,最外电子层上有_____个电子,它容易_____(填“得”或“失”)电子,形成_____(填“阴”或“阳”)离子。
2
6
8
+16
16
3
6
得
阴
第3题图
第4题图
3.某粒子的结构示意图如图所示,则m= ,n= ,
x= 。该粒子是 (填粒子的化学符号)
4.某粒子的结构示意图如图所示,若该粒子带2个单位负电荷,它的化学符号是 ;若该粒子带2个单位正电荷,它的化学符号是 ;若该粒子不显电性,它的化学符号是 。
16
2
8
S
O2-
Mg2+
Ne
粒子种类
电性
质量(kg)
质子
1个单位正电荷
1.6726×10-27
中子
不带电
1.6749×10-27
电子
1个单位负电荷
质子质量的1/1836
四、相对原子质量(Ar)
P56
阅读上表 (表3-2),能得出什么结论?
1、质子和中子的质量很小且很接近,但比电子大很多。
2、整个原子的质量主要集中在原子核上。
原子的质量测定值
一个氢原子的质量是:
0.00000000000000000000000000167千克
即1.67×10-27千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克
一个碳原子的质量是:
0.00000000000000000000000001992千克
即1.992×10-26千克
原子的质量很小,记忆、计算都很不方便,那怎么办?请你想办法。
三、相对原子质量(Ar)
相对原子质量就是以一种碳原子质量的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的比值。
一个碳原子的实际质量的1/12
Ar=
一个原子的实际质量
(1) 相对原子质量________ 原子的实际质量,是个比值。
(2) 原子实际质量越大,它的相对原子质量数值 越____ 。
(3)相对原子质量的单位是: ___________ 。
(4)原子实际质量的单位是: ___________ 。
不等于
大
“1”(常省略不写)
千克
相对原子质量的近似值
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
氯
17
18
17
35
铁
26
30
26
56
找规律:阅读上表,你能得到什么信息?
核电荷数=核内质子数=核外电子
练 习
相对原子质量≈质子数+中子数
1、填表:
2、氧原子的相对原子质量为( )
A、16g B、16 C、2.657×10-26kg D、16g
3、最近,俄罗斯科学家宣布他们通过核反应合成了核电荷数为114、相对原子质量为289的超重元素原子,该原子内质子数为 ,中子数为 ,核外电子数为 。
原子种类
核电荷数
质子数
中子数
电子数
相对原子质量
H
1
?
?
?
Mg
12
?
?
24
Fe
?
26
?
56
B
114
175
114
1
0
12
26
30
1
1
12
12
26
第三单元
物质构成的奥秘
学习目标:
1、认识原子的构成,了解原子核外电子是分层排布的.(重点)
2、知道原子结构示意图的含义,初步学会分析原子结构示意图.(重点)
自学指导:
阅读课本P53——P55,独立完成练习册第17页课前预习导学案的一到二题。
时间:5分钟。
在过氧化氢分解制氧气的实验中,过氧化氢 破裂为氢 和氧 ,该反应的文字表达为: __。可见,分子很小,但在化学反应中可以 ,而 在化学变化中不可再分,所以说 是化学变化中的最小的粒子。
(提示:填“分子”或“原子”)
分子
原子
原子
再分
原子
原子
过氧化氢 水 + 氧气
二氧化锰
能力源于运用
知识回顾
那原子还能再分吗?
原子是怎样构成的?
一
【智慧阅读】结合原子结构的探索历程,阅读书P53讨论:
1. 原子是实心球体吗?原子的体积大小怎样?
2. 原子是由哪几个部分构成的?
3. 原子核由哪几种粒子构成?
4. 原子中各种粒子带电情况如何?
5. 什么叫核电荷数?它与质子数有什么关系?
+
+
+
原子不是实心球体,它的体积很小。
原子由原子核和核外电子构成。
原子核由质子和中子构成。
每个质子带一个单位正电荷,每个电子带一个单位负电荷,中子不带电。
原子核所带的正电荷数即核电荷数,其等于质子数。
一、原子的构成
原 子
核外电子
原子核
质 子
中 子
(带正电)
(不带电)
(带负电)
(带正电)
(不带电)
1、原子的结构
原子种类
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
氯
17
18
17
观察表3-1中不同原子中各微粒的数目,你能找出哪些规律?
原子中:核电荷数==质子数==核外电子数
不是所有的原子都有中子(氢原子没有中子)
不同原子,质子数不同。
质子数不一定等于中子数。
原子中某些粒子是带电的,以氧原子为例,说明为什么原子不显电性?
整个原子不显电性。
【分组讨论】
原子种类
质子数
中子数
核外电子数
核电荷数
原子序数
氢
1
0
1
1
1
碳
6
6
6
6
6
氧
8
8
8
8
8
钠
11
12
11
11
11
氯
17
18
17
17
17
观察表格(表3-1),思考下列问题
1. 质子数、中子数在数量上有什么关系?
2.质子数、电子数、核电荷数、原子序数有什么联系?
质子数不一定等于中子数。
质子数=核外电子数=核电荷数=原子序数
原子种类
核电荷数
质子数
中子数
核外电子数
氧
8
8
硫
16
16
镁
12
12
1. 填写下表中的空格。
8
8
16
16
12
12
1.原子是由居于原子中心、带_____的原子核和核外带_____的电子构成,原子核是由_____和_____构成。由于它们所带的电荷_____,电性____,所以整个原子_____(填显或不显)电性。
2.能保持物质的化学性质的最小粒子是____;化学变化中的最小粒子是_____;原子中带正电荷的粒子是_ _________;不显电性的粒子有 、 、 。
3.据报道,1994年12月科学家发现了一种新元素,它的原子核内有111个质子, 161个中子,则该元素核外电子数是_____ 。
正电
负电
质子
中子
相等
相反
不显
分子
原子
质子和原子核
中子
111
原子
分子
核外电子是怎样运动的?
观看原子的核外电子运动的模拟动画。
氢原子的结构
(1个电子)
行星绕太阳运功
第一层
第二层
第三层
钠原子的结构
(11个电子)
二、原子核外电子的排布
1、高速运动
2、无规则运动
3、分层运动
电子经常出现的区域叫电子层;核外电子的这种分层运动又叫分层排布。
(2)第一层最多排2个电子,第二层最多排8个电子。
(3)最外层最多排8个电子。(只有一个电子层时最多 2个电子)
(1)电子的能量不同,能量低的离核近,能量高的离核远。
4.核外电子分层排布的规律
(4)先排第一层,排满第一层再排第二层,依次类推。
11
+
原子核
质子带正电
质子数
电子层
1
2
8
第二层
第一层
第三层
最外层
该层的电子数目
钠原子结构示意图
次外层
5.原子结构示意图
例如:O和P的原子结构示意图:
O
P
下列原子结构示意图书写正确的是( )
A B C D
+3
3
2
6
4
2
+14
7
5
2
+10
8
C
氢 H 氦He
锂 Li 铍 Be 硼 B 碳 C 氮N 氧O 氟 F 氖Ne
钠Na 镁Mg 铝Al 硅Si 磷P 硫 S 氯Cl 氩Ar
金属原子
非金属原子
稀有气体原子
找找规律
这三大类原子的原子最外层电子数有什么规律?
元素的分类
最外层电子数
稳定性
得失电子趋势
化学性质
一般<4
易失去电子
一般>4
易得到电子
容易发生化学反应
等于8
(氦等于2)
不易得失电子
难发生化学反应
金属元素
非金属元素
稀有气体元素
稳定
不稳定
不稳定
6.原子的性质与原子最外层电子数的关系
【结论】原子的化学性质取决于最外层电子数。最外层电子数相同,原子的化学性质相似
⑴同一横行,电子层数相同。
⑵同一横行,从左到右,最外层电子数依次增加。
⑶同一纵行,最外层电子数相同。
(4)同一纵行,从上到下,电子层数依次增加。
知识拓展
1、“嫦蛾一号”的任务之一是探测月球上的氦-3资源,He-3的原子结构示意图为 ,图中x为( )。
A.1 B. 2 C. 3 D. 4
+2
x
B
2、下列原子结构示意图所表示的原子,化学性质最稳定的是( )。
+10
2
8
2
8
7
+17
2
2
8
+12
1
2
8
+11
A
B
C
D
A
4. (多选)具有相似化学性质的组别是( )。
A.
D.
C.
B.
3.这是磷原子的结构示意图 ,该原子的核电荷数是__,共有__个电子层,第二电子层上有__个电子,最外层上的电子数是__。
15
3
8
5
CD
5.已知碘元素(1)原子结构示意图为 ,请回答下列问题:
⑴ x 的值为__;
⑵(多选)一般情况下,元素原子最外层电子数相同,具有相似化学性质.碘元素的化学性质与下列元素的化学性质最相似的是( ).
A.
B.
C.
D.
53
AB
在分子、原子、质子、中子、电子、原子核这些粒子中,选择合适的答案,填在空格上。
(1)能保持物质化学性质的最小粒子有:
(2)在化学变化中最小的粒子是:
(3)不显电性的粒子有:
(4)带正电的粒子有:
(5)带负电的粒子有:
(6)质量最小的粒子有:
(7)构成原子的微粒有:
(8)原子的质量主要集中在:
比一比速度、准确度
分子 原子
原子
分子 原子 中子
质子、原子核
电子
电子
原子核(质子 中子)、电子
原子核
课题2 原子的结构
第二课时
11
+
原子核
质子带正电
质子数
电子层
1
2
8
第二层
第一层
第三层
最外层
该层的电子数目
钠原子结构示意图
次外层
原子结构示意图
温故而知新
氢 H 氦He
锂 Li 铍 Be 硼 B 碳 C 氮N 氧O 氟 F 氖Ne
钠Na 镁Mg 铝Al 硅Si 磷P 硫 S 氯Cl 氩Ar
金属原子
非金属原子
稀有气体原子
找找规律
这三大类原子的原子最外层电子数有什么规律?
原子的分类
最外层电子数
稳定性
得失电子趋势
化学性质
一般<4
易失去电子
一般>4
易得到电子
容易发生化学反应
等于8
(氦等于2)
不易得失电子
难发生化学反应
金属原子
非金属原子
稀有气体原子
稳定
不稳定
不稳定
原子的性质与原子最外层电子数的关系
【结论】原子的化学性质取决于最外层电子数。最外层电子数相同,原子的化学性质相似
学习目标:
1、了解离子形成过程和离子的概念,知道离子是构成物质的一种微粒。(难点)
2、了解相对原子质量的概念,依据其定义进行简单的化学计算。(重点)
自学指导:
阅读课本P55——P56,独 立完成练习册课前第18页预习导学案的一到二题。
时间:5分钟。
钠原子最外层有1个电子、氯原子最外层有7个电子,最外层都没有达到相对稳定结构,它们发生化学反应时,怎样才能达到相对稳定结构?
想一想
钠原子
氯原子
钠与氯气反应
钠+氯气 氯化钠
加热
Na原子与Cl原子在化学变化中怎样达到相对稳定结构?
钠原子
氯原子
2
1
8
+11
Na
2
7
8
+17
Cl
+11
2
8
Na+
失去1电子
8
2
8
+17
Cl-
Na+
Cl-
静电作用
阳离子
阴离子
不带电的化合物NaCl
质子数 电子数
质子数 电子数
11
10
17
18
>
<
带一个单位正电荷
带一个单位负电荷
Na+
Cl-
钠原子
氯原子
钠离子
氯离子
Na
Na+
失去
1个电子
Mg
失去
2个电子
Mg2+
Al
失去
3个电子
Al3+
原子
阳离子
金属原子 阳离子
失去电子
原子结构
离子结构
钠原子
钠离子
镁原子
镁离子
铝原子
铝离子
Cl
S
P
得到
1个电子
8
Cl -
得到
2个电子
8
S2-
得到
3个电子
P3-
8
原子
阴离子
原子结构
离子结构
氯原子
氯离子
硫原子
硫离子
磷原子
磷离子
非金属原子 阴离子
得到电子
三、离 子:
1、定义:
2、分类:
阳离子:带正电荷的原子(或原子团)
阴离子:带负电荷的原子(或原子团)
3、离子的形成:
原子
阳离子
失去电子
(1)阳离子:
得到电子
原子
阴离子
(2)阴离子:
带电荷的原子(或原子团)叫做离子
(1)书写:在元素符号的右上角标出离子所带的电荷数及正负。
5、离子符号:
注 意
② 电荷数为1时,1省略不写。
① 数字在前,正负号在后。
③ 电荷数=原子得失的电子数目。
(2)意义:
例:O2-
① 表示一个氧离子
② 表示每个氧离子带2个单位的负电荷
4、离子的结构特点:
(2)阴离子:
(1)阳离子:
负电荷数=得到的电子数
正电荷数=失去的电子数
质子数>电子数
质子数<电子数,
原子中: 质子数 核外电子数
阳离子: 质子数 核外电子数
阴离子: 质子数 核外电子数
=
>
<
8
2
+11
8
+17
8
2
6
+16
8
2
8
2
+8
练习:哪些表示原子、阳离子、阴离子?
1
+11
8
2
8
2
+10
原子
原子
阴离子
阴离子
原子
阳离子
1.某原子最外层上有2个电子,则此﹙ ﹚
A:一定是非金属原子 B:一定是金属原子
C:一定是稀有气体原子 D:以上说法都不正确
D
2.某原子的原子结构示意图为 ,该元素原子原子核内有_____个质子,核外共有_____个电子层,最外电子层上有_____个电子,它容易_____(填“得”或“失”)电子,形成_____(填“阴”或“阳”)离子。
2
6
8
+16
16
3
6
得
阴
第3题图
第4题图
3.某粒子的结构示意图如图所示,则m= ,n= ,
x= 。该粒子是 (填粒子的化学符号)
4.某粒子的结构示意图如图所示,若该粒子带2个单位负电荷,它的化学符号是 ;若该粒子带2个单位正电荷,它的化学符号是 ;若该粒子不显电性,它的化学符号是 。
16
2
8
S
O2-
Mg2+
Ne
粒子种类
电性
质量(kg)
质子
1个单位正电荷
1.6726×10-27
中子
不带电
1.6749×10-27
电子
1个单位负电荷
质子质量的1/1836
四、相对原子质量(Ar)
P56
阅读上表 (表3-2),能得出什么结论?
1、质子和中子的质量很小且很接近,但比电子大很多。
2、整个原子的质量主要集中在原子核上。
原子的质量测定值
一个氢原子的质量是:
0.00000000000000000000000000167千克
即1.67×10-27千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克
一个碳原子的质量是:
0.00000000000000000000000001992千克
即1.992×10-26千克
原子的质量很小,记忆、计算都很不方便,那怎么办?请你想办法。
三、相对原子质量(Ar)
相对原子质量就是以一种碳原子质量的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的比值。
一个碳原子的实际质量的1/12
Ar=
一个原子的实际质量
(1) 相对原子质量________ 原子的实际质量,是个比值。
(2) 原子实际质量越大,它的相对原子质量数值 越____ 。
(3)相对原子质量的单位是: ___________ 。
(4)原子实际质量的单位是: ___________ 。
不等于
大
“1”(常省略不写)
千克
相对原子质量的近似值
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
氯
17
18
17
35
铁
26
30
26
56
找规律:阅读上表,你能得到什么信息?
核电荷数=核内质子数=核外电子
练 习
相对原子质量≈质子数+中子数
1、填表:
2、氧原子的相对原子质量为( )
A、16g B、16 C、2.657×10-26kg D、16g
3、最近,俄罗斯科学家宣布他们通过核反应合成了核电荷数为114、相对原子质量为289的超重元素原子,该原子内质子数为 ,中子数为 ,核外电子数为 。
原子种类
核电荷数
质子数
中子数
电子数
相对原子质量
H
1
?
?
?
Mg
12
?
?
24
Fe
?
26
?
56
B
114
175
114
1
0
12
26
30
1
1
12
12
26
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
