高中物理人教版选修3-5 自主复习学案 第十九章 第一节 原子核的组成 Word版含解析
文档属性
| 名称 | 高中物理人教版选修3-5 自主复习学案 第十九章 第一节 原子核的组成 Word版含解析 |  | |
| 格式 | zip | ||
| 文件大小 | 341.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 物理 | ||
| 更新时间 | 2020-10-27 16:21:36 | ||
图片预览


文档简介
第十九章 原子核
『判一判』
(1)天然放射现象的发现揭示了原子核还可再分。(√)
(2)原子序数大于83的元素都是放射性元素。(√)
(3)γ射线是光子流,是能量很高的电磁波。(√)
(4)同一元素的两种同位素具有相同的质量数。(×)
(5)质子和中子都不带电,是原子核的组成成分,统称为核子。(×)
(6)原子核的电荷数就是核内的质子数,也就是这种元素的原子序数。(√)
『选一选』
(2020·贵州省思南中学高二下学期检测)如图,放射性元素镭衰变过程中释放出α、β、γ三种射线,分别进入匀强电场和匀强磁场中,下列说法正确的是( C )
A.①表示γ射线,③表示α射线
B.②表示β射线,③表示α射线
C.④表示α射线,⑤表示γ射线
D.⑤表示β射线,⑥表示α射线
解析:α带正电,β带负电,γ不带电,γ射线在磁场中一定不偏转,②⑤为γ射线;如左图所示的电场中,α射线向右偏,β射线向左偏,①为β射线,③为α射线;在如右图所示磁场中,由左手定则判断,α射线向左偏,β射线向右偏,即④为α射线,⑥为β射线,故正确选项是C。
『想一想』
氢原子核中只有一个质子,能否认为质子就是氢原子核?
答案:不能。质子是原子核的组成部分。
课内互动探究
细研深究·破疑解难·萃取精华
探究?
天然放射现象
┃┃思考讨论1__■
如图为三种射线在磁场中的运动轨迹示意图。
α射线向左偏转,β射线向右偏转,γ射线不偏转说明了什么?
提示:说明α射线带正电,β射线带负电,γ射线不带电。
┃┃归纳总结__■
1.天然放射现象
(1)发现者
1896年,法国物理学家贝克勒尔。
(2)放射性
铀和含铀的矿物质都能够发出看不见的射线,这种射线可以使包在黑纸里的照相底片感光。物体放射出射线的性质叫做放射性。
(3)放射性元素
放射性并不是少数几种元素才有的,研究发现,原子序数大于或等于83的所有元素,都能自发地放出射线,原子序数小于83的元素,有的也具有放射性,元素这种自发地放出射线的现象叫做天然放射现象,现在用人工的方法也可以制造放射性同位素。
2.三种射线的比较
种类
α射线
β
射线
γ射线
组成
高速氦核流
高速电子流
光子流(高频电磁波)
带电量
2e
-e
0
质量
4mpmp=1.67×10-27
kg
静止质量为零
速度
0.1c
0.99c
c
在电磁场中
偏转
与α射线反向偏转
不偏转
贯穿本领
最弱用纸能挡住
较强穿透几毫米的铝板
最强穿透几厘米的铅板
对空气的电离作用
很强
较弱
很弱
在空气中的径迹
粗、短、直
细、较长、曲折
最长
通过胶片
感光
感光
感光
特别提醒
(1)如果一种元素具有放射性,那么不论它是以单质的形式存在,还是以某种化合物的形式存在,放射性都不受影响。也就是说,放射性与元素存在的状态无关,放射性仅与原子核有关。因此,原子核不是组成物质的最小微粒,原子核也存在着一定结构。
(2)β射线的电子是从原子核中放出来的,并不是从原子核外的电子中放出来的。
┃┃典例剖析__■
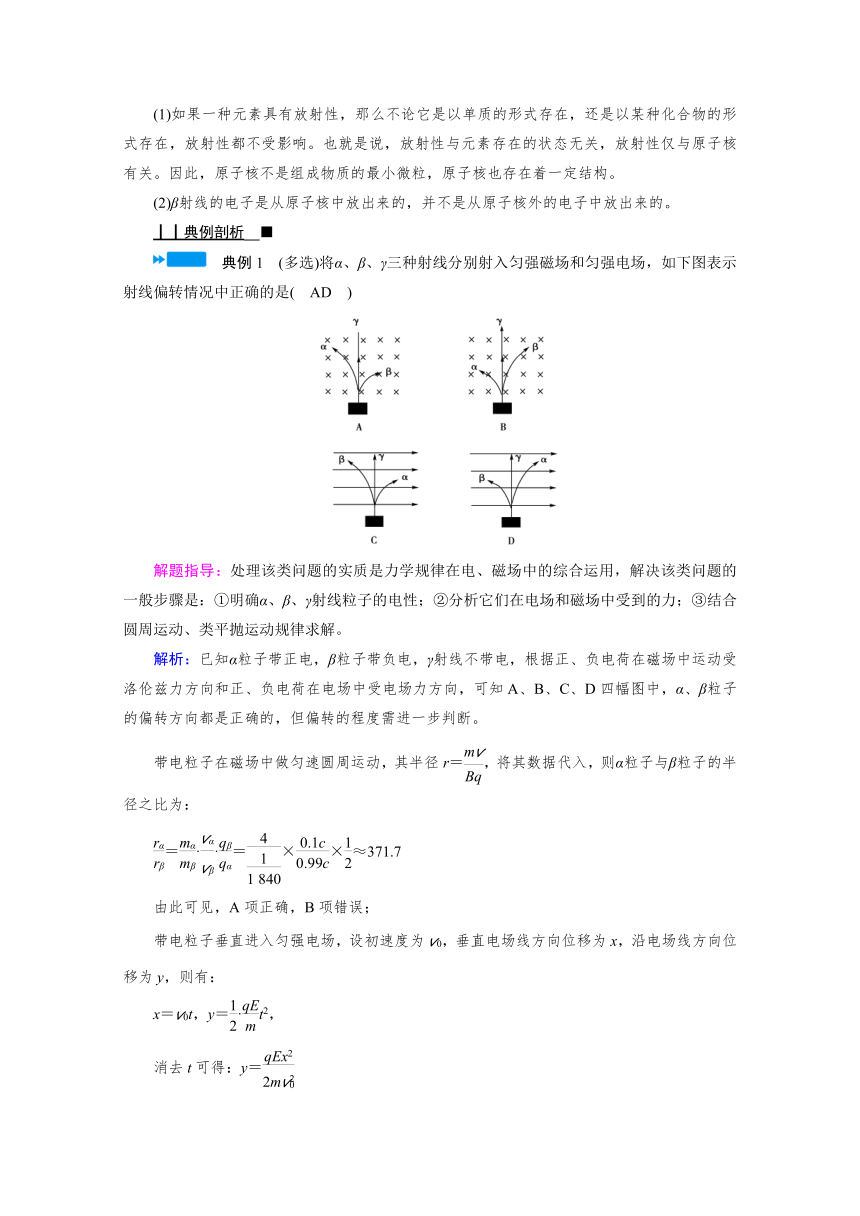
典例1 (多选)将α、β、γ三种射线分别射入匀强磁场和匀强电场,如下图表示射线偏转情况中正确的是( AD )
解题指导:处理该类问题的实质是力学规律在电、磁场中的综合运用,解决该类问题的一般步骤是:①明确α、β、γ射线粒子的电性;②分析它们在电场和磁场中受到的力;③结合圆周运动、类平抛运动规律求解。
解析:已知α粒子带正电,β粒子带负电,γ射线不带电,根据正、负电荷在磁场中运动受洛伦兹力方向和正、负电荷在电场中受电场力方向,可知A、B、C、D四幅图中,α、β粒子的偏转方向都是正确的,但偏转的程度需进一步判断。
带电粒子在磁场中做匀速圆周运动,其半径r=,将其数据代入,则α粒子与β粒子的半径之比为:
=··=××≈371.7
由此可见,A项正确,B项错误;
带电粒子垂直进入匀强电场,设初速度为v0,垂直电场线方向位移为x,沿电场线方向位移为y,则有:
x=v0t,y=·t2,
消去t可得:y=
对某一确定的x值,α、β粒子沿电场线偏转距离之比为
=··=××=
由此可见,C项错误,D项正确。
故正确答案是A、D。
┃┃对点训练__■
1.天然放射性元素放出的三种射线的穿透能力实验结果如图所示,由此可推知( D )
A.②来自原子核外的电子
B.①的电离作用最强,是一种电磁波
C.③的电离作用较强,是一种电磁波
D.③的电离作用最弱,是一种电磁波
解析:根据三种射线的贯穿本领,可知①为α射线,②为β射线,③为γ射线,α射线的电离作用最强是高速氦核流,β射线是高速电子流,它不是从原子核外的电子中放出来的,γ射线是光子流(高频电磁波),综上所述D正确。
探究?
原子核的组成
┃┃思考讨论2__■
1919年卢瑟福用镭放射出的α粒子轰击氮原子核,从氮核中打出了一种新的粒子(如图所示),叫质子。
(1)人们用α粒子轰击多种原子核,都打出了质子,说明了什么问题?
(2)绝大多数原子核的质量数都大于其质子数,说明了什么问题?
提示:(1)说明质子是原子核的组成部分。
(2)说明原子核内除质子外,还有其他粒子存在。
┃┃归纳总结__■
1.原子核(符号X)
2.对核子数、电荷数、质量数的理解
(1)核子数:质子和中子质量差别非常微小,二者统称为核子,质子数和中子数之和叫核子数。
(2)电荷数(Z):原子核所带的电荷总是质子电荷的整数倍,通常用这个整数表示原子核的电荷量,叫做原子核的电荷数。
(3)质量数(A):原子核的质量等于核内质子和中子的质量的总和,而质子与中子质量几乎相等,所以原子核的质量几乎等于单个核子质量的整数倍,这个整数叫做原子核的质量数。
3.同位素
原子核内的质子数决定了核外电子的数目,进而也决定了元素的化学性质,同种元素的质子数相同,核外电子数也相同,所以有相同的化学性质,但它们的中子数可以不同,所以它们的物理性质不同。把具有相同质子数、不同中子数的原子核互称为同位素。
特别提醒
(1)β射线是原子核变化时产生的,电子并不是原子核的组成部分。
(2)同位素的化学性质相同,但物理性质不同。
┃┃典例剖析__■
典例2 已知镭的原子序数是88,原子核质量数是226,试问:
(1)镭核中有多少个质子?多少个中子?
(2)镭核所带的电荷量是多少?
(3)若镭原子呈中性,它核外有多少个电子?
解题指导:核电荷数与原子核的电荷量是不同的,要理清他们的关系。
解析:原子序数与核内质子数、核电荷数、中性原子的核外电子数都是相等的,原子核的质量数等于核内质子数与中子数之和。由此可得:
(1)镭核中的质子数等于其原子序数,故质子数为88,中子数N等于原子核的质量数A与质子数Z之差,即N=A-Z=226-88=138。
(2)镭核所带电荷量
Q=Ze=88×1.6×10-19
C=1.41×10-17
C
(3)核外电子数等于核电荷数,故核外电子数为88。
答案:(1)88 138 (2)1.41×10-17
C (3)88
┃┃对点训练__■
2.有关O、O、O三种同位素的比较,试回答下列问题:
(1)三种同位素中哪一种粒子是不相同的?__B__。
A.质子
B.中子
C.电子
(2)三种同位素中,哪一个质量最大?__O__。
(3)三种同位素的化学性质是否相同?__相同__。
解析:(1)同位素质子数相同,中子数不同。核外电子数与质子数相同,故不相同的是中子。
(2)O、O、O的质量数分别是16、17、18,故O质量最大。
(3)三种同位素质子数相同,故化学性质相同。
核心素养提升
易错警示·以题说法·启智培优
原子核的“数”与“量”的辨析技巧
(1)核电荷数与原子核的电荷量是不同的,组成原子核的质子的电荷量都是相同的,所以原子核的电荷量一定是质子电荷量的整数倍,我们把核内的质子数叫核电荷数,而这些质子所带电荷量的总和才是原子核的电荷量。
(2)原子核的质量数与质量是不同的,也与元素的原子量不同。原子核内质子和中子的总数叫作核的质量数,原子核的质量等于质子和中子的质量的总和。
(3)基本关系:核电荷数=质子数(Z)=元素的原子序数=核外电子数。质量数(A)=核子数=质子数+中子数。
案例 以下说法正确的是( D )
A.Th为钍核,由此可知,钍核的质量数为90,钍核的质子数为234
B.Be为铍核,由此可知,铍核的质量数为9,铍核的中子数为4
C.同一元素的两种同位素具有相同的质量数
D.同一元素的两种同位素具有不同的中子数
解析:钍核的质量数为234,质子数为90,所以A错误;铍核的质子数为4,中子数为5,所以B错误;由于同位素是指质子数相同而中子数不同,即质量数不同,因而C错误,D正确。
PAGE
『判一判』
(1)天然放射现象的发现揭示了原子核还可再分。(√)
(2)原子序数大于83的元素都是放射性元素。(√)
(3)γ射线是光子流,是能量很高的电磁波。(√)
(4)同一元素的两种同位素具有相同的质量数。(×)
(5)质子和中子都不带电,是原子核的组成成分,统称为核子。(×)
(6)原子核的电荷数就是核内的质子数,也就是这种元素的原子序数。(√)
『选一选』
(2020·贵州省思南中学高二下学期检测)如图,放射性元素镭衰变过程中释放出α、β、γ三种射线,分别进入匀强电场和匀强磁场中,下列说法正确的是( C )
A.①表示γ射线,③表示α射线
B.②表示β射线,③表示α射线
C.④表示α射线,⑤表示γ射线
D.⑤表示β射线,⑥表示α射线
解析:α带正电,β带负电,γ不带电,γ射线在磁场中一定不偏转,②⑤为γ射线;如左图所示的电场中,α射线向右偏,β射线向左偏,①为β射线,③为α射线;在如右图所示磁场中,由左手定则判断,α射线向左偏,β射线向右偏,即④为α射线,⑥为β射线,故正确选项是C。
『想一想』
氢原子核中只有一个质子,能否认为质子就是氢原子核?
答案:不能。质子是原子核的组成部分。
课内互动探究
细研深究·破疑解难·萃取精华
探究?
天然放射现象
┃┃思考讨论1__■
如图为三种射线在磁场中的运动轨迹示意图。
α射线向左偏转,β射线向右偏转,γ射线不偏转说明了什么?
提示:说明α射线带正电,β射线带负电,γ射线不带电。
┃┃归纳总结__■
1.天然放射现象
(1)发现者
1896年,法国物理学家贝克勒尔。
(2)放射性
铀和含铀的矿物质都能够发出看不见的射线,这种射线可以使包在黑纸里的照相底片感光。物体放射出射线的性质叫做放射性。
(3)放射性元素
放射性并不是少数几种元素才有的,研究发现,原子序数大于或等于83的所有元素,都能自发地放出射线,原子序数小于83的元素,有的也具有放射性,元素这种自发地放出射线的现象叫做天然放射现象,现在用人工的方法也可以制造放射性同位素。
2.三种射线的比较
种类
α射线
β
射线
γ射线
组成
高速氦核流
高速电子流
光子流(高频电磁波)
带电量
2e
-e
0
质量
4mpmp=1.67×10-27
kg
静止质量为零
速度
0.1c
0.99c
c
在电磁场中
偏转
与α射线反向偏转
不偏转
贯穿本领
最弱用纸能挡住
较强穿透几毫米的铝板
最强穿透几厘米的铅板
对空气的电离作用
很强
较弱
很弱
在空气中的径迹
粗、短、直
细、较长、曲折
最长
通过胶片
感光
感光
感光
特别提醒
(1)如果一种元素具有放射性,那么不论它是以单质的形式存在,还是以某种化合物的形式存在,放射性都不受影响。也就是说,放射性与元素存在的状态无关,放射性仅与原子核有关。因此,原子核不是组成物质的最小微粒,原子核也存在着一定结构。
(2)β射线的电子是从原子核中放出来的,并不是从原子核外的电子中放出来的。
┃┃典例剖析__■
典例1 (多选)将α、β、γ三种射线分别射入匀强磁场和匀强电场,如下图表示射线偏转情况中正确的是( AD )
解题指导:处理该类问题的实质是力学规律在电、磁场中的综合运用,解决该类问题的一般步骤是:①明确α、β、γ射线粒子的电性;②分析它们在电场和磁场中受到的力;③结合圆周运动、类平抛运动规律求解。
解析:已知α粒子带正电,β粒子带负电,γ射线不带电,根据正、负电荷在磁场中运动受洛伦兹力方向和正、负电荷在电场中受电场力方向,可知A、B、C、D四幅图中,α、β粒子的偏转方向都是正确的,但偏转的程度需进一步判断。
带电粒子在磁场中做匀速圆周运动,其半径r=,将其数据代入,则α粒子与β粒子的半径之比为:
=··=××≈371.7
由此可见,A项正确,B项错误;
带电粒子垂直进入匀强电场,设初速度为v0,垂直电场线方向位移为x,沿电场线方向位移为y,则有:
x=v0t,y=·t2,
消去t可得:y=
对某一确定的x值,α、β粒子沿电场线偏转距离之比为
=··=××=
由此可见,C项错误,D项正确。
故正确答案是A、D。
┃┃对点训练__■
1.天然放射性元素放出的三种射线的穿透能力实验结果如图所示,由此可推知( D )
A.②来自原子核外的电子
B.①的电离作用最强,是一种电磁波
C.③的电离作用较强,是一种电磁波
D.③的电离作用最弱,是一种电磁波
解析:根据三种射线的贯穿本领,可知①为α射线,②为β射线,③为γ射线,α射线的电离作用最强是高速氦核流,β射线是高速电子流,它不是从原子核外的电子中放出来的,γ射线是光子流(高频电磁波),综上所述D正确。
探究?
原子核的组成
┃┃思考讨论2__■
1919年卢瑟福用镭放射出的α粒子轰击氮原子核,从氮核中打出了一种新的粒子(如图所示),叫质子。
(1)人们用α粒子轰击多种原子核,都打出了质子,说明了什么问题?
(2)绝大多数原子核的质量数都大于其质子数,说明了什么问题?
提示:(1)说明质子是原子核的组成部分。
(2)说明原子核内除质子外,还有其他粒子存在。
┃┃归纳总结__■
1.原子核(符号X)
2.对核子数、电荷数、质量数的理解
(1)核子数:质子和中子质量差别非常微小,二者统称为核子,质子数和中子数之和叫核子数。
(2)电荷数(Z):原子核所带的电荷总是质子电荷的整数倍,通常用这个整数表示原子核的电荷量,叫做原子核的电荷数。
(3)质量数(A):原子核的质量等于核内质子和中子的质量的总和,而质子与中子质量几乎相等,所以原子核的质量几乎等于单个核子质量的整数倍,这个整数叫做原子核的质量数。
3.同位素
原子核内的质子数决定了核外电子的数目,进而也决定了元素的化学性质,同种元素的质子数相同,核外电子数也相同,所以有相同的化学性质,但它们的中子数可以不同,所以它们的物理性质不同。把具有相同质子数、不同中子数的原子核互称为同位素。
特别提醒
(1)β射线是原子核变化时产生的,电子并不是原子核的组成部分。
(2)同位素的化学性质相同,但物理性质不同。
┃┃典例剖析__■
典例2 已知镭的原子序数是88,原子核质量数是226,试问:
(1)镭核中有多少个质子?多少个中子?
(2)镭核所带的电荷量是多少?
(3)若镭原子呈中性,它核外有多少个电子?
解题指导:核电荷数与原子核的电荷量是不同的,要理清他们的关系。
解析:原子序数与核内质子数、核电荷数、中性原子的核外电子数都是相等的,原子核的质量数等于核内质子数与中子数之和。由此可得:
(1)镭核中的质子数等于其原子序数,故质子数为88,中子数N等于原子核的质量数A与质子数Z之差,即N=A-Z=226-88=138。
(2)镭核所带电荷量
Q=Ze=88×1.6×10-19
C=1.41×10-17
C
(3)核外电子数等于核电荷数,故核外电子数为88。
答案:(1)88 138 (2)1.41×10-17
C (3)88
┃┃对点训练__■
2.有关O、O、O三种同位素的比较,试回答下列问题:
(1)三种同位素中哪一种粒子是不相同的?__B__。
A.质子
B.中子
C.电子
(2)三种同位素中,哪一个质量最大?__O__。
(3)三种同位素的化学性质是否相同?__相同__。
解析:(1)同位素质子数相同,中子数不同。核外电子数与质子数相同,故不相同的是中子。
(2)O、O、O的质量数分别是16、17、18,故O质量最大。
(3)三种同位素质子数相同,故化学性质相同。
核心素养提升
易错警示·以题说法·启智培优
原子核的“数”与“量”的辨析技巧
(1)核电荷数与原子核的电荷量是不同的,组成原子核的质子的电荷量都是相同的,所以原子核的电荷量一定是质子电荷量的整数倍,我们把核内的质子数叫核电荷数,而这些质子所带电荷量的总和才是原子核的电荷量。
(2)原子核的质量数与质量是不同的,也与元素的原子量不同。原子核内质子和中子的总数叫作核的质量数,原子核的质量等于质子和中子的质量的总和。
(3)基本关系:核电荷数=质子数(Z)=元素的原子序数=核外电子数。质量数(A)=核子数=质子数+中子数。
案例 以下说法正确的是( D )
A.Th为钍核,由此可知,钍核的质量数为90,钍核的质子数为234
B.Be为铍核,由此可知,铍核的质量数为9,铍核的中子数为4
C.同一元素的两种同位素具有相同的质量数
D.同一元素的两种同位素具有不同的中子数
解析:钍核的质量数为234,质子数为90,所以A错误;铍核的质子数为4,中子数为5,所以B错误;由于同位素是指质子数相同而中子数不同,即质量数不同,因而C错误,D正确。
PAGE
