江苏省苏州市吴江汾湖高级中学2020-2021学年高一上学期10月月考化学试卷
文档属性
| 名称 | 江苏省苏州市吴江汾湖高级中学2020-2021学年高一上学期10月月考化学试卷 |  | |
| 格式 | doc | ||
| 文件大小 | 292.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-29 15:57:39 | ||
图片预览



文档简介
2020-2021学年第一学期汾湖高级中学阶段性教学反馈训练
高一化学试卷
试卷分值:100分 考试用时:60分钟
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 K 39 Cu 64 Ba 137
选择题
单项选择题:本题包括8小题,每题2分,共计16分。每小题只有一个选项符合题意。
1、新型冠状病毒可通过气溶胶传播,气溶胶属于胶体的一种。下列叙述正确的是( )
A.依据丁达尔效应可将分散系分为溶液、胶体与浊液
B.胶体的本质特征是具有丁达尔效应
C.雾是气溶胶,在阳光下可观察到丁达尔效应
D.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即做布朗运动
2、某学生利用如图所示装置对电解质溶液导电性进行实验探究。下列说法中正确的是( )
A.闭合开关K后,电流计指针不发生偏转,证明酒精溶液是非电解质
B.闭合开关K,往溶液中通入氯气,随着气体通入,电流计示数增大,故氯气是电解质
C.取用的蔗糖溶液替换酒精溶液,电流计的示数相同
D.闭合开关K,往烧杯中加固体,虽然固体溶解,由于不反应,故电流计指针不偏转
3、已知反应前后元素化合价都没有变化的反应为非氧化还原反应,下列关于四种基本反应类型与氧化还原反应、非氧化还原反应的关系图正确的是( )
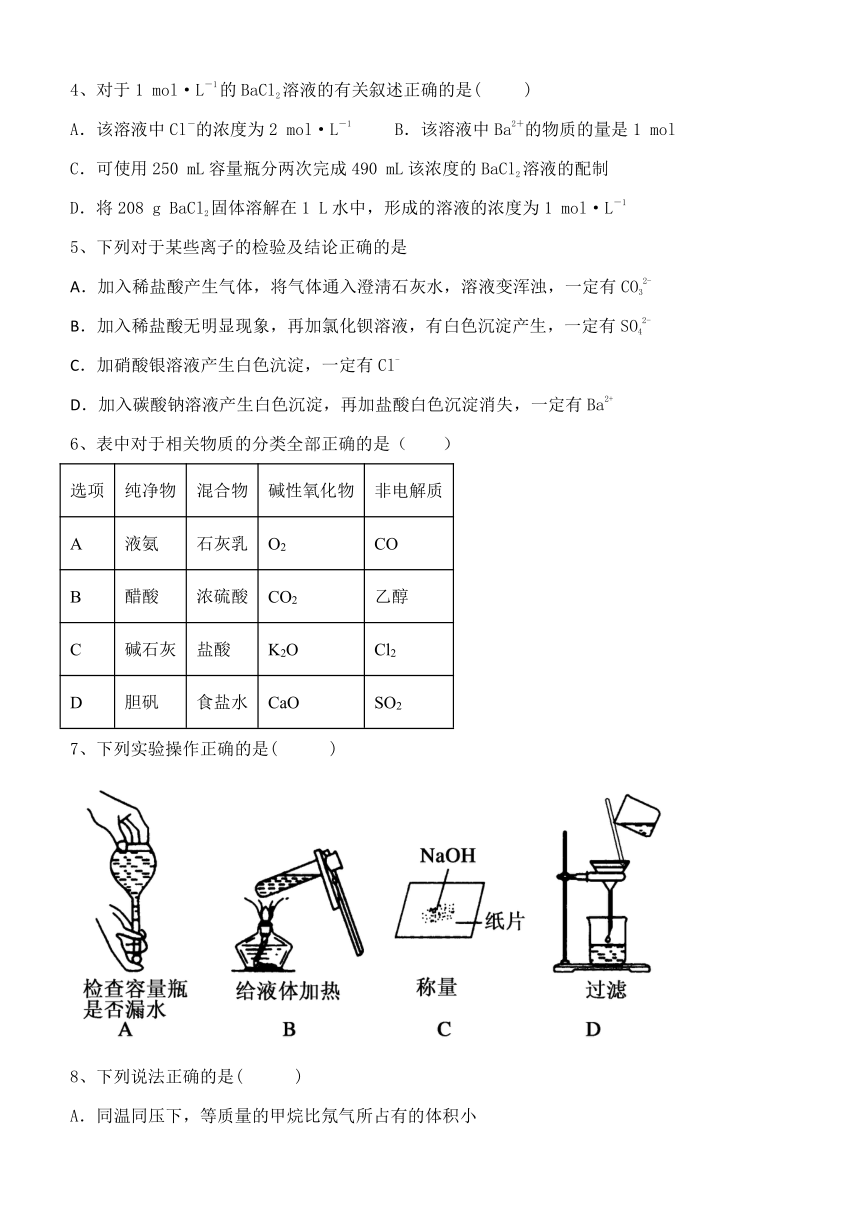
4、对于1 mol·L-1的BaCl2溶液的有关叙述正确的是( )
A.该溶液中Cl-的浓度为2 mol·L-1 B.该溶液中Ba2+的物质的量是1 mol
C.可使用250 mL容量瓶分两次完成490 mL该浓度的BaCl2溶液的配制
D.将208 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为1 mol·L-1
5、下列对于某些离子的检验及结论正确的是
A.加入稀盐酸产生气体,将气体通入澄淸石灰水,溶液变浑浊,一定有CO32-
B.加入稀盐酸无明显现象,再加氯化钡溶液,有白色沉淀产生,一定有SO42-
C.加硝酸银溶液产生白色沆淀,一定有Cl-
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
6、表中对于相关物质的分类全部正确的是( )
选项 纯净物 混合物 碱性氧化物 非电解质
A 液氨 石灰乳 O2 CO
B 醋酸 浓硫酸 CO2 乙醇
C 碱石灰 盐酸 K2O Cl2
D 胆矾 食盐水 CaO SO2
7、下列实验操作正确的是( )
8、下列说法正确的是( )
A.同温同压下,等质量的甲烷比氖气所占有的体积小
B.3.01×1023个X气体分子的质量为16 g,则X气体的摩尔质量是64 g·mol-1
C.0.5 L 1 mol·L-1 FeCl3溶液与0.2 L 1mol·L-1 KCl溶液中Cl-的数目之比为15:2
D.100 L 1 mol·L-1 NaCl溶液与50 mL 1 mol·L-1 AlCl3溶液中Cl-的物质的量浓度相等
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。多选、错选得0分,漏选得2分。
9、以下实验方案可以从海洋生物中提取具有抗肿瘤活性的天然物质:
下列说法错误的是( )
A.步骤(1)需要用到玻璃棒 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要用到温度计
10、NA代表阿伏加德罗常数,下列叙述错误的是( )
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2 = 2HCl+O2反应中,每生成32 g氧气,则消耗NA个Cl2分子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,1 L 0.50 mol·L-1 NaCl溶液与2 L 0.25 mol·L-1 Na2CO3溶液含Na+的物质的量不同
11、2016年苏州园艺博览会为倡导绿色、低碳、环保的办会理念,取消了开幕式等大型庆典活动,而改用音乐焰火晚会。绚丽的焰火与高中化学中“焰色反应”的知识相关。下列说法中正确的是( )
A.非金属单质燃烧时火焰均为无色 B.所有金属及其化合物灼烧时均有颜色
C.焰色反应均应透过蓝色钴玻璃观察 D.NaCl溶液与Na2CO3固体灼烧时火焰颜色相同
12、一包白色固体粉末,加水搅拌,有白色沉淀析出,且该沉淀不溶于稀HNO3。过滤后,向滤液中加入NaOH溶液,有刺激性气味的无色气体产生,此气体能使湿润的红色石蕊试纸变蓝,若改为向滤液中加入硝酸银溶液,则会产生不溶于稀硝酸的白色沉淀,根据以上现象判断,该固体可能是( )
A.NH4Cl和BaSO4 B.(NH4)2CO3和BaCO3 C.BaCl2和(NH4)2SO4 D.(NH4)2SO4和BaCO3
13、使用胆矾(CuSO4·5H2O)配制0.1 mol/L的硫酸铜溶液,正确的操作是( )
A.将胆矾加热除去结晶水后,称取16 g溶解在1 L水里
B.称取胆矾25 g,溶解在1 L水里
C.将25 g胆矾溶于水,然后将此溶液稀释至1 L
D.将16 g完全失去结晶水的胆矾溶于水,然后将此溶液稀释至1 L
非选择题
14、(15分)某化学实验小组需用480 mL 0.5 mol/L的碳酸钾溶液,请回答下列问题:
(1)需用碳酸钾的质量为_____________g。
(2)下面是配制碳酸钾溶液过程中的5个操作步骤:①向盛有碳酸钾的烧杯中加入20 mL蒸馏水使其溶解;②继续往容量瓶中加蒸馏水,至液面距刻度线1~2 cm处;③将烧杯中的溶液沿玻璃棒注入500 mL容量瓶中;④在烧杯中加入少量的蒸馏水,洗涤烧杯内壁和玻璃棒2~3次后移入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;⑤改用胶头滴管加蒸馏水至刻度线,盖好瓶塞,反复上下颠倒,摇匀。正确的操作顺序为___________________(填序号)。
(3)上述操作中,①、③都用到玻璃棒,其作用分别为_________、__________。
(4)下列操作会导致所配碳酸钾溶液物质的量浓度偏低的是_________________(填序号,下同);对所配溶液物质的量浓度无影响的是_______________。
①在烧杯中搅拌溶液时,有少量液体溅出
②定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线
③容量瓶使用前未进行干燥 ④所使用的容量瓶刚用某种浓度的碳酸钾溶液润洗过
⑤定容后,塞好瓶塞摇匀,装入用蒸馏水洗净的试剂瓶中
⑥没有洗涤溶解时所用的烧杯和玻璃棒
(5)草木灰是草本和木本植物燃烧后的残余物,含有碳酸钾,可用作肥料。现有一份草木灰样品,请设计实验方案检验其中含有碳酸钾。
实验方案:_________________________________________________________________________
___________________________________________________________________________________
__________________________________________________________________________________。
15、(16分)食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
(1)加入A试剂,是为了除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-。A代表的是多种试剂,按滴加顺序依次为:_____________________________________。(填化学式)
(2)下列的过滤操作中不规范的是____________(填标号)。
a.漏斗末端尖嘴未紧靠烧杯壁 b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗内壁 d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(3)操作Ⅲ的名称是_____________________。
(4)m g粗盐提纯后得到n g纯净的NaCl固体,则m与n的大小关系为____________。
A.m>n B.m无法确定
(5)实验室需配制500 mL 0.400 mol/L盐酸,现用如图所示浓盐酸配制,回答下列问题:
①配制需要的玻璃仪器有玻璃棒、量筒、_________________、________________、________________(填仪器名称)。
②需量取浓盐酸的体积为_________________ mL。(结果保留1位小数)
16、(18分)某化学兴趣小组在课外活动中对某溶液进行了多次检测,其中三次检测的结果如表所示,请回答下列问题。
检测次数 溶液中检测出的物质
第一次 KCl、K2SO4、Na2CO3、NaCl
第二次 KCl、BaCl2、Na2SO4、K2CO3
第三次 Na2SO4、KCl、K2CO3、NaCl
(1)三次检测结果中第_____________次检测结果不正确。
(2)在检测时,为了确定该溶液中是否存在SO42—、CO32—和Cl-,进行了如下操作:
①向溶液中滴加___________(填化学式)溶液,其目的是检测____________;继续滴加过量的该溶液,其目的是________________。
②过滤,向滤液中滴加____________(填化学式)溶液,其目的是检测_____________;继续滴加过量的该溶液,其目的是______________。
③过滤,再向滤液中滴加____________(填化学式)溶液,其目的是检测_____________。
17、(7分).已知:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2,且Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题:
(1)通入CO2前,灯泡________(填“亮”或“不亮”)。
(2)开始通入CO2时,灯泡的亮度________。
(3)继续通入过量的CO2,灯泡的亮度__________________。
(4)下列四个图中,________(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。
18、(8分)一定质量的液态化合物XY2与标准状况下一定质量的O2恰好完全反应,化学方程式为XY2(l)+3O2(g)XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的总体积是672 mL,密度为2.56 g·L-1。
(1)反应前O2的体积为______________mL。
(2)化合物XY2的摩尔质量为_______________。
(3)若XY2分子中X、Y两元素的质量之比是3:16,则X、Y两元素分别为_______、__________(填元素符号)。(顺序不能错)
2020-2021学年第一学期汾湖高级中学阶段性教学反馈训练
高一化学试卷答案
1-8:C、C、C、A、B、D、A、C 9-13:C、A、D、AC、CD
14、(15分)
(1)34.5(2分) (2)①③④②⑤(2分)
(3)搅拌、引流(各1分,共2分)
(4)①②⑤⑥(2分,漏选一个或两个得1分,漏选三个或者错选得0分)、③(2分)
(5)将草木灰样品溶于蒸馏水中,充分搅拌、静置,过滤(1分),将滤液加热浓缩(1分),用铂丝蘸取溶液,在酒精灯火焰上灼烧,并透过蓝色钴玻璃观察,火焰显紫色,证明有钾离子(1分);取少量溶液,置于一小烧杯中,加入足量氯化钙溶液,过滤取滤渣,加入足量稀盐酸,并在烧杯口盖上凃有澄清石灰水的玻璃片(1分),若石灰水变浑浊,证明溶液中含有碳酸根离子,则草木灰中含有碳酸钾(1分)。(共5分)
15、(16分)
(1)NaOH、BaCl2、Na2CO3(2分,顺序错得0分)
(2)ade(2分,漏选一个得1分,漏选2个或者错选得0分)
(3)蒸发结晶(2分) (4)B (2分)
(5)①烧杯(2分)、胶头滴管(2分)、500ml容量瓶(2分)②16.7(2分)
16、(18分)
(1)二(2分) (2)①HNO3(2分)、CO(2分);除尽CO(2分)
②Ba(NO3)2(2分)、SO(2分);除尽SO (2分) ③AgNO3 (2分)、Cl-(2分)。
17、(7分)
(1)亮(1分) (2)先变暗后熄灭(2分)
(3)熄灭后又逐渐变亮(2分) (4)D(2分)
18、(8分)
(1)672(2分)(2)76g/mol(2分,不写单位得1分)(3)C(2分)、S(2分)(顺序不能错)
高一化学试卷
试卷分值:100分 考试用时:60分钟
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 K 39 Cu 64 Ba 137
选择题
单项选择题:本题包括8小题,每题2分,共计16分。每小题只有一个选项符合题意。
1、新型冠状病毒可通过气溶胶传播,气溶胶属于胶体的一种。下列叙述正确的是( )
A.依据丁达尔效应可将分散系分为溶液、胶体与浊液
B.胶体的本质特征是具有丁达尔效应
C.雾是气溶胶,在阳光下可观察到丁达尔效应
D.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即做布朗运动
2、某学生利用如图所示装置对电解质溶液导电性进行实验探究。下列说法中正确的是( )
A.闭合开关K后,电流计指针不发生偏转,证明酒精溶液是非电解质
B.闭合开关K,往溶液中通入氯气,随着气体通入,电流计示数增大,故氯气是电解质
C.取用的蔗糖溶液替换酒精溶液,电流计的示数相同
D.闭合开关K,往烧杯中加固体,虽然固体溶解,由于不反应,故电流计指针不偏转
3、已知反应前后元素化合价都没有变化的反应为非氧化还原反应,下列关于四种基本反应类型与氧化还原反应、非氧化还原反应的关系图正确的是( )
4、对于1 mol·L-1的BaCl2溶液的有关叙述正确的是( )
A.该溶液中Cl-的浓度为2 mol·L-1 B.该溶液中Ba2+的物质的量是1 mol
C.可使用250 mL容量瓶分两次完成490 mL该浓度的BaCl2溶液的配制
D.将208 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为1 mol·L-1
5、下列对于某些离子的检验及结论正确的是
A.加入稀盐酸产生气体,将气体通入澄淸石灰水,溶液变浑浊,一定有CO32-
B.加入稀盐酸无明显现象,再加氯化钡溶液,有白色沉淀产生,一定有SO42-
C.加硝酸银溶液产生白色沆淀,一定有Cl-
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
6、表中对于相关物质的分类全部正确的是( )
选项 纯净物 混合物 碱性氧化物 非电解质
A 液氨 石灰乳 O2 CO
B 醋酸 浓硫酸 CO2 乙醇
C 碱石灰 盐酸 K2O Cl2
D 胆矾 食盐水 CaO SO2
7、下列实验操作正确的是( )
8、下列说法正确的是( )
A.同温同压下,等质量的甲烷比氖气所占有的体积小
B.3.01×1023个X气体分子的质量为16 g,则X气体的摩尔质量是64 g·mol-1
C.0.5 L 1 mol·L-1 FeCl3溶液与0.2 L 1mol·L-1 KCl溶液中Cl-的数目之比为15:2
D.100 L 1 mol·L-1 NaCl溶液与50 mL 1 mol·L-1 AlCl3溶液中Cl-的物质的量浓度相等
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。多选、错选得0分,漏选得2分。
9、以下实验方案可以从海洋生物中提取具有抗肿瘤活性的天然物质:
下列说法错误的是( )
A.步骤(1)需要用到玻璃棒 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要用到温度计
10、NA代表阿伏加德罗常数,下列叙述错误的是( )
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2 = 2HCl+O2反应中,每生成32 g氧气,则消耗NA个Cl2分子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,1 L 0.50 mol·L-1 NaCl溶液与2 L 0.25 mol·L-1 Na2CO3溶液含Na+的物质的量不同
11、2016年苏州园艺博览会为倡导绿色、低碳、环保的办会理念,取消了开幕式等大型庆典活动,而改用音乐焰火晚会。绚丽的焰火与高中化学中“焰色反应”的知识相关。下列说法中正确的是( )
A.非金属单质燃烧时火焰均为无色 B.所有金属及其化合物灼烧时均有颜色
C.焰色反应均应透过蓝色钴玻璃观察 D.NaCl溶液与Na2CO3固体灼烧时火焰颜色相同
12、一包白色固体粉末,加水搅拌,有白色沉淀析出,且该沉淀不溶于稀HNO3。过滤后,向滤液中加入NaOH溶液,有刺激性气味的无色气体产生,此气体能使湿润的红色石蕊试纸变蓝,若改为向滤液中加入硝酸银溶液,则会产生不溶于稀硝酸的白色沉淀,根据以上现象判断,该固体可能是( )
A.NH4Cl和BaSO4 B.(NH4)2CO3和BaCO3 C.BaCl2和(NH4)2SO4 D.(NH4)2SO4和BaCO3
13、使用胆矾(CuSO4·5H2O)配制0.1 mol/L的硫酸铜溶液,正确的操作是( )
A.将胆矾加热除去结晶水后,称取16 g溶解在1 L水里
B.称取胆矾25 g,溶解在1 L水里
C.将25 g胆矾溶于水,然后将此溶液稀释至1 L
D.将16 g完全失去结晶水的胆矾溶于水,然后将此溶液稀释至1 L
非选择题
14、(15分)某化学实验小组需用480 mL 0.5 mol/L的碳酸钾溶液,请回答下列问题:
(1)需用碳酸钾的质量为_____________g。
(2)下面是配制碳酸钾溶液过程中的5个操作步骤:①向盛有碳酸钾的烧杯中加入20 mL蒸馏水使其溶解;②继续往容量瓶中加蒸馏水,至液面距刻度线1~2 cm处;③将烧杯中的溶液沿玻璃棒注入500 mL容量瓶中;④在烧杯中加入少量的蒸馏水,洗涤烧杯内壁和玻璃棒2~3次后移入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;⑤改用胶头滴管加蒸馏水至刻度线,盖好瓶塞,反复上下颠倒,摇匀。正确的操作顺序为___________________(填序号)。
(3)上述操作中,①、③都用到玻璃棒,其作用分别为_________、__________。
(4)下列操作会导致所配碳酸钾溶液物质的量浓度偏低的是_________________(填序号,下同);对所配溶液物质的量浓度无影响的是_______________。
①在烧杯中搅拌溶液时,有少量液体溅出
②定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线
③容量瓶使用前未进行干燥 ④所使用的容量瓶刚用某种浓度的碳酸钾溶液润洗过
⑤定容后,塞好瓶塞摇匀,装入用蒸馏水洗净的试剂瓶中
⑥没有洗涤溶解时所用的烧杯和玻璃棒
(5)草木灰是草本和木本植物燃烧后的残余物,含有碳酸钾,可用作肥料。现有一份草木灰样品,请设计实验方案检验其中含有碳酸钾。
实验方案:_________________________________________________________________________
___________________________________________________________________________________
__________________________________________________________________________________。
15、(16分)食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
(1)加入A试剂,是为了除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-。A代表的是多种试剂,按滴加顺序依次为:_____________________________________。(填化学式)
(2)下列的过滤操作中不规范的是____________(填标号)。
a.漏斗末端尖嘴未紧靠烧杯壁 b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗内壁 d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(3)操作Ⅲ的名称是_____________________。
(4)m g粗盐提纯后得到n g纯净的NaCl固体,则m与n的大小关系为____________。
A.m>n B.m无法确定
(5)实验室需配制500 mL 0.400 mol/L盐酸,现用如图所示浓盐酸配制,回答下列问题:
①配制需要的玻璃仪器有玻璃棒、量筒、_________________、________________、________________(填仪器名称)。
②需量取浓盐酸的体积为_________________ mL。(结果保留1位小数)
16、(18分)某化学兴趣小组在课外活动中对某溶液进行了多次检测,其中三次检测的结果如表所示,请回答下列问题。
检测次数 溶液中检测出的物质
第一次 KCl、K2SO4、Na2CO3、NaCl
第二次 KCl、BaCl2、Na2SO4、K2CO3
第三次 Na2SO4、KCl、K2CO3、NaCl
(1)三次检测结果中第_____________次检测结果不正确。
(2)在检测时,为了确定该溶液中是否存在SO42—、CO32—和Cl-,进行了如下操作:
①向溶液中滴加___________(填化学式)溶液,其目的是检测____________;继续滴加过量的该溶液,其目的是________________。
②过滤,向滤液中滴加____________(填化学式)溶液,其目的是检测_____________;继续滴加过量的该溶液,其目的是______________。
③过滤,再向滤液中滴加____________(填化学式)溶液,其目的是检测_____________。
17、(7分).已知:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2,且Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题:
(1)通入CO2前,灯泡________(填“亮”或“不亮”)。
(2)开始通入CO2时,灯泡的亮度________。
(3)继续通入过量的CO2,灯泡的亮度__________________。
(4)下列四个图中,________(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。
18、(8分)一定质量的液态化合物XY2与标准状况下一定质量的O2恰好完全反应,化学方程式为XY2(l)+3O2(g)XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的总体积是672 mL,密度为2.56 g·L-1。
(1)反应前O2的体积为______________mL。
(2)化合物XY2的摩尔质量为_______________。
(3)若XY2分子中X、Y两元素的质量之比是3:16,则X、Y两元素分别为_______、__________(填元素符号)。(顺序不能错)
2020-2021学年第一学期汾湖高级中学阶段性教学反馈训练
高一化学试卷答案
1-8:C、C、C、A、B、D、A、C 9-13:C、A、D、AC、CD
14、(15分)
(1)34.5(2分) (2)①③④②⑤(2分)
(3)搅拌、引流(各1分,共2分)
(4)①②⑤⑥(2分,漏选一个或两个得1分,漏选三个或者错选得0分)、③(2分)
(5)将草木灰样品溶于蒸馏水中,充分搅拌、静置,过滤(1分),将滤液加热浓缩(1分),用铂丝蘸取溶液,在酒精灯火焰上灼烧,并透过蓝色钴玻璃观察,火焰显紫色,证明有钾离子(1分);取少量溶液,置于一小烧杯中,加入足量氯化钙溶液,过滤取滤渣,加入足量稀盐酸,并在烧杯口盖上凃有澄清石灰水的玻璃片(1分),若石灰水变浑浊,证明溶液中含有碳酸根离子,则草木灰中含有碳酸钾(1分)。(共5分)
15、(16分)
(1)NaOH、BaCl2、Na2CO3(2分,顺序错得0分)
(2)ade(2分,漏选一个得1分,漏选2个或者错选得0分)
(3)蒸发结晶(2分) (4)B (2分)
(5)①烧杯(2分)、胶头滴管(2分)、500ml容量瓶(2分)②16.7(2分)
16、(18分)
(1)二(2分) (2)①HNO3(2分)、CO(2分);除尽CO(2分)
②Ba(NO3)2(2分)、SO(2分);除尽SO (2分) ③AgNO3 (2分)、Cl-(2分)。
17、(7分)
(1)亮(1分) (2)先变暗后熄灭(2分)
(3)熄灭后又逐渐变亮(2分) (4)D(2分)
18、(8分)
(1)672(2分)(2)76g/mol(2分,不写单位得1分)(3)C(2分)、S(2分)(顺序不能错)
同课章节目录
