吉林公主岭范家屯一中2020-2021学年高二上学期期中考试化学试卷 Word版含答案
文档属性
| 名称 | 吉林公主岭范家屯一中2020-2021学年高二上学期期中考试化学试卷 Word版含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 286.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-29 16:27:17 | ||
图片预览



文档简介
化学试卷
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.对该反应体系加热 B.不用稀硫酸,改用98%的浓硫酸
C.向H2SO4中通入HCl气体 D.不用铁片,改用铁粉
2.反应X(g) + Y(g) 2Z(g)false,达到平衡时,下列说法正确的是( )
A.减小容器体积,平衡向右移动
B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大
D.降低温度,Y的转化率增大
3.已知X(g)+ 3Y(g) = 2Z(g) ΔH>0,下列对该反应的说法中正确的是( )
A.ΔS>0 B.能自发进行
C.反应物总能量大于生成物总能量 D.在任何温度下都不能自发进行
4.在不同情况下测得A(g)+3B(g)2C(g)+2D(g)的下列反应速率,其中反应速率最大的是(?? )
A.v(D)=0.01mol·L-1·s-1
B.v(C)=0.5mol·L-1·min-1
C.v(B)=0.6mol·L-1·min-1
D.v(A)=0.2mol·L-1·min-1
5.在同温、同压下,下列各组热化学方程式中,ΔH1>ΔH2的是( )
A. 2H2(g)+O2(g)=2H2O(l) ΔH1 2H2(g)+O2(g)=2H2O(g) ΔH2
B. S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2
C. C(s)+1/2O2(g)=CO(g) ΔH1 C(s)+O2(g)=CO2(g) ΔH2
D. H2(g)+Cl2(g)=2HCl(g) ΔH1 1/2H2(g)+1/2Cl2(g)=HCl(g) ΔH2
6.一定条件下的可逆反应: false false,若改变下列条件,可提高反应物中的活化分子百分数的是( ? )
A.升高温度????????????????????????B.降低温度 C.增大压强????????????????????????D.增大反应物浓度
7.将一定量A、B装入容积为1 L的恒温密闭容器中,发生反应:2A(g)+mB(g)nC(g),
1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的1/2,达到新的平衡时C的浓度为1.8x mol·L-1。下列说法正确的是( )
A. 化学计量数的关系为2+m <n
B. 容器的容积缩小,正反应速率增大,逆反应速率减小
C. 原容器中用B表示的该反应在1 min内的平均速率为falsemol·(L·min)-1
D. 若保持温度和容器容积不变,充入氦气,平衡向逆反应方向移动
8.下列热化学方程式书写正确的是(?? )
A.2NO2=2NO+O2△H=-184.6kJ/mol(反应热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=57.3kJ/mol(中和热)
C.C(s)+1/2O2(g)=CO(g)△H=-184.6kJ/mol(燃烧热)
D.S(s)+O2(g)=SO2(g)△H=-184.6kJ/mol(燃烧热)
9.某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)2C(g)达到平衡,此时测得n(A):n(B):n(C)=2:2:1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是( )
A.刚充入时反应速率v正减少,v逆增大
B.平衡不发生移动
C.平衡向正反应方向移动,A的物质的量浓度减小
D.物质C的质量分数增大
10.已知:
CH4(g)+2O2(g)=2CO2(g)+2H2O(l)???△H=-Q1
2H2(g)+O2(g)=2H2O(g)???△H=-Q2
2H2(g)+O2(g)=2H2O(l)???△H=-Q3
常温下取体积比为4:1的CH4和H2的混合气体11.2L(标况)经完全燃烧后恢复至常温,放出的热量是(?? )
A.0.4Q1+0.05Q3?????B.0.4Q1+0.05Q2
C.0.4Q1+0.1Q3?????D.0.4Q1+0.2Q2
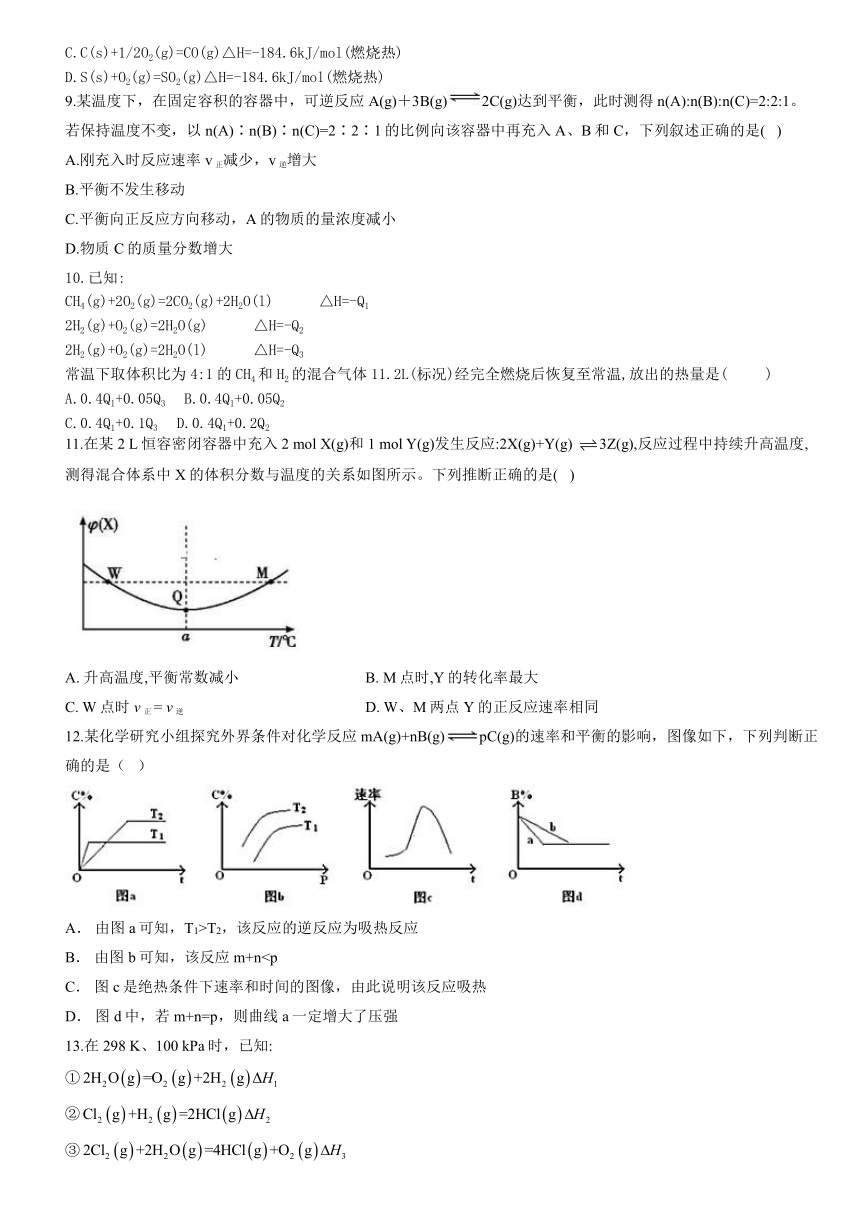
11.在某2 L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g) false3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
A. 升高温度,平衡常数减小 B. M点时,Y的转化率最大
C. W点时 v正 = v逆 D. W、M两点Y的正反应速率相同
12.某化学研究小组探究外界条件对化学反应mA(g)+nB(g)pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )
A. 由图a可知,T1>T2,该反应的逆反应为吸热反应
B. 由图b可知,该反应m+n
C. 图c是绝热条件下速率和时间的图像,由此说明该反应吸热
D. 图d中,若m+n=p,则曲线a一定增大了压强
13.在298 K、100 kPa时,已知:
①false
②false
③false
则false与false间的关系正确的是( )
A.false B.false
C.false D.false
14.已知某化学反应的平衡常数表达式为K=c(CO2) c(H2)/(CO) c(H2O),在不同的温度下该反应的平衡常数值分别为:
t/°C
700
800
830
1000
1200
K
1.67
1.11
1.00
0.60
0.38
下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 如果在一定体积的密闭容器中加入CO2和H2各1mol,5min后温度升高到830 ℃,此时测得CO为0.4mol时,该反应为平衡状态
D. 某温度下,如果平衡浓度符合下列关系式: c(CO2)/3(CO)=c(H2O)/5c(H2),判断此时的温度1000℃
15.已知:①2H2O(g) 2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1
②H2S(g) H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )
A.氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B.相同条件下,充分燃烧1mol H2(g)与1mol S(g)的混合物比充分燃烧1mol H2S(g)放热多20.1 kJ
C.由①②知,水的热稳定性小于硫化氢
D.②中若生成固态硫,ΔH将增大
16.将4mol A气体和2mol B气体在2L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol·L-1·s-1;
②用物质B表示的反应的平均速率为0.6mol·L-1·s-1;
③2s时物质A的转化率为30%;
④2s时物质B的浓度为1.4mol·L-1。
其中正确的是(? ?)
A.①③???????B.①④???????C.②③???????D.③④
17.可以证明可逆反应N2(g)+3H2(g) 2NH3(g)已达到平衡状态的是(?? )
①1个NN键断裂的同时,有3?个H-H键断裂
②1个NN键断裂的同时,有6?个N-H?键断裂
③其他条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2?的体积分数都不再改变
⑥恒温恒容时,混合气体的密度保持不变
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4?mol/(?L·min)
A.全部???????B.②③④⑤?????C.②③④⑤⑦?????D.③⑤⑥⑦
18.在一个1L的密闭容器中加2mol A和1mol B发生反应:2A(g)+B(g)3C(g)+D(s),达到平衡时C的浓度为1.2mol/L,C的体积分数为a%。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,C的体积分数仍为a%的是(?? )
A.6mol C+2mol D B.4mol A+2mol B
C.1mol A+0.5mol B+1.5mol C D.3mol C+5mol D
19.下列关于热化学反应的描述中正确的是(?? )
A.HCl和NaOH反应的中和热ΔΗ=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔΗ=2×(-57.3)kJ/mol
B.甲烷的标准燃烧热ΔΗ=-890.3kJ·mol-1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔΗ<-890.3kJ·mol-1
C.已知:500℃、30MPa下,N2(g)+3H2(g)= 2NH3(g) ΔΗ=-92.4kJ·mol-1;将1.5mol H2和过量的N2在此条件下充分反应,放出热量46.2kJ
D.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔΗ=+566.0kJ/mol
20.falsefalse是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2false的恒容密闭容器中投入false和false,其起始物质的量及false的平衡转化率如下表所示:
项目
甲
乙
丙
起始物质的量
false??
0.4
0.8
0.8
false??
0.24
0.24
0.48
false的平衡转化率%
80
false????
false?
下列判断中,正确的是(?? )
A.甲中反应的平衡常数小于乙
B.该温度下,平衡常数值为400
C.平衡时,丙中false是甲中的2倍
D.平衡时,甲中false的转化率大于乙中false的转化率
二、填空题
21.能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。
(1)已知:在25℃、101kPa下,1mol甲烷燃烧生成CO2和液态水时放热890.31kJ。请写出甲烷燃烧热的热化学方程式__________。
(2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).在其他条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大300℃)?。
①合成甲醇反应的△H__________(填“>”、“<”或“=”)0。
②平衡常数的表达式为:__________。温度为T2时的平衡常数__________(填“>”、“<”或“=”)温度为T1时的平衡常数。
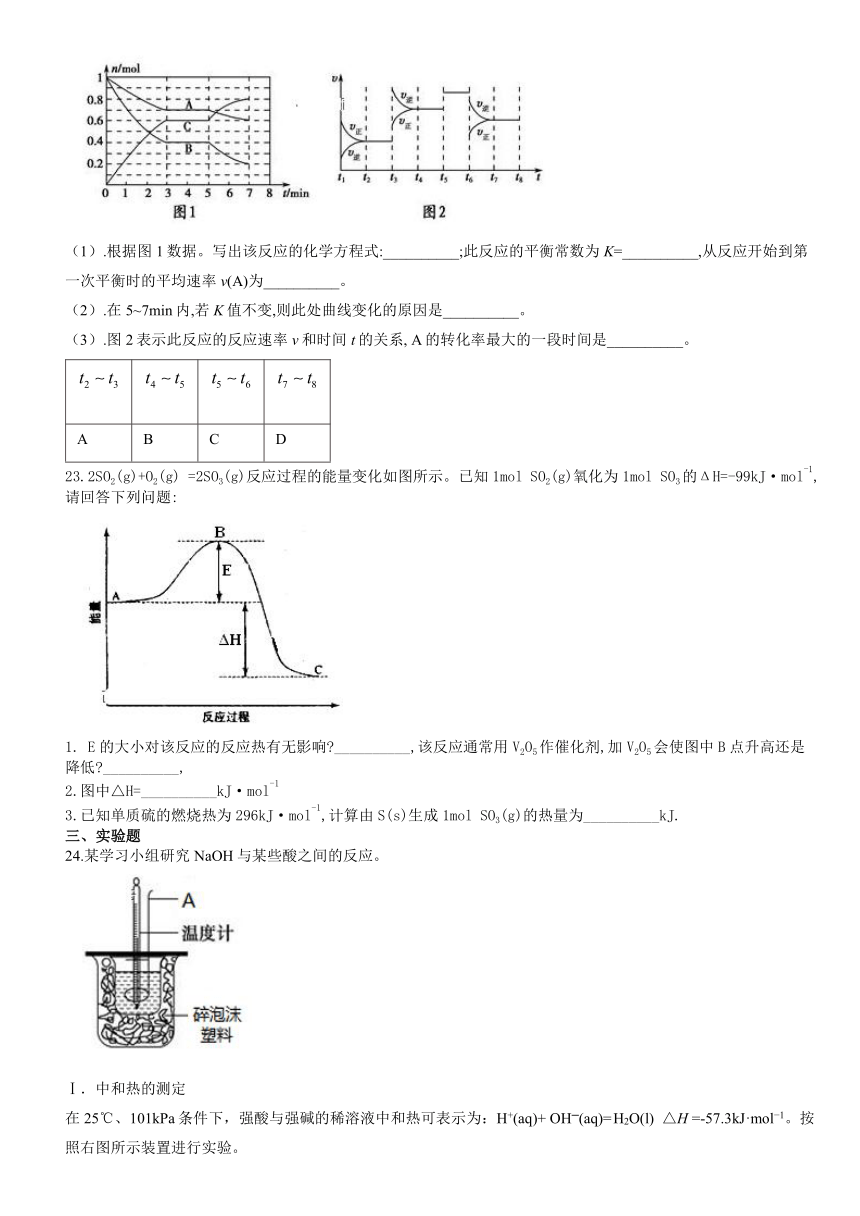
22. 25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间1的变化如图1所示,已知反应达到平衡后,降低温度,A的转化率将增大。
(1).根据图1数据。写出该反应的化学方程式:__________;此反应的平衡常数为K=__________,从反应开始到第一次平衡时的平均速率v(A)为__________。
(2).在5~7min内,若K值不变,则此处曲线变化的原因是__________。
(3).图2表示此反应的反应速率v和时间t的关系, A的转化率最大的一段时间是__________。
false
false
false
false
A
B
C
D
23.2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1,请回答下列问题:
1. E的大小对该反应的反应热有无影响?__________,该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?__________,
2.图中△H=__________kJ·mol-1
3.已知单质硫的燃烧热为296kJ·mol-1,计算由S(s)生成1mol SO3(g)的热量为__________kJ.
三、实验题
24.某学习小组研究NaOH与某些酸之间的反应。
Ⅰ.中和热的测定
在25℃、101kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+ OH─(aq)= H2O(l) △H =-57.3kJ·mol?1。按照右图所示装置进行实验。
(1)仪器A的名称是________________________。
(2)碎泡沫塑料的作用是____________________________________________。
(3)在25℃、101kPa条件下,取50mL 0.50 mol·L?1 CH3COOH溶液、50mL 0.55 mol·L?1 NaOH溶液进行实验,测得的中和热△H______-57.3kJ·mol?1(填“>”“=”或“<”)。
Ⅱ.某实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计方案如下(KMnO4溶液已酸化):
实验序号
A溶液
B溶液
①
30mL 0.1mol·L-1??H2C2O4溶液
20mL 0.01mol.L-1? KMnO4溶液
②
30mL 0.2mol·L-1?H2C2O4溶液
20mL 0.01mol.L-1? KMnO4溶液
1.若反应均未结束,则相同时间内针筒中所得CO2的体积大小关系是__________(填实验序号)。
2.若实验①在2min末注射器的活塞向右移动到了a mL的位置,则这段时间的反应速率可表示为v(CO2)=______________mL/min。若实验②在t min收集了4.48×10-3L CO2(标准状况下),则t min末c(false)=______________。
3.该小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是:①_____________________________? ② 反应放热使体系温度升高。
参考答案
1.答案:B
解析:
2.答案:D
解析:该反应化学计量数之和前后相等.减小容积相当于增大压强,对平衡移动无影响,故A项错误;加入催化剂,平衡不移动,Z 的产率不变,故B项错误;增大c (X),平衡向右移动,但X的转化率减小,Y的转化率增大,故C项错误;反应焓变小于0,为放热 反应,降低温度.平衡向右移动.Y的转化率增大,故D项正确。综上所述,本题正确答案为D。
3.答案:D
解析:A. 根据方程式知,反应前后气体计量数之和减小,则为熵减的反应,则△S<0,故A错误;
B.?△H>0、△S<0,则△G=△H?T△S>0,所以不能自发进行,故B错误;
C. 该反应为吸热反应,则反应物总能量小于生成物总能量,故C错误;
D.?△H>0、△S<0,则△G=△H?T△S>0,所以在任何温度下都不能自发进行,故D正确;
故选:D。
4.答案:A
解析:
5.答案:C
解析:
6.答案:A
解析:
7.答案:A
解析:A. 保持温度不变,将密闭容器的容积压缩为原来的12,如果平衡不移动,则达到新的平衡时C的浓度为2.0x?mol?L?1,但此时平衡时C的浓度为1.8x?mol?L?1,说明增大压强平衡向逆反应方向(气体体积减小)移动,说明2+m
C.v(C)=△c(C)/△t=xmol?L?1 / 1min=xmol ,v(B):v(C)=m:n,则v(B)=mx/n?(L?min)?1,故C错误;
D. 充入氦气,体积压强增大,但反应物浓度和生成物浓度都没有变,所以化学平衡不移动,故D错误,
故选:A。
8.答案:D
解析:
9.答案:D
解析:
10.答案:C
解析:标准状况下,11.2 L混合气体中,n(CH4)="×0.5" mol="0.4" mol,则n(H2)="0.1" mol,由于完全燃烧恢复到室温时,水为液体,因此H2燃烧放出的热量应按③进行计算,结果为0.4Q1+0.1Q3。
11.答案:A
解析:根据图知,随着反应的进行,Q点为平衡点,平衡后继续升高温度X转化率升高,平衡逆向移动,则正反应为放热反应,
A. 升高温度平衡逆向移动,则化学平衡常数减小,故A正确;
B. 平衡点Y的转化率最大,Q点为平衡点,则Q点Y的转化率最大,故B错误;
C.?W点平衡正向移动,则v正?>v逆,故C错误;
D. 温度越高化学反应速率越快,温度:W
故选:A。
12.答案:A
解析:
13.答案:A
解析:将题给热化学方程式依次标记为①、②、③,由于① false② false③,因此由盖斯定律可得: false,选项A正确。
14.答案:C
解析:
15.答案:B
解析:A.氢气的燃烧热是生成液态水,由已知条件无法求得,错误。 B正确。 C由于产物不同,无法比较,错误。D.②中若生成固态硫,将要放出一些热量,则吸收的热量比较少,△H将减小,错误。
16.答案:A
解析:
17.答案:C
解析:
18.答案:D
解析:反应体系体积和温度不变,必须是等效平衡才能使C的浓度和体积分数不变。
A. 起始物料为6mol C+2mol D等效于起始物料为4mol A+2mol B,反应达到平衡后C的浓度为2.4mol/L,体积分数为a%,故A错误;
B. 起始物料为4mol A+2mol B等效于如下过程:向两个1L的密闭容器中分别加入2mol A和1mol B,反应达到平衡后,两个容器中C的浓度均为1.2 mol/L,体积分数均为a%,将两个1L密闭容器压缩到一个容积为1L的容器中,平衡不移动,C的浓度为2.4mol/L ,体积分数为a%,故B错误;
C. 起始物料为1mol A+0.5mol B+1.5mol C等效于起始物料为1mol A+0.5mol B反应达平衡后再加入1.5mol C,与2mol A+1mol B不等效,反应达平衡后C的浓度和体积分数将发生变化,故C错误;
D. 物质D为固态物质,其量的增加对平衡移动无影响,所以起始物料为3mol C+5mol D等效于起始物料为2mol A+1mol B反应体系,反应达平衡后C的浓度和体积分数不变,故D正确。
故选:D。
19.答案:D
解析:中和热是指稀溶液中酸和碱反应生成1 mol H2O放出的热董.HCl和NaOH反应的中和热false=-57.3 kJ/mol,但由于稀 硫酸与氢氧化钙反应生成的硫酸钙微溶,则H2SO4和Ca(OH)2反应的中和热false-57. 3 kJ/mol,A错误;
由于气态水的能 量高于液态水的能量.则甲烷完全燃烧生成液态水放热多,但放热越多,false越小,因此反应CH4(g) + 2O2(g)=CO2(g) + 2H2O(g)的false>-890.3 kJ/mol错误;
合成氨反应是可逆反应,将1.5 mol H2和过量的N2在此条件下充分反应,放出 热量小于 46.2 kJ,C 错误;
Co(g)的燃烧热是 283.0 kJ/mol,则 2CO(g) +O2(g) =2CO(g) false=- 566. 0 kJ/mol,互为逆反 应时,焓变的数值相同、符号相反,则2CO2(g)—2CO(g)+O2(g)反应的false=+566. 0 kJ/mol,D正确。
20.答案:B
解析:A.温度相同时,该反应的平衡常数不变,则甲、乙中反应的平衡常数相等,故A错误;
B.根据false false,
开始 0.4?? 0.24? ? 0
转化 0.32?? 0.16?? 0.32
平衡 0.08?? 0.08?? 0.32
平衡浓度0.04?? 0.04?? 0.16
所以该温度下,平衡常数值为false,故B正确;
C.体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大,即丙中false大于甲中false的2倍,故C错误;
D.由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,则乙中false的转化率大于甲中false的转化率,故D错误;
故选B。
21.答案:(1)CH4(g)+2O2(g)CO2(g)+2H2O(l) △H=-890.31kJ/mol
(2)①<;
②false; <
解析:
23.答案:1.false; false; 0.05false
2.增大压强;3.false
解析:(1).由图1中曲线变化情况可知:A和B是反应物,C是生成物,再由物质的量的变化值可得化学计量数之比。
(2).已知反应达平衡后,降低温度,A的转化率将增大,说明正反应是放热反应。在5~7min内,K值不变,说明平衡移动不是由温度变化引起的,因此此处改变的条件只能是增大压强。
(3).根据速率-时间图象分析,false时改变的条件是升温,false时改变的条件是使用催化剂,false时改变的条件是减压,因此有false。由于false、false时条件的改变均导致化学平衡逆向移动,因此A的转化率最大的一段时间是false
24.答案:1.; 无影响; 降低; 催化剂改变反应历程,降低活化能E
2.-198; 3.0.025; 0.05; 4.S(s)+O2(g)=SO2(g)?△H1=-296 kJ·mol-1,SO2(g)+1/2O2(g)=SO3(g)?△H2=-99 kJ·mol-1,3S(s)+9/2O2(g)=3SO3(g) △H=(△H1+△H2)×3=-1185 kJ·mol-1
解析:
25.答案:
Ⅰ.(1) 环形玻璃搅拌棒 (2) 保温隔热、减少热量的损失 (3) >
Ⅱ.(1) 0.23 mol·L-1
滴入最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色
(2) EF
解析: Ⅰ.(1)根据仪器的特点,得到仪器名称:环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)碎泡沫塑料的导热效果差,可以起到保温作用,作用是:保温、隔热,减少实验过程中热量损失,故答案为:保温、隔热,减少实验过程中热量损失;
(3)CH3COOH是弱酸,在反应过程中会继续电离吸收热量,使放出的热量减少,中和反应的焓变是负值,△H>?57.3kJ/mol,故答案为:>;CH3COOH是弱酸,在反应过程中会继续电离吸收热量,使放出的热量减少,△H>?57.3?kJ/mol。
Ⅱ.(1)利用酸式滴定管量取20.00mL待测稀盐酸溶液放入锥形瓶中,因酸遇酚酞不变色,碱遇酚酞变红,则滴定终点的标志为最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色,半分钟内不褪色,由c(酸)=c碱V碱V酸可知,因第一次数据差别较大,则V(NaOH)=23.00+23.022mL=23.01mL,则c(HCl)=0.2mol/L×0.02301L0.02L=0.23mol/L,滴定达到终点的标志是:滴入最后一滴氢氧化钠溶液,溶液由无色恰好变成红色,半分钟内不褪色,
故答案为:0.23mol?L?1;滴入最后一滴氢氧化钠溶液,溶液由无色恰好变成红色,半分钟内不褪色;
(2) A.滴定终点读数时俯视读数,导致体积偏小,则测定结果偏小,故A错误;
B.酸式滴定管使用前,水洗后未用待测盐酸润洗,导致盐酸浓度较低,需要标准液体积偏小,则测定结果偏小,故B错误;
C.锥形瓶水洗后未干燥,对实验无影响,故C错误;
D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中,则NaOH浓度偏大,体积偏小,则测定结果偏小,故D错误;
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线,导致标准液体积偏大,则滴定结果偏高,故E正确;
F.碱式滴定管尖嘴部分有气泡,滴定后消失,导致标准液体积偏大,则滴定结果偏高,故F正确。
故答案为:EF。
26.答案:1.②>①; 2.(a-30)/2 ;3.2×10-3mol/L
3.①产物Mn2+是反应的催化剂
解析:
