鲁教版(五四制)八年级全一册化学5.3 化学反应中的有关计算 课件 (共40张PPT)
文档属性
| 名称 | 鲁教版(五四制)八年级全一册化学5.3 化学反应中的有关计算 课件 (共40张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-29 00:00:00 | ||
图片预览









文档简介
第三节 化学反应中的有关计算
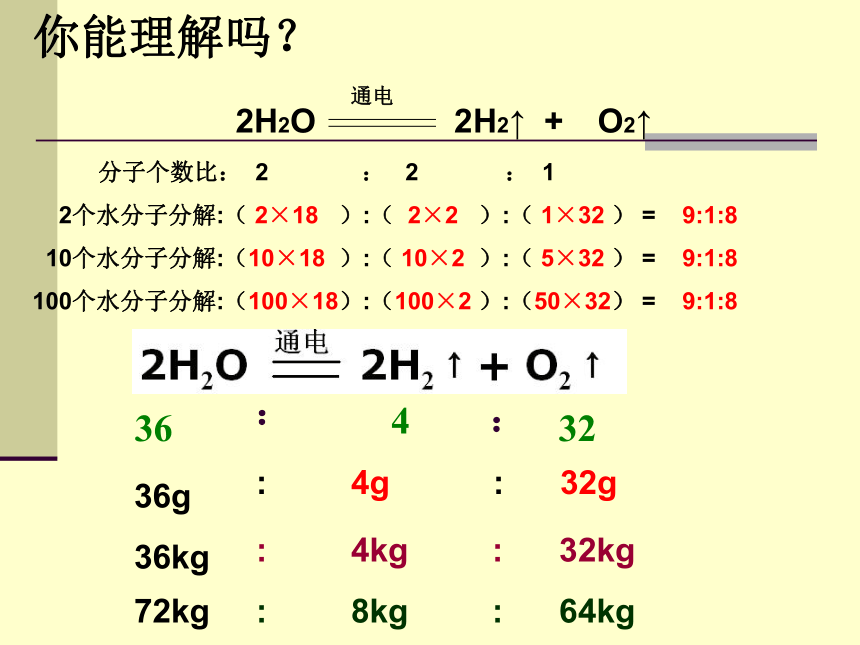
你能理解吗?
2H2O 2H2↑ + O2↑
分子个数比: 2 : 2 : 1
2个水分子分解:( 2×18 ):( 2×2 ):( 1×32 ) = 9:1:8
10个水分子分解:(10×18 ):( 10×2 ):( 5×32 ) = 9:1:8
100个水分子分解:(100×18):(100×2 ):(50×32) = 9:1:8
通电
: 4kg : 32kg
36kg
: 4g
72kg
36g
: 8kg : 64kg
: 32g
32
36
4
:
:
知识点归结:
㈠在化学反应中各物质的质量关系:
与物质的相对分子质量和物质的化学计量数有关
㈡根据化学方程式的计算依据是:
化学方程式中各物质间恒定的质量比
在化学反应中,反应物与生成物之间的质量比是成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应物(或生成物)的质量,可求生成物(或反应物)的质量。
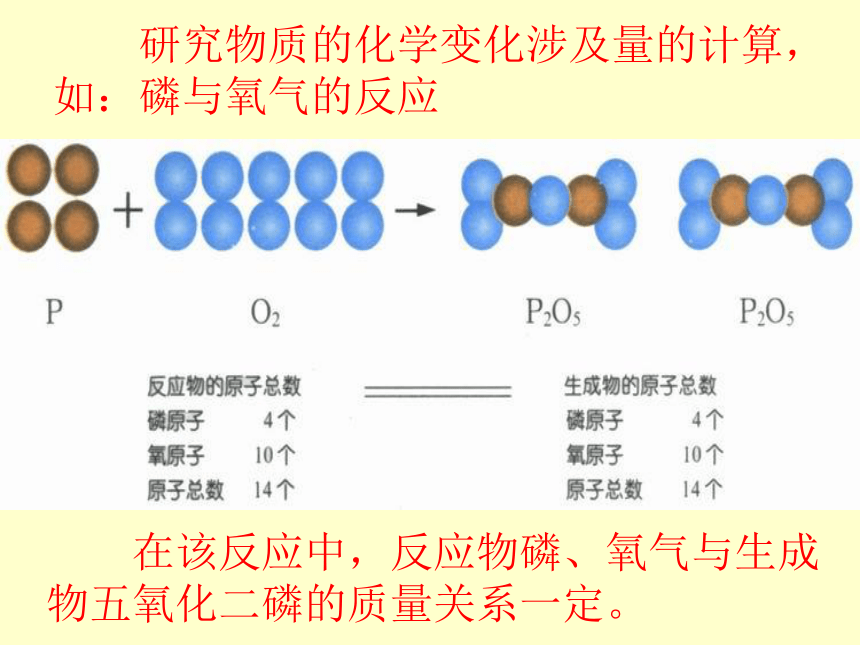
研究物质的化学变化涉及量的计算,如:磷与氧气的反应
在该反应中,反应物磷、氧气与生成物五氧化二磷的质量关系一定。
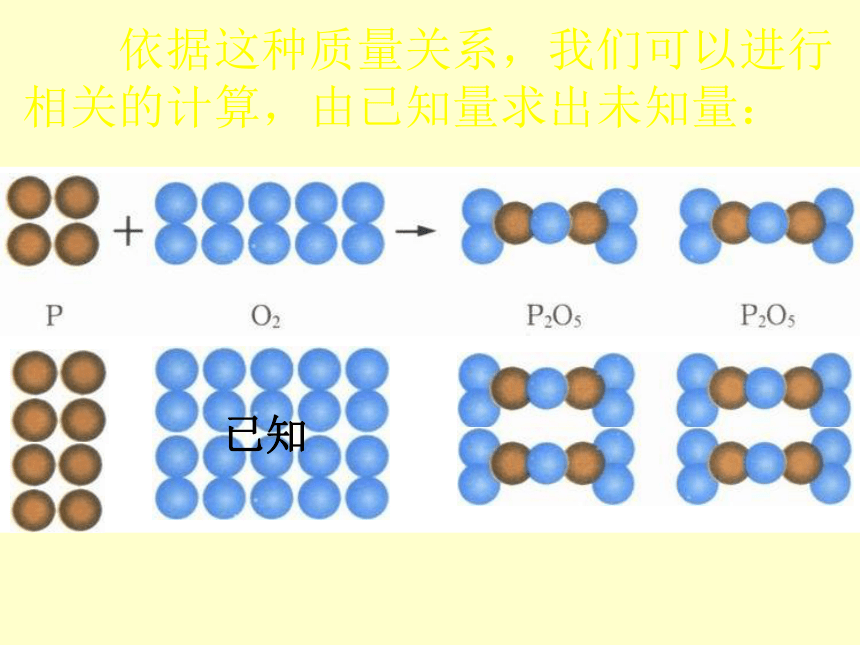
依据这种质量关系,我们可以进行相关的计算,由已知量求出未知量:
?
?
已知
未知
未知
我们一定要记住:
1、要正确写出化学方程式(很关键)。
2、要准确计算已知量与未知量的相对分子质量和(很重要)
3、解设未知数时不要写单位,但列比例时一定要写单位,计算结果也要写单位。
4、已知量与未知量的关系一定要在相应的物质下面对齐了
5、计算时可以先约分再计算
6、要仔细检查过程和结果。
解题过程
解:设需要氧化铝的质量为x
2Al2O3====4Al+3O2↑
204 108
x 1.08kg
=
x= =2.04kg
答:需要氧化铝的质量为2.04kg
归纳解题步骤
⑴设未知量
⑵写出反应的化学方程式
⑶写(找)出已知量与未知量的关系
⑷列比例式求解
⑸写出简明答案
⑹回顾检查
204
x
108
1.08kg
204×1.08kg
108
通电
根据化学方程式计算的步骤
设未知量
写出化学方程式并配平
写出有关物质的相对分子质量和已知量、未知量(找出已知量和未知量之间的关系)
列出比例式、求解
写出简明答案
回顾检查
例 加热分解6g高锰酸钾,可以得到多少克氧气?
解 设:加热分解 6g高锰酸钾,可以得到氧气的质量为x
2KMnO4 K2MnO4 +O2↑+MnO2
△
2×158
6g
32
x
答:加热分解 6g高锰酸钾,可以得到0.6g氧气。
简化格式:
2×158
6g
32
x
答:加热分解 6g高锰酸钾,可以得到0.6g氧气。
设:加热分解 6g高锰酸钾,可以得到氧气的质量为x
[解]
2KMnO4 K2MnO4 +O2↑+MnO2
△
一、根据化学方程式进行计算的步骤
(1)设未知数 ……………....….… 设
(2)写出化学方程式并配平 ...….写
(3) 写出有关物质的量
(4) 列比例式,求解 …...….……..列
(5) 简明地写出答案 ….….…..写
………………….….写
上:相对分子质量乘系数
下:已知质量和未知数
⑹回顾检查 …………………查
注意事项:
⑴.设未知量时一定要注意质量单位,已知量和未知量单位不一致的一定要进行单位换算,单位必须一致才能计算。
⑵.写出方程式要注意配平,而且要注意方程式的完整,反应条件、气体和沉淀的符号要注意标明。
⑶.相关物质的相对分子质量写在相应化学式的下面,一定要注意用相对分子质量乘以化学式前面的系数,已知量和未知量写在相应相对分子质量的下边。
⑷.计算结果的小数位保留按题中要求进行,若题中没有要求,一般保留一位小数。
化学方程式计算的三个要领和三个关键。
三个要领:
①步骤要完整;②格式要规范;③得数要准确。
三个关键:
①准确书写化学式; ②化学方程式要配平; ③准确计算相对分子质量。
练习1:15.5克红磷在氧气中充分燃烧,可 生成五氧化二磷多少克?
现 在 你 会 做 吗 ?
练习2、假如你是长征系列火箭推进器的设计师,已知,火箭升空至少要携带100kg的液氢,充分燃烧才能获得足够的量。你会在火箭助燃仓中填充多少千克的液氧来满足这些液氢的完全燃烧?
解:设完全燃烧100Kg液氢所需氧气质量为X
2H2 + O2 点 燃 2H2O
4
32
100Kg
X
4
100Kg
32
x
_______
=
X=800Kg
答:-------。
练习3、足量的镁带在标准状况下与11.2升的氧气(密度为1.43g/L) 充分燃烧,可以生成多少克氧化镁?
解:设可生成氧化镁的质量为X
2 Mg + O 2 ====== 2 Mg O
点燃
32 80
16g X
32
------ = ------
16g
80
X
X = ------------
80×16g
32
= 40g
答:充分燃烧后可生成氧化镁 40 克。
依题意,可知:
m(O2)=ρV=1.43g/L×11.2L=16g
二、根据化学方程式的简单计算
·山东教育版
质量守恒
未知量(设未知量)
化学方程式
关系
关系
(1)、已知一种反应物的质量,求生成物的质量。
例1:电解3.6g水,可以得到多少克氧气?
解:
(1)设未知量
设电解3.6g水,可以得到
氧气的质量为x。
(2)写出化学方程式
通电
2H2O = 2H2↑+ O2↑
(3)写出有关物质的
相对分子质量、
已知量和未知量。
36
32
3.6g
x
(4)列比例式。
(6)简明地写出答案。
答:电解3.6g水可以得到
3.2g氧气。
X=3.2g
(5)求解.
Zn+2HCl=ZnCl2+H2↑
65 136 2
32.5g x y
解:设可制得氢气的质量为x,氯化锌的
质量为y,根据题意得:
x=68g
y=1g
答:可制得氯化锌的质量为68克,氢气的质量为1克。
1、在实验室用32.5g锌跟足量的
盐酸反应可制得氢气和氯化锌
各多少g?
(Zn——65 H——1 Cl——35.5)
课堂练习
答:所需过氧化氢的质量至少为17g。
解:设所需过氧化氢的质量至少为x。
2H2O2 H2↑+O2↑
68 32
x 8g
(2)、已知一种生成物的质量,求反应物的质量。
例2、实验室用过氧化氢和二氧化锰制取氧气,若要制得8g氧气,最少需多少克的过氧化氢?
1、工业上,高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳。如果要制取28t氧化钙,需要碳酸钙多少吨?
当堂达标
答:需要碳酸钙50吨。
KMnO4 K2MnO4 + MnO2 + O2
解:设制取10Kg氧气需要高锰酸钾质量为x。
158
32
答:需要98.8Kg的高锰酸钾。
X=98.8Kg
X
10
158
——
32
=
X
——
10
2
2X
Kg
2X
Kg
2、 中国登山协会为纪念我国首次攀登珠穆朗玛峰成功50周年再次组织攀登,阿旺扎西等一行登山运动员于2003年5月21日13:40成功登顶。在登山过程中,人均携带10Kg的氧气,若实验室用高锰酸钾为原料,制取相同质量的氧气,需多少千克的高锰酸钾?
3、在“绿色氧化剂”双氧水(H2O2)的溶液中加入二氧化锰后,常温下即可产生大量氧气,若制取33.6L氧气需消耗过氧化氢多少克?(氧气的密度为1.429g/L)
纯度
·山东教育版
方法一:按方程式计算
解:设生成铁的质量为x
Fe2O3+3CO===2Fe+3CO2
160 112
1000t×80% x
160/ 1000t×80% =112/ x
x=560t
560t÷96%=583.3t
答:炼出生铁的质量为583.3t.
方法二:按铁元素的质量计算
反应前后铁元素的总量不变
Fe2O3中铁的质量分数为:
112/160×100%=70%
参加反应的铁原子的总质量为: 1000t×80%×70% =560t
560t÷96%=583.3t
答:炼出生铁的质量为583.3t.
方法一:按方程式计算
解:设生成生铁的质量为x
Fe2O3+3CO===2Fe+3CO2
160 112
1000t×80% x ×96%
160/ 1000t×80% =112/ x
x=583.3t
答:炼出生铁的质量为583.3t.
·山东教育版
B
有一块不纯的锌片15.25g,跟足量稀硫酸充分反应(杂质不跟硫酸反应),生成0.4g氢气,
求该锌片中锌的质量分数.
达标练习
用镁、铝、铁、锌分别与足量的盐酸反应制取氢气,若产生氢气的质量相同时,所消耗镁.铝.铁的质量比是多少?
达标练习
MMg:MAl:MFe:MZn
=12m:9m:28m:32.5m
=12:9:28:32.5
变式作业
天平两边的烧杯中分别放有硫酸锌溶液和稀硫酸,此时天平保持平衡。现分别向两边烧杯中投入少量质量相同的锌粒,过一
段时间,天平指针( )
A.偏向硫酸锌溶液一边
B.偏向稀硫酸一边
C.指针指向正中,天平保持平衡
D.无法确定
A
变式作业
在天平两边各放一个烧杯,在两烧杯中分别注入质量相等的、相同的稀硫酸(足量),调节天平至平衡。在左边烧杯中放入6.6克铝粉,为使天平最终保持平衡,右边烧杯中应放入镁粉的质量为( )
A. 6.6克 B. 6.5克
C. 6.4克 D. 6.3克
C
当堂练习
当堂小结
1.根据化学方程式计算的一般方法是:
掌握根据化学方程式计算各反应物和生成物之间的质量比是这类计算的关键。因此必须注意以下几点:
(1)认真审题,分析题目涉及到什么反应,已知物是什么,待求物是什么。
(2)正确书写出反应的化学方程式(这是正确解题的前提),因此在计算之前必须检查化学方程式是否正确(重点查:①各物质的化学式是否正确;②化学方程式是否符合质量守恒定律即是否配平。)。
(3)正确计算出反应中已知物质和待求物质的质量比。
(这是正确解题的关键)
(4)进行准确、熟练的数学运算(这是解题正确的保证)。
(5)要有完整的解题步骤和规范的书写格式。
(这是解题规范的必需)
3.根据化学方程式计算的注意事项:
(1)所有代入化学方程计算的量必须是纯净物的质量,如果是不纯物,则需要转换。
纯物质的质量=不纯物质质量×纯度=不纯物质质量×(1-杂质的质量分数)
(2)气体、液体的体积,要换算成气体、液体的质量。
?? 气体质量(g)=气体体积(L)×密度(g/L)
?? 液体质量(g)=液体体积(mL)×密度(g/mL)
(3)若题目中只给出一种物质的质量,则另一种物质的用量往往用“足量”、“适量”、“过量”或“完全反应”、“恰好完全反应”等来描述。如果同时知道两种反应物的质量,需要考虑过量问题。
(4)注意已知质量的单位;设未知数的时候要设×××的质量为X,而不能设××× X克;整个化学计算过程要带单位,最后求出的X的值后写上单位。(无说明则保留到小数点后一位)
1.在“绿色氧化剂”双氧水(H2O2)的溶液中加入二氧化锰后,常温下即可产生大量氧气,若制取48g氧气需消耗H2O2多少?
答: 若制取48g氧气需消H2O2102g。
X=
2×34×48g
32
=102g
解:设制取48g氧气需消耗纯净的双氧水的质量为X。
2×34
X
32 48g
2H2O2
MnO2
2H2O + O2
2×34
X
=
32
48g
课堂达标
2.有一种过氧化氢溶液10g,在二氧化锰的催化作用下,完全分解得到3.2g氧气,试求此过氧化氢溶液中过氧化氢的质量分数?
3、在反应4A+3B==2C中,若2.7gA完全反应生成 5.1 g的C.已知B的相对分子质量为32,则C的相对分子质量为( )
A、34 B、68 C、102 D 、204
C
你能理解吗?
2H2O 2H2↑ + O2↑
分子个数比: 2 : 2 : 1
2个水分子分解:( 2×18 ):( 2×2 ):( 1×32 ) = 9:1:8
10个水分子分解:(10×18 ):( 10×2 ):( 5×32 ) = 9:1:8
100个水分子分解:(100×18):(100×2 ):(50×32) = 9:1:8
通电
: 4kg : 32kg
36kg
: 4g
72kg
36g
: 8kg : 64kg
: 32g
32
36
4
:
:
知识点归结:
㈠在化学反应中各物质的质量关系:
与物质的相对分子质量和物质的化学计量数有关
㈡根据化学方程式的计算依据是:
化学方程式中各物质间恒定的质量比
在化学反应中,反应物与生成物之间的质量比是成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应物(或生成物)的质量,可求生成物(或反应物)的质量。
研究物质的化学变化涉及量的计算,如:磷与氧气的反应
在该反应中,反应物磷、氧气与生成物五氧化二磷的质量关系一定。
依据这种质量关系,我们可以进行相关的计算,由已知量求出未知量:
?
?
已知
未知
未知
我们一定要记住:
1、要正确写出化学方程式(很关键)。
2、要准确计算已知量与未知量的相对分子质量和(很重要)
3、解设未知数时不要写单位,但列比例时一定要写单位,计算结果也要写单位。
4、已知量与未知量的关系一定要在相应的物质下面对齐了
5、计算时可以先约分再计算
6、要仔细检查过程和结果。
解题过程
解:设需要氧化铝的质量为x
2Al2O3====4Al+3O2↑
204 108
x 1.08kg
=
x= =2.04kg
答:需要氧化铝的质量为2.04kg
归纳解题步骤
⑴设未知量
⑵写出反应的化学方程式
⑶写(找)出已知量与未知量的关系
⑷列比例式求解
⑸写出简明答案
⑹回顾检查
204
x
108
1.08kg
204×1.08kg
108
通电
根据化学方程式计算的步骤
设未知量
写出化学方程式并配平
写出有关物质的相对分子质量和已知量、未知量(找出已知量和未知量之间的关系)
列出比例式、求解
写出简明答案
回顾检查
例 加热分解6g高锰酸钾,可以得到多少克氧气?
解 设:加热分解 6g高锰酸钾,可以得到氧气的质量为x
2KMnO4 K2MnO4 +O2↑+MnO2
△
2×158
6g
32
x
答:加热分解 6g高锰酸钾,可以得到0.6g氧气。
简化格式:
2×158
6g
32
x
答:加热分解 6g高锰酸钾,可以得到0.6g氧气。
设:加热分解 6g高锰酸钾,可以得到氧气的质量为x
[解]
2KMnO4 K2MnO4 +O2↑+MnO2
△
一、根据化学方程式进行计算的步骤
(1)设未知数 ……………....….… 设
(2)写出化学方程式并配平 ...….写
(3) 写出有关物质的量
(4) 列比例式,求解 …...….……..列
(5) 简明地写出答案 ….….…..写
………………….….写
上:相对分子质量乘系数
下:已知质量和未知数
⑹回顾检查 …………………查
注意事项:
⑴.设未知量时一定要注意质量单位,已知量和未知量单位不一致的一定要进行单位换算,单位必须一致才能计算。
⑵.写出方程式要注意配平,而且要注意方程式的完整,反应条件、气体和沉淀的符号要注意标明。
⑶.相关物质的相对分子质量写在相应化学式的下面,一定要注意用相对分子质量乘以化学式前面的系数,已知量和未知量写在相应相对分子质量的下边。
⑷.计算结果的小数位保留按题中要求进行,若题中没有要求,一般保留一位小数。
化学方程式计算的三个要领和三个关键。
三个要领:
①步骤要完整;②格式要规范;③得数要准确。
三个关键:
①准确书写化学式; ②化学方程式要配平; ③准确计算相对分子质量。
练习1:15.5克红磷在氧气中充分燃烧,可 生成五氧化二磷多少克?
现 在 你 会 做 吗 ?
练习2、假如你是长征系列火箭推进器的设计师,已知,火箭升空至少要携带100kg的液氢,充分燃烧才能获得足够的量。你会在火箭助燃仓中填充多少千克的液氧来满足这些液氢的完全燃烧?
解:设完全燃烧100Kg液氢所需氧气质量为X
2H2 + O2 点 燃 2H2O
4
32
100Kg
X
4
100Kg
32
x
_______
=
X=800Kg
答:-------。
练习3、足量的镁带在标准状况下与11.2升的氧气(密度为1.43g/L) 充分燃烧,可以生成多少克氧化镁?
解:设可生成氧化镁的质量为X
2 Mg + O 2 ====== 2 Mg O
点燃
32 80
16g X
32
------ = ------
16g
80
X
X = ------------
80×16g
32
= 40g
答:充分燃烧后可生成氧化镁 40 克。
依题意,可知:
m(O2)=ρV=1.43g/L×11.2L=16g
二、根据化学方程式的简单计算
·山东教育版
质量守恒
未知量(设未知量)
化学方程式
关系
关系
(1)、已知一种反应物的质量,求生成物的质量。
例1:电解3.6g水,可以得到多少克氧气?
解:
(1)设未知量
设电解3.6g水,可以得到
氧气的质量为x。
(2)写出化学方程式
通电
2H2O = 2H2↑+ O2↑
(3)写出有关物质的
相对分子质量、
已知量和未知量。
36
32
3.6g
x
(4)列比例式。
(6)简明地写出答案。
答:电解3.6g水可以得到
3.2g氧气。
X=3.2g
(5)求解.
Zn+2HCl=ZnCl2+H2↑
65 136 2
32.5g x y
解:设可制得氢气的质量为x,氯化锌的
质量为y,根据题意得:
x=68g
y=1g
答:可制得氯化锌的质量为68克,氢气的质量为1克。
1、在实验室用32.5g锌跟足量的
盐酸反应可制得氢气和氯化锌
各多少g?
(Zn——65 H——1 Cl——35.5)
课堂练习
答:所需过氧化氢的质量至少为17g。
解:设所需过氧化氢的质量至少为x。
2H2O2 H2↑+O2↑
68 32
x 8g
(2)、已知一种生成物的质量,求反应物的质量。
例2、实验室用过氧化氢和二氧化锰制取氧气,若要制得8g氧气,最少需多少克的过氧化氢?
1、工业上,高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳。如果要制取28t氧化钙,需要碳酸钙多少吨?
当堂达标
答:需要碳酸钙50吨。
KMnO4 K2MnO4 + MnO2 + O2
解:设制取10Kg氧气需要高锰酸钾质量为x。
158
32
答:需要98.8Kg的高锰酸钾。
X=98.8Kg
X
10
158
——
32
=
X
——
10
2
2X
Kg
2X
Kg
2、 中国登山协会为纪念我国首次攀登珠穆朗玛峰成功50周年再次组织攀登,阿旺扎西等一行登山运动员于2003年5月21日13:40成功登顶。在登山过程中,人均携带10Kg的氧气,若实验室用高锰酸钾为原料,制取相同质量的氧气,需多少千克的高锰酸钾?
3、在“绿色氧化剂”双氧水(H2O2)的溶液中加入二氧化锰后,常温下即可产生大量氧气,若制取33.6L氧气需消耗过氧化氢多少克?(氧气的密度为1.429g/L)
纯度
·山东教育版
方法一:按方程式计算
解:设生成铁的质量为x
Fe2O3+3CO===2Fe+3CO2
160 112
1000t×80% x
160/ 1000t×80% =112/ x
x=560t
560t÷96%=583.3t
答:炼出生铁的质量为583.3t.
方法二:按铁元素的质量计算
反应前后铁元素的总量不变
Fe2O3中铁的质量分数为:
112/160×100%=70%
参加反应的铁原子的总质量为: 1000t×80%×70% =560t
560t÷96%=583.3t
答:炼出生铁的质量为583.3t.
方法一:按方程式计算
解:设生成生铁的质量为x
Fe2O3+3CO===2Fe+3CO2
160 112
1000t×80% x ×96%
160/ 1000t×80% =112/ x
x=583.3t
答:炼出生铁的质量为583.3t.
·山东教育版
B
有一块不纯的锌片15.25g,跟足量稀硫酸充分反应(杂质不跟硫酸反应),生成0.4g氢气,
求该锌片中锌的质量分数.
达标练习
用镁、铝、铁、锌分别与足量的盐酸反应制取氢气,若产生氢气的质量相同时,所消耗镁.铝.铁的质量比是多少?
达标练习
MMg:MAl:MFe:MZn
=12m:9m:28m:32.5m
=12:9:28:32.5
变式作业
天平两边的烧杯中分别放有硫酸锌溶液和稀硫酸,此时天平保持平衡。现分别向两边烧杯中投入少量质量相同的锌粒,过一
段时间,天平指针( )
A.偏向硫酸锌溶液一边
B.偏向稀硫酸一边
C.指针指向正中,天平保持平衡
D.无法确定
A
变式作业
在天平两边各放一个烧杯,在两烧杯中分别注入质量相等的、相同的稀硫酸(足量),调节天平至平衡。在左边烧杯中放入6.6克铝粉,为使天平最终保持平衡,右边烧杯中应放入镁粉的质量为( )
A. 6.6克 B. 6.5克
C. 6.4克 D. 6.3克
C
当堂练习
当堂小结
1.根据化学方程式计算的一般方法是:
掌握根据化学方程式计算各反应物和生成物之间的质量比是这类计算的关键。因此必须注意以下几点:
(1)认真审题,分析题目涉及到什么反应,已知物是什么,待求物是什么。
(2)正确书写出反应的化学方程式(这是正确解题的前提),因此在计算之前必须检查化学方程式是否正确(重点查:①各物质的化学式是否正确;②化学方程式是否符合质量守恒定律即是否配平。)。
(3)正确计算出反应中已知物质和待求物质的质量比。
(这是正确解题的关键)
(4)进行准确、熟练的数学运算(这是解题正确的保证)。
(5)要有完整的解题步骤和规范的书写格式。
(这是解题规范的必需)
3.根据化学方程式计算的注意事项:
(1)所有代入化学方程计算的量必须是纯净物的质量,如果是不纯物,则需要转换。
纯物质的质量=不纯物质质量×纯度=不纯物质质量×(1-杂质的质量分数)
(2)气体、液体的体积,要换算成气体、液体的质量。
?? 气体质量(g)=气体体积(L)×密度(g/L)
?? 液体质量(g)=液体体积(mL)×密度(g/mL)
(3)若题目中只给出一种物质的质量,则另一种物质的用量往往用“足量”、“适量”、“过量”或“完全反应”、“恰好完全反应”等来描述。如果同时知道两种反应物的质量,需要考虑过量问题。
(4)注意已知质量的单位;设未知数的时候要设×××的质量为X,而不能设××× X克;整个化学计算过程要带单位,最后求出的X的值后写上单位。(无说明则保留到小数点后一位)
1.在“绿色氧化剂”双氧水(H2O2)的溶液中加入二氧化锰后,常温下即可产生大量氧气,若制取48g氧气需消耗H2O2多少?
答: 若制取48g氧气需消H2O2102g。
X=
2×34×48g
32
=102g
解:设制取48g氧气需消耗纯净的双氧水的质量为X。
2×34
X
32 48g
2H2O2
MnO2
2H2O + O2
2×34
X
=
32
48g
课堂达标
2.有一种过氧化氢溶液10g,在二氧化锰的催化作用下,完全分解得到3.2g氧气,试求此过氧化氢溶液中过氧化氢的质量分数?
3、在反应4A+3B==2C中,若2.7gA完全反应生成 5.1 g的C.已知B的相对分子质量为32,则C的相对分子质量为( )
A、34 B、68 C、102 D 、204
C
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
