鄞州高级中学高三化学十月份月考试卷
文档属性
| 名称 | 鄞州高级中学高三化学十月份月考试卷 |

|
|
| 格式 | zip | ||
| 文件大小 | 372.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-30 00:00:00 | ||
图片预览



文档简介
鄞州高级中学2021届高三10月月考化学试题卷
命题人:许建华?????????
审题人:王叶浓
何强
可能用到的相对原子质量:H
1 C
12 O
16 Mg
24 Al
27 Fe
56
一、选择题(本大题共25小题,每小题2分,共50分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.水溶液呈中性的是
A.NaNO3
B.NaHSO4
C.HCOONa
D.NaHCO3
2.互溶的两种沸点不同的有机物分离操作中,需要用到的仪器是
A.
B.
C.
D.
3.下列物质在熔融状态下能导电的是
A.C2H5OH
B.NH3·H2O
C.HCl
D.KCl
4.下列物质对应的组成正确的是
A.NaHCO3:苏打
B.BaSO4:重晶石
C.H2NCH2COOH:丙氨酸
D.绿矾:KAl(SO4)2·12H2O
5.下列表示不正确的是
A.乙炔的结构式:H-C≡C-H
B.甲酸乙酯的结构简式:C3H6O2
C.2?甲基丁烷的键线式:
D.甲基的电子式:
6.下列说法正确的是
A.天然气是可再生能源
B.用水煤气可合成液态碳氢化合物和含氧有机物
C.石油的分馏和煤的干馏属于物理变化
D.煤中含有苯、甲苯、二甲苯等有机物,可以通过煤的干馏得到
7.下列说法正确的是
A.16O和18O是两种不同的元素
B.单晶硅和石英互为同素异形体
C.甘油和酒精互为同系物
D.Be与Ca在元素周期表中处于同一主族
8.下列说法不正确的是
A.Cl?会破坏铝表面的氧化膜
B.黄绿色气体
ClO2是一种高效安全的灭菌消毒剂
C.KMnO4具有氧化性,其稀溶液可用于消毒
D.钢铁在潮湿空气中生锈主要是发生了化学腐蚀
9.下列说法不正确的是
A.金属钠可用来制造透雾能力强的高压钠灯
B.某些含铝的化合物可作净水剂
C.硫酸铁可用于治疗缺铁性贫血
D.二氧化硅可用于制造光导纤维
10.反应
KClO3+6HCl===KCl+3Cl2↑+3H2O
中,氧化产物和还原产物物质的量之比是:
A.1:3
B.3:1
C.5:1
D.1:5
11.下列有关实验说法不正确的是
A.萃取Br2时,向盛有溴水的分液漏斗中加入苯,振荡、静置分层后,打开旋塞,先将水层放出,上层液体从上口倒出
B.做焰色反应前,铂丝用稀盐酸清洗并灼烧至火焰呈无色
C.乙醇、汽油等有机溶剂易被引燃,使用时须远离明火,用毕立即塞紧瓶塞
D.在中和热的测定实验中,将氢氧化钠和盐酸混合后,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度
12.下列说法正确的是
A.Ca单质可以从TiCl4中置换出Ti
B.Mg加入到过量FeCl3溶液中可得Fe
C.FeS2在沸腾炉中与O2反应主要生成SO3
D.H2O2溶液中加入少量MnO2粉末生成H2和O2
13.能正确表示下列反应的离子方程式是
A.(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:SO+Ba2+=BaSO4↓
B.电解MgCl2水溶液:2Cl?+2H2O2OH?+Cl2↑+H2↑
C.乙酸乙酯与NaOH溶液共热:CH3COOCH2CH3+OH?CH3COO?+CH3CH2OH
D.CuSO4溶液中滴加稀氨水:Cu2++2OH?=Cu(OH)2↓
14.下列说法不正确的是
A.石油经催化裂化得到的汽油能使溴水和酸性高锰酸钾溶液褪色
B.用酸性
KMnO4
溶液(必要时可加热)能鉴别苯、甲苯、乙醇、乙酸乙酯
C.苯酚溶液可用氯化铁溶液或溴水检验
D.乙醛、乙酸、乙酸乙酯可用新制
Cu(OH)2悬浊液鉴别
15.有关下图所示化合物的说法正确的是
A.能发生取代、消去、中和、氧化等反应
B.1
mol
该化合物最多可以与
4
mol
Br2
反应
C.既可以催化加氢,又可以使酸性
KMnO4溶液褪色
D.可以与
FeCl3
溶液发生显色反应,但不能与
NaOH
溶液反应
16.下列说法正确的是
A.同一原子中,在离核较远的区域运动的电子能量较高
B.原子核外电子排布,先排满K层再排L层、先排满M层再排N层
C.同一周期中,随着核电荷数的增加,元素的原子半径逐渐增大
D.同一周期中,ⅡA与ⅢA族元素原子的核电荷数都相差1
17.下列说法不正确的是
A.将KCl溶液从常温加热至80℃,溶液的pH变小但仍保持中性
B.中和pH和体积均相等的氨水、NaOH溶液,所需HCl的物质的量相同
C.相同温度下,pH相等的盐酸、CH3COOH溶液中,c(OH?)相等
D.氨水和盐酸反应后的溶液,若溶液呈中性,则c(Cl?)=c(NH)
18.5
mL
0.1
mol·L?1
KI溶液与1
mL
0.1
mol·L?1
FeCl3溶液发生反应:
2Fe3+(aq)+2I?(aq)
2Fe2+(aq)+I2(aq),达到平衡。下别说法不正确的是
A.加入苯,振荡,平衡正向移动
B.经苯2次萃取分离后,在水溶液中加入KSCN,溶液呈血红色,表明该化学反应存在限度
C.加入FeSO4固体,平衡逆向移动
D.该反应的平衡常数K=
19.国际计量大会第
26
次会议新修订了阿伏伽德罗常数(NA=6.02×1023
mol?1),并于
2019
年
5
月
20
日正式生效。下列说法正确的是
A.标况下
1
个
N2
分子的体积小于22.4/NA
L
B.12
g
金刚石和石墨中均含有
2NA个共价键
C.1
L
1
mol·L?1的硫酸钠溶液中含有的氧原子数为
0.4NA
D.16.25
g
FeCl3
水解形成的
Fe(OH)3
胶体粒子数为
0.1NA
20.一定条件下:2NO2(g)
N2O4(g) ΔH<0。在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是
A.温度0℃、压强50
kPa
B.温度130℃、压强300
kPa
C.温度25℃、压强100
kPa
D.温度130℃、压强50
kPa
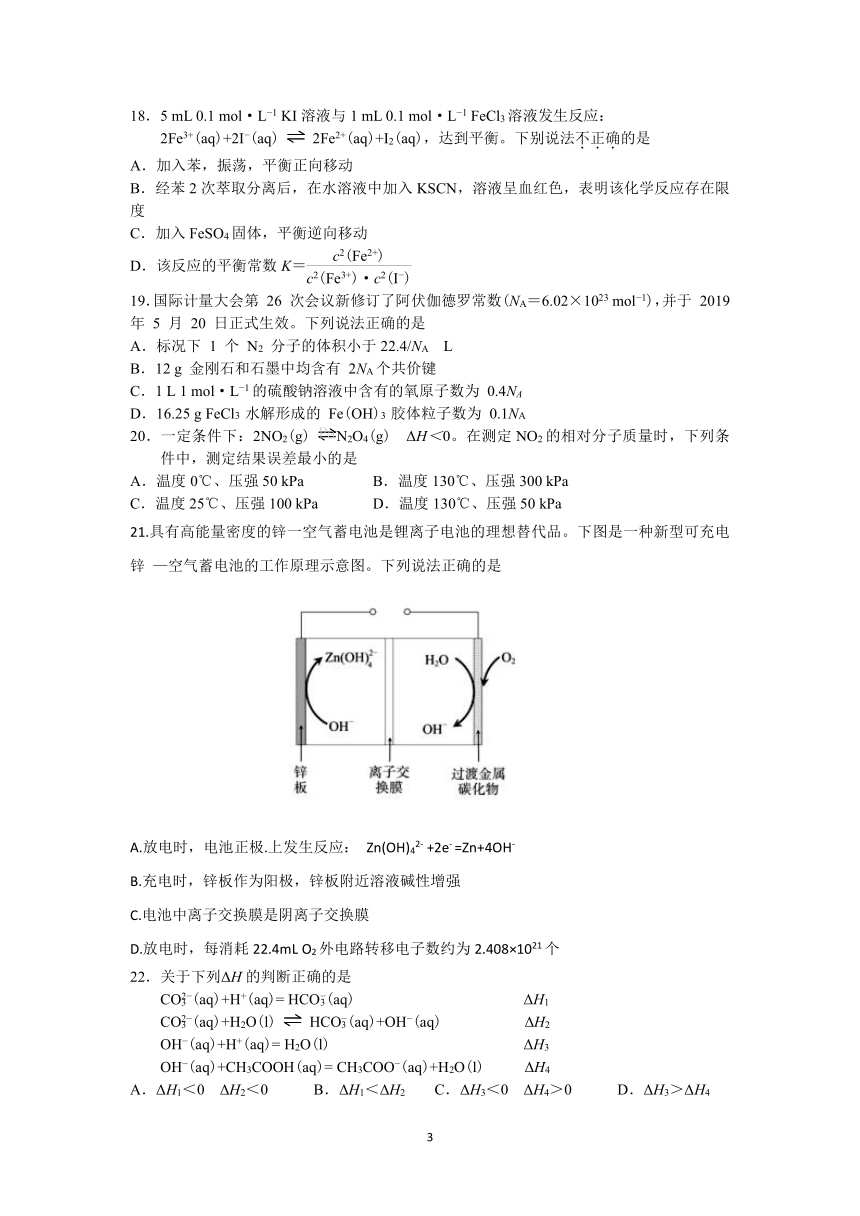
21.具有高能量密度的锌一空气蓄电池是锂离子电池的理想替代品。下图是一种新型可充电锌
—空气蓄电池的工作原理示意图。下列说法正确的是
A.放电时,电池正极.上发生反应:
Zn(OH)42-
+2e-
=Zn+4OH-
B.充电时,锌板作为阳极,锌板附近溶液碱性增强
C.电池中离子交换膜是阴离子交换膜
D.放电时,每消耗22.4mL
O2外电路转移电子数约为2.408×1021个
22.关于下列ΔH的判断正确的是
CO(aq)+H+(aq)=
HCO(aq)
ΔH1
CO(aq)+H2O(l)
HCO(aq)+OH?(aq)
ΔH2
OH?(aq)+H+(aq)=
H2O(l)
ΔH3
OH?(aq)+CH3COOH(aq)=
CH3COO?(aq)+H2O(l)
ΔH4
A.ΔH1<0 ΔH2<0
B.ΔH1<ΔH2
C.ΔH3<0 ΔH4>0
D.ΔH3>ΔH4
23.常温下,用0.1
mol·L?1氨水滴定10
mL浓度均为0.1
mol·L?1的HCl和CH3COOH的混合液,下列说法不正确的是
A.在氨水滴定前,HCl和CH3COOH的混合液中c(Cl?)>c(CH3COO?)
B.当滴入氨水10
mL时,c(NH)+c(NH3·H2O)=c(CH3COO?)+c(CH3COOH)
C.当滴入氨水20
mL时,c(CH3COOH)+c(H+)=c(NH3·H2O)+c(OH?)
D.当溶液呈中性时,氨水滴入量大于20
mL,c(NH)<c(Cl?)
24.过硝酸钠(NaNO4)能与水发生反应:NaNO4+H2O===NaNO3+H2O2,
下列说法不正确的是
A.过硝酸钠可用于杀菌消毒
B.过硝酸钠中含有—O—O—结构
C.过硝酸钠具有强氧化性,没有还原性
D.将过硝酸钠加入酸性
FeSO4溶液中发生的离子方程式:
NO4?+2Fe2++2H+
===NO3?+2Fe3++H2O
25.黄色固体X,可能含有漂白粉、FeSO4、Fe2(SO4)3、CuCl2、KI之中的几种或全部。将X与足量的水作用,得到深棕色固体混合物Y和无色碱性溶液Z。下列结论合理的是
A.X中含KI,可能含有CuCl2
B.X中含有漂白粉和FeSO4
C.X中含有CuCl2,Y中含有Fe(OH)3
D.用H2SO4酸化溶液Z,若有黄绿色气体放出,说明X中含有CuCl2
二、非选择题(本大题共6小题,共50分)
26.(4分)
(1)气态氢化物热稳定性NH3大于PH3的主要原因是
。
(2)NH4CN是离子化合物,各原子除了H均满足8电子稳定结构,NH4CN的电子式是
。
(3)常温下,在水中的溶解度乙醇大于乙苯,原因是
。
(4)FeCl3溶液中加入Cu片,反应的离子方程式是
27.(4分)为测定FeC2O4·2H2O(M=180
g·mol?1)样品的纯度,用硫酸溶解6.500
g样品,定容至250
mL。取25.00
mL溶液,用0.1000
mol·L?1
KMnO4标准溶液滴定至终点。重复实验,数据如下:
序号
滴定前读数/mL
滴定终点读数/mL
1
0.00
19.98
2
1.20
22.40
3
1.54
21.56
已知:3MnO+5FeC2O4·2H2O+24H+3Mn2++5Fe3++10CO2↑+22H2O
假设杂质不参加反应。
该样品中FeC2O4·2H2O的质量分数是________%(保留小数点后一位);
写出简要计算过程:
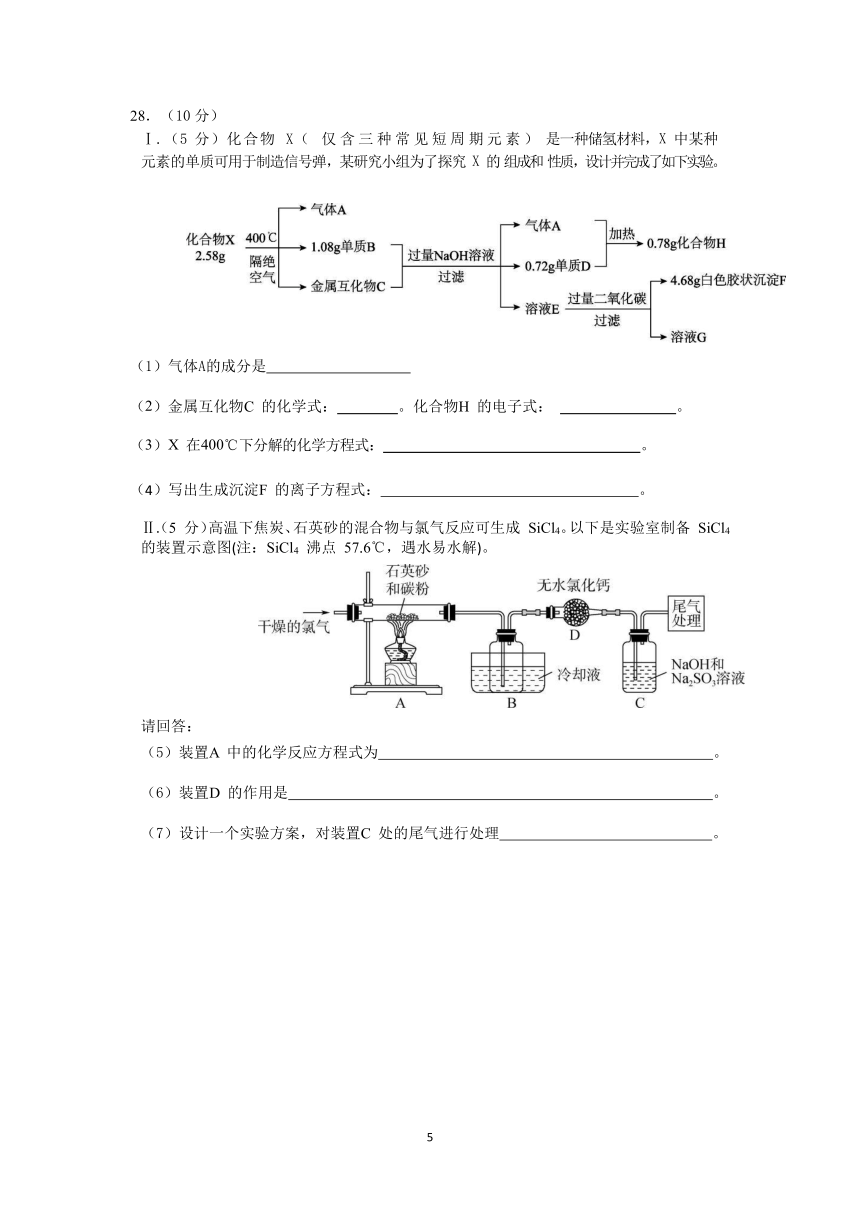
28.(10分)
Ⅰ.(5
分)化合物
X(
仅含三种常见短周期元素)
是一种储氢材料,X
中某种元素的单质可用于制造信号弹,某研究小组为了探究
X
的
组成和
性质,设计并完成了如下实验。
(1)气体A的成分是
(2)金属互化物
C
的化学式:
。化合物
H
的电子式:
。
(3)X
在
400℃下分解的化学方程式:
。
写出生成沉淀
F
的离子方程式:
。
Ⅱ.(5
分)高温下焦炭、石英砂的混合物与氯气反应可生成
SiCl4。以下是实验室制备
SiCl4
的装置示意图(注:SiCl4
沸点
57.6℃,遇水易水解)。
请回答:
(5)装置
A
中的化学反应方程式为
。
(6)装置
D
的作用是
。
(7)设计一个实验方案,对装置
C
处的尾气进行处理
。
29.(10分)研究CO2氧化C2H6制C2H4对资源综合利用
有重要意义。相关的主要化学反应有:
Ⅰ C2H6(g)
C2H4(g)+H2(g)
ΔH1=136
kJ·mol?1
Ⅱ C2H6(g)+CO2(g)
C2H4(g)+H2O(g)+CO(g)
ΔH2=177
kJ·mol?1
Ⅲ C2H6(g)+2CO2(g)
4CO(g)+3H2(g) ΔH3
Ⅳ CO2(g)+H2(g)
CO(g)+H2O(g)
ΔH4=41
kJ·mol?1
已知:298K时,相关物质的相对能量(如图1)。
可根据相关物质的相对能量计算反应或变化的ΔH
(ΔH随温度变化可忽略)。例如:
H2O(g)=
H2O(l) ΔH=?286
kJ·mol?1-(-242
kJ·mol?1)=-44
kJ·mol?1。
请回答:
(1)①根据相关物质的相对能量计算ΔH3=_______kJ·mol?1。
②下列描述正确的是________。
A.升高温度反应Ⅰ的平衡常数增大
B.加压有利于反应Ⅰ、Ⅱ的平衡正
向移动
C.反应Ⅲ有助于乙烷脱氢,有利于
乙烯生成
D.恒温恒压下通水蒸气,反应Ⅳ的
平衡逆向移动
③有研究表明,在催化剂存在下,
反应Ⅱ分两步进行,过程如下:
[C2H6(g)+CO2(g)]
→[C2H4(g)+H2(g)+CO2(g)]
→[C2H4(g)+CO(g)+H2O(g)],
且第二步速率较慢(反应活化能为210
kJ·mol?1)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量?反应
过程图”,起点从[C2H6(g)+CO2(g)]的能量?477
kJ·mol?1开始(如图2)。
(2)①CO2和C2H6按物质的量1∶1投料,在923
K和保持总压恒定的条件下,
研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如下表:
催化剂
转化率C2H6/%
转化率CO2/%
产率C2H4/%
催化剂X
19.0
37.6
3.3
结合具体反应分析,在催化剂X作用下,CO2氧化C2H6的主要产物是
________,判断依据是
。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高C2H4的选择性(生成C2H4的物质的量与消耗C2H6的物质的量之比)。在773
K,乙烷平衡转化率为9.1%,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到11.0%。结合具体反应说明乙烷转化率增大的原因是
。
(10分)
I.
某学习小组欲从含有[Cu(NH3)4]SO4、乙醇和氨水的实验室废液中分离乙醇并制备硫酸铜铵[CuSO4·(NH4)2SO4]固体,完成了如下实验:
已知:[Cu(NH3)4]2++4H+Cu2++4NH
请回答:
(1)
步骤①中,试剂X应采用________。
(2)
甲、乙两同学取相同量的溶液Y分别进行蒸馏,收集到的馏出液体积相近,经检测,甲同学的馏出液中乙醇的含量明显偏低,可能的原因是________。
(3)
设计实验方案验证硫酸铜铵固体中的NH________。
II.用无水Na2CO3固体配制250
mL
0.1000
mol·L-1的溶液。请回答:
(4)在配制溶液需要称量的Na2CO3固体为
克。
(5)定容时的操作:当液面接近容量瓶刻度线时,
,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(6)下列操作会使配得的Na2CO3溶液浓度偏低的是
。
A.称取相同质量的Na2CO3·10H2O固体进行配制
B.定容时俯视容量瓶的刻度线
C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制
31.(12分)某有机物F()在自身免疫性疾病的治疗中有着重要的应用,工业上以乙烯和芳香族化合物B为基本原料制备F的路线图如下:
已知:RCHO+R1CH2CHO
(1)乙烯生成A的原子利用率为100%,则X是________(填化学式),F中含氧官能团的名称为________。
(2)E→F的反应类型为________,B的结构简式为
(3)写出D与NaOH溶液反应的化学方程式:____________________________________________________________。
(4)E有多种同分异构体,符合下列条件的同分异构体有________种,其中核磁共振氢谱有6个峰的物质的结构简式为________。
①能发生水解反应、银镜反应且1
mol该物质最多可还原出4
mol
Ag②遇FeCl3溶液发生显色反应③分子中没有甲基,且苯环上有2个取代基
(5)以乙烯为基本原料,设计合成路线合成2?丁烯酸(CH3CH=CHCOOH),写出合成路线(其他试剂任选)。
鄞州高级中学2021届高三10月月考化学答题卷
1-25题:请将选择题答案写入下列表格:(单选,每题2分,共50分)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26.(4分)
(1)
。
(2)
。
(3)
。
(4)
27.(4分)
%(保留小数点后一位);
28.(10分)
(1)
(2)
。
。
(3)
。
(4)
。
(5)
。
(6)
。
(7)
。
29.(10分)
(1)①ΔH3=
kJ·mol?1。②________。
③
①
,
②
。
30.(10分)
(1)
。
(2)
。
(3)
________
(4)
。
(5)
,
(6)
。
31.(12分)
(1)
,
。
(2)
,
(3)____________________________________________________________。
(4)________,
。
(5)
鄞州高级中学2021届高三10月月考化学试题参考答案
1
2
3
4
5
6
7
8
9
10
A
B
D
B
B
B
D
D
C
C
11
12
13
14
15
16
17
18
19
20
D
A
C
B
C
A
B
D
A
D
21
22
23
24
25
C
B
D
C
C
(4分)(1)N-H键键能大于P-H键(2)
(3)乙醇和水分子间存在氢键,乙苯和水分子间没有氢键。(4)2Fe3++Cu=2Fe2++Cu2+
27.(4分)
(1)
92.3%
(2)
28.(10分)
I(1)H2
(2)
Mg3Al2
[H:]-Mg2+[H:]-
(3)3Mg(AlH4)2=12H2+4Al+Mg3Al2
(4)
AlO2-+CO2+2H2O=Al(OH)3+HCO3-
高温
高温
高温
II(1)SiO2+2C+Cl2=SiCl4+2CO
或者SiO2+2C=Si+2CO
Si+2Cl2=SiC4
避免水蒸气进入B,防止SiCl4水解。
C中尾气主要是CO,可在出口处放一个点燃的酒精灯将CO燃烧成无害的CO2或绑一塑料袋将CO收集。
30.(10分)
(1)H2SO4溶液(2)加热温度偏高,馏出速度过快;冷却效果不好,造成乙醇损失。
(3)取少量固体于试管中加水溶解,滴加足量NaOH溶液,振荡,加热,用湿润的红色石蕊试纸置于试管口,若观察到试纸变蓝,则证明含NH4+
(4)2.6
应改用胶头滴管加水至凹液面与刻度线相切。
AC
(12分)
(1)O2
(酚)羟基,酯基
(2)酯化(取代)反应
(3)
3
CH2=CH2
CH3CHO
CH3CH=CHCHO
CH3CH=CHCOOH
命题人:许建华?????????
审题人:王叶浓
何强
可能用到的相对原子质量:H
1 C
12 O
16 Mg
24 Al
27 Fe
56
一、选择题(本大题共25小题,每小题2分,共50分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.水溶液呈中性的是
A.NaNO3
B.NaHSO4
C.HCOONa
D.NaHCO3
2.互溶的两种沸点不同的有机物分离操作中,需要用到的仪器是
A.
B.
C.
D.
3.下列物质在熔融状态下能导电的是
A.C2H5OH
B.NH3·H2O
C.HCl
D.KCl
4.下列物质对应的组成正确的是
A.NaHCO3:苏打
B.BaSO4:重晶石
C.H2NCH2COOH:丙氨酸
D.绿矾:KAl(SO4)2·12H2O
5.下列表示不正确的是
A.乙炔的结构式:H-C≡C-H
B.甲酸乙酯的结构简式:C3H6O2
C.2?甲基丁烷的键线式:
D.甲基的电子式:
6.下列说法正确的是
A.天然气是可再生能源
B.用水煤气可合成液态碳氢化合物和含氧有机物
C.石油的分馏和煤的干馏属于物理变化
D.煤中含有苯、甲苯、二甲苯等有机物,可以通过煤的干馏得到
7.下列说法正确的是
A.16O和18O是两种不同的元素
B.单晶硅和石英互为同素异形体
C.甘油和酒精互为同系物
D.Be与Ca在元素周期表中处于同一主族
8.下列说法不正确的是
A.Cl?会破坏铝表面的氧化膜
B.黄绿色气体
ClO2是一种高效安全的灭菌消毒剂
C.KMnO4具有氧化性,其稀溶液可用于消毒
D.钢铁在潮湿空气中生锈主要是发生了化学腐蚀
9.下列说法不正确的是
A.金属钠可用来制造透雾能力强的高压钠灯
B.某些含铝的化合物可作净水剂
C.硫酸铁可用于治疗缺铁性贫血
D.二氧化硅可用于制造光导纤维
10.反应
KClO3+6HCl===KCl+3Cl2↑+3H2O
中,氧化产物和还原产物物质的量之比是:
A.1:3
B.3:1
C.5:1
D.1:5
11.下列有关实验说法不正确的是
A.萃取Br2时,向盛有溴水的分液漏斗中加入苯,振荡、静置分层后,打开旋塞,先将水层放出,上层液体从上口倒出
B.做焰色反应前,铂丝用稀盐酸清洗并灼烧至火焰呈无色
C.乙醇、汽油等有机溶剂易被引燃,使用时须远离明火,用毕立即塞紧瓶塞
D.在中和热的测定实验中,将氢氧化钠和盐酸混合后,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度
12.下列说法正确的是
A.Ca单质可以从TiCl4中置换出Ti
B.Mg加入到过量FeCl3溶液中可得Fe
C.FeS2在沸腾炉中与O2反应主要生成SO3
D.H2O2溶液中加入少量MnO2粉末生成H2和O2
13.能正确表示下列反应的离子方程式是
A.(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:SO+Ba2+=BaSO4↓
B.电解MgCl2水溶液:2Cl?+2H2O2OH?+Cl2↑+H2↑
C.乙酸乙酯与NaOH溶液共热:CH3COOCH2CH3+OH?CH3COO?+CH3CH2OH
D.CuSO4溶液中滴加稀氨水:Cu2++2OH?=Cu(OH)2↓
14.下列说法不正确的是
A.石油经催化裂化得到的汽油能使溴水和酸性高锰酸钾溶液褪色
B.用酸性
KMnO4
溶液(必要时可加热)能鉴别苯、甲苯、乙醇、乙酸乙酯
C.苯酚溶液可用氯化铁溶液或溴水检验
D.乙醛、乙酸、乙酸乙酯可用新制
Cu(OH)2悬浊液鉴别
15.有关下图所示化合物的说法正确的是
A.能发生取代、消去、中和、氧化等反应
B.1
mol
该化合物最多可以与
4
mol
Br2
反应
C.既可以催化加氢,又可以使酸性
KMnO4溶液褪色
D.可以与
FeCl3
溶液发生显色反应,但不能与
NaOH
溶液反应
16.下列说法正确的是
A.同一原子中,在离核较远的区域运动的电子能量较高
B.原子核外电子排布,先排满K层再排L层、先排满M层再排N层
C.同一周期中,随着核电荷数的增加,元素的原子半径逐渐增大
D.同一周期中,ⅡA与ⅢA族元素原子的核电荷数都相差1
17.下列说法不正确的是
A.将KCl溶液从常温加热至80℃,溶液的pH变小但仍保持中性
B.中和pH和体积均相等的氨水、NaOH溶液,所需HCl的物质的量相同
C.相同温度下,pH相等的盐酸、CH3COOH溶液中,c(OH?)相等
D.氨水和盐酸反应后的溶液,若溶液呈中性,则c(Cl?)=c(NH)
18.5
mL
0.1
mol·L?1
KI溶液与1
mL
0.1
mol·L?1
FeCl3溶液发生反应:
2Fe3+(aq)+2I?(aq)
2Fe2+(aq)+I2(aq),达到平衡。下别说法不正确的是
A.加入苯,振荡,平衡正向移动
B.经苯2次萃取分离后,在水溶液中加入KSCN,溶液呈血红色,表明该化学反应存在限度
C.加入FeSO4固体,平衡逆向移动
D.该反应的平衡常数K=
19.国际计量大会第
26
次会议新修订了阿伏伽德罗常数(NA=6.02×1023
mol?1),并于
2019
年
5
月
20
日正式生效。下列说法正确的是
A.标况下
1
个
N2
分子的体积小于22.4/NA
L
B.12
g
金刚石和石墨中均含有
2NA个共价键
C.1
L
1
mol·L?1的硫酸钠溶液中含有的氧原子数为
0.4NA
D.16.25
g
FeCl3
水解形成的
Fe(OH)3
胶体粒子数为
0.1NA
20.一定条件下:2NO2(g)
N2O4(g) ΔH<0。在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是
A.温度0℃、压强50
kPa
B.温度130℃、压强300
kPa
C.温度25℃、压强100
kPa
D.温度130℃、压强50
kPa
21.具有高能量密度的锌一空气蓄电池是锂离子电池的理想替代品。下图是一种新型可充电锌
—空气蓄电池的工作原理示意图。下列说法正确的是
A.放电时,电池正极.上发生反应:
Zn(OH)42-
+2e-
=Zn+4OH-
B.充电时,锌板作为阳极,锌板附近溶液碱性增强
C.电池中离子交换膜是阴离子交换膜
D.放电时,每消耗22.4mL
O2外电路转移电子数约为2.408×1021个
22.关于下列ΔH的判断正确的是
CO(aq)+H+(aq)=
HCO(aq)
ΔH1
CO(aq)+H2O(l)
HCO(aq)+OH?(aq)
ΔH2
OH?(aq)+H+(aq)=
H2O(l)
ΔH3
OH?(aq)+CH3COOH(aq)=
CH3COO?(aq)+H2O(l)
ΔH4
A.ΔH1<0 ΔH2<0
B.ΔH1<ΔH2
C.ΔH3<0 ΔH4>0
D.ΔH3>ΔH4
23.常温下,用0.1
mol·L?1氨水滴定10
mL浓度均为0.1
mol·L?1的HCl和CH3COOH的混合液,下列说法不正确的是
A.在氨水滴定前,HCl和CH3COOH的混合液中c(Cl?)>c(CH3COO?)
B.当滴入氨水10
mL时,c(NH)+c(NH3·H2O)=c(CH3COO?)+c(CH3COOH)
C.当滴入氨水20
mL时,c(CH3COOH)+c(H+)=c(NH3·H2O)+c(OH?)
D.当溶液呈中性时,氨水滴入量大于20
mL,c(NH)<c(Cl?)
24.过硝酸钠(NaNO4)能与水发生反应:NaNO4+H2O===NaNO3+H2O2,
下列说法不正确的是
A.过硝酸钠可用于杀菌消毒
B.过硝酸钠中含有—O—O—结构
C.过硝酸钠具有强氧化性,没有还原性
D.将过硝酸钠加入酸性
FeSO4溶液中发生的离子方程式:
NO4?+2Fe2++2H+
===NO3?+2Fe3++H2O
25.黄色固体X,可能含有漂白粉、FeSO4、Fe2(SO4)3、CuCl2、KI之中的几种或全部。将X与足量的水作用,得到深棕色固体混合物Y和无色碱性溶液Z。下列结论合理的是
A.X中含KI,可能含有CuCl2
B.X中含有漂白粉和FeSO4
C.X中含有CuCl2,Y中含有Fe(OH)3
D.用H2SO4酸化溶液Z,若有黄绿色气体放出,说明X中含有CuCl2
二、非选择题(本大题共6小题,共50分)
26.(4分)
(1)气态氢化物热稳定性NH3大于PH3的主要原因是
。
(2)NH4CN是离子化合物,各原子除了H均满足8电子稳定结构,NH4CN的电子式是
。
(3)常温下,在水中的溶解度乙醇大于乙苯,原因是
。
(4)FeCl3溶液中加入Cu片,反应的离子方程式是
27.(4分)为测定FeC2O4·2H2O(M=180
g·mol?1)样品的纯度,用硫酸溶解6.500
g样品,定容至250
mL。取25.00
mL溶液,用0.1000
mol·L?1
KMnO4标准溶液滴定至终点。重复实验,数据如下:
序号
滴定前读数/mL
滴定终点读数/mL
1
0.00
19.98
2
1.20
22.40
3
1.54
21.56
已知:3MnO+5FeC2O4·2H2O+24H+3Mn2++5Fe3++10CO2↑+22H2O
假设杂质不参加反应。
该样品中FeC2O4·2H2O的质量分数是________%(保留小数点后一位);
写出简要计算过程:
28.(10分)
Ⅰ.(5
分)化合物
X(
仅含三种常见短周期元素)
是一种储氢材料,X
中某种元素的单质可用于制造信号弹,某研究小组为了探究
X
的
组成和
性质,设计并完成了如下实验。
(1)气体A的成分是
(2)金属互化物
C
的化学式:
。化合物
H
的电子式:
。
(3)X
在
400℃下分解的化学方程式:
。
写出生成沉淀
F
的离子方程式:
。
Ⅱ.(5
分)高温下焦炭、石英砂的混合物与氯气反应可生成
SiCl4。以下是实验室制备
SiCl4
的装置示意图(注:SiCl4
沸点
57.6℃,遇水易水解)。
请回答:
(5)装置
A
中的化学反应方程式为
。
(6)装置
D
的作用是
。
(7)设计一个实验方案,对装置
C
处的尾气进行处理
。
29.(10分)研究CO2氧化C2H6制C2H4对资源综合利用
有重要意义。相关的主要化学反应有:
Ⅰ C2H6(g)
C2H4(g)+H2(g)
ΔH1=136
kJ·mol?1
Ⅱ C2H6(g)+CO2(g)
C2H4(g)+H2O(g)+CO(g)
ΔH2=177
kJ·mol?1
Ⅲ C2H6(g)+2CO2(g)
4CO(g)+3H2(g) ΔH3
Ⅳ CO2(g)+H2(g)
CO(g)+H2O(g)
ΔH4=41
kJ·mol?1
已知:298K时,相关物质的相对能量(如图1)。
可根据相关物质的相对能量计算反应或变化的ΔH
(ΔH随温度变化可忽略)。例如:
H2O(g)=
H2O(l) ΔH=?286
kJ·mol?1-(-242
kJ·mol?1)=-44
kJ·mol?1。
请回答:
(1)①根据相关物质的相对能量计算ΔH3=_______kJ·mol?1。
②下列描述正确的是________。
A.升高温度反应Ⅰ的平衡常数增大
B.加压有利于反应Ⅰ、Ⅱ的平衡正
向移动
C.反应Ⅲ有助于乙烷脱氢,有利于
乙烯生成
D.恒温恒压下通水蒸气,反应Ⅳ的
平衡逆向移动
③有研究表明,在催化剂存在下,
反应Ⅱ分两步进行,过程如下:
[C2H6(g)+CO2(g)]
→[C2H4(g)+H2(g)+CO2(g)]
→[C2H4(g)+CO(g)+H2O(g)],
且第二步速率较慢(反应活化能为210
kJ·mol?1)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量?反应
过程图”,起点从[C2H6(g)+CO2(g)]的能量?477
kJ·mol?1开始(如图2)。
(2)①CO2和C2H6按物质的量1∶1投料,在923
K和保持总压恒定的条件下,
研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如下表:
催化剂
转化率C2H6/%
转化率CO2/%
产率C2H4/%
催化剂X
19.0
37.6
3.3
结合具体反应分析,在催化剂X作用下,CO2氧化C2H6的主要产物是
________,判断依据是
。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高C2H4的选择性(生成C2H4的物质的量与消耗C2H6的物质的量之比)。在773
K,乙烷平衡转化率为9.1%,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到11.0%。结合具体反应说明乙烷转化率增大的原因是
。
(10分)
I.
某学习小组欲从含有[Cu(NH3)4]SO4、乙醇和氨水的实验室废液中分离乙醇并制备硫酸铜铵[CuSO4·(NH4)2SO4]固体,完成了如下实验:
已知:[Cu(NH3)4]2++4H+Cu2++4NH
请回答:
(1)
步骤①中,试剂X应采用________。
(2)
甲、乙两同学取相同量的溶液Y分别进行蒸馏,收集到的馏出液体积相近,经检测,甲同学的馏出液中乙醇的含量明显偏低,可能的原因是________。
(3)
设计实验方案验证硫酸铜铵固体中的NH________。
II.用无水Na2CO3固体配制250
mL
0.1000
mol·L-1的溶液。请回答:
(4)在配制溶液需要称量的Na2CO3固体为
克。
(5)定容时的操作:当液面接近容量瓶刻度线时,
,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(6)下列操作会使配得的Na2CO3溶液浓度偏低的是
。
A.称取相同质量的Na2CO3·10H2O固体进行配制
B.定容时俯视容量瓶的刻度线
C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制
31.(12分)某有机物F()在自身免疫性疾病的治疗中有着重要的应用,工业上以乙烯和芳香族化合物B为基本原料制备F的路线图如下:
已知:RCHO+R1CH2CHO
(1)乙烯生成A的原子利用率为100%,则X是________(填化学式),F中含氧官能团的名称为________。
(2)E→F的反应类型为________,B的结构简式为
(3)写出D与NaOH溶液反应的化学方程式:____________________________________________________________。
(4)E有多种同分异构体,符合下列条件的同分异构体有________种,其中核磁共振氢谱有6个峰的物质的结构简式为________。
①能发生水解反应、银镜反应且1
mol该物质最多可还原出4
mol
Ag②遇FeCl3溶液发生显色反应③分子中没有甲基,且苯环上有2个取代基
(5)以乙烯为基本原料,设计合成路线合成2?丁烯酸(CH3CH=CHCOOH),写出合成路线(其他试剂任选)。
鄞州高级中学2021届高三10月月考化学答题卷
1-25题:请将选择题答案写入下列表格:(单选,每题2分,共50分)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26.(4分)
(1)
。
(2)
。
(3)
。
(4)
27.(4分)
%(保留小数点后一位);
28.(10分)
(1)
(2)
。
。
(3)
。
(4)
。
(5)
。
(6)
。
(7)
。
29.(10分)
(1)①ΔH3=
kJ·mol?1。②________。
③
①
,
②
。
30.(10分)
(1)
。
(2)
。
(3)
________
(4)
。
(5)
,
(6)
。
31.(12分)
(1)
,
。
(2)
,
(3)____________________________________________________________。
(4)________,
。
(5)
鄞州高级中学2021届高三10月月考化学试题参考答案
1
2
3
4
5
6
7
8
9
10
A
B
D
B
B
B
D
D
C
C
11
12
13
14
15
16
17
18
19
20
D
A
C
B
C
A
B
D
A
D
21
22
23
24
25
C
B
D
C
C
(4分)(1)N-H键键能大于P-H键(2)
(3)乙醇和水分子间存在氢键,乙苯和水分子间没有氢键。(4)2Fe3++Cu=2Fe2++Cu2+
27.(4分)
(1)
92.3%
(2)
28.(10分)
I(1)H2
(2)
Mg3Al2
[H:]-Mg2+[H:]-
(3)3Mg(AlH4)2=12H2+4Al+Mg3Al2
(4)
AlO2-+CO2+2H2O=Al(OH)3+HCO3-
高温
高温
高温
II(1)SiO2+2C+Cl2=SiCl4+2CO
或者SiO2+2C=Si+2CO
Si+2Cl2=SiC4
避免水蒸气进入B,防止SiCl4水解。
C中尾气主要是CO,可在出口处放一个点燃的酒精灯将CO燃烧成无害的CO2或绑一塑料袋将CO收集。
30.(10分)
(1)H2SO4溶液(2)加热温度偏高,馏出速度过快;冷却效果不好,造成乙醇损失。
(3)取少量固体于试管中加水溶解,滴加足量NaOH溶液,振荡,加热,用湿润的红色石蕊试纸置于试管口,若观察到试纸变蓝,则证明含NH4+
(4)2.6
应改用胶头滴管加水至凹液面与刻度线相切。
AC
(12分)
(1)O2
(酚)羟基,酯基
(2)酯化(取代)反应
(3)
3
CH2=CH2
CH3CHO
CH3CH=CHCHO
CH3CH=CHCOOH
同课章节目录
