第五单元 课题1 质量守恒定律 同步提高练 (含解析)
文档属性
| 名称 | 第五单元 课题1 质量守恒定律 同步提高练 (含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 152.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-30 00:02:25 | ||
图片预览

文档简介
第五单元 课题1 质量守恒定律
1.下列对质量守恒定律的理解错误的是( )
A.质量守恒定律只适用于化学反应,不适用于物理变化
B.质量守恒定律研究的内容仅是指“质量”,不能推广到其他物理量
C.质量守恒定律揭示了化学变化中宏观物质之间的质量关系,与微观过程无关
D.蜡烛燃烧后,质量虽然减轻但符合质量守恒定律
2.钠着火不能用二氧化碳灭火。钠在二氧化碳中燃烧生成炭黑和一种白色固体,它可能是( )
A.碳酸钠false B.硫酸钠false
C.碳酸氢钠false D.氢氧化钠false
3.铁丝在装满氧气的密闭容器中燃烧,下列图中能正确表示容器里所盛物质总质量变化的是( )
A.B.C.D.
4.下列实验能够直接用于验证质量守恒定律的是(已知:false,false)( )
A. B.
C. D.
5.把一定质量的甲、乙、丙、丁四种物质放入一个密闭容器中,在一定条件下反应一段时间后,测得反应前后各物质的质量如下表。下列说法不正确的是( )
物质
甲
乙
丙
丁
反应前的质量/g
4.0
2.0
3.0
2.0
反应后的质量/g
1.2
false
2.4
5.4
A.该反应是化合反应 B.false,乙可能是催化剂
C.参加反应的甲、丙的质量比为1:2 D.丙可能是单质
6.超氧化钾false常备于急救器和消防队员的背包中,能迅速与水反应放出氧气:false,关于此反应的说法不正确的是( )
A.X的化学式为false B.反应前后元素种类发生变化
C.反应前后氧元素化合价发生变化 D.反应前后物质状态发生变化
7.氨催化氧化是制硝酸的主要反应之一,该反应前后分子种类变化的微观示意图如下。下列说法正确的是( )
A.生成的丙与丁的分子个数比为2:3 B.乙的相对分子质量为32g
C.反应前后分子的个数不变 D.反应过程中共涉及三种氧化物
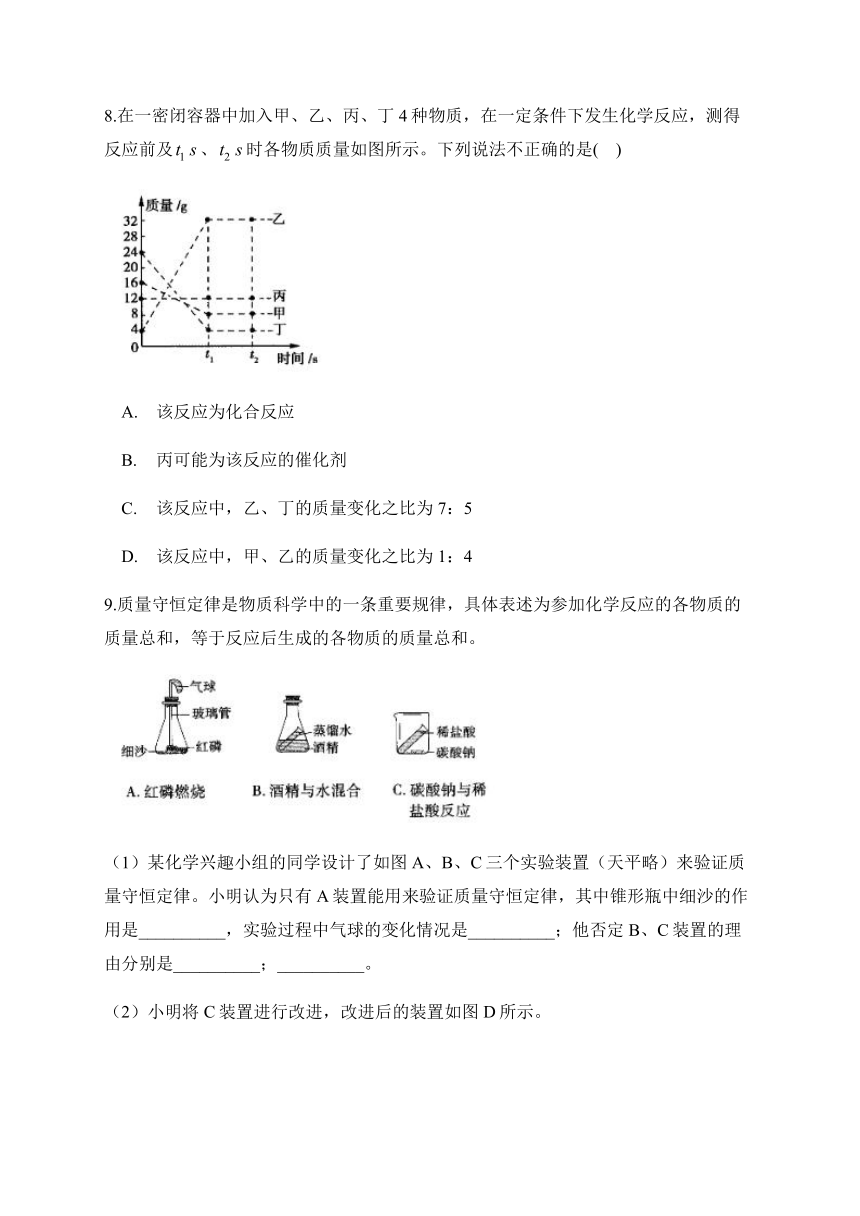
8.在一密闭容器中加入甲、乙、丙、丁4种物质,在一定条件下发生化学反应,测得反应前及false、false时各物质质量如图所示。下列说法不正确的是( )
该反应为化合反应
丙可能为该反应的催化剂
该反应中,乙、丁的质量变化之比为7:5
该反应中,甲、乙的质量变化之比为1:4
9.质量守恒定律是物质科学中的一条重要规律,具体表述为参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
(1)某化学兴趣小组的同学设计了如图A、B、C三个实验装置(天平略)来验证质量守恒定律。小明认为只有A装置能用来验证质量守恒定律,其中锥形瓶中细沙的作用是__________,实验过程中气球的变化情况是__________;他否定B、C装置的理由分别是__________;__________。
(2)小明将C装置进行改进,改进后的装置如图D所示。
①此实验的现象是__________;
②待完全反应后,将D装置置于天平上称量,所得数据较反应前的小,若整个操作过程无差错,则造成上述实验误差的原因是__________。
10.某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的文字表达式: 。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律。我 (填“同意”或“不同意”)小明的观点,因为 。
(3)小红同学按如图所示装置改进实验,验证了质量守恒定律,却发现产物中还有少量淡黄色固体。
【提出问题】淡黄色固体是什么?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气剧烈反应生成淡黄色的氮化镁 (Mg3N2 )固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试
蓝。
【做出猜想】淡黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想:
实验操作
实验现象
结论
取燃烧后的产物于试管中, 加少量水,再将 放在试管口,观察现象
燃烧产物中含有 Mg3N2
【反思与交流】空气中N2的含量远大于O2的含量。 而镁条在空气中燃烧生成的MgO却远多于Mg3N2, 为什么呢 ? 请给出合理的解释: 。
答案以及解析
1.答案:C
解析:质量守恒定律揭示了化学变化中宏观物质之间的质量关系,其与微观过程有关。因为化学变化的实质是分子分成原子,原子再重新组合成新的分子,化学变化中原子的种类和数目不变,所以化学反应前后物质的质量总和不变。
2.答案:A
解析:钠能在二氧化碳中燃烧生成炭黑和一种白色固体,反应物中有Na、C、O三种元素,根据化学反应前后元素种类不变,生成物中不会含S、H等元素,故不会生成硫酸钠、碳酸氢钠、氢氧化钠,B、C、D错误,白色固体可能是碳酸钠,A正确。
3.答案:C
解析:反应在密闭容器中进行,由质量守恒定律知,参加反应的铁和氧气的质量之和等于反应后生成的false的质量,因此容器里所盛物质总质量不变。故选C。
4.答案:C
解析:用于验证质量守恒定律时,有气体参加或生成的反应,应该在密闭容器中进行。镁燃烧有氧气参与,稀盐酸和碳酸钠反应生成二氧化碳,锌和稀硫酸反应生成氢气,由于不是在密闭容器中进行,不能用于验证质量守恒定律,A、B、D错误。
5.答案:C
解析:分析表格数据可知:反应后甲的质量减少了4.0g-1.2g=2.8g,说明甲是反应物,参加反应的甲的质量为2.8g,反应后丙的质量减少了3.0g-2.4g=0.6g,说明丙是反应物,参加反应的丙的质量为0.6g,反应后丁的质量增加了5.4g-2.0g=3.4g,说明丁是生成物,反应生成丁的质量为3.4g,综合以上数据,可知2.8g甲和0.6g丙反应生成3.4g丁,符合质量守恒定律,则false。进一步分析可知,该反应符合“多变一”的特点,属于化合反应;乙可能是催化剂,也可能没有参与该反应;参加反应的甲、丙的质量比为2.8g:0.6g=14:3;丙作为反应物之一,可能是单质。
6.答案:B
解析:化学反应前后元素的种类不变,B错误。
7.答案:A
解析:由反应前后分子种类变化的徽观示意图,可得出该反应的化学方程式为false。由化学方程式可知,生成物丙和丁的分子个数比为2:3,A正确;乙是氧气,相对分子质量为32,单位是“1”,常省略不写,B错误;反应前后分子的总数之比为9:10,分子的个数发生了改变,C错误;氧化物中含有两种元素且其中一种是氧元素,则反应过程中只有NO和false属于氧化物,D错误。
8.答案:D
解析:根据图中信息可知,反应过程中甲、丁的质量减少,则甲、丁是反应物,乙的质量增加,则乙是生成物。该反应由甲和丁生成乙,属于化合反应,A正确;的质量不变,则丙可能是该反应的催化剂,也可能是与该反应无关的物质(杂质),B正确;该反应中,乙和丁的质量变化之比为(32g-4g):(24g-4g)=7:5,C正确;该反应中,甲和乙的质量变化之比为(16g-8g):(32g-4g)=2:7,D错误。
9.答案:(1)防止锥形瓶炸裂 先变大后变小 B装置内发生的是物理变化 C装置内产生的气体会逸散到空气中
(2)①锥形瓶内有大量气泡产生,气球变大 ②气球膨胀后会受到空气浮力的作用
解析:
10.答案:(1)镁+氧气false氧化镁(2)不同意;所有的化学反应都遵 守质量守恒定律
(3)【实验探究】湿润的红色石蕊试纸湿润的红色石蕊试纸变成蓝色
【反思与交流】氧气的化学性质比氮气活泼,镁条更容易与氧气发 生反应
解析: (1)在点燃的条件下.镁与氧气反应生成氧化镁,反应的文字表达式是镁+氧气false氧化镁。(2)所有的化学变化都遵守质量守恒定律,镁条燃烧是镁与空气中的氧气等物质的反应, 所以产物的质量大于反应物镁条的质量,
(3)【实验探究】根据题干信息,可将生成的固体物质放入水中, 检验是否产生氨气来进行判断,具体实验操作:将镁条燃烧的产 物放在一支试管中,加入少量水,然后将一湿润的红色石蕊试纸 放在试管口,观察现象.若看到红色的石蕊试纸变成蓝色,说明淡 黄色固体为氮化镁。
【反思与交流】氧气的化学性质比氮气活泼,镁条更容易与氧气发 生反应。
1.下列对质量守恒定律的理解错误的是( )
A.质量守恒定律只适用于化学反应,不适用于物理变化
B.质量守恒定律研究的内容仅是指“质量”,不能推广到其他物理量
C.质量守恒定律揭示了化学变化中宏观物质之间的质量关系,与微观过程无关
D.蜡烛燃烧后,质量虽然减轻但符合质量守恒定律
2.钠着火不能用二氧化碳灭火。钠在二氧化碳中燃烧生成炭黑和一种白色固体,它可能是( )
A.碳酸钠false B.硫酸钠false
C.碳酸氢钠false D.氢氧化钠false
3.铁丝在装满氧气的密闭容器中燃烧,下列图中能正确表示容器里所盛物质总质量变化的是( )
A.B.C.D.
4.下列实验能够直接用于验证质量守恒定律的是(已知:false,false)( )
A. B.
C. D.
5.把一定质量的甲、乙、丙、丁四种物质放入一个密闭容器中,在一定条件下反应一段时间后,测得反应前后各物质的质量如下表。下列说法不正确的是( )
物质
甲
乙
丙
丁
反应前的质量/g
4.0
2.0
3.0
2.0
反应后的质量/g
1.2
false
2.4
5.4
A.该反应是化合反应 B.false,乙可能是催化剂
C.参加反应的甲、丙的质量比为1:2 D.丙可能是单质
6.超氧化钾false常备于急救器和消防队员的背包中,能迅速与水反应放出氧气:false,关于此反应的说法不正确的是( )
A.X的化学式为false B.反应前后元素种类发生变化
C.反应前后氧元素化合价发生变化 D.反应前后物质状态发生变化
7.氨催化氧化是制硝酸的主要反应之一,该反应前后分子种类变化的微观示意图如下。下列说法正确的是( )
A.生成的丙与丁的分子个数比为2:3 B.乙的相对分子质量为32g
C.反应前后分子的个数不变 D.反应过程中共涉及三种氧化物
8.在一密闭容器中加入甲、乙、丙、丁4种物质,在一定条件下发生化学反应,测得反应前及false、false时各物质质量如图所示。下列说法不正确的是( )
该反应为化合反应
丙可能为该反应的催化剂
该反应中,乙、丁的质量变化之比为7:5
该反应中,甲、乙的质量变化之比为1:4
9.质量守恒定律是物质科学中的一条重要规律,具体表述为参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
(1)某化学兴趣小组的同学设计了如图A、B、C三个实验装置(天平略)来验证质量守恒定律。小明认为只有A装置能用来验证质量守恒定律,其中锥形瓶中细沙的作用是__________,实验过程中气球的变化情况是__________;他否定B、C装置的理由分别是__________;__________。
(2)小明将C装置进行改进,改进后的装置如图D所示。
①此实验的现象是__________;
②待完全反应后,将D装置置于天平上称量,所得数据较反应前的小,若整个操作过程无差错,则造成上述实验误差的原因是__________。
10.某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的文字表达式: 。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律。我 (填“同意”或“不同意”)小明的观点,因为 。
(3)小红同学按如图所示装置改进实验,验证了质量守恒定律,却发现产物中还有少量淡黄色固体。
【提出问题】淡黄色固体是什么?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气剧烈反应生成淡黄色的氮化镁 (Mg3N2 )固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试
蓝。
【做出猜想】淡黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想:
实验操作
实验现象
结论
取燃烧后的产物于试管中, 加少量水,再将 放在试管口,观察现象
燃烧产物中含有 Mg3N2
【反思与交流】空气中N2的含量远大于O2的含量。 而镁条在空气中燃烧生成的MgO却远多于Mg3N2, 为什么呢 ? 请给出合理的解释: 。
答案以及解析
1.答案:C
解析:质量守恒定律揭示了化学变化中宏观物质之间的质量关系,其与微观过程有关。因为化学变化的实质是分子分成原子,原子再重新组合成新的分子,化学变化中原子的种类和数目不变,所以化学反应前后物质的质量总和不变。
2.答案:A
解析:钠能在二氧化碳中燃烧生成炭黑和一种白色固体,反应物中有Na、C、O三种元素,根据化学反应前后元素种类不变,生成物中不会含S、H等元素,故不会生成硫酸钠、碳酸氢钠、氢氧化钠,B、C、D错误,白色固体可能是碳酸钠,A正确。
3.答案:C
解析:反应在密闭容器中进行,由质量守恒定律知,参加反应的铁和氧气的质量之和等于反应后生成的false的质量,因此容器里所盛物质总质量不变。故选C。
4.答案:C
解析:用于验证质量守恒定律时,有气体参加或生成的反应,应该在密闭容器中进行。镁燃烧有氧气参与,稀盐酸和碳酸钠反应生成二氧化碳,锌和稀硫酸反应生成氢气,由于不是在密闭容器中进行,不能用于验证质量守恒定律,A、B、D错误。
5.答案:C
解析:分析表格数据可知:反应后甲的质量减少了4.0g-1.2g=2.8g,说明甲是反应物,参加反应的甲的质量为2.8g,反应后丙的质量减少了3.0g-2.4g=0.6g,说明丙是反应物,参加反应的丙的质量为0.6g,反应后丁的质量增加了5.4g-2.0g=3.4g,说明丁是生成物,反应生成丁的质量为3.4g,综合以上数据,可知2.8g甲和0.6g丙反应生成3.4g丁,符合质量守恒定律,则false。进一步分析可知,该反应符合“多变一”的特点,属于化合反应;乙可能是催化剂,也可能没有参与该反应;参加反应的甲、丙的质量比为2.8g:0.6g=14:3;丙作为反应物之一,可能是单质。
6.答案:B
解析:化学反应前后元素的种类不变,B错误。
7.答案:A
解析:由反应前后分子种类变化的徽观示意图,可得出该反应的化学方程式为false。由化学方程式可知,生成物丙和丁的分子个数比为2:3,A正确;乙是氧气,相对分子质量为32,单位是“1”,常省略不写,B错误;反应前后分子的总数之比为9:10,分子的个数发生了改变,C错误;氧化物中含有两种元素且其中一种是氧元素,则反应过程中只有NO和false属于氧化物,D错误。
8.答案:D
解析:根据图中信息可知,反应过程中甲、丁的质量减少,则甲、丁是反应物,乙的质量增加,则乙是生成物。该反应由甲和丁生成乙,属于化合反应,A正确;的质量不变,则丙可能是该反应的催化剂,也可能是与该反应无关的物质(杂质),B正确;该反应中,乙和丁的质量变化之比为(32g-4g):(24g-4g)=7:5,C正确;该反应中,甲和乙的质量变化之比为(16g-8g):(32g-4g)=2:7,D错误。
9.答案:(1)防止锥形瓶炸裂 先变大后变小 B装置内发生的是物理变化 C装置内产生的气体会逸散到空气中
(2)①锥形瓶内有大量气泡产生,气球变大 ②气球膨胀后会受到空气浮力的作用
解析:
10.答案:(1)镁+氧气false氧化镁(2)不同意;所有的化学反应都遵 守质量守恒定律
(3)【实验探究】湿润的红色石蕊试纸湿润的红色石蕊试纸变成蓝色
【反思与交流】氧气的化学性质比氮气活泼,镁条更容易与氧气发 生反应
解析: (1)在点燃的条件下.镁与氧气反应生成氧化镁,反应的文字表达式是镁+氧气false氧化镁。(2)所有的化学变化都遵守质量守恒定律,镁条燃烧是镁与空气中的氧气等物质的反应, 所以产物的质量大于反应物镁条的质量,
(3)【实验探究】根据题干信息,可将生成的固体物质放入水中, 检验是否产生氨气来进行判断,具体实验操作:将镁条燃烧的产 物放在一支试管中,加入少量水,然后将一湿润的红色石蕊试纸 放在试管口,观察现象.若看到红色的石蕊试纸变成蓝色,说明淡 黄色固体为氮化镁。
【反思与交流】氧气的化学性质比氮气活泼,镁条更容易与氧气发 生反应。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
