人教版高中化学 选修3 期中测试(含解析)
文档属性
| 名称 | 人教版高中化学 选修3 期中测试(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-02 22:30:49 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
选修3物质的结构与性质期中测试(解析版)
第I卷(选择题)
一、单选题(共50分)
1.(本题2分)由中国近代化学启蒙者徐寿确认汉译名的下列元素中,属于d区元素的是
A.Ca
B.Ni
C.Zn
D.Ga
2.(本题2分)已知元素的原子序数,不可以推断元素原子的( )
A.质子数
B.核电荷数
C.核外电子数
D.离子所带的电荷数
3.(本题2分)116元素的名称和符号如图所示。下列有关说法不正确的是
A.Lv属于金属元素
B.Lv位于第七周期
C.Lv原子的最外层有6个电子
D.Lv原子的相对原子质量是116
4.(本题2分)2011年3月12日日本福岛几组核电站受强地震的影响连续爆炸,造成严重的核泄漏。据报道在核电站附近检测到主要的两种放射性物质为:13153I和13755Cs,下列关于13153I和13755Cs的说法不正确的是
A.13153I位于第五周期第ⅦA族
B.13755Cs的质量数为137
C.13153I原子中中子数与核外电子数之差为25
D.13755Cs的失电子能力比钾的弱
5.(本题2分)前四周期元素X、Y、Z、W、T的原子序数依次增大,Y、Z、W位于同一周期,X的最简单氢化物分子的空间结构为正四面体,Y在同周期中电负性最小,二元化合物E中元素Y和W的质量比为23:16;同周期元素简单离子中,元素Z形成的离子半径最小;T元素的价电子排布式为3d104s1。下列说法正确的是(
)
A.X的最简单氢化物分子为极性分子
B.W的单质在足量的氧气中燃烧,所得产物溶于水可得强酸
C.W和T的单质混合加热可得化合物TW
D.化合物E中存在离子键
6.(本题2分)下列分子中所有原子都满足最外层为8电子结构的是
①BeCl2②NCl3③PCl3④COCl2⑤SF6
⑥XeF2⑦CS2⑧CH4⑨CF2Cl2⑩S2Cl2
A.②④⑦⑧⑨⑩
B.②③④⑦⑨⑩
C.①③④⑦⑩
D.③④⑤⑦⑨⑩
7.(本题2分)有X、Y两种原子,X原子的M电子层比Y原子的M电子层少3个电子,Y原子的L电子层的电子数恰好为X原子L电子层电子数的2倍,X和Y分别是
A.碳和铝
B.硅和钠??
C.硼和氮?
D.氯和碳
8.(本题2分)某元素R的最高价含氧酸的化学式为HnRO5-n,在其气态氢化物的分子中,H原子的个数为
A.3n-2
B.3n-4
C.3n-6
D.2n-3
9.(本题2分)现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>①>③=②
10.(本题2分)下列原子的价电子排布中,对应元素第一电离能最大的是(
)
A.3s23p1
B.3s23p2
C.3s23p3
D.3s23p4
11.(本题2分)下列说法正确的是(
)
A.水很稳定是因为水中含有大量的氢键
B.ABn型分子中,若中心原子没有孤电子对,则ABn为空间对称结构,属于非极性分子
C.H2O、NH3、CH4分子中的O、N、C分别形成2个、3个、4个键,故O、N、C分别采取sp、sp2、sp3杂化
D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配体是SO42-,配位数是1
12.(本题2分)下列不属于等电子体的是(
)
A.N2和CO
B.CO2和N2O
C.PH3和HCl
D.H2S和
13.(本题2分)对于共价分子相关性质的叙述中,正确的是(
)
A.CO2、H2O、C2H2都是直线型分子
B.CH4、CCl4都是含有极性键的非极性分子
C.H2O、H2S、H2Se的熔沸点依次升高
D.HF、HCl、HBr、HI的稳定性依次增强
14.(本题2分)在“石蜡
→石蜡油
→石蜡气体→裂化气”的变化过程中,被破坏的作用力依次是()
A.范德华力、范德华力、范德华力
B.共价键、共价键、共价键
C.范德华力、共价键、共价键
D.范德华力、范德华力、共价键
15.(本题2分)下列说法中正确的是( )
A.CH4,C2H2,HCN都是含有极性键的非极性分子
B.CO2与SO2的立体构型相似,都是非极性分子
C.葡萄糖分子(HOCH2—CHOH—CHOH—CHOH—CHOH—CHO)中的手性碳原子数为5
D.酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数比HClO的多
16.(本题2分)下列关于价层电子对互斥模型(VSEPR
模型)的叙述中不正确的是(
)
A.VSEPR
模型可用来预测分子的立体构型
B.分子中价电子对相互排斥决定了分子的立体构型
C.中心原子上的孤对电子也要占据中心原子周围的空间并参与互相排斥
D.分子中键角越大,价电子对相互排斥力越大,分子越稳定
17.(本题2分)下列说法正确的是
A.含有非极性键的分子不一定是共价化合物
B.分子间作用力比化学键弱得多,但它对物质的熔点、沸点有较大的影响,而对溶解度无影响
C.根据π键的成键特征判断C=C键能是C﹣C键能的2倍
D.H2O中心原子采取sp杂化
18.(本题2分)下列有关有机物分子的叙述不正确的是(
)
A.乙烯分子中有一个sp2-sp2σ键和一个p-p
π键
B.乙炔每个碳原子都有两个未杂化的2p轨道,它们之间可形成两个π键
C.乙烷两个C原子均是sp3杂化,分子中一共有6个σ键
D.苯分子每个碳原子均是sp2杂化
19.(本题2分)铜离子是人体内多种酶的辅因子,某化合物与Cu+结合形成如图所示的离子。下列有关该离子说法正确的是(
)
A.该离子中碳原子的杂化方式为sp2
B.该离子中氮原子的杂化方式为sp2
C.该离子中只有共价键(含配位键),没有离子键
D.H、N、Cu三种元素的电负性顺序为:Cu>H>N
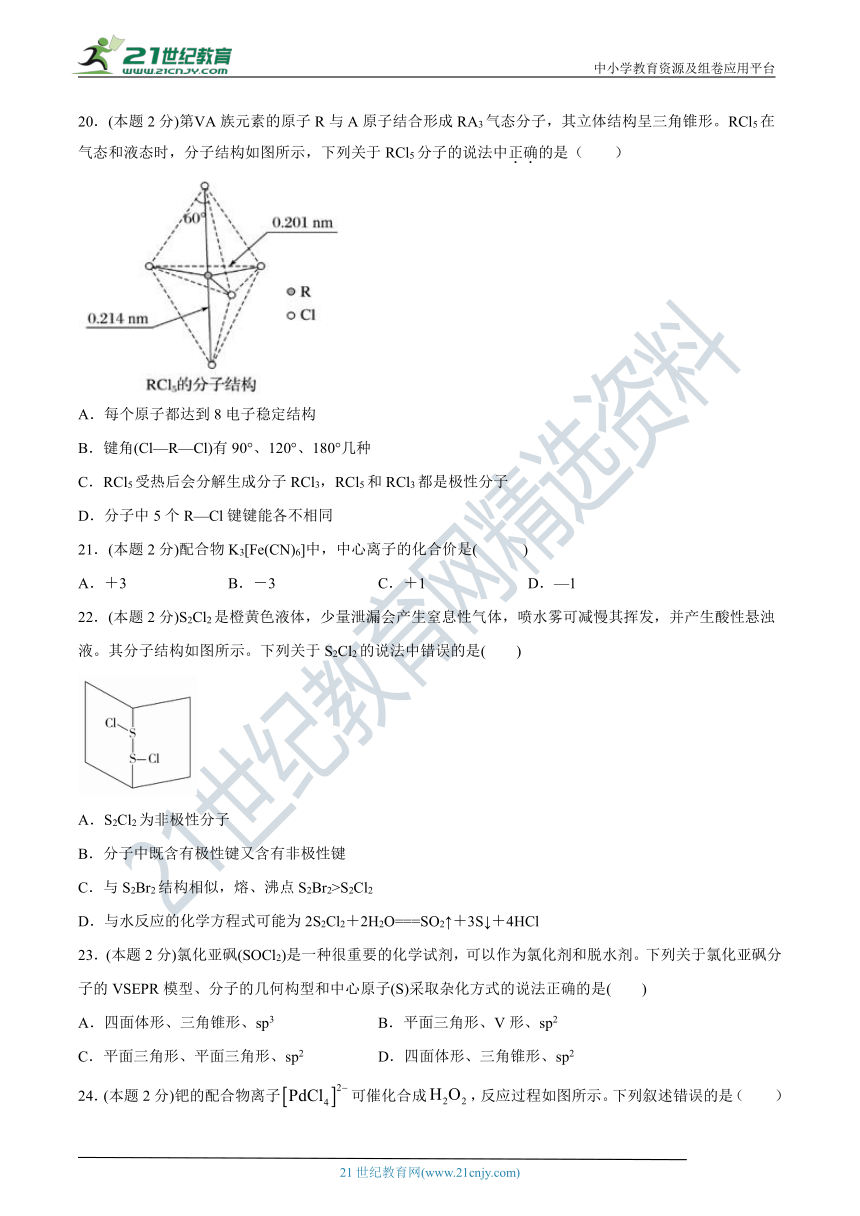
20.(本题2分)第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中正确的是(
)
A.每个原子都达到8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°、180°几种
C.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D.分子中5个R—Cl键键能各不相同
21.(本题2分)配合物K3[Fe(CN)6]中,中心离子的化合价是(
)
A.+3
B.-3
C.+1
D.—1
22.(本题2分)S2Cl2是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法中错误的是(
)
A.S2Cl2为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔、沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O===SO2↑+3S↓+4HCl
23.(本题2分)氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的VSEPR模型、分子的几何构型和中心原子(S)采取杂化方式的说法正确的是(
)
A.四面体形、三角锥形、sp3
B.平面三角形、V形、sp2
C.平面三角形、平面三角形、sp2
D.四面体形、三角锥形、sp2
24.(本题2分)钯的配合物离子可催化合成,反应过程如图所示。下列叙述错误的是(
)
A.是反应中间体
B.催化合成总反应为
C.反应过程中的成键数目保持不变
D.存在反应
25.(本题2分)下列配合物的水溶液中加入硝酸银不能生成沉淀的是
A.[Co(NH3)4Cl2]Cl
B.[Co(NH3)6]Cl3
C.[Cu(NH3)4]Cl2
D.[Co(NH3)3Cl3]
第II卷(非选择题)
二、填空题(共33分)
26.(本题10分)亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式___。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有___和___。
(3)黄血盐中N原子的杂化方式为____;C、N、O的第一电离能由大到小的排序为___,电负性由大到小的排序为___。
27.(本题7分)部分等电子体类型、代表物质及对应的空间构型如表所示:
等电子类型
代表物质
空间构型
四原子24电子等电子体
SO3
平面三角形
四原子26电子等电子体
SO32-
三角锥形
五原子32电子等电子体
CCl4
四面体形
六原子40电子等电子体
PCl5
三角双锥形
七原子48电子等电子体
SF6
八面体形
请回答下列问题。
(1)请写出下列离子的空间构型:
_______________,_________________,________________。
(2)由第2周期元素原子构成,与F2互为等电子体的离子是__________。
(3)的空间构型如图1所示,请再按照图1的表示方法在图2中表示出分子中O、S、F原子的空间位置。已知分子中O、S间为共价双键,S、F间为共价单键。__________。
28.(本题16分)某盐的组成可表示为3[H3ON5]·3[NH4N5]·NH4Cl。回答下列问题:
(1)氯原子的电子排布式为________________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_________________;氮元素的E1呈现异常的原因是__________________。
(3)经X射线衍射测得化合物3[H3ON5]·3[NH4N5]·NH4Cl的晶体结构,其局部结构如图(b)所示。
①H3O+中心原子的杂化类型为________,NH4+的空间构型为________。
②3[H3ON5]·3[NH4N5]·NH4Cl中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则N5-中的大π键应表示为________。
③图(b)中虚线代表氢键,其中表示式为(NH4+)N—H…Cl、________、________。
三、推断题(共17分)
29.(本题17分)现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)G的元素名称为__________________?
(2)A、B、C三种元素电负性由大到小的顺序为_____________________(用元素符号表示),第一电离能D
_______Al(填“>”“<”或“=”),其原因是___________________________。
(3)C元素的电子排布图为__________________;E3+的离子符号为__________________
(4)F元素位于元素周期表的______区,其基态原子的电子排布式为___________________
(5)G元素可能的性质_______________
A.其单质可作为半导体材料?????
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
D.其第一电离能小于硒
参考答案
1.B
【解析】
A.Ca元素位于第ⅡA族,为s区元素,故A不符合题意;
B.Ni元素位于第Ⅷ族,为d区元素,故B符合题意;
C.Zn元素位于第ⅡB族,为ds区元素,故C不符合题意;
D.Ga元素位于第ⅢA族,为p区元素,故D不符合题意;
综上所述答案为B。
2.D
【解析】
已知元素的原子序数,由“原子序数=质子数=核电荷数=核外电子数”可知,选项ABC推知,选项D无法推知;
答案选D。
3.D
【解析】
A.从名称上看,
Lv属于金属元素,A项正确;
B.因第七周期的原子序数为87-118,因此原子序数为116的
Lv位于第七周期,B项正确;
C.
从原子序数上看,Lv距离稀有气体的原子序数仅差2,因此为第VIA元素原子,故其最外层有6个电子,C项正确;
D.
116为Lv的原子序数,并非相对原子质量,D项错误;
答案选D。
4.D
【解析】
A.
13153I的核电荷数为53,位于第五周期第ⅦA族,故正确;B.
13755Cs的质量数为137,故正确;C.
13153I原子中中子数为131-53=78,核外电子数为53,二者差78-53=25,故正确;D.
13755Cs与钾是同主族元素,核电荷数比钾大,失电子能力比钾的强,故错误。故选D。
5.D
【解析】
T元素的价电子3d104s1,可知T元素为Cu
;X的最简单氢化物分子的空间结构为正四面体,则X应为C或Si;Y在同周期中电负性最小,则Y为Na或K,若Y为K,元素Z形成的离子半径最小,则Z应为Ga元素,其原子序数大于Cu,故不符合题意,所以Y为Na,则X为C;二元化合物E中元素Y和W的质量比为23:16,Y为Na,则W为S,化为物E为Na2S;同周期元素简单离子中,元素Z形成的离子半径最小,则Z为Al;。
A.X的最简单氢化物为CH4,空间构型为正四面体,正负电荷中心重合,为非极性分子,故A错误;
B.S在足量的氧气中燃烧生成SO2,SO2溶于水后生成H2SO3,亚硫酸不是强酸,故B错误;
C.Cu与S在加热条件下发生反应,因为S的氧化性较弱,只能将Cu氧化成较低价态,得到产物是Cu2S,故C错误;
D.化合物E为Na2S,钠离子和硫离子之间为离子键,故D正确;
故答案为D。
6.B
【解析】
①二氯化铍分子中铍元素的族序数+成键数=2+2=4,所以分子中不能满足所有原子最外层8电子结构,故错误;
②NCl3中,N原子的最外层电子为:5+3=8,Cl原子的最外层电子为:7+|﹣1|=8,都满足8电子稳定结构,故正确;
③PCl3中,P原子的最外层电子为:5+3=8,Cl原子的最外层电子为:7+|﹣1|=8,都满足8电子稳定结构,故正确;
④COCl2中,C原子的最外层电子为4+4=8,O原子的最外层电子为6+2=8,Cl原子的最外层电子为7+1=8,故错误;
⑤SF6中,只有F原子满足了8电子稳定结构,故错误;
⑥XeF2中,Xe原子的原子核外最外层电子数为8,其在分子中的化合价为+2价,在分子中的原子最外层电子数为10,故错误;
⑦CS2
分子中C元素的族序数+成键数=4+4=8,则二硫含碳满足分子中所有原子都满足最外层8电子结构,故正确;
⑧CH4
中,C原子的最外层电子为:4+|﹣4|=8,H原子的最外层电子为:1+1=2,不都满足8电子稳定结构,故错误;
⑨CF2Cl2分子中C原子与F、Cl原子之间形成C﹣F、C﹣Cl,C原子最外层电子数为4+4=8,Cl原子最外层电子数=7+1=8,F原子最外层电子数7+1=8,均满足8电子结构,故正确;
⑩S2Cl2结构式为Cl﹣S﹣S﹣Cl,S原子最外层电子数为6+2=8,Cl原子最外层电子数=7+1=8,均满足8电子结构,故正确;
故选:B。
7.A
【解析】
X原子的M电子层比Y原子的M电子层少3个电子,说明Y原子的L层已经排满8个电子,Y原子的L电子层的电子数恰好为X原子的L层电子数的2倍,则X原子L层电子数为4,则X为碳元素,碳原子的M层电子数为0,所以Y原子的M层电子数为3,故Y为铝元素,即X和Y分别是碳和铝,
故选:A。
8.A
【解析】
由化学式HnRO5-n知R的最高正化合价为10-3n,根据最高正价与负价绝对值之和为8,得负价为10-3n-8
=
-(3n-2),在其气态氢化物的分子中,氢为+1价,所以H的个数为3n-2,故答案为:A。
9.A
【解析】
由四种元素基态原子电子排布式可知,①1s22s22p63s23p4是S元素、②1s22s22p63s23p3是P元素、③1s22s22p3是N元素、④1s22s22p5是F元素;A.同周期自左而右第一电离能呈增大趋势,故第一电离能N<F,但P元素原子3p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,所以第一电离能S<P,同主族自上而下第一电离能降低,所以第一电离能N>P,所以第一电离能S<P<N<F,即④>③>②>①,故A正确;B.同周期自左而右原子半径减小,所以原子半径P>S,N>F,电子层越多原子半径越大,故原子半径P>S>N>F,即②>①>③>④,故B错误;C.同周期自左而右电负性增大,所以电负性P<S,N<F,N元素非金属性比S元素强,所以电负性S<N,故电负性P<S<N<F,即②<①<③<④,故C错误;D.最高正化合价等于最外层电子数,但F元素没有正化合价,所以最高正化合价:①>②=③,故D错误。故答案为A。
10.C
【解析】
四个选项中C中3P轨道属于半充满状态,稳定性强,第一电离能最大。答案选C。
11.B
【解析】
A、氢键影响物质的部分物理性质,如溶解性、熔沸点等,稳定性是物质的化学性质,因此水很稳定与水中含有大量的氢键无关,故A错误;
B、ABn型分子中,若中心原子没有孤电子对,则ABn为空间对称结构,属于非极性分子,故B正确;
C、H2O中心原子O有2个σ键,孤电子对数(6-2×1)/2=2,杂化类型为sp3,NH3中心原子N有3个σ键,孤电子对数(5-3×1)/2=1,杂化类型为sp3,CH4中心原子C有4个σ键,孤电子对数为(4-4×1)/2=0,杂化类型为sp3,故C错误;
D、根据配合物组成,Cu2+为中心离子,配体为H2O,配位数为4,故D错误。
12.C
【解析】
A.N2和CO均为双原子分子,且均有10个价电子,属于等电子体,A不合题意;
B.CO2和N2O均为三原子分子,且均有16个价电子,属于等电子体,B不合题意;
C.PH3和HCl分子中所含原子数不同,不是等电子体,C符合题意;
D.H2S和H2O均为三原子分子,价电子数均为8,属于等电子体,D不合题意。
故选C。
13.B
【解析】
A.
H2O是V型分子,A错误;
B.
CH4中含有C-H极性键,CCl4中含有C-Cl极性键,都是含有极性键的非极性分子,B正确;
C.
H2O分子间存在氢键,熔沸点反常的高,熔沸点:H2O>H2Se>H2S,C错误;
D.
同一主族,从上到下,气态氢化物稳定性减弱,
HF、HCl、HBr、HI的稳定性依次减弱,D错误;故答案为:B。
14.D
【解析】
石蜡→液体石蜡→石蜡蒸气属于物质的三态变化,属于物理变化,破坏了范德华力,石蜡蒸气→裂化气发生了化学变化,破坏了共价键;所以在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是范德华力、范德华力、共价键,
故答案为D。
15.D
【解析】
A.CH4、C2H2为极性键构成的非极性分子,而HCN为极性分子,故A错误;
B.SO2分子为V形结构,分子中正负电荷重心不重合,属于极性分子,CO2分子为直线型对称结构,分子中正负电荷重心重合,属于非极性分子,故B错误;
C.葡萄糖分子(HOCH2—CHOH—CHOH—CHOH—CHOH—CHO)中中间的4个C原子连接了四个不同的原子或原子团,为手性碳原子,则手性碳原子数为4,故C错误;
D.H3PO4的非羟基氧原子数比HClO的多,含氧酸中非羟基氧原子数越多,酸性越强,所以磷酸的酸性强于次氯酸,故D正确;
答案选D。
16.D
【解析】
A项、VSEPR模型可用来预测分子的立体构型,注意实际空间构型要去掉孤电子对,故A正确;
B项、分子的空间结构与价电子对相互排斥有关,排斥能力大小顺序是:孤电子对间排斥力>孤电子对和成对电子对间的排斥力>成对电子对间的排斥力,故B正确;
C项、中心原子上的孤电子对参与互相排斥,如水分子中氧原子价层电子对个数为4,孤对电子数为2,空间构型为V形,四氯化碳分子中碳原子价层电子对个数为4,孤对电子数为,0,空间构型为正四面体形,故C正确;
D项、在多原子分子内,两个共价键之间的夹角,分子中键角越大,价电子对相互排斥力越小,分子越稳定,如NH3为三角锥形,键角为107°,CH4为正四面体,具有对称性,键角为109°28′,CH4比氨气稳定,故D错误;
故选D。
17.A
【解析】
A.氧气分子间存在非极性共价键,但氧气是单质,不是化合物,故A正确;
B.化学键是指分子或晶体中,直接相邻的原子之间的强烈相互作用,分子间作用力是指分子间存在着将分子聚集在一起的作用力,分子间作用力比化学键弱得多,化学键影响物质的化学性质和物理性质,分子间作用力影响物质熔沸点和溶解性,影响着物质的溶解度,故B错误;
C.已知碳碳双键中含有1个σ键和1个π键,C-C中只含有1个σ键,而且π键不稳定键能比σ键小,所以碳碳双键的键能比碳碳单键键能的2倍要小,故B错误;
D.H2O中价层电子对个数=σ键个数+孤电子对个数=2+2=4,所以采取sp3杂化,故D错误;
答案:A
18.C
【解析】
A.乙烯结构为CH2=CH2,C原子为sp2杂化,C=C含有一个sp2-sp2σ键和一个p-p
π键,所以A选项是正确的;
B.乙炔分子中,碳氢原子之间形成两个键,碳碳三键中含有一个键和两个π键,所以乙炔分子中含有三个键两个键,所以B选项是正确的;
C.乙烷中存在6个C-H键、1个C-C键,共7个键,故C错误;
D.苯分子中C原子形成3个键,为sp2杂化,分子中存在大π键,所以D选项是正确的。
故答案选C。
19.C
【解析】
A.该离子中,六元环上碳原子价层电子对数为3,C原子的杂化方式为sp2;饱和C原子价层电子对数为4,这些C原子采用sp3杂化,A错误;
B.该离子中六元环上氮原子的杂化方式为sp2杂化,连接环的-NH-的N原子采用sp3杂化,B错误;
C.该离子中有非金属元素的原子之间的共价键,有Cu+与N原子之间的配位键,不存在离子键,C正确;
D.元素的非金属性越强,其电负性就越大,元素的非金属性N>H>Cu,所以三种元素的电负性顺序为:N>H>Cu,D错误;
故合理选项是C。
20.B
【解析】
A.R元素最外层有5个电子,形成5个共用电子对,所以RCl5分子的最外层电子数为10,不满足8电子稳定结构,A项错误;
B.上、下两个顶点的原子与中心R原子形成的键角为180°,中间的平面三角形中,中心原子与三个项点的原子形成的键角为120°,中心原子与上、下顶点原子、与此三角形平面项点的原子形成的键角为90°,所以键角(Cl—R—Cl)有90°、120°、180°几种,B项正确;
C.由图可知RCl5分子空间构型是高度对称的,形成非极性分子,而RCl3是三角锥形结构,其分子是极性分子,C项错误;
D.分子上、下顶点的Cl原子与R原子形成的键长相同,键能相同,平面上正三角形顶点三个Cl原子与R原子形成的键长相同,键能相同,D项错误;
所以答案选择B项。
21.A
【解析】
K元素的化合价是+1,CN-整体的化合价为-1,假设Fe元素的价态为x,按照化合物中各元素化合总价为零的原则,可得(+1)×3+x+(-1)×6=0,解得x=3,因而中心离子为Fe3+,化合价为+3。
故答案选A。
22.A
【解析】
A、根据S2Cl2的结构,S2Cl2不是对称结构,S2Cl2为极性分子,故A说法错误;
B、S和Cl之间形成共价键为极性键,S和S之间形成共价键为非极性键,故B说法正确;
C、S2Cl2与S2Br2结构相似,通过分子间作用力或范德华力进行分析,S2Br2相对分子质量大于S2Cl2的相对分子质量,S2Br2分子间的范德华力大于S2Cl2分子间的范德华力,即S2Br2的熔沸点高于S2Cl2,故C说法正确;
D、S2Cl2与水反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl,故D说法正确。
23.A
【解析】
SOCl2中S原子成2个S-Cl键,1个S=O,价层电子对个数=σ键个数+孤电子对个数=3+(6?2?1×2)/2=4,杂化轨道数是4,故S原子采取sp3杂化,含一对孤电子,分子的VSEPR模型为四面体形,分子形状为三角锥形。
答案选A。
24.C
【解析】
催化合成H2O2,是催化剂,和Pd是反应的中间体,总反应为。
A.由图可知,钯的配合物离子先与氢气生成Pd,Pd继续与O2和Cl-反应生成,再与HCl生成H2O2,所以是反应中间体,故A正确;
B.结合题意,由图可知发生的总反应为:,故B正确;
C.中Pd形成6个键,可以看出Pd的成键数目由4变为6再变为4,依次循环,故C错误;
D.在流程中存在反应,故D正确。
答案选C。
25.D
【解析】
A项、[Co(NH3)4Cl2]Cl能电离出氯离子,所以能和硝酸银反应生成氯化银沉淀,故A错误;
B项、[Co(NH3)6]Cl3能电离出氯离子,所以能和硝酸银反应生成氯化银沉淀,故B错误;
C项、[Cu(NH3)4]Cl2能电离出氯离子,所以能和硝酸银反应生成氯化银沉淀,故C错误;
D项、[Co(NH3)3Cl3]不能电离出氯离子,所以不能和硝酸银反应生成氯化银沉淀,故D正确。
故选D。
26.1s22s22p63s23p63d5或[Ar]3d5
配位键
离子键
sp
N>O>C
O>N>C
【解析】
(1)Fe原子核外有26个电子,失去外围3个电子形成Fe3+,所以基态Fe3+的核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5;
(2)K4[Fe(CN)6]是离子化合物,存在离子键,其中Fe(CN)64-含有共价键和配位键,即化学键为离子键、配位键和共价键;
(3)CN-中N的价层电子对数=1+=2,所以N采用sp杂化;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但是第IIA族、第VA族元素第一电离能大于其相邻元素,所以C、N、O第一电离能大小顺序为N>O>C;同一周期元素电负性随着原子序数增大而增大,所以C、N、O的电负性大小顺序为O>N>C。
27.三角锥形
平面三角形
四面体形
【解析】
(1)判断离子的空间构型时,需寻找等电子体:价电子数为26,与SO32-互为等电子体,所以空间构型为三角锥形;的价电子数为24,与SO3互为等电子体,所以空间构型为平面三角形;的价电子数为32,与CCl4互为等电子体,所以空间构型为四面体形。答案为:三角锥形;平面三角形;四面体形;
(2)由第2周期元素原子构成,与F2互为等电子体的离子,可从C、N、O进行分析,如O元素,构成。答案为:;
(3)已知分子中O、S间为共价双键,S、F间为共价单键。含有6个原子,价电子数为40,与PCl5互为等电子体,则结构为三角双锥形,4个S—F键的键长相同,另含1个S=O键,则应为PCl5分子中位于同一平面内的2个S—F键被S=O键所替代,从而得出PCl5的空间构型为。
28.1s22s22p63s23p5
同周期元素随核电荷数增大,原子半径逐渐变小,故结合一个电子释放出的能量(E1)依次增大
N原子的2p轨道为半充满状态,具有稳定性,故不易结合一个电子
sp3杂化
正四面体
5
Π
(H3O+)O—H…N(N)
(NH)N—H…N(N)
【解析】
(1)、氯原子的核电荷数为17,其电子排布式为1s22s22p63s23p5;
(2)、周期元素随核电荷数依次增大,原子半径逐渐变小,故结合1个电子释放出的能量依次增大,氮原子的2p轨道为半充满状态,具有稳定性;
故答案为:同周期元素随核电荷数增大,原子半径逐渐变小,故结合一个电子释放出的能量(E1)依次增大;N原子的2p轨道为半充满状态,具有稳定性,故不易结合一个电子;
(3)①H3O+中价层电子对数都是3且含有一对孤电子对,所以为三角锥形结构,中心原子的杂化类型为sp3杂化,NH中价层电子对个数是4且不含孤电子对,其空间构型为正四面体;
②3[H3ON5]·3[NH4N5]·NH4Cl中阴离子N中的σ键总数为5个,根据已知信息,N中参与形成大π键的原子数为5,形成大π键的电子数为6,所以N中的大π键表示为Π;
③图(b)中虚线代表氢键,其中表示式为(NH)N—H…Cl、(H3O+)O—H…N(N)、(NH)N—H…N(N);
故答案为:sp3杂化;正四面体;5
;Π;(H3O+)O—H…N(N);(NH)N—H…N(N)。
29.砷
F、O、N
>
Mg的3s处于全满状态较稳定
Fe3+
ds区
1s22s22p63s23p63d104s1或[Ar]3d104s1
A
【解析】
属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大,A元素的价电子构型为nsnnpn+1,则n=2,故A为N元素;C元素为最活泼的非金属元素,则C为F元素;B原子序数介于氮、氟之间,故B为O元素;D元素核外有三个电子层,最外层电子数是核外电子总数的,最外层电子数为2,故D为Mg元素;E元素正三价离子的3d轨道为半充满状态,原子核外电子排布为1s22s22p63s23p63d64s2,则原子序数为26,为Fe元素;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,核外电子排布为1s22s22p63s23p63d104s1,故F为Cu元素;G元素与A元素位于同一主族,其某种氧化物有剧毒,则G为As元素。
(1)
G为As元素,G的元素名称为砷;
(2)同周期元素从左到右元素的电负性逐渐增强,故电负性F>O>N;Al价电子排布式为3s23p1,D为Mg元素,价电子排布式为3s2,Mg的3s处于全满状态较稳定,第一电离能Mg>Al;
(3)
C为F元素,电子排布图为,E3+的离子符号为Fe3+;
(4)
F为Cu,位于周期表ds区,其基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;
(5)G为As元素,
A.As与Si位于周期表中金属与非金属分界线处,其单质可作为半导体材料,故A正确;
B.同一主族,从上到下,电负性减弱,As电负性比P小,故B错误;
C.As非金属性比P的弱,因磷酸为中强酸,则As的最高价氧化物对应的水化物是弱酸,故C错误;
D.砷元素位于VA族,P轨道为半充满状态,所以As第一电离能大于硒,故D错误;
故答案选A。
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
选修3物质的结构与性质期中测试(解析版)
第I卷(选择题)
一、单选题(共50分)
1.(本题2分)由中国近代化学启蒙者徐寿确认汉译名的下列元素中,属于d区元素的是
A.Ca
B.Ni
C.Zn
D.Ga
2.(本题2分)已知元素的原子序数,不可以推断元素原子的( )
A.质子数
B.核电荷数
C.核外电子数
D.离子所带的电荷数
3.(本题2分)116元素的名称和符号如图所示。下列有关说法不正确的是
A.Lv属于金属元素
B.Lv位于第七周期
C.Lv原子的最外层有6个电子
D.Lv原子的相对原子质量是116
4.(本题2分)2011年3月12日日本福岛几组核电站受强地震的影响连续爆炸,造成严重的核泄漏。据报道在核电站附近检测到主要的两种放射性物质为:13153I和13755Cs,下列关于13153I和13755Cs的说法不正确的是
A.13153I位于第五周期第ⅦA族
B.13755Cs的质量数为137
C.13153I原子中中子数与核外电子数之差为25
D.13755Cs的失电子能力比钾的弱
5.(本题2分)前四周期元素X、Y、Z、W、T的原子序数依次增大,Y、Z、W位于同一周期,X的最简单氢化物分子的空间结构为正四面体,Y在同周期中电负性最小,二元化合物E中元素Y和W的质量比为23:16;同周期元素简单离子中,元素Z形成的离子半径最小;T元素的价电子排布式为3d104s1。下列说法正确的是(
)
A.X的最简单氢化物分子为极性分子
B.W的单质在足量的氧气中燃烧,所得产物溶于水可得强酸
C.W和T的单质混合加热可得化合物TW
D.化合物E中存在离子键
6.(本题2分)下列分子中所有原子都满足最外层为8电子结构的是
①BeCl2②NCl3③PCl3④COCl2⑤SF6
⑥XeF2⑦CS2⑧CH4⑨CF2Cl2⑩S2Cl2
A.②④⑦⑧⑨⑩
B.②③④⑦⑨⑩
C.①③④⑦⑩
D.③④⑤⑦⑨⑩
7.(本题2分)有X、Y两种原子,X原子的M电子层比Y原子的M电子层少3个电子,Y原子的L电子层的电子数恰好为X原子L电子层电子数的2倍,X和Y分别是
A.碳和铝
B.硅和钠??
C.硼和氮?
D.氯和碳
8.(本题2分)某元素R的最高价含氧酸的化学式为HnRO5-n,在其气态氢化物的分子中,H原子的个数为
A.3n-2
B.3n-4
C.3n-6
D.2n-3
9.(本题2分)现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>①>③=②
10.(本题2分)下列原子的价电子排布中,对应元素第一电离能最大的是(
)
A.3s23p1
B.3s23p2
C.3s23p3
D.3s23p4
11.(本题2分)下列说法正确的是(
)
A.水很稳定是因为水中含有大量的氢键
B.ABn型分子中,若中心原子没有孤电子对,则ABn为空间对称结构,属于非极性分子
C.H2O、NH3、CH4分子中的O、N、C分别形成2个、3个、4个键,故O、N、C分别采取sp、sp2、sp3杂化
D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配体是SO42-,配位数是1
12.(本题2分)下列不属于等电子体的是(
)
A.N2和CO
B.CO2和N2O
C.PH3和HCl
D.H2S和
13.(本题2分)对于共价分子相关性质的叙述中,正确的是(
)
A.CO2、H2O、C2H2都是直线型分子
B.CH4、CCl4都是含有极性键的非极性分子
C.H2O、H2S、H2Se的熔沸点依次升高
D.HF、HCl、HBr、HI的稳定性依次增强
14.(本题2分)在“石蜡
→石蜡油
→石蜡气体→裂化气”的变化过程中,被破坏的作用力依次是()
A.范德华力、范德华力、范德华力
B.共价键、共价键、共价键
C.范德华力、共价键、共价键
D.范德华力、范德华力、共价键
15.(本题2分)下列说法中正确的是( )
A.CH4,C2H2,HCN都是含有极性键的非极性分子
B.CO2与SO2的立体构型相似,都是非极性分子
C.葡萄糖分子(HOCH2—CHOH—CHOH—CHOH—CHOH—CHO)中的手性碳原子数为5
D.酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数比HClO的多
16.(本题2分)下列关于价层电子对互斥模型(VSEPR
模型)的叙述中不正确的是(
)
A.VSEPR
模型可用来预测分子的立体构型
B.分子中价电子对相互排斥决定了分子的立体构型
C.中心原子上的孤对电子也要占据中心原子周围的空间并参与互相排斥
D.分子中键角越大,价电子对相互排斥力越大,分子越稳定
17.(本题2分)下列说法正确的是
A.含有非极性键的分子不一定是共价化合物
B.分子间作用力比化学键弱得多,但它对物质的熔点、沸点有较大的影响,而对溶解度无影响
C.根据π键的成键特征判断C=C键能是C﹣C键能的2倍
D.H2O中心原子采取sp杂化
18.(本题2分)下列有关有机物分子的叙述不正确的是(
)
A.乙烯分子中有一个sp2-sp2σ键和一个p-p
π键
B.乙炔每个碳原子都有两个未杂化的2p轨道,它们之间可形成两个π键
C.乙烷两个C原子均是sp3杂化,分子中一共有6个σ键
D.苯分子每个碳原子均是sp2杂化
19.(本题2分)铜离子是人体内多种酶的辅因子,某化合物与Cu+结合形成如图所示的离子。下列有关该离子说法正确的是(
)
A.该离子中碳原子的杂化方式为sp2
B.该离子中氮原子的杂化方式为sp2
C.该离子中只有共价键(含配位键),没有离子键
D.H、N、Cu三种元素的电负性顺序为:Cu>H>N
20.(本题2分)第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中正确的是(
)
A.每个原子都达到8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°、180°几种
C.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D.分子中5个R—Cl键键能各不相同
21.(本题2分)配合物K3[Fe(CN)6]中,中心离子的化合价是(
)
A.+3
B.-3
C.+1
D.—1
22.(本题2分)S2Cl2是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法中错误的是(
)
A.S2Cl2为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔、沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O===SO2↑+3S↓+4HCl
23.(本题2分)氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的VSEPR模型、分子的几何构型和中心原子(S)采取杂化方式的说法正确的是(
)
A.四面体形、三角锥形、sp3
B.平面三角形、V形、sp2
C.平面三角形、平面三角形、sp2
D.四面体形、三角锥形、sp2
24.(本题2分)钯的配合物离子可催化合成,反应过程如图所示。下列叙述错误的是(
)
A.是反应中间体
B.催化合成总反应为
C.反应过程中的成键数目保持不变
D.存在反应
25.(本题2分)下列配合物的水溶液中加入硝酸银不能生成沉淀的是
A.[Co(NH3)4Cl2]Cl
B.[Co(NH3)6]Cl3
C.[Cu(NH3)4]Cl2
D.[Co(NH3)3Cl3]
第II卷(非选择题)
二、填空题(共33分)
26.(本题10分)亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式___。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有___和___。
(3)黄血盐中N原子的杂化方式为____;C、N、O的第一电离能由大到小的排序为___,电负性由大到小的排序为___。
27.(本题7分)部分等电子体类型、代表物质及对应的空间构型如表所示:
等电子类型
代表物质
空间构型
四原子24电子等电子体
SO3
平面三角形
四原子26电子等电子体
SO32-
三角锥形
五原子32电子等电子体
CCl4
四面体形
六原子40电子等电子体
PCl5
三角双锥形
七原子48电子等电子体
SF6
八面体形
请回答下列问题。
(1)请写出下列离子的空间构型:
_______________,_________________,________________。
(2)由第2周期元素原子构成,与F2互为等电子体的离子是__________。
(3)的空间构型如图1所示,请再按照图1的表示方法在图2中表示出分子中O、S、F原子的空间位置。已知分子中O、S间为共价双键,S、F间为共价单键。__________。
28.(本题16分)某盐的组成可表示为3[H3ON5]·3[NH4N5]·NH4Cl。回答下列问题:
(1)氯原子的电子排布式为________________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_________________;氮元素的E1呈现异常的原因是__________________。
(3)经X射线衍射测得化合物3[H3ON5]·3[NH4N5]·NH4Cl的晶体结构,其局部结构如图(b)所示。
①H3O+中心原子的杂化类型为________,NH4+的空间构型为________。
②3[H3ON5]·3[NH4N5]·NH4Cl中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则N5-中的大π键应表示为________。
③图(b)中虚线代表氢键,其中表示式为(NH4+)N—H…Cl、________、________。
三、推断题(共17分)
29.(本题17分)现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)G的元素名称为__________________?
(2)A、B、C三种元素电负性由大到小的顺序为_____________________(用元素符号表示),第一电离能D
_______Al(填“>”“<”或“=”),其原因是___________________________。
(3)C元素的电子排布图为__________________;E3+的离子符号为__________________
(4)F元素位于元素周期表的______区,其基态原子的电子排布式为___________________
(5)G元素可能的性质_______________
A.其单质可作为半导体材料?????
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
D.其第一电离能小于硒
参考答案
1.B
【解析】
A.Ca元素位于第ⅡA族,为s区元素,故A不符合题意;
B.Ni元素位于第Ⅷ族,为d区元素,故B符合题意;
C.Zn元素位于第ⅡB族,为ds区元素,故C不符合题意;
D.Ga元素位于第ⅢA族,为p区元素,故D不符合题意;
综上所述答案为B。
2.D
【解析】
已知元素的原子序数,由“原子序数=质子数=核电荷数=核外电子数”可知,选项ABC推知,选项D无法推知;
答案选D。
3.D
【解析】
A.从名称上看,
Lv属于金属元素,A项正确;
B.因第七周期的原子序数为87-118,因此原子序数为116的
Lv位于第七周期,B项正确;
C.
从原子序数上看,Lv距离稀有气体的原子序数仅差2,因此为第VIA元素原子,故其最外层有6个电子,C项正确;
D.
116为Lv的原子序数,并非相对原子质量,D项错误;
答案选D。
4.D
【解析】
A.
13153I的核电荷数为53,位于第五周期第ⅦA族,故正确;B.
13755Cs的质量数为137,故正确;C.
13153I原子中中子数为131-53=78,核外电子数为53,二者差78-53=25,故正确;D.
13755Cs与钾是同主族元素,核电荷数比钾大,失电子能力比钾的强,故错误。故选D。
5.D
【解析】
T元素的价电子3d104s1,可知T元素为Cu
;X的最简单氢化物分子的空间结构为正四面体,则X应为C或Si;Y在同周期中电负性最小,则Y为Na或K,若Y为K,元素Z形成的离子半径最小,则Z应为Ga元素,其原子序数大于Cu,故不符合题意,所以Y为Na,则X为C;二元化合物E中元素Y和W的质量比为23:16,Y为Na,则W为S,化为物E为Na2S;同周期元素简单离子中,元素Z形成的离子半径最小,则Z为Al;。
A.X的最简单氢化物为CH4,空间构型为正四面体,正负电荷中心重合,为非极性分子,故A错误;
B.S在足量的氧气中燃烧生成SO2,SO2溶于水后生成H2SO3,亚硫酸不是强酸,故B错误;
C.Cu与S在加热条件下发生反应,因为S的氧化性较弱,只能将Cu氧化成较低价态,得到产物是Cu2S,故C错误;
D.化合物E为Na2S,钠离子和硫离子之间为离子键,故D正确;
故答案为D。
6.B
【解析】
①二氯化铍分子中铍元素的族序数+成键数=2+2=4,所以分子中不能满足所有原子最外层8电子结构,故错误;
②NCl3中,N原子的最外层电子为:5+3=8,Cl原子的最外层电子为:7+|﹣1|=8,都满足8电子稳定结构,故正确;
③PCl3中,P原子的最外层电子为:5+3=8,Cl原子的最外层电子为:7+|﹣1|=8,都满足8电子稳定结构,故正确;
④COCl2中,C原子的最外层电子为4+4=8,O原子的最外层电子为6+2=8,Cl原子的最外层电子为7+1=8,故错误;
⑤SF6中,只有F原子满足了8电子稳定结构,故错误;
⑥XeF2中,Xe原子的原子核外最外层电子数为8,其在分子中的化合价为+2价,在分子中的原子最外层电子数为10,故错误;
⑦CS2
分子中C元素的族序数+成键数=4+4=8,则二硫含碳满足分子中所有原子都满足最外层8电子结构,故正确;
⑧CH4
中,C原子的最外层电子为:4+|﹣4|=8,H原子的最外层电子为:1+1=2,不都满足8电子稳定结构,故错误;
⑨CF2Cl2分子中C原子与F、Cl原子之间形成C﹣F、C﹣Cl,C原子最外层电子数为4+4=8,Cl原子最外层电子数=7+1=8,F原子最外层电子数7+1=8,均满足8电子结构,故正确;
⑩S2Cl2结构式为Cl﹣S﹣S﹣Cl,S原子最外层电子数为6+2=8,Cl原子最外层电子数=7+1=8,均满足8电子结构,故正确;
故选:B。
7.A
【解析】
X原子的M电子层比Y原子的M电子层少3个电子,说明Y原子的L层已经排满8个电子,Y原子的L电子层的电子数恰好为X原子的L层电子数的2倍,则X原子L层电子数为4,则X为碳元素,碳原子的M层电子数为0,所以Y原子的M层电子数为3,故Y为铝元素,即X和Y分别是碳和铝,
故选:A。
8.A
【解析】
由化学式HnRO5-n知R的最高正化合价为10-3n,根据最高正价与负价绝对值之和为8,得负价为10-3n-8
=
-(3n-2),在其气态氢化物的分子中,氢为+1价,所以H的个数为3n-2,故答案为:A。
9.A
【解析】
由四种元素基态原子电子排布式可知,①1s22s22p63s23p4是S元素、②1s22s22p63s23p3是P元素、③1s22s22p3是N元素、④1s22s22p5是F元素;A.同周期自左而右第一电离能呈增大趋势,故第一电离能N<F,但P元素原子3p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,所以第一电离能S<P,同主族自上而下第一电离能降低,所以第一电离能N>P,所以第一电离能S<P<N<F,即④>③>②>①,故A正确;B.同周期自左而右原子半径减小,所以原子半径P>S,N>F,电子层越多原子半径越大,故原子半径P>S>N>F,即②>①>③>④,故B错误;C.同周期自左而右电负性增大,所以电负性P<S,N<F,N元素非金属性比S元素强,所以电负性S<N,故电负性P<S<N<F,即②<①<③<④,故C错误;D.最高正化合价等于最外层电子数,但F元素没有正化合价,所以最高正化合价:①>②=③,故D错误。故答案为A。
10.C
【解析】
四个选项中C中3P轨道属于半充满状态,稳定性强,第一电离能最大。答案选C。
11.B
【解析】
A、氢键影响物质的部分物理性质,如溶解性、熔沸点等,稳定性是物质的化学性质,因此水很稳定与水中含有大量的氢键无关,故A错误;
B、ABn型分子中,若中心原子没有孤电子对,则ABn为空间对称结构,属于非极性分子,故B正确;
C、H2O中心原子O有2个σ键,孤电子对数(6-2×1)/2=2,杂化类型为sp3,NH3中心原子N有3个σ键,孤电子对数(5-3×1)/2=1,杂化类型为sp3,CH4中心原子C有4个σ键,孤电子对数为(4-4×1)/2=0,杂化类型为sp3,故C错误;
D、根据配合物组成,Cu2+为中心离子,配体为H2O,配位数为4,故D错误。
12.C
【解析】
A.N2和CO均为双原子分子,且均有10个价电子,属于等电子体,A不合题意;
B.CO2和N2O均为三原子分子,且均有16个价电子,属于等电子体,B不合题意;
C.PH3和HCl分子中所含原子数不同,不是等电子体,C符合题意;
D.H2S和H2O均为三原子分子,价电子数均为8,属于等电子体,D不合题意。
故选C。
13.B
【解析】
A.
H2O是V型分子,A错误;
B.
CH4中含有C-H极性键,CCl4中含有C-Cl极性键,都是含有极性键的非极性分子,B正确;
C.
H2O分子间存在氢键,熔沸点反常的高,熔沸点:H2O>H2Se>H2S,C错误;
D.
同一主族,从上到下,气态氢化物稳定性减弱,
HF、HCl、HBr、HI的稳定性依次减弱,D错误;故答案为:B。
14.D
【解析】
石蜡→液体石蜡→石蜡蒸气属于物质的三态变化,属于物理变化,破坏了范德华力,石蜡蒸气→裂化气发生了化学变化,破坏了共价键;所以在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是范德华力、范德华力、共价键,
故答案为D。
15.D
【解析】
A.CH4、C2H2为极性键构成的非极性分子,而HCN为极性分子,故A错误;
B.SO2分子为V形结构,分子中正负电荷重心不重合,属于极性分子,CO2分子为直线型对称结构,分子中正负电荷重心重合,属于非极性分子,故B错误;
C.葡萄糖分子(HOCH2—CHOH—CHOH—CHOH—CHOH—CHO)中中间的4个C原子连接了四个不同的原子或原子团,为手性碳原子,则手性碳原子数为4,故C错误;
D.H3PO4的非羟基氧原子数比HClO的多,含氧酸中非羟基氧原子数越多,酸性越强,所以磷酸的酸性强于次氯酸,故D正确;
答案选D。
16.D
【解析】
A项、VSEPR模型可用来预测分子的立体构型,注意实际空间构型要去掉孤电子对,故A正确;
B项、分子的空间结构与价电子对相互排斥有关,排斥能力大小顺序是:孤电子对间排斥力>孤电子对和成对电子对间的排斥力>成对电子对间的排斥力,故B正确;
C项、中心原子上的孤电子对参与互相排斥,如水分子中氧原子价层电子对个数为4,孤对电子数为2,空间构型为V形,四氯化碳分子中碳原子价层电子对个数为4,孤对电子数为,0,空间构型为正四面体形,故C正确;
D项、在多原子分子内,两个共价键之间的夹角,分子中键角越大,价电子对相互排斥力越小,分子越稳定,如NH3为三角锥形,键角为107°,CH4为正四面体,具有对称性,键角为109°28′,CH4比氨气稳定,故D错误;
故选D。
17.A
【解析】
A.氧气分子间存在非极性共价键,但氧气是单质,不是化合物,故A正确;
B.化学键是指分子或晶体中,直接相邻的原子之间的强烈相互作用,分子间作用力是指分子间存在着将分子聚集在一起的作用力,分子间作用力比化学键弱得多,化学键影响物质的化学性质和物理性质,分子间作用力影响物质熔沸点和溶解性,影响着物质的溶解度,故B错误;
C.已知碳碳双键中含有1个σ键和1个π键,C-C中只含有1个σ键,而且π键不稳定键能比σ键小,所以碳碳双键的键能比碳碳单键键能的2倍要小,故B错误;
D.H2O中价层电子对个数=σ键个数+孤电子对个数=2+2=4,所以采取sp3杂化,故D错误;
答案:A
18.C
【解析】
A.乙烯结构为CH2=CH2,C原子为sp2杂化,C=C含有一个sp2-sp2σ键和一个p-p
π键,所以A选项是正确的;
B.乙炔分子中,碳氢原子之间形成两个键,碳碳三键中含有一个键和两个π键,所以乙炔分子中含有三个键两个键,所以B选项是正确的;
C.乙烷中存在6个C-H键、1个C-C键,共7个键,故C错误;
D.苯分子中C原子形成3个键,为sp2杂化,分子中存在大π键,所以D选项是正确的。
故答案选C。
19.C
【解析】
A.该离子中,六元环上碳原子价层电子对数为3,C原子的杂化方式为sp2;饱和C原子价层电子对数为4,这些C原子采用sp3杂化,A错误;
B.该离子中六元环上氮原子的杂化方式为sp2杂化,连接环的-NH-的N原子采用sp3杂化,B错误;
C.该离子中有非金属元素的原子之间的共价键,有Cu+与N原子之间的配位键,不存在离子键,C正确;
D.元素的非金属性越强,其电负性就越大,元素的非金属性N>H>Cu,所以三种元素的电负性顺序为:N>H>Cu,D错误;
故合理选项是C。
20.B
【解析】
A.R元素最外层有5个电子,形成5个共用电子对,所以RCl5分子的最外层电子数为10,不满足8电子稳定结构,A项错误;
B.上、下两个顶点的原子与中心R原子形成的键角为180°,中间的平面三角形中,中心原子与三个项点的原子形成的键角为120°,中心原子与上、下顶点原子、与此三角形平面项点的原子形成的键角为90°,所以键角(Cl—R—Cl)有90°、120°、180°几种,B项正确;
C.由图可知RCl5分子空间构型是高度对称的,形成非极性分子,而RCl3是三角锥形结构,其分子是极性分子,C项错误;
D.分子上、下顶点的Cl原子与R原子形成的键长相同,键能相同,平面上正三角形顶点三个Cl原子与R原子形成的键长相同,键能相同,D项错误;
所以答案选择B项。
21.A
【解析】
K元素的化合价是+1,CN-整体的化合价为-1,假设Fe元素的价态为x,按照化合物中各元素化合总价为零的原则,可得(+1)×3+x+(-1)×6=0,解得x=3,因而中心离子为Fe3+,化合价为+3。
故答案选A。
22.A
【解析】
A、根据S2Cl2的结构,S2Cl2不是对称结构,S2Cl2为极性分子,故A说法错误;
B、S和Cl之间形成共价键为极性键,S和S之间形成共价键为非极性键,故B说法正确;
C、S2Cl2与S2Br2结构相似,通过分子间作用力或范德华力进行分析,S2Br2相对分子质量大于S2Cl2的相对分子质量,S2Br2分子间的范德华力大于S2Cl2分子间的范德华力,即S2Br2的熔沸点高于S2Cl2,故C说法正确;
D、S2Cl2与水反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl,故D说法正确。
23.A
【解析】
SOCl2中S原子成2个S-Cl键,1个S=O,价层电子对个数=σ键个数+孤电子对个数=3+(6?2?1×2)/2=4,杂化轨道数是4,故S原子采取sp3杂化,含一对孤电子,分子的VSEPR模型为四面体形,分子形状为三角锥形。
答案选A。
24.C
【解析】
催化合成H2O2,是催化剂,和Pd是反应的中间体,总反应为。
A.由图可知,钯的配合物离子先与氢气生成Pd,Pd继续与O2和Cl-反应生成,再与HCl生成H2O2,所以是反应中间体,故A正确;
B.结合题意,由图可知发生的总反应为:,故B正确;
C.中Pd形成6个键,可以看出Pd的成键数目由4变为6再变为4,依次循环,故C错误;
D.在流程中存在反应,故D正确。
答案选C。
25.D
【解析】
A项、[Co(NH3)4Cl2]Cl能电离出氯离子,所以能和硝酸银反应生成氯化银沉淀,故A错误;
B项、[Co(NH3)6]Cl3能电离出氯离子,所以能和硝酸银反应生成氯化银沉淀,故B错误;
C项、[Cu(NH3)4]Cl2能电离出氯离子,所以能和硝酸银反应生成氯化银沉淀,故C错误;
D项、[Co(NH3)3Cl3]不能电离出氯离子,所以不能和硝酸银反应生成氯化银沉淀,故D正确。
故选D。
26.1s22s22p63s23p63d5或[Ar]3d5
配位键
离子键
sp
N>O>C
O>N>C
【解析】
(1)Fe原子核外有26个电子,失去外围3个电子形成Fe3+,所以基态Fe3+的核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5;
(2)K4[Fe(CN)6]是离子化合物,存在离子键,其中Fe(CN)64-含有共价键和配位键,即化学键为离子键、配位键和共价键;
(3)CN-中N的价层电子对数=1+=2,所以N采用sp杂化;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但是第IIA族、第VA族元素第一电离能大于其相邻元素,所以C、N、O第一电离能大小顺序为N>O>C;同一周期元素电负性随着原子序数增大而增大,所以C、N、O的电负性大小顺序为O>N>C。
27.三角锥形
平面三角形
四面体形
【解析】
(1)判断离子的空间构型时,需寻找等电子体:价电子数为26,与SO32-互为等电子体,所以空间构型为三角锥形;的价电子数为24,与SO3互为等电子体,所以空间构型为平面三角形;的价电子数为32,与CCl4互为等电子体,所以空间构型为四面体形。答案为:三角锥形;平面三角形;四面体形;
(2)由第2周期元素原子构成,与F2互为等电子体的离子,可从C、N、O进行分析,如O元素,构成。答案为:;
(3)已知分子中O、S间为共价双键,S、F间为共价单键。含有6个原子,价电子数为40,与PCl5互为等电子体,则结构为三角双锥形,4个S—F键的键长相同,另含1个S=O键,则应为PCl5分子中位于同一平面内的2个S—F键被S=O键所替代,从而得出PCl5的空间构型为。
28.1s22s22p63s23p5
同周期元素随核电荷数增大,原子半径逐渐变小,故结合一个电子释放出的能量(E1)依次增大
N原子的2p轨道为半充满状态,具有稳定性,故不易结合一个电子
sp3杂化
正四面体
5
Π
(H3O+)O—H…N(N)
(NH)N—H…N(N)
【解析】
(1)、氯原子的核电荷数为17,其电子排布式为1s22s22p63s23p5;
(2)、周期元素随核电荷数依次增大,原子半径逐渐变小,故结合1个电子释放出的能量依次增大,氮原子的2p轨道为半充满状态,具有稳定性;
故答案为:同周期元素随核电荷数增大,原子半径逐渐变小,故结合一个电子释放出的能量(E1)依次增大;N原子的2p轨道为半充满状态,具有稳定性,故不易结合一个电子;
(3)①H3O+中价层电子对数都是3且含有一对孤电子对,所以为三角锥形结构,中心原子的杂化类型为sp3杂化,NH中价层电子对个数是4且不含孤电子对,其空间构型为正四面体;
②3[H3ON5]·3[NH4N5]·NH4Cl中阴离子N中的σ键总数为5个,根据已知信息,N中参与形成大π键的原子数为5,形成大π键的电子数为6,所以N中的大π键表示为Π;
③图(b)中虚线代表氢键,其中表示式为(NH)N—H…Cl、(H3O+)O—H…N(N)、(NH)N—H…N(N);
故答案为:sp3杂化;正四面体;5
;Π;(H3O+)O—H…N(N);(NH)N—H…N(N)。
29.砷
F、O、N
>
Mg的3s处于全满状态较稳定
Fe3+
ds区
1s22s22p63s23p63d104s1或[Ar]3d104s1
A
【解析】
属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大,A元素的价电子构型为nsnnpn+1,则n=2,故A为N元素;C元素为最活泼的非金属元素,则C为F元素;B原子序数介于氮、氟之间,故B为O元素;D元素核外有三个电子层,最外层电子数是核外电子总数的,最外层电子数为2,故D为Mg元素;E元素正三价离子的3d轨道为半充满状态,原子核外电子排布为1s22s22p63s23p63d64s2,则原子序数为26,为Fe元素;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,核外电子排布为1s22s22p63s23p63d104s1,故F为Cu元素;G元素与A元素位于同一主族,其某种氧化物有剧毒,则G为As元素。
(1)
G为As元素,G的元素名称为砷;
(2)同周期元素从左到右元素的电负性逐渐增强,故电负性F>O>N;Al价电子排布式为3s23p1,D为Mg元素,价电子排布式为3s2,Mg的3s处于全满状态较稳定,第一电离能Mg>Al;
(3)
C为F元素,电子排布图为,E3+的离子符号为Fe3+;
(4)
F为Cu,位于周期表ds区,其基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;
(5)G为As元素,
A.As与Si位于周期表中金属与非金属分界线处,其单质可作为半导体材料,故A正确;
B.同一主族,从上到下,电负性减弱,As电负性比P小,故B错误;
C.As非金属性比P的弱,因磷酸为中强酸,则As的最高价氧化物对应的水化物是弱酸,故C错误;
D.砷元素位于VA族,P轨道为半充满状态,所以As第一电离能大于硒,故D错误;
故答案选A。
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
同课章节目录
