人教版高中化学必修一2.2 离子反应及其发生的条件 课件(共33张ppt)
文档属性
| 名称 | 人教版高中化学必修一2.2 离子反应及其发生的条件 课件(共33张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 378.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-31 00:00:00 | ||
图片预览










文档简介
第二章 化学物质及其变化
第二节 离子反应
第二课时 离子反应及其发生的条件
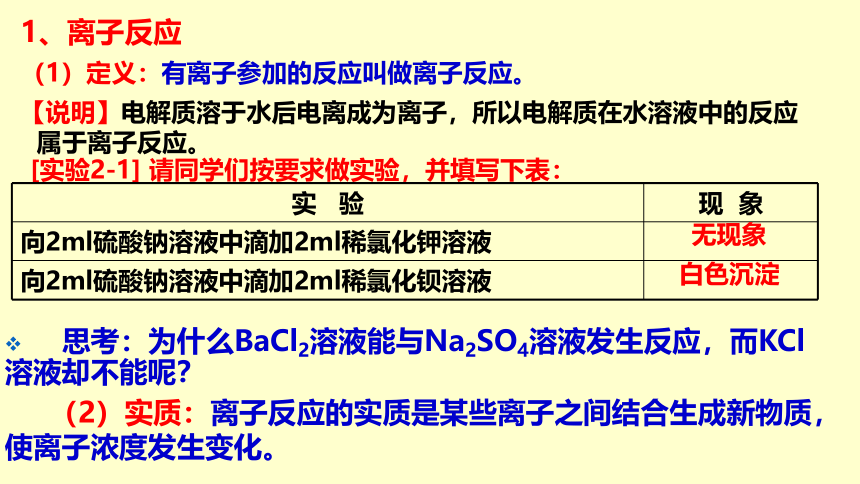
1、离子反应
(1)定义:有离子参加的反应叫做离子反应。
【说明】电解质溶于水后电离成为离子,所以电解质在水溶液中的反应属于离子反应。
[实验2-1] 请同学们按要求做实验,并填写下表:
实 验
现 象
向2ml硫酸钠溶液中滴加2ml稀氯化钾溶液
向2ml硫酸钠溶液中滴加2ml稀氯化钡溶液
无现象
白色沉淀
思考:为什么BaCl2溶液能与Na2SO4溶液发生反应,而KCl溶液却不能呢?
(2)实质:离子反应的实质是某些离子之间结合生成新物质,使离子浓度发生变化。
2、离子方程式:
(1)定义: 用实际参加反应的离子符号或化学式来表示离子反应的式子叫做离子方程式。
①写:写出正确的化学方程式。
Na2SO4+BaCl2=BaSO4↓+2NaCl
②拆:将易溶且易电离的物质拆成离子形式,而难溶、难电离及气体等仍用化学式表示。
2Na++SO42-+Ba2++2Cl-=BaSO4↓+2Na++2Cl-
③删:删去方程式两边不参加反应的离子。
2Na++SO42-+Ba2++2Cl-=BaSO4↓+2Na++2Cl-
即:Ba2++SO42-=BaSO4↓
④查:检查方程式两边各元素原子的个数和电荷总数是否守恒
*离子方程式的书写步骤:写、拆、删、查
(2)离子方程式的书写步骤:以硫酸钠与氯化钡反应为例:
可拆物质(易溶易电离)
强酸: HCl、H2SO4、HNO3
强碱:NaOH、KOH、Ba(OH)2
可溶性的盐:钾、钠、铵盐;硝酸盐等。
物质易溶易电离,用离子形式来表示。
溶解性口诀:
钾钠铵盐硝酸盐,都能溶于水中间;
氯化物除银亚汞,硫酸不溶钡与铅;
碳酸磷酸亚硫酸,可溶只有钾钠铵;
易溶钾钠铵钡碱,不溶的酸是硅酸。
单质:Fe、Zn、Cl2等
弱酸:H2S、CH3COOH、H2SO3等
弱碱:Cu(OH)2、Mg(OH)2 、NH3·H2O等
难溶性盐:AgCl 、 CaCO3、BaSO4等
不可拆的物质
氧化物:H2O、CO2、CaO等
气体:NH3、H2、H2S、CO2、SO2等
气体、难溶、难电离,表示则以化学式。
注意事项1:
微溶物
生成物,都不可拆
反应物
若为稀溶液,可拆
若为悬浊液或固体,不可拆
如Ca(OH)2
①若为石灰水,拆成Ca2+和OH-
若为石灰乳或悬浊液,不拆
②作为生成物时,写化学式
写出下列反应的离子方程式。
二氧化碳通入澄清石灰水中
CO2+Ca2++2OH-=CaCO3↓+H2O
(2)酸式盐的弱酸根离子不能拆开,强酸根离子要拆写。
例:NaHCO3溶液和稀盐酸反应:
HCO3-+H+=CO2↑+H2O
NaHSO4 和BaCl2反应,HSO4- 要拆开:
Ba2+ + SO42- = BaSO4 ↓
(1)凡非溶液中进行的反应一般不能写成离子方程式
注意事项2:
注意事项3:
氨水:①作为反应物时,写成NH3·H2O
②作为生成物时,稀溶液中写成NH3·H2O,
浓溶液中或加热时写成”NH3↑+H2O
浓H2SO4不拆
请同学们由下列反应的化学方程式写出对应的离子方程式
(1)氢氧化钠溶液与盐酸的反应
NaOH+HCl=NaCl+H2O
OH-+H+=H2O
(2)氢氧化钾溶液与硫酸的反应
2KOH+H2SO4=K2SO4+2H2O
OH-+H+=H2O
(3)氢氧化钡溶液与硝酸反应
Ba(OH)2+2HNO3==Ba(NO3)2+2H2O
OH-+H+=H2O
酸碱发生中和反应的实质是由酸电离出来的H+与由碱电离出来的OH-结合生成了H2O
上述反应虽然化学反应方程式是不同的,但是它们的离子方程式却是相同的。可以说明化学反应方程式与离子方程式所表示的意义是不同的。
化学反应方程式与离子方程式的有什么不同呢?
化学反应方程表示一个具体的化学反应
离子方程式不仅可以表示一个具体的化学反应,还可以表示同一类型的离子反应,它揭示了离子反应的本质
3.化学反应方程与离子方程式的区别:
4、离子反应发生条件
实验操作
实验现象
1、向盛有2mlCuSO4溶液的试管中加入2mlNaOH,观察溶液颜色的变化。
2、向盛有2mlNaOH溶液的试管中加入几滴酚酞试液,再向试管中慢慢加入稀盐酸,至溶液恰好变色为止。
3、向盛有2mlNa2CO3溶液的试管中加入5ml盐酸,观察实验现象。
产生无色、无味的气体
CO32+2H+=CO2↑+H2O
有蓝色沉淀产生
Cu2++2OH=
Cu(OH)2↓
溶液先变红后变为无色
OH-+H+=H2O
离子反应发生的条件:
1、生成沉淀
2、生成气体
3、生成弱电解质(弱酸、弱碱和水)
只要具备上述条件之一,离子反应就能发生
4、金属与盐溶液之间的置换反应
A .① ② ④ ⑤ B. ② ③ ④ ⑧ ⑨
C. ①⑤ ⑥ ⑦ D. ③ ④ ⑥
1.下列物质在书写离子反应方程式时可以拆成
离子形式的是( )
① Cu(OH)2 ②Na2CO3 ③ K2SO4 ④ NaOH
⑤CaCO3 ⑥BaSO4 ⑦H2O ⑧H2SO4 ⑨HCl
B
2.能正确表示下列化学反应的离子方程式的是 ( )
A.澄清石灰水与盐酸的反应:OH-+H+=H2O
B.氧化镁与稀硝酸反应:O2-+2H+=H2O
C.硫酸镁溶液与氢氧化钡溶液混合:
Ba2++SO42-=BaSO4↓
D.碳酸钙溶于稀盐酸中:
CO32-+2H+=H2O+CO2↑
A
3.硫酸铜溶液是蓝色溶液,向硫酸铜溶液中加入BaCl2溶液,有白色沉淀生成。
(1)硫酸铜电离出的离子是____________;BaCl2电离出的离子是____________。
(2)生成的白色沉淀是______________。
(3)Cu2+和Cl-有没有参加反应?______________________。
(4)硫酸铜与BaCl2反应的实质____________________ 。
(5)上述反应的离子方程式是_______________________。
SO42-与Ba2+结合生成难溶性BaSO4
BaSO4
Cu2+、SO42-
Ba2+、Cl-
没有
SO42-+Ba2+=BaSO4↓
4.写出下列反应的离子方程式:
(1) Ba(OH)2溶液和H2SO4溶液反应
________________________________________________;
(2)KOH溶液和CH3COOH溶液反应
______________________________________________
(3)Na2CO3溶液和HNO3溶液反应_________________________ ;
(4)碳酸钙和HCl溶液反应________________________________;
(5)氧化镁和H2SO4溶液反应_____________________________。
OH-+CH3COOH=CH3COO-+H2O
CO32-+2H+=CO2↑+H2O
CaCO3+2H+= Ca2++CO2↑+H2O
一、离子反应:
有离子参加或生成的反应。
二、离子反应
书写步骤:
写、拆、删、查
能拆的物质
不能拆的物质
特殊记忆
三、离子反应的意义
四、离子反应发生的条件
拆
小结:
离子方程式的正误判断之七看
1.原理是否正确。铁与稀盐酸反应: 2Fe +6H+=2Fe3+ +3H2↑
2.拆分是否正确。大理石溶于醋酸:Ca2++CO32-+2CH3COO-+2H+=(CH3COO)2Ca+H2O+CO2↑
3.电荷是否守恒。铜放入硝酸银溶液中: Cu + Ag+=Cu2++Ag
4.离子是否漏写。稀硫酸和氢氧化钡溶液反应:SO42- + Ba2+= BaSO4↓
错,应为Fe +2H+=Fe2+ +H2↑
错,应为:CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑
错,应为Cu +2Ag+=Cu2++2Ag
错,应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
5.符号“↑”、“↓”是否遗漏或错写。氧化铜与硫酸应:CuO+2H++SO42-=CuSO4↓+H2O
6.反应条件是否标注氯化铵溶液和浓NaOH共热:NH4++OH-=NH3↑ + H2O
7.是否符合题设条件及要求(少量,过量,滴加顺序)。
CO2与过量氢氧化钠溶液反应:CO2+OH-=HCO3-
向碳酸钠溶液中滴加过量的盐酸:H+ +CO32- = HCO3-
错,应为 CuO+2H+= Cu2++H2O
错,应为NH4++OH- = NH3↑+ H2O
△
错,应为CO2+2OH-=CO32-+H2O
错,应为2H+ +CO32- = CO2↑+H2O
1. 在Ca(HCO3)2溶液中加入少量NaOH溶液 2. 在Ca(HCO3)2溶液中加入大量NaOH溶液
3.氢氧化钡溶液中滴入少量硫酸
4.向一定量KHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性
5.向一定量KHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
Ca2++HCO3-+OH-=CaCO3↓+H2O
Ca2++2HCO3-+OH-=CaCO3↓+CO32- +H2O
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
Ba2++OH-+H++SO42-=BaSO4↓+H2O
【学以致用】
1、下列离子方程式,书写正确的是( )
A、盐酸与碳酸钡反应:
CO32-+2H+=CO2↑+H2O
B、硫酸铜溶液与氢氧化钡溶液:
Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓
C、硝酸银溶液中加入铜粉:
Ag++Cu=Cu2++Ag
D、铁与稀盐酸反应:
2Fe+6H+=2Fe3++3H2↑
B
2、下列离子方程式正确的是多选( )
A、氢氧化铝与盐酸反应:H++OH-=H2O
B、锌片与稀盐酸反应:Zn+2H+=Zn2++H2↑
C、硫酸与氢氧化钡溶液反应:
H++SO42-+OH-+Ba2+=Ba(OH)2↓+ H2O
D、二氧化碳与过量氢氧化钠溶液反应:
CO2+2OH-=CO32-+H2O
B D
3.下列化学方程式中,不能用离子方程式:H+ + OH- = H2O表示的是( )
A. 2NaOH +H2SO4 =Na 2SO4 +2 H2O
B. Ba(OH)2 +2HCl = BaCl2 +2 H2O C. KOH +HCl = KCl + H2O
D. Cu(OH)2 +2HNO3 = Cu(NO3)2 +2 H2O
D
4.下列离子方程式正确的是( )
A.铁和稀盐酸反应:
2Fe+6H+ =2Fe3++3H2↑
B.少量二氧化碳和足量NaOH溶液反应:
CO2+OH-= HCO3-
C.Na2CO3和醋酸反应:2H+ +CO32-=H2O+CO2↑
D.Ba(OH)2和CuSO4溶液反应:
Ba2++ SO42-= BaSO4↓
E、稀HCl和NH3·H2O反应:H++OH-= H2O
F、Ba(OH)2和H2SO4溶液反应:
Ba2++ OH- +H++ SO42-= BaSO4↓+ H2O
G、CaCO3和HCl 溶液反应:
CaCO3 +2H+=H2O+CO2↑+ Ca2+
G
五、离子共存
同一溶液中若离子间符合下列任意一个条件就会发生离子反应,在溶液中不能大量共存
(1)生成难溶物或微溶物
如 Ba 2 + 与CO32-、 SO42-、 SO32- ;
Ca2+与CO32-、 SO42-、 SO32- ;
Ag+与Cl-、Br-、I-、 OH- 、 CO32-、 SO42-、SO32- 等; OH-与Cu2+ 、 Fe3+ 、 Fe2+ 、 Mg2+ 、 Al3+ 、Zn2+等
(2)生成气体或挥发性物质
如 : NH4+与OH- ;
H+与CO32-、 SO32-、HCO3-、 HSO3-、 HS-等
(3)生成难电离物质
如: H+与CH3COO-、ClO -、F-、 OH- 等
OH- 与HCO3-
(4)发生氧化还原反应
(5)发生络合反应
隐含条件的应用规律:
(1)溶液无色透明时,则溶液中一定没有有色离子,如Cu2+ 、 Fe3+ 、 Fe2+ 、 MnO4-;
(2)强碱性溶液,石蕊变蓝,酚酞变红;
肯定不存在能与OH-反应的离子,如Cu2+ 、 Fe3+ 、 Fe2+ 、 Mg2+ 、 Al3+、H+、 HCO3-、 HSO3-、 HS-、 NH4+等
除了钾钙钠钡的金属阳离子,H+、NH4+和弱酸的酸式酸根
(3)强酸性溶液,石蕊变红
肯定不存在能与H+反应的离子,如 CO32-、 SO32-、 S2- 、 HCO3-、 HSO3-、 HS-、 OH-、 CH3COO-、ClO - 、 F-、 OH- 等 弱酸根离子和OH-
1.下列各组离子在强酸性溶液中能大量共存,且溶液为无色透明的一组是 ( )
A. NH4+、Ca2+、Al3+、Cl-
B. Na+、CO32-、K+、NO3- C. MnO4-、K+、SO42-、SO32-
D. K+、SO42-、Cl-、Ba2+
A
2.某溶液能使酚酞试液变红,在此溶液中可能大量共存的离子是 ( )
A.Cl-、NO3-、Fe2+、Al3+
B.K+、Fe3+、Cl-、MnO4-
C.K+、SO42-、Na+、OH-
D.Na+、K+、NO3-、HCO3-
C
3、下列各组离子中,能在溶液中大量共存的( )
A、 K+、 Ag+、 H+、 Cl-
B、 Ba 2 + 、 Na+ 、 CO32-、 OH-
C、 Al3+ 、 Fe3+ 、 SO42- 、 Cl-
D、 H+、 K+、 CO32-、 SO42-
4、在无色透明的强酸性溶液中,能大量共存的离子组的是( )
A、 K+、 Cu2+ 、 NO3-、 SO42-
B 、 K+、 Cl-、 Na+ 、 CO32-
C、 Zn2+ 、 NH4+、 NO3-、 Cl-
D、 K+、 Na+ 、 SO42-、 MnO4-、
C
C
5.下列各组离子在pH=1和pH=13的条件下,都能大量共存的是( )
A.Al3+ Mg2+ Cl- SO42-
B.K+ Na+ Cl- HCO3-
C.Fe2+ K+ NO3- SO42-
D.K+ Ba2+ NO3- Cl-
D
6、现有H+、OH-、Cl-、CO32-、SO42-、Cu2+、Ag+、Mg2+
1)当溶液中含Ba2+时,不可能同时存在的是 离子
2)当溶液中含H+ 时,不可能同时存在的是 离子
3)当溶液中含 OH-时,不可能同时存在的是 离子
CO32-、SO42-
CO32- 、OH-
H+、Cu2+、Mg2+、Ag+
6、现有H+、OH-、Cl-、CO32-、SO42-、
Cu2+、Ag+、Mg2+
1)当溶液中含Ba2+时,
不可能同时存在的是 离子
2)当溶液中含H+ 时,
不可能同时存在的是 离子
3)当溶液中含OH-时,不可能同时存在的
是 离子
CO32-、SO42-
CO32- 、OH-
H+、Cu2+、Mg2+、Ag+
离子推断题:现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:
{5940675A-B579-460E-94D1-54222C63F5DA}阳离子
Na+ H+ Ba2+
阴离子
OH- CO32- SO42-
为鉴别它们,分别完成一些实验。根据实验的结果回答下列问题: (1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为 ,A溶液与B溶液反应的离子方程式为 。 (2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为 ,B溶于水后的电离方程式为 。 (3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为 。
CO2
CO32-+H+=CO2↑+H2O
Ba(OH)2
NaHSO4=Na++H++SO42-
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
第二节 离子反应
第二课时 离子反应及其发生的条件
1、离子反应
(1)定义:有离子参加的反应叫做离子反应。
【说明】电解质溶于水后电离成为离子,所以电解质在水溶液中的反应属于离子反应。
[实验2-1] 请同学们按要求做实验,并填写下表:
实 验
现 象
向2ml硫酸钠溶液中滴加2ml稀氯化钾溶液
向2ml硫酸钠溶液中滴加2ml稀氯化钡溶液
无现象
白色沉淀
思考:为什么BaCl2溶液能与Na2SO4溶液发生反应,而KCl溶液却不能呢?
(2)实质:离子反应的实质是某些离子之间结合生成新物质,使离子浓度发生变化。
2、离子方程式:
(1)定义: 用实际参加反应的离子符号或化学式来表示离子反应的式子叫做离子方程式。
①写:写出正确的化学方程式。
Na2SO4+BaCl2=BaSO4↓+2NaCl
②拆:将易溶且易电离的物质拆成离子形式,而难溶、难电离及气体等仍用化学式表示。
2Na++SO42-+Ba2++2Cl-=BaSO4↓+2Na++2Cl-
③删:删去方程式两边不参加反应的离子。
2Na++SO42-+Ba2++2Cl-=BaSO4↓+2Na++2Cl-
即:Ba2++SO42-=BaSO4↓
④查:检查方程式两边各元素原子的个数和电荷总数是否守恒
*离子方程式的书写步骤:写、拆、删、查
(2)离子方程式的书写步骤:以硫酸钠与氯化钡反应为例:
可拆物质(易溶易电离)
强酸: HCl、H2SO4、HNO3
强碱:NaOH、KOH、Ba(OH)2
可溶性的盐:钾、钠、铵盐;硝酸盐等。
物质易溶易电离,用离子形式来表示。
溶解性口诀:
钾钠铵盐硝酸盐,都能溶于水中间;
氯化物除银亚汞,硫酸不溶钡与铅;
碳酸磷酸亚硫酸,可溶只有钾钠铵;
易溶钾钠铵钡碱,不溶的酸是硅酸。
单质:Fe、Zn、Cl2等
弱酸:H2S、CH3COOH、H2SO3等
弱碱:Cu(OH)2、Mg(OH)2 、NH3·H2O等
难溶性盐:AgCl 、 CaCO3、BaSO4等
不可拆的物质
氧化物:H2O、CO2、CaO等
气体:NH3、H2、H2S、CO2、SO2等
气体、难溶、难电离,表示则以化学式。
注意事项1:
微溶物
生成物,都不可拆
反应物
若为稀溶液,可拆
若为悬浊液或固体,不可拆
如Ca(OH)2
①若为石灰水,拆成Ca2+和OH-
若为石灰乳或悬浊液,不拆
②作为生成物时,写化学式
写出下列反应的离子方程式。
二氧化碳通入澄清石灰水中
CO2+Ca2++2OH-=CaCO3↓+H2O
(2)酸式盐的弱酸根离子不能拆开,强酸根离子要拆写。
例:NaHCO3溶液和稀盐酸反应:
HCO3-+H+=CO2↑+H2O
NaHSO4 和BaCl2反应,HSO4- 要拆开:
Ba2+ + SO42- = BaSO4 ↓
(1)凡非溶液中进行的反应一般不能写成离子方程式
注意事项2:
注意事项3:
氨水:①作为反应物时,写成NH3·H2O
②作为生成物时,稀溶液中写成NH3·H2O,
浓溶液中或加热时写成”NH3↑+H2O
浓H2SO4不拆
请同学们由下列反应的化学方程式写出对应的离子方程式
(1)氢氧化钠溶液与盐酸的反应
NaOH+HCl=NaCl+H2O
OH-+H+=H2O
(2)氢氧化钾溶液与硫酸的反应
2KOH+H2SO4=K2SO4+2H2O
OH-+H+=H2O
(3)氢氧化钡溶液与硝酸反应
Ba(OH)2+2HNO3==Ba(NO3)2+2H2O
OH-+H+=H2O
酸碱发生中和反应的实质是由酸电离出来的H+与由碱电离出来的OH-结合生成了H2O
上述反应虽然化学反应方程式是不同的,但是它们的离子方程式却是相同的。可以说明化学反应方程式与离子方程式所表示的意义是不同的。
化学反应方程式与离子方程式的有什么不同呢?
化学反应方程表示一个具体的化学反应
离子方程式不仅可以表示一个具体的化学反应,还可以表示同一类型的离子反应,它揭示了离子反应的本质
3.化学反应方程与离子方程式的区别:
4、离子反应发生条件
实验操作
实验现象
1、向盛有2mlCuSO4溶液的试管中加入2mlNaOH,观察溶液颜色的变化。
2、向盛有2mlNaOH溶液的试管中加入几滴酚酞试液,再向试管中慢慢加入稀盐酸,至溶液恰好变色为止。
3、向盛有2mlNa2CO3溶液的试管中加入5ml盐酸,观察实验现象。
产生无色、无味的气体
CO32+2H+=CO2↑+H2O
有蓝色沉淀产生
Cu2++2OH=
Cu(OH)2↓
溶液先变红后变为无色
OH-+H+=H2O
离子反应发生的条件:
1、生成沉淀
2、生成气体
3、生成弱电解质(弱酸、弱碱和水)
只要具备上述条件之一,离子反应就能发生
4、金属与盐溶液之间的置换反应
A .① ② ④ ⑤ B. ② ③ ④ ⑧ ⑨
C. ①⑤ ⑥ ⑦ D. ③ ④ ⑥
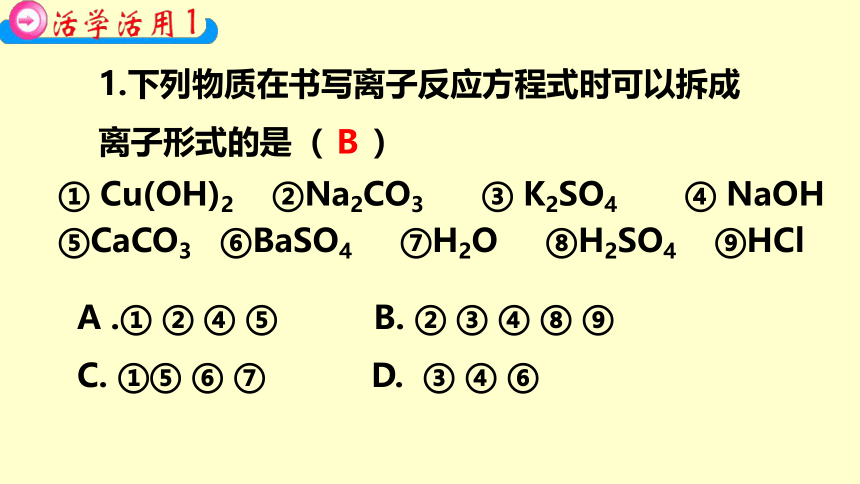
1.下列物质在书写离子反应方程式时可以拆成
离子形式的是( )
① Cu(OH)2 ②Na2CO3 ③ K2SO4 ④ NaOH
⑤CaCO3 ⑥BaSO4 ⑦H2O ⑧H2SO4 ⑨HCl
B
2.能正确表示下列化学反应的离子方程式的是 ( )
A.澄清石灰水与盐酸的反应:OH-+H+=H2O
B.氧化镁与稀硝酸反应:O2-+2H+=H2O
C.硫酸镁溶液与氢氧化钡溶液混合:
Ba2++SO42-=BaSO4↓
D.碳酸钙溶于稀盐酸中:
CO32-+2H+=H2O+CO2↑
A
3.硫酸铜溶液是蓝色溶液,向硫酸铜溶液中加入BaCl2溶液,有白色沉淀生成。
(1)硫酸铜电离出的离子是____________;BaCl2电离出的离子是____________。
(2)生成的白色沉淀是______________。
(3)Cu2+和Cl-有没有参加反应?______________________。
(4)硫酸铜与BaCl2反应的实质____________________ 。
(5)上述反应的离子方程式是_______________________。
SO42-与Ba2+结合生成难溶性BaSO4
BaSO4
Cu2+、SO42-
Ba2+、Cl-
没有
SO42-+Ba2+=BaSO4↓
4.写出下列反应的离子方程式:
(1) Ba(OH)2溶液和H2SO4溶液反应
________________________________________________;
(2)KOH溶液和CH3COOH溶液反应
______________________________________________
(3)Na2CO3溶液和HNO3溶液反应_________________________ ;
(4)碳酸钙和HCl溶液反应________________________________;
(5)氧化镁和H2SO4溶液反应_____________________________。
OH-+CH3COOH=CH3COO-+H2O
CO32-+2H+=CO2↑+H2O
CaCO3+2H+= Ca2++CO2↑+H2O
一、离子反应:
有离子参加或生成的反应。
二、离子反应
书写步骤:
写、拆、删、查
能拆的物质
不能拆的物质
特殊记忆
三、离子反应的意义
四、离子反应发生的条件
拆
小结:
离子方程式的正误判断之七看
1.原理是否正确。铁与稀盐酸反应: 2Fe +6H+=2Fe3+ +3H2↑
2.拆分是否正确。大理石溶于醋酸:Ca2++CO32-+2CH3COO-+2H+=(CH3COO)2Ca+H2O+CO2↑
3.电荷是否守恒。铜放入硝酸银溶液中: Cu + Ag+=Cu2++Ag
4.离子是否漏写。稀硫酸和氢氧化钡溶液反应:SO42- + Ba2+= BaSO4↓
错,应为Fe +2H+=Fe2+ +H2↑
错,应为:CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑
错,应为Cu +2Ag+=Cu2++2Ag
错,应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
5.符号“↑”、“↓”是否遗漏或错写。氧化铜与硫酸应:CuO+2H++SO42-=CuSO4↓+H2O
6.反应条件是否标注氯化铵溶液和浓NaOH共热:NH4++OH-=NH3↑ + H2O
7.是否符合题设条件及要求(少量,过量,滴加顺序)。
CO2与过量氢氧化钠溶液反应:CO2+OH-=HCO3-
向碳酸钠溶液中滴加过量的盐酸:H+ +CO32- = HCO3-
错,应为 CuO+2H+= Cu2++H2O
错,应为NH4++OH- = NH3↑+ H2O
△
错,应为CO2+2OH-=CO32-+H2O
错,应为2H+ +CO32- = CO2↑+H2O
1. 在Ca(HCO3)2溶液中加入少量NaOH溶液 2. 在Ca(HCO3)2溶液中加入大量NaOH溶液
3.氢氧化钡溶液中滴入少量硫酸
4.向一定量KHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性
5.向一定量KHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
Ca2++HCO3-+OH-=CaCO3↓+H2O
Ca2++2HCO3-+OH-=CaCO3↓+CO32- +H2O
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
Ba2++OH-+H++SO42-=BaSO4↓+H2O
【学以致用】
1、下列离子方程式,书写正确的是( )
A、盐酸与碳酸钡反应:
CO32-+2H+=CO2↑+H2O
B、硫酸铜溶液与氢氧化钡溶液:
Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓
C、硝酸银溶液中加入铜粉:
Ag++Cu=Cu2++Ag
D、铁与稀盐酸反应:
2Fe+6H+=2Fe3++3H2↑
B
2、下列离子方程式正确的是多选( )
A、氢氧化铝与盐酸反应:H++OH-=H2O
B、锌片与稀盐酸反应:Zn+2H+=Zn2++H2↑
C、硫酸与氢氧化钡溶液反应:
H++SO42-+OH-+Ba2+=Ba(OH)2↓+ H2O
D、二氧化碳与过量氢氧化钠溶液反应:
CO2+2OH-=CO32-+H2O
B D
3.下列化学方程式中,不能用离子方程式:H+ + OH- = H2O表示的是( )
A. 2NaOH +H2SO4 =Na 2SO4 +2 H2O
B. Ba(OH)2 +2HCl = BaCl2 +2 H2O C. KOH +HCl = KCl + H2O
D. Cu(OH)2 +2HNO3 = Cu(NO3)2 +2 H2O
D
4.下列离子方程式正确的是( )
A.铁和稀盐酸反应:
2Fe+6H+ =2Fe3++3H2↑
B.少量二氧化碳和足量NaOH溶液反应:
CO2+OH-= HCO3-
C.Na2CO3和醋酸反应:2H+ +CO32-=H2O+CO2↑
D.Ba(OH)2和CuSO4溶液反应:
Ba2++ SO42-= BaSO4↓
E、稀HCl和NH3·H2O反应:H++OH-= H2O
F、Ba(OH)2和H2SO4溶液反应:
Ba2++ OH- +H++ SO42-= BaSO4↓+ H2O
G、CaCO3和HCl 溶液反应:
CaCO3 +2H+=H2O+CO2↑+ Ca2+
G
五、离子共存
同一溶液中若离子间符合下列任意一个条件就会发生离子反应,在溶液中不能大量共存
(1)生成难溶物或微溶物
如 Ba 2 + 与CO32-、 SO42-、 SO32- ;
Ca2+与CO32-、 SO42-、 SO32- ;
Ag+与Cl-、Br-、I-、 OH- 、 CO32-、 SO42-、SO32- 等; OH-与Cu2+ 、 Fe3+ 、 Fe2+ 、 Mg2+ 、 Al3+ 、Zn2+等
(2)生成气体或挥发性物质
如 : NH4+与OH- ;
H+与CO32-、 SO32-、HCO3-、 HSO3-、 HS-等
(3)生成难电离物质
如: H+与CH3COO-、ClO -、F-、 OH- 等
OH- 与HCO3-
(4)发生氧化还原反应
(5)发生络合反应
隐含条件的应用规律:
(1)溶液无色透明时,则溶液中一定没有有色离子,如Cu2+ 、 Fe3+ 、 Fe2+ 、 MnO4-;
(2)强碱性溶液,石蕊变蓝,酚酞变红;
肯定不存在能与OH-反应的离子,如Cu2+ 、 Fe3+ 、 Fe2+ 、 Mg2+ 、 Al3+、H+、 HCO3-、 HSO3-、 HS-、 NH4+等
除了钾钙钠钡的金属阳离子,H+、NH4+和弱酸的酸式酸根
(3)强酸性溶液,石蕊变红
肯定不存在能与H+反应的离子,如 CO32-、 SO32-、 S2- 、 HCO3-、 HSO3-、 HS-、 OH-、 CH3COO-、ClO - 、 F-、 OH- 等 弱酸根离子和OH-
1.下列各组离子在强酸性溶液中能大量共存,且溶液为无色透明的一组是 ( )
A. NH4+、Ca2+、Al3+、Cl-
B. Na+、CO32-、K+、NO3- C. MnO4-、K+、SO42-、SO32-
D. K+、SO42-、Cl-、Ba2+
A
2.某溶液能使酚酞试液变红,在此溶液中可能大量共存的离子是 ( )
A.Cl-、NO3-、Fe2+、Al3+
B.K+、Fe3+、Cl-、MnO4-
C.K+、SO42-、Na+、OH-
D.Na+、K+、NO3-、HCO3-
C
3、下列各组离子中,能在溶液中大量共存的( )
A、 K+、 Ag+、 H+、 Cl-
B、 Ba 2 + 、 Na+ 、 CO32-、 OH-
C、 Al3+ 、 Fe3+ 、 SO42- 、 Cl-
D、 H+、 K+、 CO32-、 SO42-
4、在无色透明的强酸性溶液中,能大量共存的离子组的是( )
A、 K+、 Cu2+ 、 NO3-、 SO42-
B 、 K+、 Cl-、 Na+ 、 CO32-
C、 Zn2+ 、 NH4+、 NO3-、 Cl-
D、 K+、 Na+ 、 SO42-、 MnO4-、
C
C
5.下列各组离子在pH=1和pH=13的条件下,都能大量共存的是( )
A.Al3+ Mg2+ Cl- SO42-
B.K+ Na+ Cl- HCO3-
C.Fe2+ K+ NO3- SO42-
D.K+ Ba2+ NO3- Cl-
D
6、现有H+、OH-、Cl-、CO32-、SO42-、Cu2+、Ag+、Mg2+
1)当溶液中含Ba2+时,不可能同时存在的是 离子
2)当溶液中含H+ 时,不可能同时存在的是 离子
3)当溶液中含 OH-时,不可能同时存在的是 离子
CO32-、SO42-
CO32- 、OH-
H+、Cu2+、Mg2+、Ag+
6、现有H+、OH-、Cl-、CO32-、SO42-、
Cu2+、Ag+、Mg2+
1)当溶液中含Ba2+时,
不可能同时存在的是 离子
2)当溶液中含H+ 时,
不可能同时存在的是 离子
3)当溶液中含OH-时,不可能同时存在的
是 离子
CO32-、SO42-
CO32- 、OH-
H+、Cu2+、Mg2+、Ag+
离子推断题:现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:
{5940675A-B579-460E-94D1-54222C63F5DA}阳离子
Na+ H+ Ba2+
阴离子
OH- CO32- SO42-
为鉴别它们,分别完成一些实验。根据实验的结果回答下列问题: (1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为 ,A溶液与B溶液反应的离子方程式为 。 (2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为 ,B溶于水后的电离方程式为 。 (3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为 。
CO2
CO32-+H+=CO2↑+H2O
Ba(OH)2
NaHSO4=Na++H++SO42-
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
