人教版高中化学选修四2.3 化学平衡 第二课时 影响化学平衡的条件-课件 (共62张ppt)
文档属性
| 名称 | 人教版高中化学选修四2.3 化学平衡 第二课时 影响化学平衡的条件-课件 (共62张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 270.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-31 00:00:00 | ||
图片预览





文档简介
第二课时
影响化学平衡的条件
第一讲
复习
化学平衡状态的定义:
指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
化学平衡状态的特征:
动
动态平衡:V(正) ≠0;V(逆) ≠0
等
定
变
V(正)=V(逆) ≠0
C(B)或X(B)或φ(B)一定
条件改变→平衡改变
逆
研究对象是可逆反应
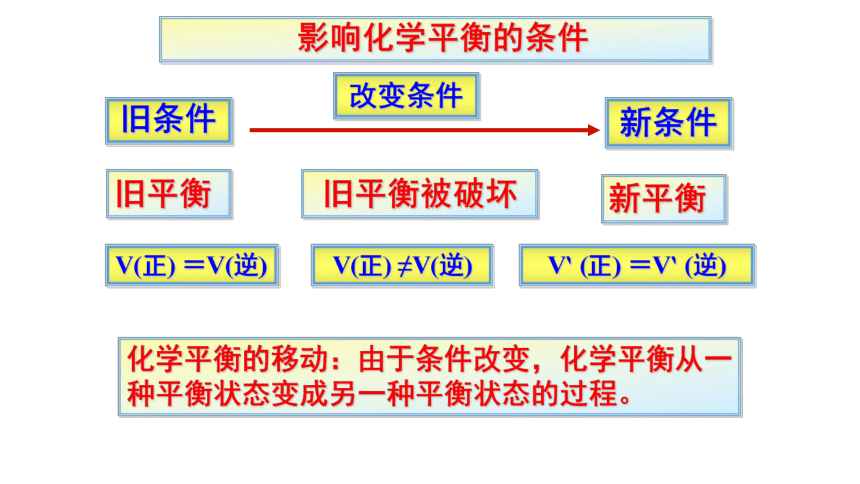
影响化学平衡的条件
旧条件
改变条件
旧平衡
V(正) ≠V(逆)
新平衡
新条件
旧平衡被破坏
V(正) =V(逆)
V‵ (正) =V‵ (逆)
化学平衡的移动:由于条件改变,化学平衡从一种平衡状态变成另一种平衡状态的过程。
造成平衡移动的原因:
由于条件改变使V(正) ≠V(逆)
平衡移动的结果:
改变混合物中X(B)
研究的意义:
对于处于平衡状态的可逆反应,如何改变条件(浓度、压强、温度),使它朝着有益于人类的方向移动,这就是本节所要解决的问题。
1、化学平衡移动的定义:
化学上把这种可逆反应中旧化学平衡的破坏、新化学平衡建立的过程叫做化学平衡的移动
2、化学平衡的移动方向的速率判断:
⑴、若外界条件变化引起V正> V逆:
旧平衡未被破坏,平衡不移动
平衡向正反应方向移动
⑵、若外界条件变化引起V正< V逆:
平衡向逆反应方向移动
⑶、若外界条件变化引起V正= V逆:
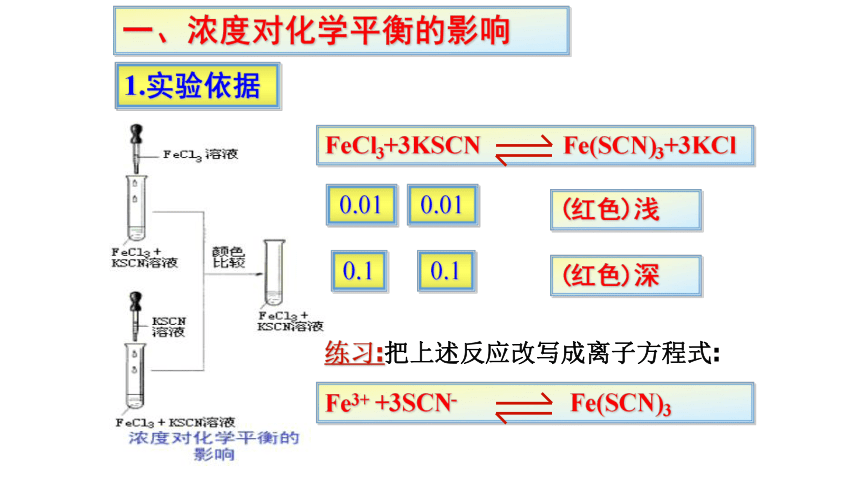
一、浓度对化学平衡的影响
1.实验依据
FeCl3+3KSCN Fe(SCN)3+3KCl
0.01
0.01
0.1
0.1
(红色)深
(红色)浅
练习:把上述反应改写成离子方程式:
Fe3+ +3SCN- Fe(SCN)3
滴加饱和FeCl3溶液
滴1mol/L KSCN溶液
滴加NaOH溶液
现象
增大c(Fe3+)
增大c(SCN-)
红色加深
C[Fe(SCN)3)增大
平衡破坏
平衡正向移动
Fe3+ + 3OH- 〓 Fe(OH)3↓
实验2-6
结论:增大反应物的浓度平衡向正反应方向移动
结论:减小反应物的浓度平衡向逆反应方向移动
红色加深
红色加深
有红褐色沉淀生成,溶液红色变浅
减小c(Fe3+)
红色变浅
C[Fe(SCN)3]减小
平衡破坏
平衡逆向移动
现象及分析
Fe3+ + 3SCN- Fe(SCN)3
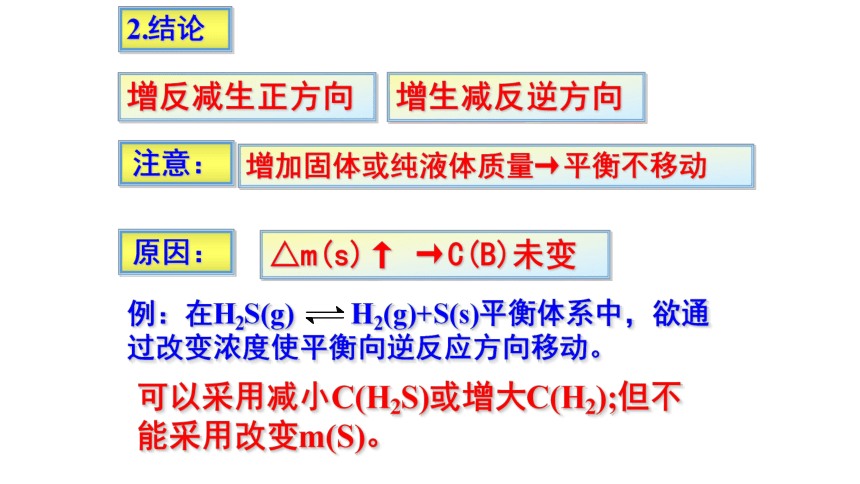
2.结论
增反减生正方向
增生减反逆方向
注意:
增加固体或纯液体质量→平衡不移动
原因:
△m(s)↑ →C(B)未变
可以采用减小C(H2S)或增大C(H2);但不能采用改变m(S)。
例:在H2S(g) H2(g)+S(s)平衡体系中,欲通过改变浓度使平衡向逆反应方向移动。
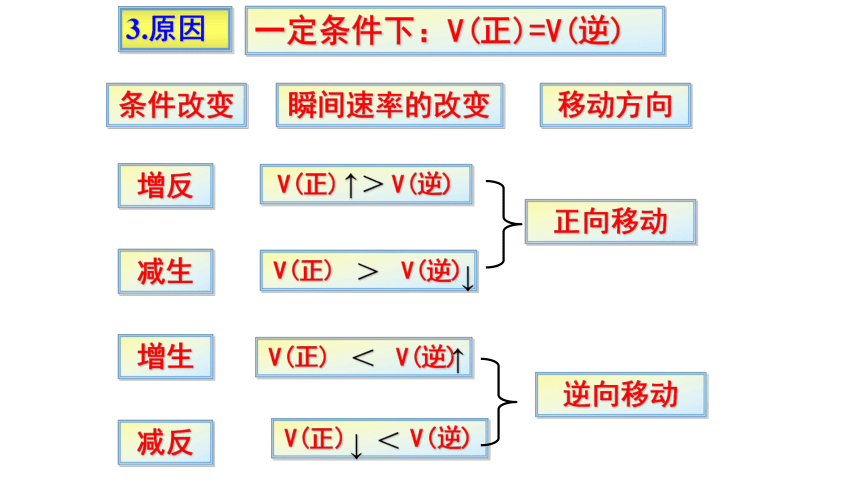
3.原因
一定条件下:V(正)=V(逆)
条件改变
瞬间速率的改变
移动方向
增反
V(正) V(逆)
减生
V(正) V(逆)
增生
V(正) V(逆)
减反
V(正) V(逆)
>
<
↓
↑
↑
↓
>
<
正向移动
逆向移动
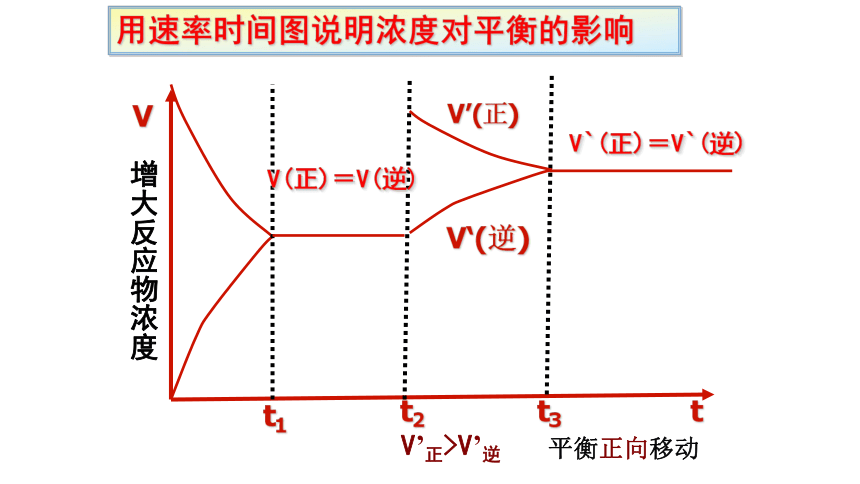
用速率时间图说明浓度对平衡的影响
V
t
t1
t2
t3
V’(正)
V‘(逆)
V(正)=V(逆)
V`(正)=V`(逆)
增大反应物浓度
V’正>V’逆
平衡正向移动
V`(正)=V`(逆)
V(正)=V(逆)
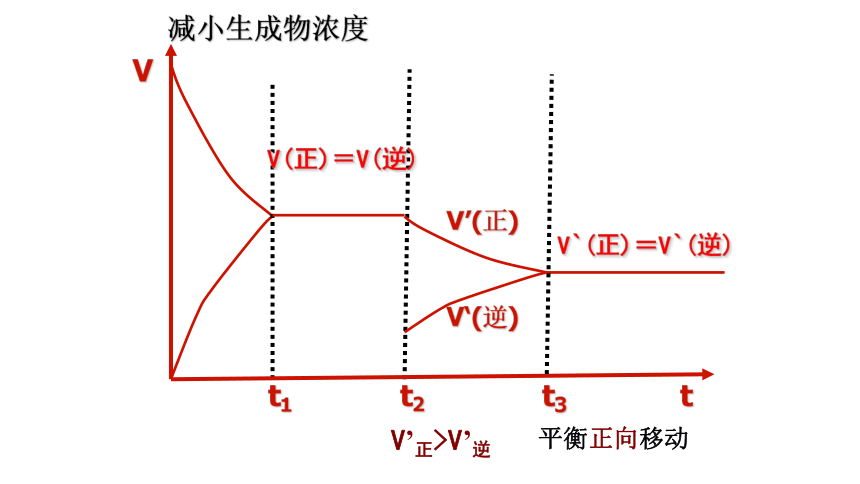
t
t1
t2
t3
V
V’(正)
V‘(逆)
减小生成物浓度
平衡正向移动
V’正>V’逆
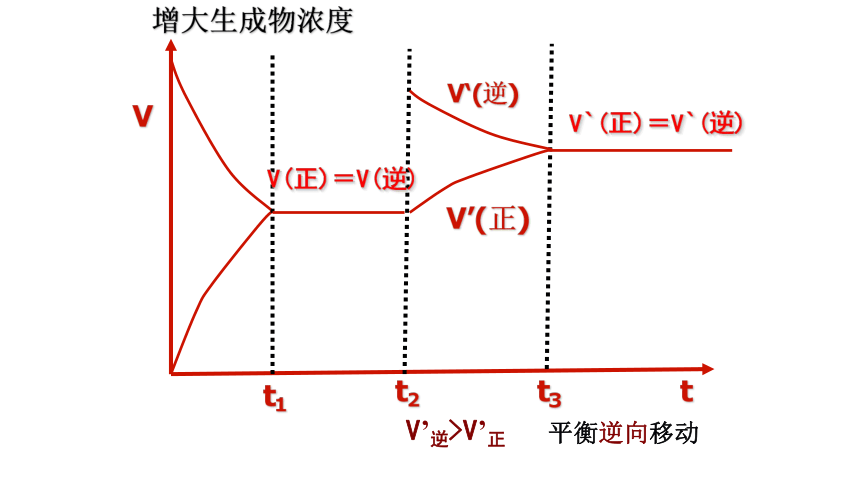
V
t
t1
t2
t3
V‘(逆)
V’(正)
V(正)=V(逆)
V`(正)=V`(逆)
增大生成物浓度
V’逆>V’正
平衡逆向移动
V`(正)=V`(逆)
V(正)=V(逆)
t
t1
t2
t3
V
V‘(逆)
V’(正)
减小反应物浓度
V’逆>V’正
平衡逆向移动
4. 由以上四图可以得出结论:
1)改变反应物浓度瞬间,只能改变正反应速率
改变生成物浓度瞬间,只能改变逆反应速率
2)改变浓度瞬间,
若v(正)>v(逆),平衡向正反应方向移动
若v(逆)>v(正),平衡向逆反应方向移动
3)新旧平衡速率比较:
增大浓度,新平衡速率大于旧平衡速率
减小浓度,新平衡速率小于旧平衡速率
4)增大一种反应物的浓度,另一种反应物的转
化率一定提高,而本身的转化率一定降低。
5. 应用:
1)硫酸工业中,常鼓入过量的空气与SO2反应,你认为原因是什么?
在工业生产中适当增大廉价的反应物的浓度,使
化学平衡向正反应方向移动,可以提高价格较高
原料的转化率,以降低生产成本
2)在密闭容器中进行CaCO3 CaO+CO2,达平衡。
A、为什么在密闭容器中该反应才是可逆反应?
B、加入CaCO3平衡如何移动?
C、体积不变,充入CO2平衡怎么移动?
3)在下列平衡体系3NO2+H2O 2HNO3+NO中保持体积不变加入O2,则化学平衡
A、向生成HNO3方向进行 B、向左移
C、不移动 D、降低NO浓度
往容器中充H2O (g) ,平衡怎么移动?
达新平衡后,混合气体中[CO]浓度怎么变?【CO2】、【H2】、 【H2O (g)】呢?
对比旧平衡,新平衡下CO的转化率怎么变?H2O的转化率呢?
对比旧平衡,新平衡下CO2的百分含量怎么变?
800℃ 在密闭容器中CO+H2O(g) CO2+H2 达平衡
人体吸入CO后,空气中的CO、O2与人体的血红蛋白将建立如下平衡:
CO + HemO2 O2 + HemCO (Hem为血红蛋白)当HemCO的浓度为HemO2浓度的2%时,人的智力将受到严重损伤。
如果有人CO中毒,根据平衡移动原理,你认为该怎么办?
想一想?
练习:可逆反应H2O(g) + C(s) CO(g) + H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?
①增大水蒸气浓度 ②加入更多的碳 ③增加H2浓度
①平衡正向移动,CO浓度增大
②平衡不移动,CO浓度不变
③平衡逆向移动,CO浓度减小
小结:增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以V(正)仍等于V(逆),平衡不移动。
例.可逆反应2SO2+O2=2SO3(正反应为放热反应),当采取下列措施(瞬间)时,将对正逆反应速率的影响填入空格中:
1.增大O2浓度,V(正)____ V(逆)_____
2.减小SO2浓度,V(正)____ V(逆)____
3.在体积不变情况下充入N2, V(正)____ V(逆)____
4.在压强不变情况下充入N2, V(正)____ V(逆)____
5.增大反应容器的压强, V(正)____ V(逆)____
6.升高温度, V(正)____ V(逆)_____
再见!
第二课时
影响化学平衡的条件
第二讲
A、加入氢氧化钠发生____反应,平衡向___移动;
B、久置氯水的成分是_______,如何用化学平衡移动的观点来解释?
C、平衡后增加HCl的浓度平衡向_____移动;
D、次氯酸钠中加盐酸,观察到的现象_________
E、为什么氯气不溶于饱和食盐水?
F、加入NaHCO3 固体,C(HClO)变___;
G、加H2O ,C(HClO)变____
1. Cl2+H2O HCl+HClO达平衡后
复习:
二、压强对化学平衡的影响
1.演示实验
(2体积,红棕色)
(1体积,无色)
2NO2(g) N2O4(g)
气体体积减少
气体体积增大
条件改变
现象
原因
结论
速增压强
先深后浅
增浓正移
体减方向
速减压强
先浅后深
减浓逆移
体增方向
450℃时N2和H2反应生成NH3的实验数据
压强/MPa
NH3/%
1 5 10 30 60 100
2.0 9.2 16.4 35.5 53.6 69.4
由数据分析对于N2 + 3H2 2NH3中,加压,平衡朝哪边移?
分析数据:
2.结论
在其它条件不变的情况下:
A:增大压强,会使化学平衡向着气体体积缩小的方向移动
B:减小压强,会使化学平衡向着气体体积增大的方向移动。
3.原因
2NO2(g) N2O4(g)
气体体积减少
气体体积增大
原平衡
V(减)=V(增)
移动方向
新平衡
增大压强
V(减) V(增)
体减
V`(减)=V`(增)
减小压强
V(减) V(增)
体增
V`(减)=V`(增)
??
?
? ?
?
>
<
说明:增大压强,正逆反应速率均增大,但增大
倍数不一样,平衡向着体积缩小的方向移动。
用速率时间图分析压强对平衡的影响
V
t
t1
t2
t3
V(减)
V(增)
V(增)=V(减)
V`(增)=V`(减)
加压
V`(增)=V`(减)
减压
V(减)
V(增)
对于反应前后气体体积无变化的化学平衡
2HI(g) H2 + I2(g)
原平衡
V(正)=V(逆)
移动方向
原平衡
增大压强
V(正) V(逆)
不移动
V`(正)=V`(逆)
减小压强
V(正) V(逆)
不移动
V`(正)=V`(逆)
?
?
?
?
=
=
思考
C(B)有无变化?
φ(B)有无变化?
用速率时间图分析压强对平衡的影响
V
t
t1
t2
V(正)=V(逆)
V`(正)=V`(逆)
加压
V`(正)=V`(逆)
减压
4.注意事项
⑴改变压强,需判断出平衡移动的具体方向(正或逆)
⑵对于反应前后气态物质总体积无变化的可逆反应,改变压强,平衡不移动。
V(B)改变
C(B)改变
X(B)不变
⑶无气体参加的可逆反应,改变压强,平衡不移动。
⑷增大压强后的平衡,其正逆反应速率都比原来大。
⑸向平衡混合气中加入惰性气体
①在等温等容(T、V):
平衡不移动
②在等温等压(T、P):
平衡向体增方向移动
改变压强的几种形式:①改变体积
②充入惰性气体(恒容不移动;
恒压向气体增大方向移动)
③充入反应物(恒压最终和原平衡一样;
恒容正移
5.应用
工业上为了使平衡向生成生成物的方向移动,或提高原料的利用率,常采用改变压强的方法。
例:在N2+3H2 2NH3中,常采用增大压强的方法来提高平衡混合气中NH3的含量。
[例1]分析下列两个可逆反应达到平衡后,当改变压强平衡是否移动?怎样移动?
①H2 + I2(g) 2HI
②CO2 + C(s) 2CO
反应
增大压强
减小压强
①
②
不移动
不移动
向逆反应方向移动
向正反应方向移动
[例2] 对于反应2NO2(气) N2O4(气)试比较以下三种状态下的压强关系:
1)改变压强前混和气体压强P1;改变压强后瞬时气体压强P2;改变压强达新平衡后混和气体压强P3;
加压:_____________
减压:_____________
2)加压后达新平衡,与原平衡相比,总物质的量增大还是减小?平均分子量呢?
P2 > P3 > P1
P1 > P3 > P2
练习:
1、2SO2+O2 2SO3中为充分利用SO2,从压强角度,应采取什么措施?
2. H2+I2(g) 2HI反应中达平衡时,加压后下列说法正确的是:
A、平衡不移动 B、 H2的物质的量增大
C、 [H2]增大
D、加压后平衡的速率比原来要大
E、 H2%增大
3、反应mA(g)+nB(g) pC(g)+qD(g)+Q,在相同温度不同压强下,A的转化率与反应时间(t)的关系如下图所示,下列关系正确的是 ( )
A、p1>p2 B、m+n=p+q
C、m+n>p+q D、m+n t
A的转化率
P2
P1
t1
t2
D
4、将等物质的量的A、B、C、D四种物质混合,发生如下反应: aA + bB cC(固)+ dD,当反应进行一段时间后,测得A减少了nmol,B减少了n/2mol,C增加了3n/2mol,D增加了nmol,此时反应达到平衡。
(1)该反应方程式中,各物质的系数分别为:
a=______,b=_______,c=_______,d=_______
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A_______,B_______,D_______
再见!
第二课时
影响化学平衡的条件
第三讲
三、温度对化学平衡的影响
1.演示实验
红棕色
无色
2NO2(g) N2O4(g)
放热
吸热
条件改变
现象
原因
结论
升温
加深
逆向移动
向吸热方向移动
降温
变浅
正向移动
向放热方向移动
2.结论
在其他条件不变的情况下,
温度升高,会使化学平衡向着吸热反应的方向移动;
降低温度,会使化学平衡向着放热的方向移动。
3.原因
2NO2(g) N2O4(g)
放热
吸热
原平衡
V(吸)=V(放)
移动方向
新平衡
升高温度
V(吸) V(放)
吸热
V`(吸)=V`(放)
降低温度
V(吸) V(放)
放热
V`(吸)=V`(放)
??
?
? ?
?
>
<
用速率时间图分析温度对平衡的影响
V
t
t1
t2
t3
V(吸)
V(放)
V(吸)=V(放)
V`(吸)=V`(放)
升温
V`(吸)=V`(放)
降温
V(吸)
V(放)
4.注意事项
⑴具体平衡,需判断出平衡移动的具体方向(正或逆)
⑵升温达平衡后,正逆反应速率都比原平衡的大;
降温达平衡后,正逆反应速率都比原平衡的小。
⑶同一可逆反应,在较高温度下进行,达到平衡所需时间较少(见图示)。
t
t1
t2
V(吸)=V(放);500℃
V`(吸)=V`(放); 200℃
V
在较高温度下进行的可逆反应,达到平衡所需时间较少
5.应用
工业上为了使平衡向生成生成物的方向移动,或提高原料的利用率,常采用改变温度的方法。
例:在NH3 +H2O NH3·H2O中,欲有利于氨气的吸收,应采用升温或降温?
[讨论] 对于反应2NO2(g) N2O4(g) +57kJ
试比较以下三种状态下的温度关系:
改变温度前混和气体温度T1;改变温度后瞬时气体温度T2;改变温度达新平衡后混和气体温度T3;
升温: ;
降温: 。
T2 >T3 >T1
T1 >T3 > T2
③ 2SO2 + O2 2SO3 + Q
④ CO+NO2 CO2+NO + Q
A. ①② B. ①
C. ③ D. 没有
① 2Cl2(g)+2H2O 4HCl(g)+O2 - Q
② N2+O2 2NO - Q
练1.下列各反应中,在温度升高或压强增大时,化学平衡都向右移动的是( )
n(Z)
t
T2P1
T2P2
T1P2
0
练2.反应2X(g)+Y(g) 2Z(g)(正反应为放热反应),在不同的温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如右图所示。下列判断正确的是
A. T1 <T2 P1<P2 B. T1 <T2 P1>P2
C. T1 >T2 P1>P2 D. T1 >T2 P1<P2
四、催化剂与化学平衡的关系
1.关系:不能使平衡发生移动,X(B)不变
2.原因:催化剂同样倍数地增加正逆反应的速率。
原平衡
V(正)=V(逆)
X(B)
平衡
催化剂
V(正) V(逆)
不变
不移动
?
?
=
用速率时间图分析催化剂与化学平衡的关系
V
t
t1
t2
V(正)=V(逆)
V`(正)=V`(逆)
催化剂
3.使用催化剂前后的平衡状态比较
(1)正、逆速率同倍数增大;
(2)反应混合物百分组成不变或X(B)不变
4.应用
(1)缩短反应达到平衡的时间
V
t
t1
t2
有催化剂V(正)=V(逆)
无催化剂V(正)=V(逆)
[总结]改变反应条件时平衡移动的方向
改变反应条件
平 衡 移 动
①
②
③
增大反应物浓度
向减少反应物的浓度方向移动
减小反应物浓度
向增大反应物的浓度方向移动
增 大 压 强
向气体体积缩小的方向移动
减 小 压 强
向气体体积增大的方向移动
升 高 温 度
向吸热反应方向移动
向放热反应方向移动
降 低 温 度
五、平衡移动原理(勒夏特列原理)
适用范围:
化学平衡、溶解平衡、电离平衡等
如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向着能够减弱这种改变方向移动。
注意事项:
适用于可逆反应,且已达到平衡后的变化
思考:下列事实不能用勒夏特列原理解释的是:
A.向氨水中滴加氯化铵溶液碱性减弱
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
小结:
影响化学反应速率的条件:
浓
压
温
催
固体粒度
影响化学平衡的条件:
浓
压
温
化学平衡移动原理(勒夏特列原理)
1. 在一密闭容器中,反应aA(g)=bB(g)达到平衡后,保持温度不变,将容器体积增大一倍, 当达到新的平衡时,B的浓度是原来65%,则 ( )
A.平衡向逆反应方向移动了
B.物质A的转化率减小了
C.物质B的质量分数增加了
D.a>b
C
课堂练习:
2.可逆反应A(g)+B C(g)+D,A和C均为无色气体,当反应达到平衡时,下列叙述错误的是( )
增大A的浓度,平衡体系颜色加深,则说明D是有颜色的气体
若升高温度,C的百分含量减少,则说明正反应为放热反应
若增大压强,平衡不移动,则说明B和D一定都是气体
如果B是气体,则增大A的浓度会使B的转化率增大
3. 在5升的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生反应:2A(g)+B(g) 2C(g)达平衡时,在相同温度下测得混合气体的压强是反应前的5/6,则A的转化率( )
A. 67% B. 50% C.2.5% D.5%
4.在一密闭容器中充人1 mol N02,建立如下平衡2NO2 N2O4,测得N02的转化率为a%,其他条件不变,再充人l mol NO2,待新平衡建立时,测得N02的转化率为b%,则a和b的大小关系为________。
再见!
影响化学平衡的条件
第一讲
复习
化学平衡状态的定义:
指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
化学平衡状态的特征:
动
动态平衡:V(正) ≠0;V(逆) ≠0
等
定
变
V(正)=V(逆) ≠0
C(B)或X(B)或φ(B)一定
条件改变→平衡改变
逆
研究对象是可逆反应
影响化学平衡的条件
旧条件
改变条件
旧平衡
V(正) ≠V(逆)
新平衡
新条件
旧平衡被破坏
V(正) =V(逆)
V‵ (正) =V‵ (逆)
化学平衡的移动:由于条件改变,化学平衡从一种平衡状态变成另一种平衡状态的过程。
造成平衡移动的原因:
由于条件改变使V(正) ≠V(逆)
平衡移动的结果:
改变混合物中X(B)
研究的意义:
对于处于平衡状态的可逆反应,如何改变条件(浓度、压强、温度),使它朝着有益于人类的方向移动,这就是本节所要解决的问题。
1、化学平衡移动的定义:
化学上把这种可逆反应中旧化学平衡的破坏、新化学平衡建立的过程叫做化学平衡的移动
2、化学平衡的移动方向的速率判断:
⑴、若外界条件变化引起V正> V逆:
旧平衡未被破坏,平衡不移动
平衡向正反应方向移动
⑵、若外界条件变化引起V正< V逆:
平衡向逆反应方向移动
⑶、若外界条件变化引起V正= V逆:
一、浓度对化学平衡的影响
1.实验依据
FeCl3+3KSCN Fe(SCN)3+3KCl
0.01
0.01
0.1
0.1
(红色)深
(红色)浅
练习:把上述反应改写成离子方程式:
Fe3+ +3SCN- Fe(SCN)3
滴加饱和FeCl3溶液
滴1mol/L KSCN溶液
滴加NaOH溶液
现象
增大c(Fe3+)
增大c(SCN-)
红色加深
C[Fe(SCN)3)增大
平衡破坏
平衡正向移动
Fe3+ + 3OH- 〓 Fe(OH)3↓
实验2-6
结论:增大反应物的浓度平衡向正反应方向移动
结论:减小反应物的浓度平衡向逆反应方向移动
红色加深
红色加深
有红褐色沉淀生成,溶液红色变浅
减小c(Fe3+)
红色变浅
C[Fe(SCN)3]减小
平衡破坏
平衡逆向移动
现象及分析
Fe3+ + 3SCN- Fe(SCN)3
2.结论
增反减生正方向
增生减反逆方向
注意:
增加固体或纯液体质量→平衡不移动
原因:
△m(s)↑ →C(B)未变
可以采用减小C(H2S)或增大C(H2);但不能采用改变m(S)。
例:在H2S(g) H2(g)+S(s)平衡体系中,欲通过改变浓度使平衡向逆反应方向移动。
3.原因
一定条件下:V(正)=V(逆)
条件改变
瞬间速率的改变
移动方向
增反
V(正) V(逆)
减生
V(正) V(逆)
增生
V(正) V(逆)
减反
V(正) V(逆)
>
<
↓
↑
↑
↓
>
<
正向移动
逆向移动
用速率时间图说明浓度对平衡的影响
V
t
t1
t2
t3
V’(正)
V‘(逆)
V(正)=V(逆)
V`(正)=V`(逆)
增大反应物浓度
V’正>V’逆
平衡正向移动
V`(正)=V`(逆)
V(正)=V(逆)
t
t1
t2
t3
V
V’(正)
V‘(逆)
减小生成物浓度
平衡正向移动
V’正>V’逆
V
t
t1
t2
t3
V‘(逆)
V’(正)
V(正)=V(逆)
V`(正)=V`(逆)
增大生成物浓度
V’逆>V’正
平衡逆向移动
V`(正)=V`(逆)
V(正)=V(逆)
t
t1
t2
t3
V
V‘(逆)
V’(正)
减小反应物浓度
V’逆>V’正
平衡逆向移动
4. 由以上四图可以得出结论:
1)改变反应物浓度瞬间,只能改变正反应速率
改变生成物浓度瞬间,只能改变逆反应速率
2)改变浓度瞬间,
若v(正)>v(逆),平衡向正反应方向移动
若v(逆)>v(正),平衡向逆反应方向移动
3)新旧平衡速率比较:
增大浓度,新平衡速率大于旧平衡速率
减小浓度,新平衡速率小于旧平衡速率
4)增大一种反应物的浓度,另一种反应物的转
化率一定提高,而本身的转化率一定降低。
5. 应用:
1)硫酸工业中,常鼓入过量的空气与SO2反应,你认为原因是什么?
在工业生产中适当增大廉价的反应物的浓度,使
化学平衡向正反应方向移动,可以提高价格较高
原料的转化率,以降低生产成本
2)在密闭容器中进行CaCO3 CaO+CO2,达平衡。
A、为什么在密闭容器中该反应才是可逆反应?
B、加入CaCO3平衡如何移动?
C、体积不变,充入CO2平衡怎么移动?
3)在下列平衡体系3NO2+H2O 2HNO3+NO中保持体积不变加入O2,则化学平衡
A、向生成HNO3方向进行 B、向左移
C、不移动 D、降低NO浓度
往容器中充H2O (g) ,平衡怎么移动?
达新平衡后,混合气体中[CO]浓度怎么变?【CO2】、【H2】、 【H2O (g)】呢?
对比旧平衡,新平衡下CO的转化率怎么变?H2O的转化率呢?
对比旧平衡,新平衡下CO2的百分含量怎么变?
800℃ 在密闭容器中CO+H2O(g) CO2+H2 达平衡
人体吸入CO后,空气中的CO、O2与人体的血红蛋白将建立如下平衡:
CO + HemO2 O2 + HemCO (Hem为血红蛋白)当HemCO的浓度为HemO2浓度的2%时,人的智力将受到严重损伤。
如果有人CO中毒,根据平衡移动原理,你认为该怎么办?
想一想?
练习:可逆反应H2O(g) + C(s) CO(g) + H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?
①增大水蒸气浓度 ②加入更多的碳 ③增加H2浓度
①平衡正向移动,CO浓度增大
②平衡不移动,CO浓度不变
③平衡逆向移动,CO浓度减小
小结:增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以V(正)仍等于V(逆),平衡不移动。
例.可逆反应2SO2+O2=2SO3(正反应为放热反应),当采取下列措施(瞬间)时,将对正逆反应速率的影响填入空格中:
1.增大O2浓度,V(正)____ V(逆)_____
2.减小SO2浓度,V(正)____ V(逆)____
3.在体积不变情况下充入N2, V(正)____ V(逆)____
4.在压强不变情况下充入N2, V(正)____ V(逆)____
5.增大反应容器的压强, V(正)____ V(逆)____
6.升高温度, V(正)____ V(逆)_____
再见!
第二课时
影响化学平衡的条件
第二讲
A、加入氢氧化钠发生____反应,平衡向___移动;
B、久置氯水的成分是_______,如何用化学平衡移动的观点来解释?
C、平衡后增加HCl的浓度平衡向_____移动;
D、次氯酸钠中加盐酸,观察到的现象_________
E、为什么氯气不溶于饱和食盐水?
F、加入NaHCO3 固体,C(HClO)变___;
G、加H2O ,C(HClO)变____
1. Cl2+H2O HCl+HClO达平衡后
复习:
二、压强对化学平衡的影响
1.演示实验
(2体积,红棕色)
(1体积,无色)
2NO2(g) N2O4(g)
气体体积减少
气体体积增大
条件改变
现象
原因
结论
速增压强
先深后浅
增浓正移
体减方向
速减压强
先浅后深
减浓逆移
体增方向
450℃时N2和H2反应生成NH3的实验数据
压强/MPa
NH3/%
1 5 10 30 60 100
2.0 9.2 16.4 35.5 53.6 69.4
由数据分析对于N2 + 3H2 2NH3中,加压,平衡朝哪边移?
分析数据:
2.结论
在其它条件不变的情况下:
A:增大压强,会使化学平衡向着气体体积缩小的方向移动
B:减小压强,会使化学平衡向着气体体积增大的方向移动。
3.原因
2NO2(g) N2O4(g)
气体体积减少
气体体积增大
原平衡
V(减)=V(增)
移动方向
新平衡
增大压强
V(减) V(增)
体减
V`(减)=V`(增)
减小压强
V(减) V(增)
体增
V`(减)=V`(增)
??
?
? ?
?
>
<
说明:增大压强,正逆反应速率均增大,但增大
倍数不一样,平衡向着体积缩小的方向移动。
用速率时间图分析压强对平衡的影响
V
t
t1
t2
t3
V(减)
V(增)
V(增)=V(减)
V`(增)=V`(减)
加压
V`(增)=V`(减)
减压
V(减)
V(增)
对于反应前后气体体积无变化的化学平衡
2HI(g) H2 + I2(g)
原平衡
V(正)=V(逆)
移动方向
原平衡
增大压强
V(正) V(逆)
不移动
V`(正)=V`(逆)
减小压强
V(正) V(逆)
不移动
V`(正)=V`(逆)
?
?
?
?
=
=
思考
C(B)有无变化?
φ(B)有无变化?
用速率时间图分析压强对平衡的影响
V
t
t1
t2
V(正)=V(逆)
V`(正)=V`(逆)
加压
V`(正)=V`(逆)
减压
4.注意事项
⑴改变压强,需判断出平衡移动的具体方向(正或逆)
⑵对于反应前后气态物质总体积无变化的可逆反应,改变压强,平衡不移动。
V(B)改变
C(B)改变
X(B)不变
⑶无气体参加的可逆反应,改变压强,平衡不移动。
⑷增大压强后的平衡,其正逆反应速率都比原来大。
⑸向平衡混合气中加入惰性气体
①在等温等容(T、V):
平衡不移动
②在等温等压(T、P):
平衡向体增方向移动
改变压强的几种形式:①改变体积
②充入惰性气体(恒容不移动;
恒压向气体增大方向移动)
③充入反应物(恒压最终和原平衡一样;
恒容正移
5.应用
工业上为了使平衡向生成生成物的方向移动,或提高原料的利用率,常采用改变压强的方法。
例:在N2+3H2 2NH3中,常采用增大压强的方法来提高平衡混合气中NH3的含量。
[例1]分析下列两个可逆反应达到平衡后,当改变压强平衡是否移动?怎样移动?
①H2 + I2(g) 2HI
②CO2 + C(s) 2CO
反应
增大压强
减小压强
①
②
不移动
不移动
向逆反应方向移动
向正反应方向移动
[例2] 对于反应2NO2(气) N2O4(气)试比较以下三种状态下的压强关系:
1)改变压强前混和气体压强P1;改变压强后瞬时气体压强P2;改变压强达新平衡后混和气体压强P3;
加压:_____________
减压:_____________
2)加压后达新平衡,与原平衡相比,总物质的量增大还是减小?平均分子量呢?
P2 > P3 > P1
P1 > P3 > P2
练习:
1、2SO2+O2 2SO3中为充分利用SO2,从压强角度,应采取什么措施?
2. H2+I2(g) 2HI反应中达平衡时,加压后下列说法正确的是:
A、平衡不移动 B、 H2的物质的量增大
C、 [H2]增大
D、加压后平衡的速率比原来要大
E、 H2%增大
3、反应mA(g)+nB(g) pC(g)+qD(g)+Q,在相同温度不同压强下,A的转化率与反应时间(t)的关系如下图所示,下列关系正确的是 ( )
A、p1>p2 B、m+n=p+q
C、m+n>p+q D、m+n
A的转化率
P2
P1
t1
t2
D
4、将等物质的量的A、B、C、D四种物质混合,发生如下反应: aA + bB cC(固)+ dD,当反应进行一段时间后,测得A减少了nmol,B减少了n/2mol,C增加了3n/2mol,D增加了nmol,此时反应达到平衡。
(1)该反应方程式中,各物质的系数分别为:
a=______,b=_______,c=_______,d=_______
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A_______,B_______,D_______
再见!
第二课时
影响化学平衡的条件
第三讲
三、温度对化学平衡的影响
1.演示实验
红棕色
无色
2NO2(g) N2O4(g)
放热
吸热
条件改变
现象
原因
结论
升温
加深
逆向移动
向吸热方向移动
降温
变浅
正向移动
向放热方向移动
2.结论
在其他条件不变的情况下,
温度升高,会使化学平衡向着吸热反应的方向移动;
降低温度,会使化学平衡向着放热的方向移动。
3.原因
2NO2(g) N2O4(g)
放热
吸热
原平衡
V(吸)=V(放)
移动方向
新平衡
升高温度
V(吸) V(放)
吸热
V`(吸)=V`(放)
降低温度
V(吸) V(放)
放热
V`(吸)=V`(放)
??
?
? ?
?
>
<
用速率时间图分析温度对平衡的影响
V
t
t1
t2
t3
V(吸)
V(放)
V(吸)=V(放)
V`(吸)=V`(放)
升温
V`(吸)=V`(放)
降温
V(吸)
V(放)
4.注意事项
⑴具体平衡,需判断出平衡移动的具体方向(正或逆)
⑵升温达平衡后,正逆反应速率都比原平衡的大;
降温达平衡后,正逆反应速率都比原平衡的小。
⑶同一可逆反应,在较高温度下进行,达到平衡所需时间较少(见图示)。
t
t1
t2
V(吸)=V(放);500℃
V`(吸)=V`(放); 200℃
V
在较高温度下进行的可逆反应,达到平衡所需时间较少
5.应用
工业上为了使平衡向生成生成物的方向移动,或提高原料的利用率,常采用改变温度的方法。
例:在NH3 +H2O NH3·H2O中,欲有利于氨气的吸收,应采用升温或降温?
[讨论] 对于反应2NO2(g) N2O4(g) +57kJ
试比较以下三种状态下的温度关系:
改变温度前混和气体温度T1;改变温度后瞬时气体温度T2;改变温度达新平衡后混和气体温度T3;
升温: ;
降温: 。
T2 >T3 >T1
T1 >T3 > T2
③ 2SO2 + O2 2SO3 + Q
④ CO+NO2 CO2+NO + Q
A. ①② B. ①
C. ③ D. 没有
① 2Cl2(g)+2H2O 4HCl(g)+O2 - Q
② N2+O2 2NO - Q
练1.下列各反应中,在温度升高或压强增大时,化学平衡都向右移动的是( )
n(Z)
t
T2P1
T2P2
T1P2
0
练2.反应2X(g)+Y(g) 2Z(g)(正反应为放热反应),在不同的温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如右图所示。下列判断正确的是
A. T1 <T2 P1<P2 B. T1 <T2 P1>P2
C. T1 >T2 P1>P2 D. T1 >T2 P1<P2
四、催化剂与化学平衡的关系
1.关系:不能使平衡发生移动,X(B)不变
2.原因:催化剂同样倍数地增加正逆反应的速率。
原平衡
V(正)=V(逆)
X(B)
平衡
催化剂
V(正) V(逆)
不变
不移动
?
?
=
用速率时间图分析催化剂与化学平衡的关系
V
t
t1
t2
V(正)=V(逆)
V`(正)=V`(逆)
催化剂
3.使用催化剂前后的平衡状态比较
(1)正、逆速率同倍数增大;
(2)反应混合物百分组成不变或X(B)不变
4.应用
(1)缩短反应达到平衡的时间
V
t
t1
t2
有催化剂V(正)=V(逆)
无催化剂V(正)=V(逆)
[总结]改变反应条件时平衡移动的方向
改变反应条件
平 衡 移 动
①
②
③
增大反应物浓度
向减少反应物的浓度方向移动
减小反应物浓度
向增大反应物的浓度方向移动
增 大 压 强
向气体体积缩小的方向移动
减 小 压 强
向气体体积增大的方向移动
升 高 温 度
向吸热反应方向移动
向放热反应方向移动
降 低 温 度
五、平衡移动原理(勒夏特列原理)
适用范围:
化学平衡、溶解平衡、电离平衡等
如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向着能够减弱这种改变方向移动。
注意事项:
适用于可逆反应,且已达到平衡后的变化
思考:下列事实不能用勒夏特列原理解释的是:
A.向氨水中滴加氯化铵溶液碱性减弱
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
小结:
影响化学反应速率的条件:
浓
压
温
催
固体粒度
影响化学平衡的条件:
浓
压
温
化学平衡移动原理(勒夏特列原理)
1. 在一密闭容器中,反应aA(g)=bB(g)达到平衡后,保持温度不变,将容器体积增大一倍, 当达到新的平衡时,B的浓度是原来65%,则 ( )
A.平衡向逆反应方向移动了
B.物质A的转化率减小了
C.物质B的质量分数增加了
D.a>b
C
课堂练习:
2.可逆反应A(g)+B C(g)+D,A和C均为无色气体,当反应达到平衡时,下列叙述错误的是( )
增大A的浓度,平衡体系颜色加深,则说明D是有颜色的气体
若升高温度,C的百分含量减少,则说明正反应为放热反应
若增大压强,平衡不移动,则说明B和D一定都是气体
如果B是气体,则增大A的浓度会使B的转化率增大
3. 在5升的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生反应:2A(g)+B(g) 2C(g)达平衡时,在相同温度下测得混合气体的压强是反应前的5/6,则A的转化率( )
A. 67% B. 50% C.2.5% D.5%
4.在一密闭容器中充人1 mol N02,建立如下平衡2NO2 N2O4,测得N02的转化率为a%,其他条件不变,再充人l mol NO2,待新平衡建立时,测得N02的转化率为b%,则a和b的大小关系为________。
再见!
