人教版高中化学选修四3.3盐类的水解 课件(共53张ppt)
文档属性
| 名称 | 人教版高中化学选修四3.3盐类的水解 课件(共53张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 366.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-31 22:05:06 | ||
图片预览











文档简介
第三章 水溶液中的离子平衡
第三节 盐类的水解
【回忆思考】
Na2CO3俗称什么?分别往Na2CO3和NaHCO3的
溶液中滴加酚酞,可观察到什么现象?
?
NaHCO3溶液
Na2CO3溶液
盐溶液
NaCl
Na2CO3
NaHCO3
NH4Cl
酸碱性
盐类型
盐溶液
Na2SO4
CH3COONa
(NH4)2SO4
酸碱性
盐类型
一、寻找规律
探究盐溶液的酸碱性
中性
碱性
碱性
酸性
中性
碱性
酸性
强酸强碱盐
强碱弱酸盐
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
一、盐的类型与盐溶液酸碱性的关系:
P54
盐的类型
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
盐溶液酸碱性
中性
酸性
碱性
规律:谁强显谁性,同强显中性。
二、探究原因
盐溶液呈现不同酸碱性的原因
H2O H+ + OH–
纯水中:
当分别加入NaCl、NH4Cl、CH3COONa形成溶液后,请思考:
(1)相关的电离方程式?
(2)盐溶液中存在哪些粒子?
(3)哪些粒子间可能结合(生成弱电解质)?
(4)对水的电离平衡有何影响?
(5)相关的化学方程式?
分析后,填写书 P55 表格
【探究1】 往水中加NaCl形成溶液。
⑴ 电离方程式
⑵ c(H+)和c(OH–)相对大小
⑶ 盐溶液的酸碱性
⑷ 盐溶液中的粒子
⑸ 有无弱电解质生成
⑹ 相关化学方程式
H2O H+ + OH–
NaCl Cl– + Na+
Na+、Cl–、H+、OH–、H2O
无
c(H+) c(OH–)
=
中性
无
(对水的电离平衡无影响)
⑴ 电离方程式
⑵ c(H+)和c(OH–)相对大小
⑶ 盐溶液的酸碱性
⑷ 盐溶液中的粒子
⑸ 有无弱电解质生成
⑹ 相关化学方程式
【探究2】 往水中加NH4Cl形成溶液。
H2O H+ + OH–
NH4Cl Cl– + NH4+
+
有
(促进水的电离)
NH3 · H2O
c(H+) c(OH–)
>
酸性
Cl–、NH4+、H+、OH–、H2O、
NH3 · H2O
NH4Cl + H2O NH3 · H2O + HCl
NH4+ + H2O NH3 · H2O + H+
水解方程式
⑴ 电离方程式
⑵ c(H+)和c(OH–)相对大小
⑶ 盐溶液的酸碱性
⑷ 盐溶液中的粒子
⑸ 有无弱电解质生成
⑹ 相关化学方程式
【探究3】 往水中加CH3COONa形成溶液。
H2O OH– + H+
CH3COONa Na+ + CH3COO–
+
有
(促进水的电离)
CH3COOH
c(H+) c(OH–)
<
碱性
Na+、CH3COO–、OH–、H+、H2O、CH3COOH
CH3COONa + H2O CH3COOH + NaOH
CH3COO– + H2O CH3COOH + OH–
水解方程式
H2O H + + OH –
CH3COONa == Na+ + CH3COO –
NH4Cl == Cl – + NH4+
二、盐溶液呈不同酸碱性的原因:
盐类的水解
三、盐类水解:
在溶液中盐电离出来的弱离子跟水所电离出来的H+ 或OH –结合生成弱电解质的反应,叫做盐类的水解。
(弱酸、弱碱)
以CH3COONa和NH4Cl的水溶液的酸碱性为例:
1、概念:
盐 + 水 酸 + 碱
盐 + 水 酸 + 碱
盐易溶,有弱离子。
促进水的电离。
2、水解的条件:
3、水解的实质:
使 c (H+) ≠ c (OH–)
生成弱电解质;
4、水解的特点:
⑴ 可逆
⑵ 吸热
⑶ 一般很微弱
中和
水解
一般不用“↑”或“↓”;
一般不写“ ”,而写“ ”。
,必有弱酸或弱碱生成
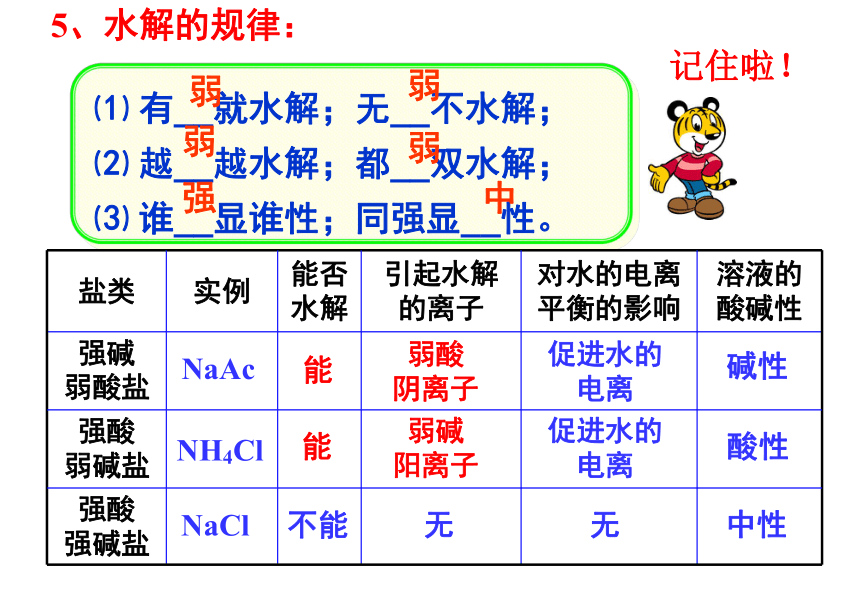
5、水解的规律:
⑴ 有__就水解;无__不水解;
⑵ 越__越水解;都__双水解;
⑶ 谁__显谁性;同强显__性。
弱
弱
弱
弱
强
中
盐类
实例
能否水解
引起水解的离子
对水的电离
平衡的影响
溶液的
酸碱性
强碱
弱酸盐
强酸
弱碱盐
强酸
强碱盐
NaAc
能
弱酸
阴离子
促进水的
电离
碱性
NH4Cl
能
弱碱
阳离子
促进水的
电离
酸性
NaCl
不能
无
无
中性
记住啦!
在溶液中,不能发生水解的离子是( )
A、ClO – B、CO3 2 –
C、Fe 3+ D、SO4 2 –
D
Exercises
下列盐的水溶液中,哪些呈酸性( )
哪些呈碱性( )
① FeCl3 ② NaClO ③ (NH4)2SO4
④ AgNO3 ⑤ Na2S ⑥ K2SO4
①③④
②⑤
Exercises
3. 下列物质分别加入到水中,因促进水的电离而使
溶液呈酸性的是( )
A、硫酸 B、NaOH C、硫酸铝 D. 碳酸钠
C
酸性
碱性
4. 在Na2S溶液中,c (Na+) 与 c (S2–) 之比值( )于2。
A、大 B、小 C、等 D、无法确定
A
四、盐类水解方程式的书写:
先找“弱”离子。
一般水解程度小,水解产物少。常用“ ” ;不写“ == ”、“↑”、“↓”;
也不把生成物(如NH3·H2O、H2CO3)写成
分解产物的形式。
多元弱酸盐分步水解,但以第一步水解为主。
多元弱碱盐的水解,常写成一步完成。
四、盐类水解方程式的书写:
(一)一元弱酸强碱盐
如:CH3COONa、NaF
化学方程式:
离子方程式:
CH3COONa + H2O CH3COOH + NaOH
CH3COO– + H2O CH3COOH + OH–
化学方程式:
离子方程式:
NaF + H2O HF + NaOH
F– + H2O HF + OH–
(二)多元弱酸强碱盐
如:Na2CO3、 Na3PO4
离子方程式:
HCO3 – + H2O H2CO3 + OH –
CO3 2– + H2O HCO3 – + OH –
(主)
(次)
?
(三)弱碱强酸盐水解
如:NH4Cl、CuSO4、AlCl3
水解的离子方程式:
NH4+ + H2O NH3·H2O + H+
Cu2+ + 2H2O Cu(OH)2 + 2H+
Al 3+ + 3H2O Al(OH)3 + 3H+
(1)一般的双水解:程度不是很大,阴阳离子仍能在溶液中大量共存的,如NH4HCO3、(NH4)2CO3
(四)弱酸弱碱盐水解
CH3COO– + NH4+ + H2O CH3COOH + NH3·H2O
若不能同时产生沉淀和气体,水解不完全
进行“一般双水解”用
若同时产生沉淀和气体,水解趋于完全
“完全双水解”的,用“ == ”、“↑”、“↓”。
(2)完全双水解:水解进行完全,阴阳离子不能在溶液中大量共存的:
①Al3+ 与 AlO2-、CO32-、HCO3- 、 HS-、S2-、SiO32-
② Fe3+ 与 AlO2-、CO32-、HCO3-
③ NH4+ 与 SiO32-、AlO2-
2Al3+ + 3S2- + 6H2O = 2Al(OH)3↓+3H2S↑
2Al3+ + 3CO32- + 3H2O = 2Al(OH)3↓+3CO2↑
Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓
Al3+ + 3HCO3-= Al(OH)3↓+3CO2 ↑
练习:双水解的离子方程式的书写: (1) Al3+ 与 CO32- (2) Al3+ 与 HCO3- (3) Al3+ 与 S2- (4)Al3+ 与 AlO2-
(五)多元弱酸酸式酸根的水解与电离方程式的区别:
⑴ NaHCO3
HCO3 – + H2O H2CO3 + OH –
①
②
① 水解
② 电离
程度:
>
∴溶液呈 性
碱
⑵ NaHSO3
HSO3 – + H2O H2SO3 + OH –
①
②
① 水解
② 电离
程度:
<
∴溶液呈 性
酸
HCO3 – + H2O CO32– + H3+O
HSO3 – + H2O SO32– + H3+O
练习:P68例2,变2
五、盐类水解平衡
(一)定义:
在一定条件下,当盐类的水解速率等于
中和速率时,达到水解平衡。
(动态平衡)
(二)影响因素:
1、内因:
盐本身的性质。
(越弱越水解)
① 不同弱酸对应的盐
NaClO (aq) NaHCO3 (aq)
MgCl2 (aq) AlCl3 (aq)
对应的酸
HClO H2CO3
<
>
碱 性
② 不同弱碱对应的盐
对应的碱
酸 性
Mg(OH)2 Al(OH)3
<
>
16
1、内因:
盐本身的性质。
(越弱越水解)
③ 同一弱酸对应的盐
Na2CO3 (aq) NaHCO3 (aq)
对应的酸
HCO3– H2CO3
<
>
碱 性
∴ 正盐的水解程度 酸式盐的水解程度
>
11
练习:已知HClO , CH3COOH, HNO2都是弱酸,其电离常数分别为3.0×10-8,1.8×10-5,4.6×10-4, 则相同浓度的NaClO CH3COONa NaNO2的PH?
﹥
﹥
2、外因:
① 温度:
升温,促进水解。
② 浓度:
加水稀释,促进水解。
③ 加酸:
弱碱阳离子的水解。
弱酸根离子的水解。
抑制
促进
④ 加碱:
弱碱阳离子的水解。
弱酸根离子的水解。
促进
抑制
配制FeCl3溶液需要注意什么问题?
加入一定量的 ,抑制FeCl3的水解。
思考
Fe 3+ + 3H2O Fe (OH)3 + 3H +
HCl
10
对于水解平衡
Fe3+ + 3H2O Fe(OH)3 + 3H+
改变条件
移动方向
n(H+)
pH
水解程度
现象
升温
通HCl(g)
加H2O
加Mg粉
加NaHCO3
加FeCl3
加NaOH
变深
变浅
变浅
变浅,冒气泡,可能产生红褐色沉淀。
变浅,冒气泡,产生红褐色沉淀。
变深
产生红褐色沉淀
25℃时,在浓度均为1mol/L的(NH4)2SO4、 (NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中c(NH4+)分别为a、b、c(单位为mo/L),则下列判断正确的是( )
A. a=b=c B. c>a>b
C. b>a>c D. a>c>b
B
P70变式1.2
混施化肥
泡沫
灭火剂
制备胶体
明矾净水
判断溶液
酸碱性
离子浓度
比较
试剂贮存
盐溶液
的蒸发
溶液配制
盐类水解
的应用
六、盐类水解的应用:
(一) 易水解盐溶液的配制与保存:
配制 FeCl3溶液:加少量 ;
配制 CuCl2溶液,为防止出现浑浊:加少量 ;
说明盛放Na2S的试剂瓶不能用玻璃塞的原因?保存NaF溶液 能否用玻璃瓶?
加相应的酸或碱
稀盐酸
稀盐酸
Fe3+ + 3H2O Fe(OH)3 + 3H+
配制 FeSO4溶液:加少量 ;
稀硫酸和Fe粉
(考点)
(二) 判断盐溶液的酸碱性:
CH3COONH4溶液
中性
NaHCO3溶液
碱性
NaHSO3溶液
酸性
NaH2PO4溶液
酸性
Na2HPO4溶液
碱性
(相同温度和浓度)
注意: 多元弱酸对应的酸式盐:一般来说,
水解趋势 电离趋势 ( NaH2PO4和NaHSO3 例外)
>
若电离占优势,则显酸性
若水解占优势,则显碱性,比如NaHCO3,NaHS
NaHPO4
Na2SO3
Na2SO4
NaHSO4
NaHSO3
比较PH大小:
﹥
﹥
﹥
练习: 无色溶液,滴加甲基橙试液后呈显红色,各组离子能大量共存的是( )
A. K+、NO3-、MnO4-、Na+
B. K+、NH4+、Mg2+、NO3-
C. Cl-、HCO3-、Al3+、Ba2+
D. K+、CH3COO-、NO3-、NH4+
B
(三) 判定离子能否大量共存:
(四)某些化肥的使用
(NH4)2SO4(硫铵)
Ca(OH)2、K2CO3(草木灰)
酸性
碱性
它们____ 混合使用,
(五)利用盐类水解除杂
否则会因_______放出____而降低肥效。
如: MgCl2溶液中混有FeCl3杂质。
Fe3+ + 3H2O Fe(OH)3 + 3H+
Mg2+ + 2H2O Mg(OH)2 + 2H+
① 加入Mg(OH)2
② 加入MgO
③ 加入MgCO3
④ 加入Mg
不引入新杂质!
(主)
(次)
不能
双水解
NH3
(七) 某些盐的无水物,不能用蒸发溶液的方法制取
AlCl3溶液
蒸干
Al(OH)3
灼烧
Al2O3
MgCl2· 6H2O
Mg(OH)2
MgO
△
△
晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2
FeCl3 溶液
Fe(NO3)3 溶液
Fe2(SO4)3 溶液
CuSO4 · 5H2O
Na2CO3 · 10H2O
Na2CO3 溶液
Na2SO3 溶液
Ca(HCO3)2 溶液
Fe2O3
Fe2O3
Fe2(SO4)3
Na2CO3
Na2CO3
CuSO4
Na2SO4
CaCO3
(六) 热的纯碱去污能力更强,Why?
升温,促进CO32–水解。
下列盐溶液加热蒸干后,得到什么固体物质?
(七) 某些盐的无水物,不能用蒸发溶液的方法制取
AlCl3溶液
蒸干
Al(OH)3
灼烧
Al2O3
MgCl2· 6H2O
Mg(OH)2
MgO
△
△
晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2
(六) 热的纯碱去污能力更强,Why?
升温,促进CO32–水解。
制备纳米材料。如:用TiCl4制备TiO2
书 P61
(九) 泡沫灭火器的原理
塑料内筒装有Al2(SO4)3溶液
外筒装有NaHCO3溶液
Al2(SO4)3 和 NaHCO3溶液:
Al 3+ + 3HCO3– Al(OH)3 + 3CO2
Al 3+ + 3H2O Al(OH)3 + 3H +
HCO3– + H2O H2CO3 + OH –
混合前
混合后
七、水溶液中微粒浓度的大小比较:
(考点)
1、电离理论:
② 多元弱酸电离是分步,主要决定第一步
① 弱电解质电离是微弱的
c (NH3 · H2O) c (OH–) c (NH4+) c (H+)
c (H2S) c (H+) c (HS–) c (S2–) c (OH–)
>
>
>
>
>
>
>
对于弱酸、弱碱,其电离程度小,产生的离子浓度远远小于弱电解质分子的浓度。
如: NH3 · H2O 溶液中:
如:H2S溶液中:
2、水解理论:
①水解是微弱
② 多元弱酸水解是分步,主要决定第一步
c (Cl–) c (NH4+) c (H+) c (OH–)
c(Na+) c (CO3–) c(OH–) c (HCO3–) c (H+)
>
>
>
>
>
单水解程度很小,水解产生的离子或分子浓度远远小于弱离子的浓度。
如:NH4Cl 溶液中:
七、水溶液中微粒浓度的大小比较:
(考点)
>
>
如:Na2CO3 溶液中:
3.混合溶液中各离子浓度比较。
弱酸(碱)与其对应盐的混合溶液
一般,等浓度的弱酸(碱)的电离都大于其对应盐
溶液中离子的水解,除了HCN的电离小于CN-的水解
如:0.1mol/LCH3COONa和0.1mol/LCH3COOH混合后,溶液中各离子浓度的大小顺序为
c (CH3COO-)> C (Na+)>c (H+)> c (OH-)
1、0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混合,则溶液中粒子浓度关系正确的为(?)
A.C(CH3COO-)>C(Na+) ?????????????????
B.C(CH3COOH)>C(CH3COO-)
C.C(CH3COO-) > C(Na+) ? > ?C(OH-) > C(H+)
D.C(CH3COOH)+C(CH3COO-)=0.01mol/L
AD
【举一反三】
若将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中 则离子浓度大小关系?
4、电荷守恒
溶液中阴离子和阳离子所带的电荷总数相等。
c ( NH4+ ) + c ( H+ ) == c ( Cl– ) + c ( OH– )
七、水溶液中微粒浓度的大小比较:
(考点)
如:NH4Cl 溶液中
阳离子: NH4+ H+
阴离子: Cl– OH–
正电荷总数 == 负电荷总数
n ( NH4+ ) + n ( H+ ) == n ( Cl– ) + n ( OH– )
七、水溶液中微粒浓度的大小比较:
(考点)
4、电荷守恒
又如:Na2S 溶液
Na2S == 2Na+ + S2– H2O H+ + OH–
S2– + H2O HS– + OH–
HS– + H2O H2S + OH–
c (Na+ ) + c ( H+ ) == c ( OH– ) + 2c ( S2–) + c ( HS– )
溶液中阴离子和阳离子所带的电荷总数相等。
∵ 正电荷总数 == 负电荷总数
阳离子: Na+ 、H+ 阴离子: OH– 、 S2– 、 HS–
七、水溶液中微粒浓度的大小比较:
(考点)
5、物料守恒
(元素or原子守恒)
溶液中,尽管有些离子能电离或水解,变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不变的。
七、水溶液中微粒浓度的大小比较:
(考点)
5、物料守恒
是指某一元素的原始浓度应该等于该元素在溶液中各种存在形式的浓度之和。
如:a mol / L 的Na2CO3 溶液中
Na2CO3 == 2 Na+ + CO32– H2O H+ + OH–
CO32– + H2O HCO3– + OH–
HCO3– + H2O H2CO3 + OH–
∴ c (Na+ ) = 2 [c (CO32–) + c (HCO3–) + c (H2CO3) ]
c (Na+ ) = 2 a mol / L
c (CO32–) + c (HCO3–) + c (H2CO3) = a mol / L
(元素or原子守恒)
即 c (Na+) : c (C) =2 : 1
七、水溶液中微粒浓度的大小比较:
(考点)
如:Na2S 溶液
Na2S == 2 Na+ + S2– H2O H+ + OH–
S2– + H2O HS– + OH–
HS– + H2O H2S + OH–
因此:c (Na+ ) == 2 [ c ( S2–) + c (HS–) + c (H2S) ]
5、物料守恒
是指某一元素的原始浓度应该等于该元素在溶液中各种存在形式的浓度之和。
(元素or原子守恒)
∵ c (Na+) : c (S) =2 : 1
6.质子守恒
水电离出的c(H+)c(OH-)始终相等,溶液中的H+或
OH-虽与其他离子结合而以不同形式存在,但其总量相等
K2S溶液
S2-
H2O
+H+
HS-
+H+
H3O+
(即H+)
-H+
OH-
+2H+
H2S
c(HS- )+c(H+) +2c(H2S)=c(OH-)
质子守恒
通过联立电荷守恒和原子守恒,消去与得到和给出质子无关的粒子
K2S溶液
c(K+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
电荷守恒
原子守恒
c(K+)=2[c(HS-)+c(H2S)+c(S2-)]
联立,消去K+得
c(HS- )+c(H+) +2c(H2S)=c(OH-)
质子守恒
KHS溶液
HS-
H2O
+H+
H3O+
-H+
OH-
+H+
H2S
-H+
S2-
c(H+) +c(H2S)=c(OH-) + c(S2- )
质子守恒
NaHS溶液
c(Na+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
电荷守恒
c(Na+)=c(HS-)+c(H2S)+c(S2-)
原子守恒
联立,消去Na+得
c(H+) +c(H2S)=c(OH-) + c(S2- )
【举一反三】
写出CH3COONa 、NaHCO3 、
H2S溶液中的电荷守恒式。
NaHCO3溶液中
c (Na+) + c (H+) = c (OH-) + c (HCO3-)+2 c (CO32-)
H2S溶液中:
c (H+) = c (OH-) + c (HS-)+2 c (S2-)
0.2mol/LNaHCO3溶液
碳守恒:
C(CO32-)+C(HCO3-)+C(H2CO3)=0.2mol/L
0.1mol/LCH3COONa溶液
醋酸根守恒:
C(CH3COO-)+C(CH3COOH)=0.1mol/L
【举一反三】
C(Na+)=C(CH3COO-)+C(CH3COOH)
C(Na+)=
C(CO32-)+C(HCO3-)+C(H2CO3)
CH3COONa溶液中:
c (H+)+ c (CH3COOH) =c (OH-)
NaHCO3溶液中
c (H+) + c (H2CO3) - c( CO32- )= c (OH-)
【举一反三】
写出CH3COONa 、 NaHCO3溶液中的质子守恒式:
小结:
1、如等号一端全是阴离子或全是阳离子,应首先考虑电荷守恒;
2、若等号一端各项中都含有同一种元素,首先考虑物料守恒,即这种元素的原子守恒;
3、若出现等号但既不是电荷守恒也不是原子守恒,则可考虑质子守恒或将两者进行合并处理
例1:在氯化铵溶液中,下列关系式正确的是
A.[Cl–]>[NH4+]>[H+]>[OH–]????
B.[NH4+]>[Cl–]>[H+]>[OH–]
C.[Cl–]=[NH4+]>[H+]=[OH–]????
D.[NH4+]=[Cl–]>[H+]>[OH–]
解析: NH4Cl是可溶性的盐,属于强电解质,在溶液中完全电离 NH4Cl=NH4++Cl–。因为NH4Cl是强酸弱碱所生成的盐,在水中要发生水解;
NH4++H2O NH3·H2O+H+,∴ [NH4+]比[H+]及[OH–]大得多;溶液因水解而呈酸性,所以[H+]>[OH-]。综合起来,不难得出:[Cl–]>[NH4+]>[H+]>[OH–]。
例题分析
A
例2:在0.1 mol/L的NH3·H2O溶液中,关系正确的是
A.c (NH3·H2O) > c (OH–) > c (NH4+) > c (H+)
B.c (NH4+) > c (NH3·H2O) > c (OH–) > c (H+)
C.c (NH3·H2O) > c (NH4+) = c (OH–) > c (H+)??
D.c (NH3·H2O) > c (NH4+) > c (H+) > c (OH–)
解析: NH3·H2O是一元弱碱,属于弱电解质,在水溶液中少部分发生电离(NH3·H2O ? NH4+ + OH–),所以 c (NH3·H2O) 必大于 c (NH4+)及 c (OH–)。
因为电荷守恒 c (OH–) = c (H+) + c (NH4+),所以
c (OH–) > c (NH4+)。综合起来,
c (NH3·H2O) > c (OH–) > c (NH4+) > c (H+)。
A
例3:用均为0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中 c (CH3COO–) > c (Na+),对该混合溶液的下列判断正确的是
A. c (OH–) > c (H+)
B. c (CH3COOH) + c (CH3COO– ) = 0.2 mol/L
C. c (CH3COOH) > c (CH3COO– )?????
D. c (CH3COO– )?+ c (OH– ) = 0.2 mol/L
解析: CH3COOH和CH3COONa的混合溶液中,CH3COOH的电离和CH3COONa的水解因素同时存在。已知[CH3COO-]>[Na+],根据电荷守恒[CH3COO-]+[OH-]=[Na+]+[H+],可得出[OH-]<[H+]。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于CH3COO-的水解趋势。根据物料守恒,可推出(B)是正确的。
4、关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A.c(NH4+):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:
c(H+)=c(OH-)+c(NH3·H2O)
D.①和③等体积混合后的溶液:
c(NH4+)>c(Cl+)>c(OH-)>c(H+)
B
第三节 盐类的水解
【回忆思考】
Na2CO3俗称什么?分别往Na2CO3和NaHCO3的
溶液中滴加酚酞,可观察到什么现象?
?
NaHCO3溶液
Na2CO3溶液
盐溶液
NaCl
Na2CO3
NaHCO3
NH4Cl
酸碱性
盐类型
盐溶液
Na2SO4
CH3COONa
(NH4)2SO4
酸碱性
盐类型
一、寻找规律
探究盐溶液的酸碱性
中性
碱性
碱性
酸性
中性
碱性
酸性
强酸强碱盐
强碱弱酸盐
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
一、盐的类型与盐溶液酸碱性的关系:
P54
盐的类型
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
盐溶液酸碱性
中性
酸性
碱性
规律:谁强显谁性,同强显中性。
二、探究原因
盐溶液呈现不同酸碱性的原因
H2O H+ + OH–
纯水中:
当分别加入NaCl、NH4Cl、CH3COONa形成溶液后,请思考:
(1)相关的电离方程式?
(2)盐溶液中存在哪些粒子?
(3)哪些粒子间可能结合(生成弱电解质)?
(4)对水的电离平衡有何影响?
(5)相关的化学方程式?
分析后,填写书 P55 表格
【探究1】 往水中加NaCl形成溶液。
⑴ 电离方程式
⑵ c(H+)和c(OH–)相对大小
⑶ 盐溶液的酸碱性
⑷ 盐溶液中的粒子
⑸ 有无弱电解质生成
⑹ 相关化学方程式
H2O H+ + OH–
NaCl Cl– + Na+
Na+、Cl–、H+、OH–、H2O
无
c(H+) c(OH–)
=
中性
无
(对水的电离平衡无影响)
⑴ 电离方程式
⑵ c(H+)和c(OH–)相对大小
⑶ 盐溶液的酸碱性
⑷ 盐溶液中的粒子
⑸ 有无弱电解质生成
⑹ 相关化学方程式
【探究2】 往水中加NH4Cl形成溶液。
H2O H+ + OH–
NH4Cl Cl– + NH4+
+
有
(促进水的电离)
NH3 · H2O
c(H+) c(OH–)
>
酸性
Cl–、NH4+、H+、OH–、H2O、
NH3 · H2O
NH4Cl + H2O NH3 · H2O + HCl
NH4+ + H2O NH3 · H2O + H+
水解方程式
⑴ 电离方程式
⑵ c(H+)和c(OH–)相对大小
⑶ 盐溶液的酸碱性
⑷ 盐溶液中的粒子
⑸ 有无弱电解质生成
⑹ 相关化学方程式
【探究3】 往水中加CH3COONa形成溶液。
H2O OH– + H+
CH3COONa Na+ + CH3COO–
+
有
(促进水的电离)
CH3COOH
c(H+) c(OH–)
<
碱性
Na+、CH3COO–、OH–、H+、H2O、CH3COOH
CH3COONa + H2O CH3COOH + NaOH
CH3COO– + H2O CH3COOH + OH–
水解方程式
H2O H + + OH –
CH3COONa == Na+ + CH3COO –
NH4Cl == Cl – + NH4+
二、盐溶液呈不同酸碱性的原因:
盐类的水解
三、盐类水解:
在溶液中盐电离出来的弱离子跟水所电离出来的H+ 或OH –结合生成弱电解质的反应,叫做盐类的水解。
(弱酸、弱碱)
以CH3COONa和NH4Cl的水溶液的酸碱性为例:
1、概念:
盐 + 水 酸 + 碱
盐 + 水 酸 + 碱
盐易溶,有弱离子。
促进水的电离。
2、水解的条件:
3、水解的实质:
使 c (H+) ≠ c (OH–)
生成弱电解质;
4、水解的特点:
⑴ 可逆
⑵ 吸热
⑶ 一般很微弱
中和
水解
一般不用“↑”或“↓”;
一般不写“ ”,而写“ ”。
,必有弱酸或弱碱生成
5、水解的规律:
⑴ 有__就水解;无__不水解;
⑵ 越__越水解;都__双水解;
⑶ 谁__显谁性;同强显__性。
弱
弱
弱
弱
强
中
盐类
实例
能否水解
引起水解的离子
对水的电离
平衡的影响
溶液的
酸碱性
强碱
弱酸盐
强酸
弱碱盐
强酸
强碱盐
NaAc
能
弱酸
阴离子
促进水的
电离
碱性
NH4Cl
能
弱碱
阳离子
促进水的
电离
酸性
NaCl
不能
无
无
中性
记住啦!
在溶液中,不能发生水解的离子是( )
A、ClO – B、CO3 2 –
C、Fe 3+ D、SO4 2 –
D
Exercises
下列盐的水溶液中,哪些呈酸性( )
哪些呈碱性( )
① FeCl3 ② NaClO ③ (NH4)2SO4
④ AgNO3 ⑤ Na2S ⑥ K2SO4
①③④
②⑤
Exercises
3. 下列物质分别加入到水中,因促进水的电离而使
溶液呈酸性的是( )
A、硫酸 B、NaOH C、硫酸铝 D. 碳酸钠
C
酸性
碱性
4. 在Na2S溶液中,c (Na+) 与 c (S2–) 之比值( )于2。
A、大 B、小 C、等 D、无法确定
A
四、盐类水解方程式的书写:
先找“弱”离子。
一般水解程度小,水解产物少。常用“ ” ;不写“ == ”、“↑”、“↓”;
也不把生成物(如NH3·H2O、H2CO3)写成
分解产物的形式。
多元弱酸盐分步水解,但以第一步水解为主。
多元弱碱盐的水解,常写成一步完成。
四、盐类水解方程式的书写:
(一)一元弱酸强碱盐
如:CH3COONa、NaF
化学方程式:
离子方程式:
CH3COONa + H2O CH3COOH + NaOH
CH3COO– + H2O CH3COOH + OH–
化学方程式:
离子方程式:
NaF + H2O HF + NaOH
F– + H2O HF + OH–
(二)多元弱酸强碱盐
如:Na2CO3、 Na3PO4
离子方程式:
HCO3 – + H2O H2CO3 + OH –
CO3 2– + H2O HCO3 – + OH –
(主)
(次)
?
(三)弱碱强酸盐水解
如:NH4Cl、CuSO4、AlCl3
水解的离子方程式:
NH4+ + H2O NH3·H2O + H+
Cu2+ + 2H2O Cu(OH)2 + 2H+
Al 3+ + 3H2O Al(OH)3 + 3H+
(1)一般的双水解:程度不是很大,阴阳离子仍能在溶液中大量共存的,如NH4HCO3、(NH4)2CO3
(四)弱酸弱碱盐水解
CH3COO– + NH4+ + H2O CH3COOH + NH3·H2O
若不能同时产生沉淀和气体,水解不完全
进行“一般双水解”用
若同时产生沉淀和气体,水解趋于完全
“完全双水解”的,用“ == ”、“↑”、“↓”。
(2)完全双水解:水解进行完全,阴阳离子不能在溶液中大量共存的:
①Al3+ 与 AlO2-、CO32-、HCO3- 、 HS-、S2-、SiO32-
② Fe3+ 与 AlO2-、CO32-、HCO3-
③ NH4+ 与 SiO32-、AlO2-
2Al3+ + 3S2- + 6H2O = 2Al(OH)3↓+3H2S↑
2Al3+ + 3CO32- + 3H2O = 2Al(OH)3↓+3CO2↑
Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓
Al3+ + 3HCO3-= Al(OH)3↓+3CO2 ↑
练习:双水解的离子方程式的书写: (1) Al3+ 与 CO32- (2) Al3+ 与 HCO3- (3) Al3+ 与 S2- (4)Al3+ 与 AlO2-
(五)多元弱酸酸式酸根的水解与电离方程式的区别:
⑴ NaHCO3
HCO3 – + H2O H2CO3 + OH –
①
②
① 水解
② 电离
程度:
>
∴溶液呈 性
碱
⑵ NaHSO3
HSO3 – + H2O H2SO3 + OH –
①
②
① 水解
② 电离
程度:
<
∴溶液呈 性
酸
HCO3 – + H2O CO32– + H3+O
HSO3 – + H2O SO32– + H3+O
练习:P68例2,变2
五、盐类水解平衡
(一)定义:
在一定条件下,当盐类的水解速率等于
中和速率时,达到水解平衡。
(动态平衡)
(二)影响因素:
1、内因:
盐本身的性质。
(越弱越水解)
① 不同弱酸对应的盐
NaClO (aq) NaHCO3 (aq)
MgCl2 (aq) AlCl3 (aq)
对应的酸
HClO H2CO3
<
>
碱 性
② 不同弱碱对应的盐
对应的碱
酸 性
Mg(OH)2 Al(OH)3
<
>
16
1、内因:
盐本身的性质。
(越弱越水解)
③ 同一弱酸对应的盐
Na2CO3 (aq) NaHCO3 (aq)
对应的酸
HCO3– H2CO3
<
>
碱 性
∴ 正盐的水解程度 酸式盐的水解程度
>
11
练习:已知HClO , CH3COOH, HNO2都是弱酸,其电离常数分别为3.0×10-8,1.8×10-5,4.6×10-4, 则相同浓度的NaClO CH3COONa NaNO2的PH?
﹥
﹥
2、外因:
① 温度:
升温,促进水解。
② 浓度:
加水稀释,促进水解。
③ 加酸:
弱碱阳离子的水解。
弱酸根离子的水解。
抑制
促进
④ 加碱:
弱碱阳离子的水解。
弱酸根离子的水解。
促进
抑制
配制FeCl3溶液需要注意什么问题?
加入一定量的 ,抑制FeCl3的水解。
思考
Fe 3+ + 3H2O Fe (OH)3 + 3H +
HCl
10
对于水解平衡
Fe3+ + 3H2O Fe(OH)3 + 3H+
改变条件
移动方向
n(H+)
pH
水解程度
现象
升温
通HCl(g)
加H2O
加Mg粉
加NaHCO3
加FeCl3
加NaOH
变深
变浅
变浅
变浅,冒气泡,可能产生红褐色沉淀。
变浅,冒气泡,产生红褐色沉淀。
变深
产生红褐色沉淀
25℃时,在浓度均为1mol/L的(NH4)2SO4、 (NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中c(NH4+)分别为a、b、c(单位为mo/L),则下列判断正确的是( )
A. a=b=c B. c>a>b
C. b>a>c D. a>c>b
B
P70变式1.2
混施化肥
泡沫
灭火剂
制备胶体
明矾净水
判断溶液
酸碱性
离子浓度
比较
试剂贮存
盐溶液
的蒸发
溶液配制
盐类水解
的应用
六、盐类水解的应用:
(一) 易水解盐溶液的配制与保存:
配制 FeCl3溶液:加少量 ;
配制 CuCl2溶液,为防止出现浑浊:加少量 ;
说明盛放Na2S的试剂瓶不能用玻璃塞的原因?保存NaF溶液 能否用玻璃瓶?
加相应的酸或碱
稀盐酸
稀盐酸
Fe3+ + 3H2O Fe(OH)3 + 3H+
配制 FeSO4溶液:加少量 ;
稀硫酸和Fe粉
(考点)
(二) 判断盐溶液的酸碱性:
CH3COONH4溶液
中性
NaHCO3溶液
碱性
NaHSO3溶液
酸性
NaH2PO4溶液
酸性
Na2HPO4溶液
碱性
(相同温度和浓度)
注意: 多元弱酸对应的酸式盐:一般来说,
水解趋势 电离趋势 ( NaH2PO4和NaHSO3 例外)
>
若电离占优势,则显酸性
若水解占优势,则显碱性,比如NaHCO3,NaHS
NaHPO4
Na2SO3
Na2SO4
NaHSO4
NaHSO3
比较PH大小:
﹥
﹥
﹥
练习: 无色溶液,滴加甲基橙试液后呈显红色,各组离子能大量共存的是( )
A. K+、NO3-、MnO4-、Na+
B. K+、NH4+、Mg2+、NO3-
C. Cl-、HCO3-、Al3+、Ba2+
D. K+、CH3COO-、NO3-、NH4+
B
(三) 判定离子能否大量共存:
(四)某些化肥的使用
(NH4)2SO4(硫铵)
Ca(OH)2、K2CO3(草木灰)
酸性
碱性
它们____ 混合使用,
(五)利用盐类水解除杂
否则会因_______放出____而降低肥效。
如: MgCl2溶液中混有FeCl3杂质。
Fe3+ + 3H2O Fe(OH)3 + 3H+
Mg2+ + 2H2O Mg(OH)2 + 2H+
① 加入Mg(OH)2
② 加入MgO
③ 加入MgCO3
④ 加入Mg
不引入新杂质!
(主)
(次)
不能
双水解
NH3
(七) 某些盐的无水物,不能用蒸发溶液的方法制取
AlCl3溶液
蒸干
Al(OH)3
灼烧
Al2O3
MgCl2· 6H2O
Mg(OH)2
MgO
△
△
晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2
FeCl3 溶液
Fe(NO3)3 溶液
Fe2(SO4)3 溶液
CuSO4 · 5H2O
Na2CO3 · 10H2O
Na2CO3 溶液
Na2SO3 溶液
Ca(HCO3)2 溶液
Fe2O3
Fe2O3
Fe2(SO4)3
Na2CO3
Na2CO3
CuSO4
Na2SO4
CaCO3
(六) 热的纯碱去污能力更强,Why?
升温,促进CO32–水解。
下列盐溶液加热蒸干后,得到什么固体物质?
(七) 某些盐的无水物,不能用蒸发溶液的方法制取
AlCl3溶液
蒸干
Al(OH)3
灼烧
Al2O3
MgCl2· 6H2O
Mg(OH)2
MgO
△
△
晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2
(六) 热的纯碱去污能力更强,Why?
升温,促进CO32–水解。
制备纳米材料。如:用TiCl4制备TiO2
书 P61
(九) 泡沫灭火器的原理
塑料内筒装有Al2(SO4)3溶液
外筒装有NaHCO3溶液
Al2(SO4)3 和 NaHCO3溶液:
Al 3+ + 3HCO3– Al(OH)3 + 3CO2
Al 3+ + 3H2O Al(OH)3 + 3H +
HCO3– + H2O H2CO3 + OH –
混合前
混合后
七、水溶液中微粒浓度的大小比较:
(考点)
1、电离理论:
② 多元弱酸电离是分步,主要决定第一步
① 弱电解质电离是微弱的
c (NH3 · H2O) c (OH–) c (NH4+) c (H+)
c (H2S) c (H+) c (HS–) c (S2–) c (OH–)
>
>
>
>
>
>
>
对于弱酸、弱碱,其电离程度小,产生的离子浓度远远小于弱电解质分子的浓度。
如: NH3 · H2O 溶液中:
如:H2S溶液中:
2、水解理论:
①水解是微弱
② 多元弱酸水解是分步,主要决定第一步
c (Cl–) c (NH4+) c (H+) c (OH–)
c(Na+) c (CO3–) c(OH–) c (HCO3–) c (H+)
>
>
>
>
>
单水解程度很小,水解产生的离子或分子浓度远远小于弱离子的浓度。
如:NH4Cl 溶液中:
七、水溶液中微粒浓度的大小比较:
(考点)
>
>
如:Na2CO3 溶液中:
3.混合溶液中各离子浓度比较。
弱酸(碱)与其对应盐的混合溶液
一般,等浓度的弱酸(碱)的电离都大于其对应盐
溶液中离子的水解,除了HCN的电离小于CN-的水解
如:0.1mol/LCH3COONa和0.1mol/LCH3COOH混合后,溶液中各离子浓度的大小顺序为
c (CH3COO-)> C (Na+)>c (H+)> c (OH-)
1、0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混合,则溶液中粒子浓度关系正确的为(?)
A.C(CH3COO-)>C(Na+) ?????????????????
B.C(CH3COOH)>C(CH3COO-)
C.C(CH3COO-) > C(Na+) ? > ?C(OH-) > C(H+)
D.C(CH3COOH)+C(CH3COO-)=0.01mol/L
AD
【举一反三】
若将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中 则离子浓度大小关系?
4、电荷守恒
溶液中阴离子和阳离子所带的电荷总数相等。
c ( NH4+ ) + c ( H+ ) == c ( Cl– ) + c ( OH– )
七、水溶液中微粒浓度的大小比较:
(考点)
如:NH4Cl 溶液中
阳离子: NH4+ H+
阴离子: Cl– OH–
正电荷总数 == 负电荷总数
n ( NH4+ ) + n ( H+ ) == n ( Cl– ) + n ( OH– )
七、水溶液中微粒浓度的大小比较:
(考点)
4、电荷守恒
又如:Na2S 溶液
Na2S == 2Na+ + S2– H2O H+ + OH–
S2– + H2O HS– + OH–
HS– + H2O H2S + OH–
c (Na+ ) + c ( H+ ) == c ( OH– ) + 2c ( S2–) + c ( HS– )
溶液中阴离子和阳离子所带的电荷总数相等。
∵ 正电荷总数 == 负电荷总数
阳离子: Na+ 、H+ 阴离子: OH– 、 S2– 、 HS–
七、水溶液中微粒浓度的大小比较:
(考点)
5、物料守恒
(元素or原子守恒)
溶液中,尽管有些离子能电离或水解,变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不变的。
七、水溶液中微粒浓度的大小比较:
(考点)
5、物料守恒
是指某一元素的原始浓度应该等于该元素在溶液中各种存在形式的浓度之和。
如:a mol / L 的Na2CO3 溶液中
Na2CO3 == 2 Na+ + CO32– H2O H+ + OH–
CO32– + H2O HCO3– + OH–
HCO3– + H2O H2CO3 + OH–
∴ c (Na+ ) = 2 [c (CO32–) + c (HCO3–) + c (H2CO3) ]
c (Na+ ) = 2 a mol / L
c (CO32–) + c (HCO3–) + c (H2CO3) = a mol / L
(元素or原子守恒)
即 c (Na+) : c (C) =2 : 1
七、水溶液中微粒浓度的大小比较:
(考点)
如:Na2S 溶液
Na2S == 2 Na+ + S2– H2O H+ + OH–
S2– + H2O HS– + OH–
HS– + H2O H2S + OH–
因此:c (Na+ ) == 2 [ c ( S2–) + c (HS–) + c (H2S) ]
5、物料守恒
是指某一元素的原始浓度应该等于该元素在溶液中各种存在形式的浓度之和。
(元素or原子守恒)
∵ c (Na+) : c (S) =2 : 1
6.质子守恒
水电离出的c(H+)c(OH-)始终相等,溶液中的H+或
OH-虽与其他离子结合而以不同形式存在,但其总量相等
K2S溶液
S2-
H2O
+H+
HS-
+H+
H3O+
(即H+)
-H+
OH-
+2H+
H2S
c(HS- )+c(H+) +2c(H2S)=c(OH-)
质子守恒
通过联立电荷守恒和原子守恒,消去与得到和给出质子无关的粒子
K2S溶液
c(K+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
电荷守恒
原子守恒
c(K+)=2[c(HS-)+c(H2S)+c(S2-)]
联立,消去K+得
c(HS- )+c(H+) +2c(H2S)=c(OH-)
质子守恒
KHS溶液
HS-
H2O
+H+
H3O+
-H+
OH-
+H+
H2S
-H+
S2-
c(H+) +c(H2S)=c(OH-) + c(S2- )
质子守恒
NaHS溶液
c(Na+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
电荷守恒
c(Na+)=c(HS-)+c(H2S)+c(S2-)
原子守恒
联立,消去Na+得
c(H+) +c(H2S)=c(OH-) + c(S2- )
【举一反三】
写出CH3COONa 、NaHCO3 、
H2S溶液中的电荷守恒式。
NaHCO3溶液中
c (Na+) + c (H+) = c (OH-) + c (HCO3-)+2 c (CO32-)
H2S溶液中:
c (H+) = c (OH-) + c (HS-)+2 c (S2-)
0.2mol/LNaHCO3溶液
碳守恒:
C(CO32-)+C(HCO3-)+C(H2CO3)=0.2mol/L
0.1mol/LCH3COONa溶液
醋酸根守恒:
C(CH3COO-)+C(CH3COOH)=0.1mol/L
【举一反三】
C(Na+)=C(CH3COO-)+C(CH3COOH)
C(Na+)=
C(CO32-)+C(HCO3-)+C(H2CO3)
CH3COONa溶液中:
c (H+)+ c (CH3COOH) =c (OH-)
NaHCO3溶液中
c (H+) + c (H2CO3) - c( CO32- )= c (OH-)
【举一反三】
写出CH3COONa 、 NaHCO3溶液中的质子守恒式:
小结:
1、如等号一端全是阴离子或全是阳离子,应首先考虑电荷守恒;
2、若等号一端各项中都含有同一种元素,首先考虑物料守恒,即这种元素的原子守恒;
3、若出现等号但既不是电荷守恒也不是原子守恒,则可考虑质子守恒或将两者进行合并处理
例1:在氯化铵溶液中,下列关系式正确的是
A.[Cl–]>[NH4+]>[H+]>[OH–]????
B.[NH4+]>[Cl–]>[H+]>[OH–]
C.[Cl–]=[NH4+]>[H+]=[OH–]????
D.[NH4+]=[Cl–]>[H+]>[OH–]
解析: NH4Cl是可溶性的盐,属于强电解质,在溶液中完全电离 NH4Cl=NH4++Cl–。因为NH4Cl是强酸弱碱所生成的盐,在水中要发生水解;
NH4++H2O NH3·H2O+H+,∴ [NH4+]比[H+]及[OH–]大得多;溶液因水解而呈酸性,所以[H+]>[OH-]。综合起来,不难得出:[Cl–]>[NH4+]>[H+]>[OH–]。
例题分析
A
例2:在0.1 mol/L的NH3·H2O溶液中,关系正确的是
A.c (NH3·H2O) > c (OH–) > c (NH4+) > c (H+)
B.c (NH4+) > c (NH3·H2O) > c (OH–) > c (H+)
C.c (NH3·H2O) > c (NH4+) = c (OH–) > c (H+)??
D.c (NH3·H2O) > c (NH4+) > c (H+) > c (OH–)
解析: NH3·H2O是一元弱碱,属于弱电解质,在水溶液中少部分发生电离(NH3·H2O ? NH4+ + OH–),所以 c (NH3·H2O) 必大于 c (NH4+)及 c (OH–)。
因为电荷守恒 c (OH–) = c (H+) + c (NH4+),所以
c (OH–) > c (NH4+)。综合起来,
c (NH3·H2O) > c (OH–) > c (NH4+) > c (H+)。
A
例3:用均为0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中 c (CH3COO–) > c (Na+),对该混合溶液的下列判断正确的是
A. c (OH–) > c (H+)
B. c (CH3COOH) + c (CH3COO– ) = 0.2 mol/L
C. c (CH3COOH) > c (CH3COO– )?????
D. c (CH3COO– )?+ c (OH– ) = 0.2 mol/L
解析: CH3COOH和CH3COONa的混合溶液中,CH3COOH的电离和CH3COONa的水解因素同时存在。已知[CH3COO-]>[Na+],根据电荷守恒[CH3COO-]+[OH-]=[Na+]+[H+],可得出[OH-]<[H+]。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于CH3COO-的水解趋势。根据物料守恒,可推出(B)是正确的。
4、关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A.c(NH4+):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:
c(H+)=c(OH-)+c(NH3·H2O)
D.①和③等体积混合后的溶液:
c(NH4+)>c(Cl+)>c(OH-)>c(H+)
B
