高中化学选修4人教版2.3化学平衡状态的影响因素( 压强、催化剂)(共23张ppt)
文档属性
| 名称 | 高中化学选修4人教版2.3化学平衡状态的影响因素( 压强、催化剂)(共23张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 899.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-31 22:10:35 | ||
图片预览





文档简介
第三节 化学平衡
第3课时 压强、催化剂对化学平衡的影响及勒夏特列原理
压强对化学平衡的影响
催化剂对化学平衡的影响
勒夏特列原理的应用
压强对化学平衡的影响
1
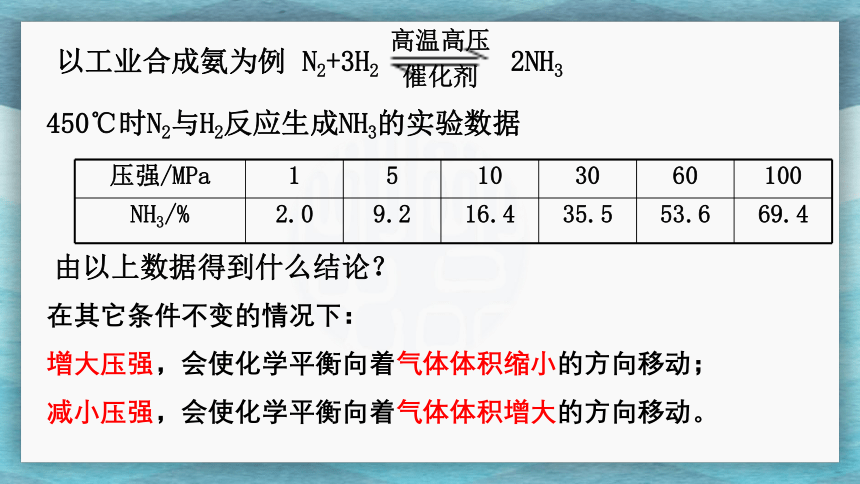
以工业合成氨为例
N2+3H2 2NH3
高温高压
催化剂
由以上数据得到什么结论?
压强/MPa
1
5
10
30
60
100
NH3/%
2.0
9.2
16.4
35.5
53.6
69.4
450℃时N2与H2反应生成NH3的实验数据
在其它条件不变的情况下:
增大压强,会使化学平衡向着气体体积缩小的方向移动;
减小压强,会使化学平衡向着气体体积增大的方向移动。
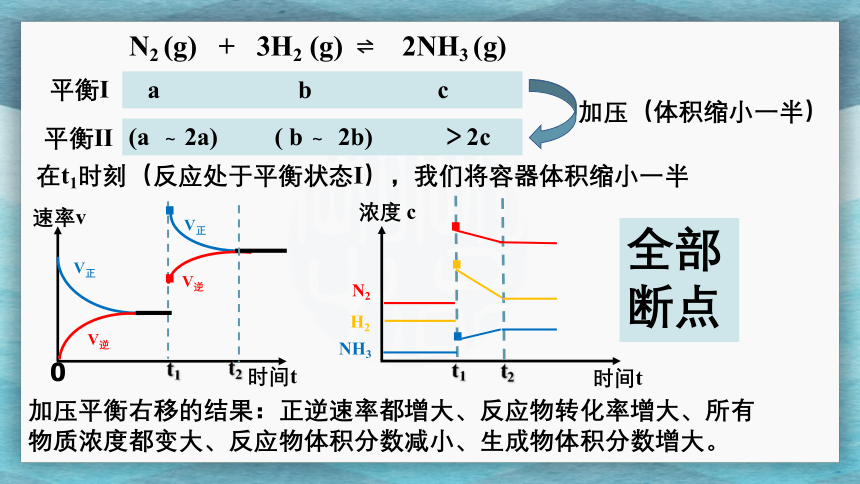
N2 (g) + 3H2 (g) ? 2NH3 (g)
平衡I
a b c
在t1时刻(反应处于平衡状态I),我们将容器体积缩小一半
时间t
速率v
0
t1
V正
V逆
.
V正
V逆
t2
.
时间t
浓度 c
t1
.
t2
.
.
N2
H2
NH3
全部
断点
加压平衡右移的结果:正逆速率都增大、反应物转化率增大、所有物质浓度都变大、反应物体积分数减小、生成物体积分数增大。
平衡II
(a ~ 2a) ( b ~ 2b) >2c
加压(体积缩小一半)
N2 (g) + 3H2 (g) ? 2NH3 (g)
平衡I
a b c
在t1时刻(反应处于平衡状态I),我们将容器体积扩大为原来二倍
减压(体积扩大二倍)
时间t
速率v
0
t1
V正
V逆
.
.
t2
V逆
V正
时间t
浓度 c
0
t1
N2
H2
NH3
.
.
.
t2
减压平衡左移的结果:正逆速率都减小、反应物转化率减小、所有物质浓度都减小、反应物体积分数增大、生成物体积分数减小。
平衡II
(a/2 ~ a) ( b/2 ~ b) (0 ~ c/2)
H2(g) + I2 (g) 2HI(g)
?
时间t
速率v
0
t1
V正
V逆
平衡I
a b c
在t1时刻(反应处于平衡状态I),我们将容器体积缩小一半
加压(体积缩小一半)
.
.
平衡II
2a 2b 2c
时间t
浓度 c
0
t1
H2
I2
HI
.
.
.
对此反应加压的结果:正逆速率同等倍数增大、平衡不移动、反应物转化率不变、所有物质浓度同等倍数都增大、体积分数不变。
思考:对此反应扩大体积减压呢?自己画画试试
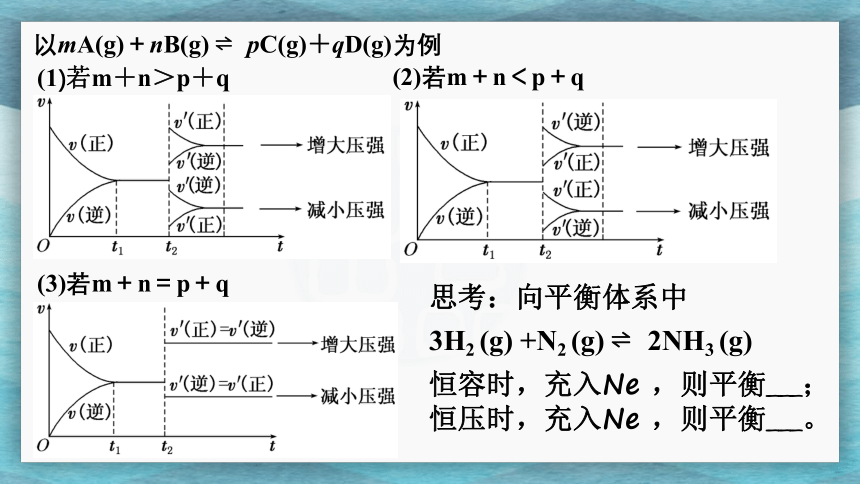
以mA(g)+nB(g) ? pC(g)+qD(g)为例
(1)若m+n>p+q
(2)若m+n<p+q
(3)若m+n=p+q
思考:向平衡体系中
3H2 (g) +N2 (g) ? 2NH3 (g)
恒容时,充入Ne ,则平衡___; 恒压时,充入Ne ,则平衡___。
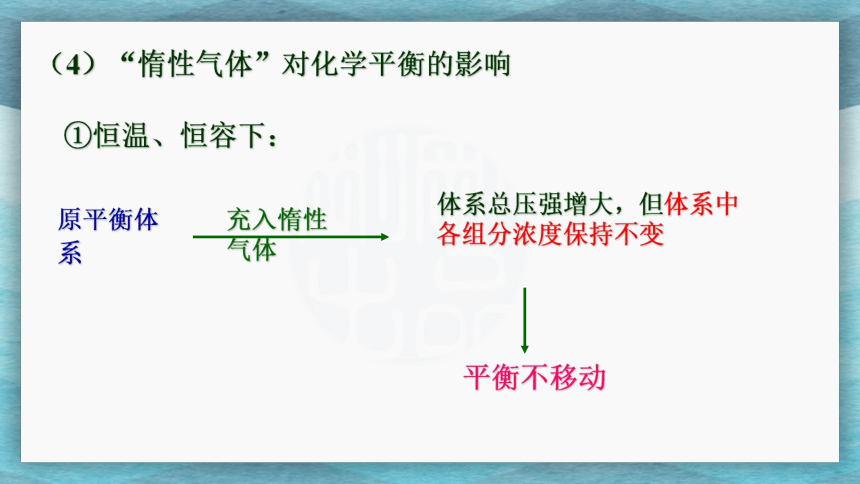
(4)“惰性气体”对化学平衡的影响
①恒温、恒容下:
原平衡体系
体系总压强增大,但体系中各组分浓度保持不变
平衡不移动
充入惰性气体
②恒温、恒压下 :
原平衡体系
充入惰性气体
各组分浓度减少
体系总体积增大
平衡向气体总体积增大的方向移动
平衡不移动
m + n = p + q
m + n ≠ p + q
(相当于压强减小)
恒温下, 反应aX(g) ? bY(g) +cZ(g)达到平衡后, 把容器体积
压缩到原来的一半且达到新平衡时, X的物质的量浓度由 0.1mol/L
增大到0.19mol/L, 下列判断正确的是( )
A,a>b+c B,a<b+c C,a=b+c D,a=b=c
A
课堂练习
课堂练习
已知化学反应2A(?)+B(g) ? 2C(?)达到平衡,当增大压
强时,平衡向逆反应方向移动,则下列情况可能的是( )
A、A是气体,C是固体 B、A、C均为气体
C、A、C均为固体 D、A是固体,C是气体
D
催化剂对化学平衡的影响
2
催化剂能够同等程度的改变正逆反应的速率,所以使用催化剂不能使平衡发生移动,但可以缩短达到平衡所需要的时间。
A.② ③ B.① ②
C.③ ④ D.④ ⑤
对可逆反应:A(g)+B(g) C(s)+2D(g) ΔH>0,如图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A ②加入催化剂 ③加压 ④升温 ⑤移走C。
符合图示条件的是( )
?
A
课堂练习
勒夏特列原理
3
如果改变影响平衡的一个条件(浓度、温度、压强等),化学平衡就向减弱这种改变的方向移动。
①此原理只适用于已达平衡的体系
②平衡移动方向与条件改变方向相反。
注意:
③移动的结果只能是减弱外界条件的该变量,但不能抵消。
不能用勒夏特列原理解释的问题
(1) 改变条件平衡不移动的
如:H2(g)+Br2(g) 2HBr(g)加压颜色加深
如:合成氨工业中使用催化剂提高生产效率。
(2)改变条件平衡移动方向与生产要求不一致时
如:合成氨工业中升高温度提高生产效率。
(3)不是可逆反应不能用
如:配制硫酸亚铁溶液时往往要加入一定量铁粉
如:经粉碎的黄铁矿在沸腾炉中燃烧较完全
讨论:反应N2(g)+3H2 (g) 2NH3 (g) △H<0 ,达到化学平衡,改变下列条件,根据反应体系中的变化填空:
①若N2的平衡浓度为a mol/L,其他条件不变时,充入N2使其浓度增大到b mol/L后平衡向——————方向移动,达到新平衡后, N2的浓度为c mol/L,则a、b、c的大小为———————;
②若平衡体系的压强为P1 ,之后缩小反应体系体积使压强增大到P2 ,此时平衡向——————方向移动,达到新平衡后 体系的压强为P3 ,则P1 、 P2、 P3 的大小为——————————;
③若平衡体系的温度为T1 ,之后将温度升高到 T2 ,此时平衡向——————方向移动,达到新平衡后 体系的温度为T3 ,则T1 、 T2、 T3 的大小为——————————。
正反应
a< c < b
正反应
P1 < P3< P2
逆反应
T1 < T3< T2
下列事实,不能用勒夏特列原理解释的是
①实验室常用饱和NaHCO3溶液除去CO2中混有的SO2气体
②长时间存放的氯水,会变为无色透明
③打开雪碧的瓶盖,立即有气体逸出
④经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全
⑤合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率
⑥合成氨工业中用铁触媒做催化剂???
⑦K2Cr2O7溶液中滴加NaOH溶液后颜色变为黄色
⑧用排饱和食盐水的方法收集氯气
①④⑥
课堂练习
向一容积不变的密闭容器中充入H2和I2,发生反应
H2(g)+I2(g)?2HI(g) ΔH<0,当达到平衡后,t0时若保持混合气体总
物质的量不变而改变某一反应条件,使平衡移动(如图所示),下
列说法正确的是( )
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度减小
D.t0时改变的条件为减小体积或升高体系温度
A
课堂练习
已知:N2(g)+3H2(g) ? 2NH3(g) ΔH=-92.4kJ·mol-1,在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
t1____________________;t2______________________;
t3___________________ _;t4____________________。
增大c(N2)或c(H2)
加入催化剂
降低温度
增大压强
课堂练习
第3课时 压强、催化剂对化学平衡的影响及勒夏特列原理
压强对化学平衡的影响
催化剂对化学平衡的影响
勒夏特列原理的应用
压强对化学平衡的影响
1
以工业合成氨为例
N2+3H2 2NH3
高温高压
催化剂
由以上数据得到什么结论?
压强/MPa
1
5
10
30
60
100
NH3/%
2.0
9.2
16.4
35.5
53.6
69.4
450℃时N2与H2反应生成NH3的实验数据
在其它条件不变的情况下:
增大压强,会使化学平衡向着气体体积缩小的方向移动;
减小压强,会使化学平衡向着气体体积增大的方向移动。
N2 (g) + 3H2 (g) ? 2NH3 (g)
平衡I
a b c
在t1时刻(反应处于平衡状态I),我们将容器体积缩小一半
时间t
速率v
0
t1
V正
V逆
.
V正
V逆
t2
.
时间t
浓度 c
t1
.
t2
.
.
N2
H2
NH3
全部
断点
加压平衡右移的结果:正逆速率都增大、反应物转化率增大、所有物质浓度都变大、反应物体积分数减小、生成物体积分数增大。
平衡II
(a ~ 2a) ( b ~ 2b) >2c
加压(体积缩小一半)
N2 (g) + 3H2 (g) ? 2NH3 (g)
平衡I
a b c
在t1时刻(反应处于平衡状态I),我们将容器体积扩大为原来二倍
减压(体积扩大二倍)
时间t
速率v
0
t1
V正
V逆
.
.
t2
V逆
V正
时间t
浓度 c
0
t1
N2
H2
NH3
.
.
.
t2
减压平衡左移的结果:正逆速率都减小、反应物转化率减小、所有物质浓度都减小、反应物体积分数增大、生成物体积分数减小。
平衡II
(a/2 ~ a) ( b/2 ~ b) (0 ~ c/2)
H2(g) + I2 (g) 2HI(g)
?
时间t
速率v
0
t1
V正
V逆
平衡I
a b c
在t1时刻(反应处于平衡状态I),我们将容器体积缩小一半
加压(体积缩小一半)
.
.
平衡II
2a 2b 2c
时间t
浓度 c
0
t1
H2
I2
HI
.
.
.
对此反应加压的结果:正逆速率同等倍数增大、平衡不移动、反应物转化率不变、所有物质浓度同等倍数都增大、体积分数不变。
思考:对此反应扩大体积减压呢?自己画画试试
以mA(g)+nB(g) ? pC(g)+qD(g)为例
(1)若m+n>p+q
(2)若m+n<p+q
(3)若m+n=p+q
思考:向平衡体系中
3H2 (g) +N2 (g) ? 2NH3 (g)
恒容时,充入Ne ,则平衡___; 恒压时,充入Ne ,则平衡___。
(4)“惰性气体”对化学平衡的影响
①恒温、恒容下:
原平衡体系
体系总压强增大,但体系中各组分浓度保持不变
平衡不移动
充入惰性气体
②恒温、恒压下 :
原平衡体系
充入惰性气体
各组分浓度减少
体系总体积增大
平衡向气体总体积增大的方向移动
平衡不移动
m + n = p + q
m + n ≠ p + q
(相当于压强减小)
恒温下, 反应aX(g) ? bY(g) +cZ(g)达到平衡后, 把容器体积
压缩到原来的一半且达到新平衡时, X的物质的量浓度由 0.1mol/L
增大到0.19mol/L, 下列判断正确的是( )
A,a>b+c B,a<b+c C,a=b+c D,a=b=c
A
课堂练习
课堂练习
已知化学反应2A(?)+B(g) ? 2C(?)达到平衡,当增大压
强时,平衡向逆反应方向移动,则下列情况可能的是( )
A、A是气体,C是固体 B、A、C均为气体
C、A、C均为固体 D、A是固体,C是气体
D
催化剂对化学平衡的影响
2
催化剂能够同等程度的改变正逆反应的速率,所以使用催化剂不能使平衡发生移动,但可以缩短达到平衡所需要的时间。
A.② ③ B.① ②
C.③ ④ D.④ ⑤
对可逆反应:A(g)+B(g) C(s)+2D(g) ΔH>0,如图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A ②加入催化剂 ③加压 ④升温 ⑤移走C。
符合图示条件的是( )
?
A
课堂练习
勒夏特列原理
3
如果改变影响平衡的一个条件(浓度、温度、压强等),化学平衡就向减弱这种改变的方向移动。
①此原理只适用于已达平衡的体系
②平衡移动方向与条件改变方向相反。
注意:
③移动的结果只能是减弱外界条件的该变量,但不能抵消。
不能用勒夏特列原理解释的问题
(1) 改变条件平衡不移动的
如:H2(g)+Br2(g) 2HBr(g)加压颜色加深
如:合成氨工业中使用催化剂提高生产效率。
(2)改变条件平衡移动方向与生产要求不一致时
如:合成氨工业中升高温度提高生产效率。
(3)不是可逆反应不能用
如:配制硫酸亚铁溶液时往往要加入一定量铁粉
如:经粉碎的黄铁矿在沸腾炉中燃烧较完全
讨论:反应N2(g)+3H2 (g) 2NH3 (g) △H<0 ,达到化学平衡,改变下列条件,根据反应体系中的变化填空:
①若N2的平衡浓度为a mol/L,其他条件不变时,充入N2使其浓度增大到b mol/L后平衡向——————方向移动,达到新平衡后, N2的浓度为c mol/L,则a、b、c的大小为———————;
②若平衡体系的压强为P1 ,之后缩小反应体系体积使压强增大到P2 ,此时平衡向——————方向移动,达到新平衡后 体系的压强为P3 ,则P1 、 P2、 P3 的大小为——————————;
③若平衡体系的温度为T1 ,之后将温度升高到 T2 ,此时平衡向——————方向移动,达到新平衡后 体系的温度为T3 ,则T1 、 T2、 T3 的大小为——————————。
正反应
a< c < b
正反应
P1 < P3< P2
逆反应
T1 < T3< T2
下列事实,不能用勒夏特列原理解释的是
①实验室常用饱和NaHCO3溶液除去CO2中混有的SO2气体
②长时间存放的氯水,会变为无色透明
③打开雪碧的瓶盖,立即有气体逸出
④经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全
⑤合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率
⑥合成氨工业中用铁触媒做催化剂???
⑦K2Cr2O7溶液中滴加NaOH溶液后颜色变为黄色
⑧用排饱和食盐水的方法收集氯气
①④⑥
课堂练习
向一容积不变的密闭容器中充入H2和I2,发生反应
H2(g)+I2(g)?2HI(g) ΔH<0,当达到平衡后,t0时若保持混合气体总
物质的量不变而改变某一反应条件,使平衡移动(如图所示),下
列说法正确的是( )
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度减小
D.t0时改变的条件为减小体积或升高体系温度
A
课堂练习
已知:N2(g)+3H2(g) ? 2NH3(g) ΔH=-92.4kJ·mol-1,在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
t1____________________;t2______________________;
t3___________________ _;t4____________________。
增大c(N2)或c(H2)
加入催化剂
降低温度
增大压强
课堂练习
