高中化学选修4人教版2.4化学反应进行的方向 课件(共30张ppt)
文档属性
| 名称 | 高中化学选修4人教版2.4化学反应进行的方向 课件(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-31 22:11:16 | ||
图片预览










文档简介
第三节 化学反应进行的方向
自发过程
焓判据
熵判据
自发过程
1
化学反应进行的方向
留意生活
化学反应进行的方向
化学反应进行的方向
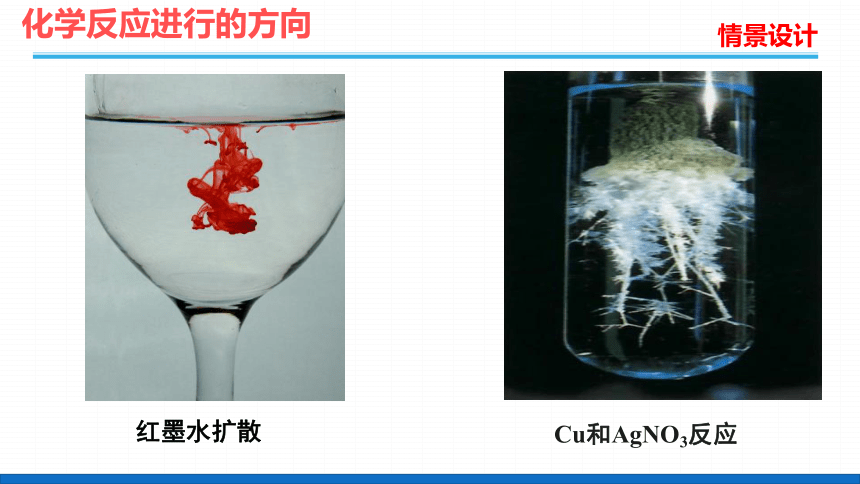
情景设计
红墨水扩散
Cu和AgNO3反应
1、自发过程:在一定条件下,不用借助外部力量就能自动进行的过程(高山流水、自由落体运动等)。
2、自发反应:在给定的一组条件下,一个反应可以自发地进行到显著程度,就称为自发反应(镁条燃烧、酸碱中和)。
化学反应进行的方向
1、反应的自发性只能用于判断反应的方向,不能确定反应是否一定会发生和过程发生的速率。
2、在讨论过程的方向时,指的是没有外界干扰时体系的性质。如果允许外界对体系施加某种作用,就可能出现相反的结果。
总结感悟
焓判据
2
思考:分析以下反应的特点:
(1)甲烷燃烧
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) △H = -802.3 kJ·mol-1
(2)铁生锈
3Fe(s) + 3/2O2(g) = Fe2O3(s) △H = -824 kJ·mol-1
(3)氢气和氧气反应
2H2(g) + O2(g) = 2H2O(l) △H = -571.6 kJ·mol-1
交流讨论
焓判据
共同特点:△H < 0 即放热反应
放热反应使体系能量降低,能量越低越稳定。
△H < 0有利于反应自发进行。
一般情况下, △H < 0 即放热反应易于发生自发反应。
焓判据
反应物的总能量高
放热反应
△H<0
生成物的总能量低
体系趋向于从高能状态转变为低能状态(这时体系会对外做功或者释放热量即△H ﹤0)这一经验规律就是焓判据,是判断化学反应进行方向的判据之一
总结感悟
焓判据
N2O5的分解:
2N2O5(g)=4NO2(g)+O2 (g) △H = +56.7 kJ·mol-1
碳酸铵的分解:
(NH4) 2CO3(s) = NH4HCO3(s)+NH3(g) △H = +74.9 kJ·mol-1
交流讨论
是不是所有自发进行的化学反应都是放热的?
焓判据
焓变只是反应能否自发进行的一个因素,但不是唯一因素。只根据焓变来判断反应方向是不全面的。
结论:
△H < 0有利于反应自发进行,但自发反应不一定要△H < 0
焓判据
交流讨论
熵判据
3
交流讨论
固体硝酸铵、氢氧化钠、氯化钠、蔗糖都能溶解于水,
他们的溶解过程与焓变有关吗?
是什么因素决定他们的溶解过程能自发进行?
熵判据
火柴散落,墨水扩散过程中混乱度如何变化?
自发过程的体系趋向于由有序变为无序,即混乱度增加。
熵判据
(1)熵:用来度量体系混乱程度的物理量。
(2)符号:S 单位:J?mol-1?K-1
(3)体系混乱度越大,熵值越大。
熵判据
①同一物质:S(g) > S(l) >S(s)
②固体的溶解、气体的扩散过程等都是混乱度增加的过程。
交流讨论
熵判据
S(冰) :47.9J mol-1K-1
S(水) :69.9J mol-1K-1
S(水蒸气):188.7J mol-1K-1
气体及其物质的量的增多是体系熵值变化的主要决定因素
熵判据
(4)熵变和熵增原理
②在与外界隔离的体系中,自发过程将导致体系的熵增大,这个原理叫做熵增原理。
①熵变(△S):产生新物质或物质状态有变化就存在着熵变。
△S=S产物-S反应物
该原理是用来判断过程方向的一个因素,又称为熵判据。
总结感悟
熵判据
反应能否自发还与温度有关
交流讨论
熵判据
加热
>0 >0 能
>0 >0 不能
﹤0 <0 能
分析下列过程的焓变、熵变与反应方向
焓变 熵变 能否自发
①NH3(g)+ HCl(g)=== NH4Cl(s)
②NH4Cl(s) === NH3(g)+ HCl(g)
③NH4Cl(s) === NH3(g)+ HCl(g)
△G<0
△G>0
△H >0 △S <0 非自发
△G=0
△H <0 △S > 0 自发
△H <0 △S< 0 低温可行
△H >0 △S > 0 高温可行
可逆反应到达平衡状态
总结感悟
熵判据与焓判据
△G=△H-T△S
复合判据
△S=+169.6J·mol-1·K-1
(2)CaCO3(s)=CaO(s)+CO2(g )
△H=+178.2kJ·mol-1
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
△S=+80.7J·mol-1·K-1
分析下列过程的焓变、熵变与反应方向
交流讨论
熵判据与焓判据
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
(2)CaCO3(s)=CaO(s)+CO2(g )
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
△H=+178.2kJ·mol-1
(2)CaCO3(s)=CaO(s)+CO2(g )
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
△S=+169.6J·mol-1·K-1
△H=+178.2kJ·mol-1
(2)CaCO3(s)=CaO(s)+CO2(g )
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
(2)CaCO3(s)=CaO(s)+CO2(g )
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
△H=+178.2kJ·mol-1
(2)CaCO3(s)=CaO(s)+CO2(g )
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
△S=+169.6J·mol-1·K-1
△H=+178.2kJ·mol-1
(2)CaCO3(s)=CaO(s)+CO2(g )
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
放热
熵增
吸热
熵增
自发
高温自发,低温不自发
2KClO3(s)==2KCl(s)+3O2(g)
△H = -78.03 kJ·mol-1 △S = +494.4 J·mol-1·K-1
CO(g)==C(s,石墨)+1/2O2(g)
△H =+110.5 kJ·mol-1 △S = -89.36 J·mol-1·K-1
判断下列反应能否自发进行
4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s)
△H = -444.3kJ·mol-1 △S = -280.1 J·mol-1·K-1
交流讨论
1、下列反应中,在高温下不能自发进行的是( )
A、(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g)
B、2N2O5(g)=4NO2(g)+O2(g)
C、MgCO3(s)=MgO(s)+CO2(g)
D、CO(g)=C(s)+1/2O2 (g)
D
当堂巩固
2、下列说法不正确的是( )
A、焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应
B、在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大
C、 一个反应能否自发进行取决于该反应放热还是吸热
D、一个反应能否自发进行,与焓变和熵变的共同影响有关
C
当堂巩固
3、碳酸铵(NH4)2CO3在室温下就能自发地分解产生氨气,对其说法中正确的是( )
A、其分解是因为生成了易挥发的气体,使体系的熵增大
B、其分解是因为外界给予了能量
C、其分解是吸热反应,据能量判据能自发分解
D、碳酸盐都不稳定,都能自发分解
A
当堂巩固
4、以下自发反应可用能量判据来解释的是( )
A、硝酸铵自发地溶于水
B、2N2O5(g)===4NO2(g)+O2(g)
△H=+56.7kJ/mol
C、(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g)
△H=+74.9 kJ/mol
D、2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
D
当堂巩固
2NO(g) + 2CO(g) = N2(g) + 2CO2(g),
请说明上述反应在什么条件下,可以自发进行?
思考:
已知, 298K、101KPa下反应
△H = - 113.0 KJ·mol-1 ,△S = - 143.5 J·mol-1·K-1
汽车尾气中含有NO、CO等有害气体。怎样将它们转化为可参与大气循环的气体?
T< 787K t<514℃
思考:
汽车尾气中含有NO、CO等有害气体。怎样将它们转化为可参与大气循环的气体?
2NO(g) + 2CO(g) = N2(g) + 2CO2(g),
思考:
汽车尾气中含有NO、CO等有害气体。怎样将它们转化为可参与大气循环的气体?
已知, 298K、101KPa下反应
△H = - 113.0 KJ·mol-1 ,△S = - 143.5 J·mol-1·K-1
2NO(g) + 2CO(g) = N2(g) + 2CO2(g),
请说明上述反应在什么条件下,可以自发进行?
已知, 298K、101KPa下反应
△H = - 113.0 KJ·mol-1 ,△S = - 143.5 J·mol-1·K-1
2NO(g) + 2CO(g) = N2(g) + 2CO2(g),
请说明上述反应在什么条件下,可以自发进行?
已知, 298K、101KPa下反应
△H = - 113.0 KJ·mol-1 ,△S = - 143.5 J·mol-1·K-1
2NO(g) + 2CO(g) = N2(g) + 2CO2(g),
请说明上述反应在什么条件下,可以自发进行?
已知, 298K、101KPa下反应
△H = - 113.0 KJ·mol-1 ,△S = - 143.5 J·mol-1·K-1
2NO(g) + 2CO(g) = N2(g) + 2CO2(g),
涂有防锈漆和未涂防锈漆的钢制器件,二者发生腐蚀过程的自发性是相同的,但只有后者可以实现。
水泵可以把水从低水位升至高水位;高温高压下可以是石墨转化为金刚石,实现的先决条件是要向体系中输入能量,该过程的本质仍然是非自发性的。
铁生锈
自发过程
焓判据
熵判据
自发过程
1
化学反应进行的方向
留意生活
化学反应进行的方向
化学反应进行的方向
情景设计
红墨水扩散
Cu和AgNO3反应
1、自发过程:在一定条件下,不用借助外部力量就能自动进行的过程(高山流水、自由落体运动等)。
2、自发反应:在给定的一组条件下,一个反应可以自发地进行到显著程度,就称为自发反应(镁条燃烧、酸碱中和)。
化学反应进行的方向
1、反应的自发性只能用于判断反应的方向,不能确定反应是否一定会发生和过程发生的速率。
2、在讨论过程的方向时,指的是没有外界干扰时体系的性质。如果允许外界对体系施加某种作用,就可能出现相反的结果。
总结感悟
焓判据
2
思考:分析以下反应的特点:
(1)甲烷燃烧
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) △H = -802.3 kJ·mol-1
(2)铁生锈
3Fe(s) + 3/2O2(g) = Fe2O3(s) △H = -824 kJ·mol-1
(3)氢气和氧气反应
2H2(g) + O2(g) = 2H2O(l) △H = -571.6 kJ·mol-1
交流讨论
焓判据
共同特点:△H < 0 即放热反应
放热反应使体系能量降低,能量越低越稳定。
△H < 0有利于反应自发进行。
一般情况下, △H < 0 即放热反应易于发生自发反应。
焓判据
反应物的总能量高
放热反应
△H<0
生成物的总能量低
体系趋向于从高能状态转变为低能状态(这时体系会对外做功或者释放热量即△H ﹤0)这一经验规律就是焓判据,是判断化学反应进行方向的判据之一
总结感悟
焓判据
N2O5的分解:
2N2O5(g)=4NO2(g)+O2 (g) △H = +56.7 kJ·mol-1
碳酸铵的分解:
(NH4) 2CO3(s) = NH4HCO3(s)+NH3(g) △H = +74.9 kJ·mol-1
交流讨论
是不是所有自发进行的化学反应都是放热的?
焓判据
焓变只是反应能否自发进行的一个因素,但不是唯一因素。只根据焓变来判断反应方向是不全面的。
结论:
△H < 0有利于反应自发进行,但自发反应不一定要△H < 0
焓判据
交流讨论
熵判据
3
交流讨论
固体硝酸铵、氢氧化钠、氯化钠、蔗糖都能溶解于水,
他们的溶解过程与焓变有关吗?
是什么因素决定他们的溶解过程能自发进行?
熵判据
火柴散落,墨水扩散过程中混乱度如何变化?
自发过程的体系趋向于由有序变为无序,即混乱度增加。
熵判据
(1)熵:用来度量体系混乱程度的物理量。
(2)符号:S 单位:J?mol-1?K-1
(3)体系混乱度越大,熵值越大。
熵判据
①同一物质:S(g) > S(l) >S(s)
②固体的溶解、气体的扩散过程等都是混乱度增加的过程。
交流讨论
熵判据
S(冰) :47.9J mol-1K-1
S(水) :69.9J mol-1K-1
S(水蒸气):188.7J mol-1K-1
气体及其物质的量的增多是体系熵值变化的主要决定因素
熵判据
(4)熵变和熵增原理
②在与外界隔离的体系中,自发过程将导致体系的熵增大,这个原理叫做熵增原理。
①熵变(△S):产生新物质或物质状态有变化就存在着熵变。
△S=S产物-S反应物
该原理是用来判断过程方向的一个因素,又称为熵判据。
总结感悟
熵判据
反应能否自发还与温度有关
交流讨论
熵判据
加热
>0 >0 能
>0 >0 不能
﹤0 <0 能
分析下列过程的焓变、熵变与反应方向
焓变 熵变 能否自发
①NH3(g)+ HCl(g)=== NH4Cl(s)
②NH4Cl(s) === NH3(g)+ HCl(g)
③NH4Cl(s) === NH3(g)+ HCl(g)
△G<0
△G>0
△H >0 △S <0 非自发
△G=0
△H <0 △S > 0 自发
△H <0 △S< 0 低温可行
△H >0 △S > 0 高温可行
可逆反应到达平衡状态
总结感悟
熵判据与焓判据
△G=△H-T△S
复合判据
△S=+169.6J·mol-1·K-1
(2)CaCO3(s)=CaO(s)+CO2(g )
△H=+178.2kJ·mol-1
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
△S=+80.7J·mol-1·K-1
分析下列过程的焓变、熵变与反应方向
交流讨论
熵判据与焓判据
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
(2)CaCO3(s)=CaO(s)+CO2(g )
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
△H=+178.2kJ·mol-1
(2)CaCO3(s)=CaO(s)+CO2(g )
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
△S=+169.6J·mol-1·K-1
△H=+178.2kJ·mol-1
(2)CaCO3(s)=CaO(s)+CO2(g )
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
(1)H+(aq)+OH-(aq)=H2O (l)
(2)CaCO3(s)=CaO(s)+CO2(g )
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
△H=+178.2kJ·mol-1
(2)CaCO3(s)=CaO(s)+CO2(g )
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
△S=+169.6J·mol-1·K-1
△H=+178.2kJ·mol-1
(2)CaCO3(s)=CaO(s)+CO2(g )
△S=+80.7J·mol-1·K-1
△H= - 57.3kJ·mol-1
放热
熵增
吸热
熵增
自发
高温自发,低温不自发
2KClO3(s)==2KCl(s)+3O2(g)
△H = -78.03 kJ·mol-1 △S = +494.4 J·mol-1·K-1
CO(g)==C(s,石墨)+1/2O2(g)
△H =+110.5 kJ·mol-1 △S = -89.36 J·mol-1·K-1
判断下列反应能否自发进行
4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s)
△H = -444.3kJ·mol-1 △S = -280.1 J·mol-1·K-1
交流讨论
1、下列反应中,在高温下不能自发进行的是( )
A、(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g)
B、2N2O5(g)=4NO2(g)+O2(g)
C、MgCO3(s)=MgO(s)+CO2(g)
D、CO(g)=C(s)+1/2O2 (g)
D
当堂巩固
2、下列说法不正确的是( )
A、焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应
B、在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大
C、 一个反应能否自发进行取决于该反应放热还是吸热
D、一个反应能否自发进行,与焓变和熵变的共同影响有关
C
当堂巩固
3、碳酸铵(NH4)2CO3在室温下就能自发地分解产生氨气,对其说法中正确的是( )
A、其分解是因为生成了易挥发的气体,使体系的熵增大
B、其分解是因为外界给予了能量
C、其分解是吸热反应,据能量判据能自发分解
D、碳酸盐都不稳定,都能自发分解
A
当堂巩固
4、以下自发反应可用能量判据来解释的是( )
A、硝酸铵自发地溶于水
B、2N2O5(g)===4NO2(g)+O2(g)
△H=+56.7kJ/mol
C、(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g)
△H=+74.9 kJ/mol
D、2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
D
当堂巩固
2NO(g) + 2CO(g) = N2(g) + 2CO2(g),
请说明上述反应在什么条件下,可以自发进行?
思考:
已知, 298K、101KPa下反应
△H = - 113.0 KJ·mol-1 ,△S = - 143.5 J·mol-1·K-1
汽车尾气中含有NO、CO等有害气体。怎样将它们转化为可参与大气循环的气体?
T< 787K t<514℃
思考:
汽车尾气中含有NO、CO等有害气体。怎样将它们转化为可参与大气循环的气体?
2NO(g) + 2CO(g) = N2(g) + 2CO2(g),
思考:
汽车尾气中含有NO、CO等有害气体。怎样将它们转化为可参与大气循环的气体?
已知, 298K、101KPa下反应
△H = - 113.0 KJ·mol-1 ,△S = - 143.5 J·mol-1·K-1
2NO(g) + 2CO(g) = N2(g) + 2CO2(g),
请说明上述反应在什么条件下,可以自发进行?
已知, 298K、101KPa下反应
△H = - 113.0 KJ·mol-1 ,△S = - 143.5 J·mol-1·K-1
2NO(g) + 2CO(g) = N2(g) + 2CO2(g),
请说明上述反应在什么条件下,可以自发进行?
已知, 298K、101KPa下反应
△H = - 113.0 KJ·mol-1 ,△S = - 143.5 J·mol-1·K-1
2NO(g) + 2CO(g) = N2(g) + 2CO2(g),
请说明上述反应在什么条件下,可以自发进行?
已知, 298K、101KPa下反应
△H = - 113.0 KJ·mol-1 ,△S = - 143.5 J·mol-1·K-1
2NO(g) + 2CO(g) = N2(g) + 2CO2(g),
涂有防锈漆和未涂防锈漆的钢制器件,二者发生腐蚀过程的自发性是相同的,但只有后者可以实现。
水泵可以把水从低水位升至高水位;高温高压下可以是石墨转化为金刚石,实现的先决条件是要向体系中输入能量,该过程的本质仍然是非自发性的。
铁生锈
