高中化学选修4人教版3.2水的电离和溶液的酸碱性-酸碱中和滴定原理课件(共30张ppt)
文档属性
| 名称 | 高中化学选修4人教版3.2水的电离和溶液的酸碱性-酸碱中和滴定原理课件(共30张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-31 00:00:00 | ||
图片预览











文档简介
第二节 水的电离和溶液的酸碱性
第3课时 酸碱中和滴定原理
酸碱中和滴定的原理
酸碱中和滴定实验仪器、试剂
酸碱中和滴定的原理
1
一、酸碱中和反应原理
概念:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法叫酸碱中和滴定。
c(酸)=
c(碱)×V(碱)
V(酸)
2、要想得到准确的结果,关键是什么?
思考
1、如果用已知浓度的碱滴定未知浓度的酸,计算酸的浓度的式子如何书写?
①准确测量参加反应的V(酸) 、V(碱)。
②准确判断中和反应终点。
c酸v酸=c碱v碱(一元酸和一元碱)
2中和滴定实验仪器试剂
你能想到那些测量液体体积的仪器?精确度如何?哪个适合进行精确的酸碱中和滴定?
量筒、烧杯、容量瓶
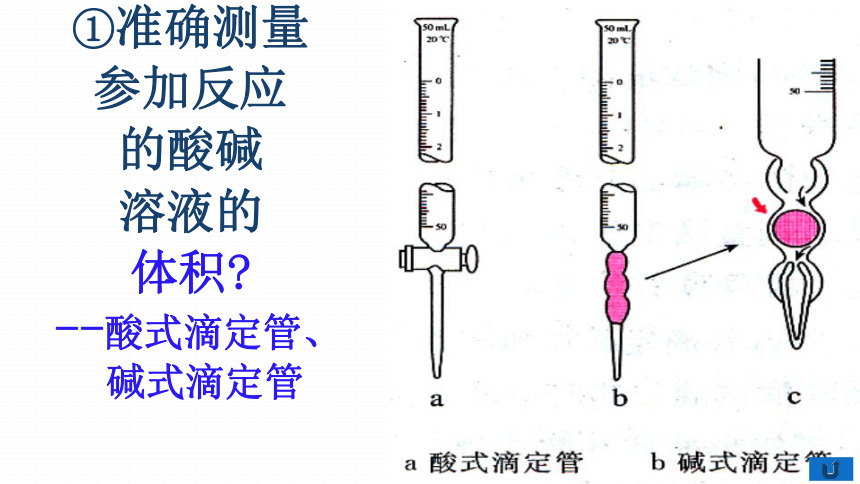
①准确测量
参加反应
的酸碱
溶液的
体积?
--酸式滴定管、
碱式滴定管
注意观察:零刻度在哪?酸式滴定管能否盛放碱液,碱式滴定管能否盛放酸液?读数时可以读到小数点后几位?
零刻度在哪?酸式滴定管能否盛放碱液,碱式滴定管能否盛放酸液?读数时可以读到小数点后几位?
①零刻度在上方。
②酸式滴定管下端为玻璃活塞,盛放碱液会生成Na2SiO3,是一种矿物胶,具有粘性,使活塞不能旋转。
③碱式滴定管下端为一段橡皮管,酸液会腐蚀橡胶。氧化剂会把橡皮管氧化。
④滴定管可以读到小数点后两位。最小刻度0.1 mL, 读数0.0l mL。
问题引导下的再学习
问题.如何使用滴定管?
①检漏:
②水洗:
③润洗:
④装液:
⑤排气泡
⑥定刻度
⑦读数:
检查是否漏水
蒸馏水洗涤
用待装液润洗2-3次(每次3-5mL)
加液到“0”以上2-3cm处,垂直固定
打开活塞/捏玻璃球快速冲出气泡
凹液面最低处位于“0”或以下某处
⑧放液:
最小刻度0.1mL,读数0.0lmL
放至所需刻度或滴定终点
注意事项
1装标准液或待测液的滴定管用水洗后,必须用待装液润洗,否则相当于稀释溶液,使结果出现不准确
2 装标准液或待测液的滴定管,滴定前尖嘴处有气泡,或滴定终了有气泡,使读数结果不准确
3读数时平视, 俯视仰视,都会使滴定结果误差
4“0”刻度在上但不是在最上端管口边沿;满刻度在下但不是最低点
酸碱指示剂法、
pH试纸法、
pH计法等。
②溶液pH值测定方法
pH
1 2 3 4 5 6 7 8 9 10 11 12 13 14
甲基橙
红色
橙色
黄色
石蕊
红色
紫色
蓝色
酚酞
无色
浅红色
红色
3.1—4.4
5.0—8.0
8.2—10.0
(1) 酸碱指示剂(定性测量范围)
如何测定pH值大小
只能测出pH范围,一般不能准确测定pH
酸碱指示剂一般是弱的有机酸或弱的有机碱,他们的颜色变化是在一定的pH值范围内发生的,用量不宜过多。我们把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。
(2) pH试纸(定量粗略测量)
用法: pH试纸放在玻璃片上,用玻璃棒蘸取待测溶液,点在pH试纸中部,半分钟后与标准比色卡对比。
粗略测定溶液pH;pH为整数;pH试纸不能润湿
讨论: pH试纸的使用
能否直接把pH试纸伸到待测液中?
是否要先湿润pH试纸后,再将待测液滴到pH试纸上?
能否用广泛pH试纸测出pH=7.1来?
标准比色卡中的数据都是整数
如用湿润的pH试纸检验待测液,对该溶液pH值的测定:
A、一定有影响 B、偏大 C、偏小 D、不确定
注意:①不能用水润湿②要放在玻璃片(或表面皿)上③用玻璃棒蘸待测液滴于试纸上
D
(3) pH计(定量精确测量)
(小数)
指示剂的选择:
1)终点时,指示剂的颜色变化明显
2)变色范围越窄越好,对溶液的酸碱性变化较灵敏
酸碱中和时判断终点
甲基橙:(红)-3.1~橙 色~4.4-(黄)
酚 酞:(无)-8.2~粉红色~10.0-(红)
石 蕊:(红)-5.0~紫 色~8.0-(蓝)
常用指示剂的变色范围
√
×
√
为什么酸碱中和滴定不能用紫色石蕊试液做指示剂?
1. 最主要的原因是石蕊反应太迟钝,尤其是对碱迟钝。意思是把酸或碱滴到石蕊里面,要过一会才变色,而不是马上变色。
2. 人的肉眼对红—紫—蓝的颜色变化不敏感
3. 指示剂的变色范围越窄越好,pH稍有变化,指示剂就能改变颜色。石蕊溶液由于变色范围较宽(5~8),所以在中和滴定中不采用。
中和情况
指示剂
变色情况
强碱滴定酸
酚酞
无色—红色
酸滴定强碱
红色—无色
碱滴定强酸
甲基橙
红色—橙色
强酸滴定碱
黄色—橙色
为什么这么选指示剂?碳酸钠明明是盐,为什么叫纯碱?
因为碳酸钠是由强碱氢氧化钠和弱酸碳酸,组成盐时碱比较强所以显碱性
如果弱酸滴定强碱用甲基橙做指示剂的话,弱酸要过量特别多,用量就不准了。
纯碱
[例题]在20mL0.1moL/LNaOH溶液中,逐滴加入0.1moL/L的盐酸溶液至20mL,求溶液的pH。若盐酸少加半滴(0.02mL)或多加半滴(0.02mL)时,溶液的pH又分别为多少?
解:HCl + NaOH = NaCl + H2O
⑴溶液的pH=7
(3)当盐酸多加0.02mL时,HCl过量
C(H+)=(0.1moL/L×0.02mL)/40mL=5×10-5moL/L
pH= -lg( C(H+))= -lg(5×10-5)=4.3
(2)当盐酸少加0.02mL时,NaOH过量
C(OH-)=(0.1moL/L×0.02mL)/40mL=5×10-5moL/L
C(H+)=10-14/(5×10-5)=2×10-10
pH= -lg( C(H+))= -lg( 2×10-10)=9.7
酸碱滴定突跃
准确量取15.00 mL的高锰酸钾溶液,可选 用的仪器是 ( )
A.50 mL量筒 B.20 mL量筒
C.酸式滴定管 D.碱式滴定管
C
练习
练习:用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在____(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.200 0 mol/L的盐酸来滴定待测溶液,不可选用___(填编号字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞 D.甲基红
A
B
准确量取25.00mLKMnO4溶液,可选用的仪器是( )
A 50mL量筒
B 10mL量筒
C 50mL的酸式滴定管
D 50mL的碱式滴定管
C
练习
有一支50mL的酸式滴定管 ,其中盛有溶液,液面恰好在10.0mL刻度处,把滴定管的溶液全部流下排出,承接在量筒中,量筒中液体的体积是 ( )
A 大于40.0mL B 等于40.0mL
C 大于10.0mL D 等于10.0mL
A
练习:某溶液取少量滴在pH试纸上,半分钟后,试纸呈深蓝色,此溶液中不可能大量共存的离子是:
A.PO43- B.HCO3- C.Al3+ D.K+
B C
课堂知识总结
1、酸碱中和滴定原理
2、酸碱中和滴定使用仪器
3、酸、碱式滴定管的使用
检漏→水洗→润洗→装液→排气泡→调零→读数
C H+ V H+ = C OH- V OH-
刻度:
0刻度在上(与量筒不同)
取液:
在刻度范围内取液,液体不能放完。
放液:
酸式:
旋转旋塞
碱式:
挤压玻璃球
中和滴定实验中的注意事项:
1.指示剂的选择 2.滴定管的使用
第3课时 酸碱中和滴定原理
酸碱中和滴定的原理
酸碱中和滴定实验仪器、试剂
酸碱中和滴定的原理
1
一、酸碱中和反应原理
概念:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法叫酸碱中和滴定。
c(酸)=
c(碱)×V(碱)
V(酸)
2、要想得到准确的结果,关键是什么?
思考
1、如果用已知浓度的碱滴定未知浓度的酸,计算酸的浓度的式子如何书写?
①准确测量参加反应的V(酸) 、V(碱)。
②准确判断中和反应终点。
c酸v酸=c碱v碱(一元酸和一元碱)
2中和滴定实验仪器试剂
你能想到那些测量液体体积的仪器?精确度如何?哪个适合进行精确的酸碱中和滴定?
量筒、烧杯、容量瓶
①准确测量
参加反应
的酸碱
溶液的
体积?
--酸式滴定管、
碱式滴定管
注意观察:零刻度在哪?酸式滴定管能否盛放碱液,碱式滴定管能否盛放酸液?读数时可以读到小数点后几位?
零刻度在哪?酸式滴定管能否盛放碱液,碱式滴定管能否盛放酸液?读数时可以读到小数点后几位?
①零刻度在上方。
②酸式滴定管下端为玻璃活塞,盛放碱液会生成Na2SiO3,是一种矿物胶,具有粘性,使活塞不能旋转。
③碱式滴定管下端为一段橡皮管,酸液会腐蚀橡胶。氧化剂会把橡皮管氧化。
④滴定管可以读到小数点后两位。最小刻度0.1 mL, 读数0.0l mL。
问题引导下的再学习
问题.如何使用滴定管?
①检漏:
②水洗:
③润洗:
④装液:
⑤排气泡
⑥定刻度
⑦读数:
检查是否漏水
蒸馏水洗涤
用待装液润洗2-3次(每次3-5mL)
加液到“0”以上2-3cm处,垂直固定
打开活塞/捏玻璃球快速冲出气泡
凹液面最低处位于“0”或以下某处
⑧放液:
最小刻度0.1mL,读数0.0lmL
放至所需刻度或滴定终点
注意事项
1装标准液或待测液的滴定管用水洗后,必须用待装液润洗,否则相当于稀释溶液,使结果出现不准确
2 装标准液或待测液的滴定管,滴定前尖嘴处有气泡,或滴定终了有气泡,使读数结果不准确
3读数时平视, 俯视仰视,都会使滴定结果误差
4“0”刻度在上但不是在最上端管口边沿;满刻度在下但不是最低点
酸碱指示剂法、
pH试纸法、
pH计法等。
②溶液pH值测定方法
pH
1 2 3 4 5 6 7 8 9 10 11 12 13 14
甲基橙
红色
橙色
黄色
石蕊
红色
紫色
蓝色
酚酞
无色
浅红色
红色
3.1—4.4
5.0—8.0
8.2—10.0
(1) 酸碱指示剂(定性测量范围)
如何测定pH值大小
只能测出pH范围,一般不能准确测定pH
酸碱指示剂一般是弱的有机酸或弱的有机碱,他们的颜色变化是在一定的pH值范围内发生的,用量不宜过多。我们把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。
(2) pH试纸(定量粗略测量)
用法: pH试纸放在玻璃片上,用玻璃棒蘸取待测溶液,点在pH试纸中部,半分钟后与标准比色卡对比。
粗略测定溶液pH;pH为整数;pH试纸不能润湿
讨论: pH试纸的使用
能否直接把pH试纸伸到待测液中?
是否要先湿润pH试纸后,再将待测液滴到pH试纸上?
能否用广泛pH试纸测出pH=7.1来?
标准比色卡中的数据都是整数
如用湿润的pH试纸检验待测液,对该溶液pH值的测定:
A、一定有影响 B、偏大 C、偏小 D、不确定
注意:①不能用水润湿②要放在玻璃片(或表面皿)上③用玻璃棒蘸待测液滴于试纸上
D
(3) pH计(定量精确测量)
(小数)
指示剂的选择:
1)终点时,指示剂的颜色变化明显
2)变色范围越窄越好,对溶液的酸碱性变化较灵敏
酸碱中和时判断终点
甲基橙:(红)-3.1~橙 色~4.4-(黄)
酚 酞:(无)-8.2~粉红色~10.0-(红)
石 蕊:(红)-5.0~紫 色~8.0-(蓝)
常用指示剂的变色范围
√
×
√
为什么酸碱中和滴定不能用紫色石蕊试液做指示剂?
1. 最主要的原因是石蕊反应太迟钝,尤其是对碱迟钝。意思是把酸或碱滴到石蕊里面,要过一会才变色,而不是马上变色。
2. 人的肉眼对红—紫—蓝的颜色变化不敏感
3. 指示剂的变色范围越窄越好,pH稍有变化,指示剂就能改变颜色。石蕊溶液由于变色范围较宽(5~8),所以在中和滴定中不采用。
中和情况
指示剂
变色情况
强碱滴定酸
酚酞
无色—红色
酸滴定强碱
红色—无色
碱滴定强酸
甲基橙
红色—橙色
强酸滴定碱
黄色—橙色
为什么这么选指示剂?碳酸钠明明是盐,为什么叫纯碱?
因为碳酸钠是由强碱氢氧化钠和弱酸碳酸,组成盐时碱比较强所以显碱性
如果弱酸滴定强碱用甲基橙做指示剂的话,弱酸要过量特别多,用量就不准了。
纯碱
[例题]在20mL0.1moL/LNaOH溶液中,逐滴加入0.1moL/L的盐酸溶液至20mL,求溶液的pH。若盐酸少加半滴(0.02mL)或多加半滴(0.02mL)时,溶液的pH又分别为多少?
解:HCl + NaOH = NaCl + H2O
⑴溶液的pH=7
(3)当盐酸多加0.02mL时,HCl过量
C(H+)=(0.1moL/L×0.02mL)/40mL=5×10-5moL/L
pH= -lg( C(H+))= -lg(5×10-5)=4.3
(2)当盐酸少加0.02mL时,NaOH过量
C(OH-)=(0.1moL/L×0.02mL)/40mL=5×10-5moL/L
C(H+)=10-14/(5×10-5)=2×10-10
pH= -lg( C(H+))= -lg( 2×10-10)=9.7
酸碱滴定突跃
准确量取15.00 mL的高锰酸钾溶液,可选 用的仪器是 ( )
A.50 mL量筒 B.20 mL量筒
C.酸式滴定管 D.碱式滴定管
C
练习
练习:用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在____(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.200 0 mol/L的盐酸来滴定待测溶液,不可选用___(填编号字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞 D.甲基红
A
B
准确量取25.00mLKMnO4溶液,可选用的仪器是( )
A 50mL量筒
B 10mL量筒
C 50mL的酸式滴定管
D 50mL的碱式滴定管
C
练习
有一支50mL的酸式滴定管 ,其中盛有溶液,液面恰好在10.0mL刻度处,把滴定管的溶液全部流下排出,承接在量筒中,量筒中液体的体积是 ( )
A 大于40.0mL B 等于40.0mL
C 大于10.0mL D 等于10.0mL
A
练习:某溶液取少量滴在pH试纸上,半分钟后,试纸呈深蓝色,此溶液中不可能大量共存的离子是:
A.PO43- B.HCO3- C.Al3+ D.K+
B C
课堂知识总结
1、酸碱中和滴定原理
2、酸碱中和滴定使用仪器
3、酸、碱式滴定管的使用
检漏→水洗→润洗→装液→排气泡→调零→读数
C H+ V H+ = C OH- V OH-
刻度:
0刻度在上(与量筒不同)
取液:
在刻度范围内取液,液体不能放完。
放液:
酸式:
旋转旋塞
碱式:
挤压玻璃球
中和滴定实验中的注意事项:
1.指示剂的选择 2.滴定管的使用
